Services on Demand
Journal
Article
Related links
Share
Archivos de Pediatría del Uruguay
On-line version ISSN 1688-1249
Arch. Pediatr. Urug. vol.84 no.4 Montevideo Dec. 2013
EXPERIENCIA CLÍNICA
Hipotiroidismo congénito, un tema vigente. ¿Qué pasa con prematuros y gemelares?
Graciela Queiruga1, Jorge Vázquez2, Paola Garlo3, Karina Franca3, Ana Soria4, Alvaro Pacheco4, Lilian Corbo3
1. Gerente de Laboratorios del Sector Salud de Prestaciones del Banco de Previsión Social (BPS).
2. Pediatra de la Unidad de Perinatología del Sanatorio Canzani, BPS.
3. Laboratorio de Pesquisa Neonatal, BPS.
4. Laboratorio Análisis Clínicos, BPS.
Prestaciones de Salud, Instituto de la Seguridad Social, Montevideo, Uruguay.
Fecha recibido: 22 de agosto de 2013.
Fecha aprobado: 10 de diciembre de 2013.
Resumen
El hipotiroidismo congénito (HC) fue la primera enfermedad estudiada en Uruguay por un Programa Nacional de Pesquisa Neonatal (PNPN) de forma obligatoria, a partir del decreto 183/94. El no tratamiento oportuno del HC causa severo retardo mental y físico, por lo que la implementación de la pesquisa así como el tratamiento tuvieron buena acogida en los ámbitos de pediatría y endocrinología.
Desde el comienzo se observó que los niños prematuros, y/o con retardo de crecimiento podían dar falsos negativos, por lo que se comenzó a solicitar una segunda muestra a los 20 días de nacidos. Posteriormente, y a propósito de un caso, se comenzó a solicitar también una segunda muestra a los gemelares.
El propósito del presente trabajo es presentar los casos de HC detectados que en la primera muestra dieron negativos y se detectaron en la segunda muestra.
Palabras clave:
HIPOTIROIDISMO CONGÉNITO
PREMATURO
GEMELOS
Summary
Congenital hypothyroidism (CH) was the first disease studied in Uruguay by a Neonatal Screening Program as required in the 183/94 law. HC late treatment cause severe mental and physical retardation, so screening and treatment implementation had good acceptance in pediatrics and endocrinology.
From the beginning it was observed that premature infants with growth retardation could give false negatives, so we started to ask for a second sample at age of 20 days. Due to a case reported, we also started to ask for a second sample in twins.
The purpose of this work is present HC cases, detected as negative in the first sample and positive in the second sample.
Key words:
CONGENITAL HYPOTHYROIDISM
INFANT, PREMATURE
TWINS
Introducción
El hipotiroidismo congénito (HC) es la endocrinopatía más común en la infancia. Es la ausencia o disminución severa de hormonas tiroideas desde el nacimiento, debido a la falta de la glándula tiroidea o de la acción de hormonas tiroideas desde la vida fetal(1). Aunque la ausencia de hormonas esté desde la etapa fetal, la mayoría de los recién nacidos afectados parecen normales debido a la protección relativa y transitoria otorgada por el paso transplacentario de hormonas tiroideas maternas.
Es la causa más común de retardo mental prevenible por medio de un diagnóstico temprano y tratamiento oportuno(2). La falta de hormonas tiroideas produce en el sistema nervioso central un retardo en la arborización dendrítica, vascularización, migración neuronal y maduración de las conexiones interneuronales, que se traduce en lesiones irreversibles del tejido neuronal, siendo esto la causa del retardo mental y otras alteraciones neurológicas(3). A nivel sistémico interfiere con todos los procesos metabólicos y de maduración del organismo sobre todo en el tejido óseo y por tanto en el crecimiento.
En el periodo posnatal es fundamental la participación de las hormonas tiroideas en el crecimiento, se observa un sinergismo en la síntesis de hormona de crecimiento y tiroidea; por lo que se deduce que el feto con HC nace con talla normal que luego se va comprometiendo(1,4).
Normalmente, inmediatamente después del parto, el nivel de T3 se incrementa por la conversión de T4 a T3 en los tejidos y también se eleva la TSH neonatal con un máximo a los 30 minutos para luego descender gradualmente en las primeras 24 horas. El eje hipotalámico-hipofisiario-tiroideo fetal funciona en forma independiente del sistema materno y la placenta es impermeable a la TSH materna y relativamente impermeable a las hormonas T3 y T4 maternas, aunque existe algún paso transplacentario de T4 al feto que parece ser importante para mantenerlo eutiroideo en forma transitoria, es por eso que en el feto atiroideo o con ectopia tiroidea, a pesar de tener una TSH elevada, el crecimiento somático y el desarrollo neurológico transcurren normalmente(5).
La deficiencia de hormona tiroidea en los primeros años de vida conduce a cambios irreversibles, como ser: reducción del tamaño absoluto del cerebro y cerebelo, disminución de la capacidad de migración y proliferación de las células gliales, retraso en la mielinización, deficiencia en la conducción axonal, disminución de las arborizaciones dendríticas, atrofia de las circunvoluciones y retraso psiconeurológico(6,7).
La mayoría de los recién nacidos con hipotiroidismo congénito no presentan sintomatología clínica típica de deficiencia alguna y solo en el 3 a 5% se puede sospechar clínicamente el diagnóstico a esta edad, por lo que se dificulta la detección temprana de la enfermedad, sino existen programas de pesquisa neonatal(5).
La pesquisa neonatal, screening o cribado, tamizaje o triagem, comenzó en el mundo hace 50 años cuando el Dr. Robert Guthrie, diseñó un método sencillo para detectar aumentos de fenilalanina y lo que es más importante, inventó una forma fácil de obtener una muestra de sangre y fácil de transportar, la gota de sangre por punción de talón en papel de filtro(8,9).
La primera enfermedad en ser detectada por pesquisa fue la fenilcetonuria, pero la gran expansión de la misma fue cuando Jean Louis Dussault(10), comenzó la detección temprana de hipotiroidismo congénito. La frecuencia de esta enfermedad y lo efectivo y sencillo del tratamiento, así como la gravedad de no detectarla y tratarla a tiempo, hicieron de ella la principal enfermedad objetivo de las pesquisas.
En Uruguay la pesquisa comenzó por HC en algunas maternidades del país, realizando la dosificación de TSH. La primera maternidad fue la del Sanatorio Canzani, seguida por grupos de la UDELAR que realizaban en el Centro de Medicina Nuclear (CMN) la detección de TSH para los hospitales de Clínicas y Pereira Rossell. Ambos grupos impulsaron el decreto de obligatoriedad que fue promulgado el 21 de setiembre de 1994. Desde allí al 2007 no se logró incorporar ninguna otra enfermedad al Programa Nacional de Pesquisa Neonatal (PNPN)(11,12).
La Pesquisa de HC fue aceptada ampliamente por el cuerpo médico y por la comunidad y ayudó a prestigiar el Programa de Pesquisa como algo necesario y oportuno(13-15). Sin embargo desde su comienzo se vio que había niños que podían dar falsos negativos por su prematurez, retardo en el crecimiento o por ser gemelares(16).
En el año 1994 nace en el sanatorio Canzani una niña prematura cuyo valor de TSH en la muestra de sangre de cordón umbilical es 8 mUI/mL (valor de corte 25 mUI/mL). La niña permanece internada por su prematurez y por otras patologías y el pediatra tratante al verla hipotónica solicita una nueva TSH, a los 8 días esta muestra da 25 mUI/mL, no se inicia tratamiento enseguida, sino que se vuelve a tomar una tercera muestra a los 15 días y esta vez da 80 mUI/mL. A partir de entonces en el PNPN de HC allí se comienza a repetir estudio de TSH en forma sistemática en todos los prematuros a los 20 días de vida.
En los niños pretérmino y/o con retardo en el crecimiento al nacer, la pesquisa puede dar normal porque el eje hipotálamo-hipófisis–tiroides es inmaduro y la TSH no responde al valor disminuido de T4. Se precisan varias semanas para que este eje madure y solo la repetición de la muestra para pesquisa detecta los casos positivos. Por ello a nivel mundial en 2008 se promulgaron las guías I/LA31-A Appendices del Clinical and Laboratory Standards Institute (CLSI) (MM) (17) que indican realizar la segunda muestra.
Otra observación importante es lo que sucede en los gemelares, en los que se entiende podría haber intercambio de sangre fetal por lo que al momento de la pesquisa pueden dar los dos normales (pesquisa negativa). La enfermedad va a manifestarse posteriormente, por ello se solicita también la repetición de la muestra a los 20 días a todos los gemelares. La T4 aportada por el niño sano inhibe el aumento de TSH en el niño enfermo y cuando desaparece el aporte de la T4 del gemelo sano, se expresa el aumento de TSH en el gemelo hipotiroideo(18,19).
Una vez que el programa de pesquisa neonatal se amplió a más enfermedades y que el Laboratorio de BPS se definió exclusivo para estas determinaciones a partir del 2007, se comenzó a visitar todo el país y a poner énfasis en la toma y envío de muestras y repeticiones, incluidas las de los prematuros, y/o con retraso en el crecimiento y gemelares. Es por ello que en el presente trabajo tomamos los datos de HC a partir del 2007 aunque esta pesquisa comenzó en 1990 y obligatoriamente en 1994.
Objetivos
Presentar la cantidad de recién nacidos con HC detectados en el PNPN en nuestro país a partir de 2007 y su incidencia. Presentar qué pasa con los prematuros, recién nacidos con retraso en el crecimiento intrauterino y con los gemelares.
Material y métodos
Se parte de los niños estudiados en el Laboratorio de Pesquisa Neonatal del BPS desde enero 2007 a diciembre 2012, para evaluar la incidencia de HC en nuestra población. Estos niños pertenecen al sector público de todo el interior del país y las maternidades privadas del interior que no realizan TSH en sus laboratorios y también al Hospital de Clínicas y Pereira Rossell, este último hasta mayo 2012, en que comenzó a procesar sus TSH de sangre de cordón.
Las metodologías usadas para dosificar TSH han ido variando con el correr de los años, durante muchos años se utilizó IMX, AXSYM y actualmente ELecsys (electroquimio luminiscencia, EQL). El punto de corte utilizado para sangre de cordón siempre se mantuvo en 25,0 mUI/mL. El valor de referencia para EQL es, a los 20 días de vida de 16,1 mUI/mL. En otras metodologías utilizadas era de 8,1 mUI/mL y en sangre de talón impregnando un papel de filtro el valor de referencia es de 10,0 mUI/mL a los 20 días de vida.
Se destaca de los niños estudiados prematuros aquellos que dieron normales en la primera muestra y luego se detectan positivos en la segunda.
Resultados
Entre enero de 2007 y diciembre de 2012 se estudiaron en los laboratorios del BPS, 166.587 niños recién nacidos, de los cuales 6779 fueron prematuros. Se detectaron 72 HC, obteniendo una incidencia de 1/2.313.
En la tabla 1 se muestran los datos de cuatro recién nacidos: dos prematuros, uno con retraso en el crecimiento y uno gemelar.
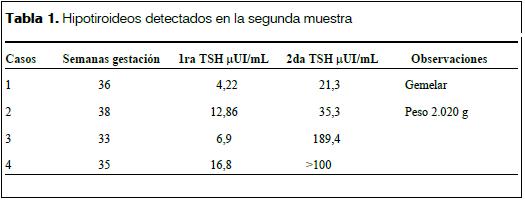
La primera niña detectada en el año 94 no se incluye en este cuadro por no corresponder al período estudiado. También hubo otros casos de los que tuvimos conocimiento pero que no se registraron entre los años 1994- 2007.
Discusión
La repetición sistemática de la muestra a los prematuros y gemelares queda a cargo de la maternidad donde nace el niño, se ha informado ampliamente de esta responsabilidad, y en parte es el motivo de este trabajo. Hay otros países que aun reconociendo la posibilidad de perder un niño por gemelar, no piden la segunda muestra de los niños, debido a que son programas muy grandes y con dificultad para obtener la segunda muestra, pero sí recomienda a sus pediatras el poner especial atención sobre los gemelos(12). También hay países que discuten la conveniencia de repetir la toma de muestra por prematuros o bajo peso(14). Nuestro trabajo sigue las guías de expertos: Newborn Screening Guidelines for Premature an/or Sick Newborns; proposed Guidelines. CLSI document I/LA31-P (ISBN 1-56238-686-7). Clinical and Laboratory Standars Institute.I/LA31-A
Conclusiones
Los cuatro niños detectados y tratados tempranamente con HC en el total de prematuros corresponde al 5,5% de los HC hallados por nuestro laboratorio en ese período. Se trata de niños que de no haberse repetido la muestra hoy serían portadores de un retardo mental evitable. Los datos presentados en el presente trabajo subrayan la importancia de repetir la toma de muestra de sangre de talón a los 20 días para dosificación de TSH a los prematuros, a aquellos recién nacidos con retraso en el crecimiento y a los gemelares, sean estos prematuros o de término.
Bibliografía
1. Fisher DA, Klein AH. Thyroid development and disorders of thyroid function in the newborn. N Engl J Med 1981; 304(12):702-12.
2. Grant DB, Smith I, Fuggle PW, Tokar S, Chapple J. Congenital hypothyroidism detected by neonatal screening: relationship between biochemical severity and early clinical features. Arch Dis Child 1992; 67(1):87-90.
3. Lavin N. Manual of endocrinology and metabolism. 2nd ed. New York: Little Brown & Co, 1994:393-414.
4. Brent GA. The molecular basis of thyroid hormone action. N Engl J Med 1994; 331(13):847-53.
5. Fisher DA. Second International Conference on Neonatal Thyroid Screening: progress report. J Pediatr 1983; 102(5):653-4.
6. Pantoja Ludueña M, Mazzi Gonzales de Prada E, Paulsen Sandi K. Hipotiroidismo congénito: a propósito de un caso. Rev Bol Ped 2002; 41(1): 11-14
7. Barrón Uribe C, Pérez Pastén LE. Conceptos actuales en hipotiroidismo congénito. Bol Med Hosp Infant Mex 1996; 53(6):264-8.
8. Guthrie R. Blood screening for phenylketonuria. JAMA 1961; 178(8):863.
9. Guthrie R, Susi A. A simple phenylalanine method for detecting phenylketonuria in large populations of newborn infants. Pediatrics 1963; 32:338–43.
10. Dussault JH, Parlow A, Letarte J, Guyda H, Laberge C. TSH measurements from blood spots on filter paper: a confirmatory screening test for neonatal hypothyroidism. J Pediatr 1976; 89(4):550-2.
11. Queiruga G, Machado M, Demczylo V. Estimación de valores de TSH en sangre de cordón en nacidos en el Sanatorio Canzani, BPS. II Congreso de Patología Clínica, Montevideo, 1990.
12. Queiruga G. Detección Sistemática de Hipotiroidismo Congénito a todos los recién nacidos de Uruguay. Rev Asoc Quím Farm Urug 1994; 11: 7-11.
13. LaFranchi S. Clinical features and detection of congenital hypotiroidism. En: Rose BD, ed. UpToDate. Waltham, MA: Wolters Kluwer, 2004. Disponible en: http://www.uptodate.com/contents/clinical-features-and-detection-of-congenital-hypothyroidism. [Consulta: agosto de 2013]
14. American Academy of Pediatrics, Rose SR; Section on Endocrinology and Committee on Genetics, American Thyroid Association, Brown RS; Public Health Committee, Lawson Wilkins Pediatric Endocrine Society, Foley T, Kaplowitz PB, Kaye CI, Sundararajan S, Varma SK. Update of newborn screening and therapy for congenital hypothyroidism. Pediatrics 2006; 117(6):2290-303.
15. Stoppa-Vaucher S, Van Vliet G, Deladoëy J. Variation by ethnicity in the prevalence of congenital hypothyroidism due to thyroid dysgenesis. Thyroid 2011; 21(1):13-8.
16. Perry R, Heinrichs C, Bourdoux P, Khoury K, Szöts F, Dussault JH, et al. Discordance of monozygotic twins for thyroid dysgenesis: implications for screening and for molecular pathophysiology. J Clin Endocrinol Metab 2002; 87(9):4072-7.
17. Azam A, Cutfield W, Mouat F, Hofman PL, Jefferies C, Webster D, et al. Missed congenital hypothyroidism in an identical twin. J Paediatr Child Health 2012; 48(10):936-8.
18. Miller J, Tuerck J. Newborn Screening Guidelines for Premature an/or Sick Newborns: proposed guidelines. Wayne, PA: Clinical and Laboratory Standars Institute, 2008.
19. Vincent MA, Rodd C, Dussault JH, Van Vliet G. Very low birth weight newborns do not need repeat screening for congenital hypothyroidism. J Pediatr 2002; 140(3):311-4.
Correspondencia: Graciela Queiruga. Tristán Narvaja 1716, Montevideo, Uruguay. Correo electrónico: gqueiruga@bps.gub.uy














