Servicios Personalizados
Revista
Articulo
Links relacionados
Compartir
Archivos de Pediatría del Uruguay
versión On-line ISSN 1688-1249
Arch. Pediatr. Urug. vol.84 no.2 Montevideo 2013
Neumonía necrotizante en niños hospitalizados en el Hospital Pediátrico- Centro Hospitalario Pereira Rossell
en el año 2010
Karina Machado 1, Gariné Kouyoumdjian 2, Gabriela Algorta 3, Catalina Pírez 4
1. Prof. Adjunta Clínica Pediátrica. Departamento de Pediatría y Especialidades. Centro Hospitalario Pereira Rossell
2. Residente de Pediatría. Departamento de Pediatría y Especialidades. Centro Hospitalario Pereira Rossell
3. Prof. Bacteriología y Virología. Departamento de Pediatría y Especialidades. Centro Hospitalario Pereira Rossell
4. Prof. Directora Clínica Pediátrica. Departamento de Pediatría y Especialidades. Centro Hospitalario Pereira Rossell
Departamento de Pediatría y Especialidades. Centro Hospitalario Pereira Rossell.
Facultad de Medicina. UDELAR
Fecha recibido: 1º octubre de 2012.
Fecha aprobado: 14 de junio de 2013.
Resumen
Tras la incorporación en Uruguay de vacunas conjugadas neumocócicas (PCV), se registró un descenso en las hospitalizaciones por neumonía bacteriana adquirida en la comunidad (NAC) en el Hospital Pediátrico del Centro Hospitalario Pereira Rossell (HP-CHPR). Así mismo, en los últimos años se asistió a niños que desarrollaron neumonía necrotizante (NN). Se denomina NN a casos de NAC en los que la inflamación determina isquemia y necrosis del parénquima, con formación de neumatoceles y fístula broncopleural, cuando ésta se produce en la periferia del pulmón. Son pacientes graves, con mal estado general, fiebre persistente y requieren hospitalizaciones prolongadas. Los neumatoceles se diagnostican en la radiografía y/o la tomografía computada de tórax.
Se realizó la descripción de los niños con NAC hospitalizados en el HP-CHPR, que evolucionaron a NN en el año 2010. Se diagnosticaron 28 niños, con un promedio de edad de 36 meses, la mayoría sanos y eutróficos. Los neumatoceles fueron identificados en la radiografía de tórax en casi todos los pacientes. Presentaron en promedio 7 días de fiebre. La mayoría evolucionó con complicaciones pulmonares y/o extrapulmonares. Diez niños requirieron ingreso a unidad de terapia intensiva. Las hospitalizaciones tuvieron una duración de hasta 43 días. Ningún paciente falleció. En la mitad de los casos se identificó Streptococcus pneumoniae. Todas las cepas aisladas eran sensibles a penicilina. Ninguno de los pacientes en los que se aisló cepas contenidas en las PCV estaba adecuadamente vacunado.
La NN es una complicación grave de NAC, que ocurre en niños sanos. Determina hospitalizaciones prolongadas y gran morbilidad. Es importante mantener la vigilancia de los ingresos hospitalarios por NAC y sus complicaciones luego de la vacunación universal con PCV.
Palabras clave:
NEUMONÍA BACTERIANA-complicaciones
NEUMONÍA ADQUIRIDA EN LA COMUNIDAD
Summary
Following the implementation in Uruguay of pneumococcal conjugate vaccines (PCV), there was a decrease in hospitalizations for bacterial community acquired pneumonia (CAP) at Hospital Pediátrico del Centro Hospitalario Pereira Rossell (HP-CHPR). Also, in recent years there were assisted children who developed necrotizing pneumonia (NP). NP are called CAP cases where inflammation determines ischemia and necrosis of the parenchyma with pneumatoceles formation and bronchopleural fistula when it occurs in the periphery lung. They are serious patients with poor general condition, persistent fever and require prolonged hospitalization. The pneumatoceles are diagnosed on radiography and/or chest computed tomography.
We performed the description of hospitalized children with CAP in the HP-CHPR, which evolved NN in 2010. Twenty-eight children were diagnosed with an average age of 36 months, most healthy and eutrophic. Pneumatoceles were identified on chest radiography in almost all patients. They presented on average seven days of fever. Most developed pulmonary and/or extrapulmonary complications. Ten children required admission to intensive care unit. Hospitalizations lasted up to 43 days. No patient died. In half of the cases Streptococcus pneumoniae was identified. All isolates were sensitive to penicillin. None of the patients with PCV serotypes was adequately immunized.
NN is a serious complication of CAP, which occurs in healthy children. Determines prolonged hospitalization and high morbidity. It is important to maintain surveillance of hospital admissions for CAP and its complications after universal vaccination with PCV.
Key words:
PNEUMONIA, BACTERIAL - complications
COMMUNITY-ACQUIRED PNEUMONIA
Introducción
La neumonía bacteriana adquirida en la comunidad (NAC) representa un importante problema de salud, siendo la primera causa de mortalidad infantil a nivel mundial. Streptococcus pneumoniae es el principal patógeno bacteriano. Otros gérmenes menos frecuentes son Staphylococcus aureus, Streptococcus pyogenes, Mycoplasma pneumoniae, entre otros (1-4). La incorporación de vacunas neumocócicas conjugadas (pneumococcal cojugated vaccine, PCV) ha determinado disminución en la incidencia de NAC en diversos países. En el Hospital Pediátrico del Centro Hospitalario Pereira Rossell (HP-CHPR) se registró un descenso en las admisiones por NAC tras la incorporación de estas vacunas(5).
En Uruguay se incorporó en 2008 al certificado esquema de vacunación (CEV) la PCV 7-valente (PCV-7), dirigida contra los serotipos 4, 6B, 9V, 14, 18C, 19F y 23F a. En marzo de 2010 esta vacuna fue sustituida por la 13-valente (PCV-13) que agrega protección contra los serotipos 1, 3, 5, 6A, 7F y 19A. Estas vacunas se administran a los 2, 4 y 12 meses. En 2008 se realizó nivelación para los niños nacidos en 2007 con dos dosis (15 y 21 meses) y en 2010 nivelación con dosis única para los nacidos entre el 1 de enero de 2005 y el 23 de abril de 2010*.
Desde 1990 se reportó en varios países un aumento de las complicaciones supurativas de NAC (6-8). Las más frecuentes son empiema y neumonía necrotizante (NN) (1). Se denomina NN a la necrosis del parénquima pulmonar, consecuencia de neumonía lobar o alveolar severa, en la que la infección determina daño parenquimatoso (9-12). Su patogenia se vincula a fenómenos inflamatorios que producen injuria celular, isquemia y necrosis. Esta lleva a licuefacción pulmonar que se elimina por vía bronquial, mediante expectoración, dejando una cavidad que es sustituida por aire y forma neumatoceles (13,14). Su curso suele ser grave, con mal estado general, fiebre persistente o recurrente y hospitalización prolongada (8,9,12). Frecuentemente se acompaña de otras complicaciones como insuficiencia respiratoria, derrame pleural, empiema, fístula broncopleural (FBP), pioneumatoceles o neumotórax (9). Son frecuentes las complicaciones extrapulmonares: shock, sepsis, anemia, hipoalbuminemia (9).
La mayoría de los casos se presentan en niños sanos, mayores de 36 meses. Diversos autores han encontrado como factores predictores de necrosis: mal estado general; fiebre que persiste o reaparece; neumonía multilobar; FBP; cifra de glóbulos blancos (GB) menor a 5.000 o mayor a 30.000 elementos/ml y trombocitopenia en sangre periférica; láctico-deshidrogenasa (LDH) en líquido pleural mayor a 2500 UI/L; proteína C reactiva (PCR) mayor a 120 mg/dl (8,9,11,12,15).
Si bien se puede diagnosticar NN por la radiografía de tórax (RxTx), la presencia frecuente de consolidación y derrame puede impedir su visualización, por lo que la tomografía computada (TC) es más sensible para el diagnóstico (12,16). Los criterios tomográficos incluyen: pérdida de la arquitectura normal del parénquima, disminución de la impregnación de medio de contraste, aparición de cavidades de pared delgada con contenido líquido y/o aéreo (9,10,17-19). Los hallazgos encontrados en la RxTx se correlacionan con los de la TC (16). La ecografía puede mostrar zonas hipoecoicas periféricas correspondientes a necrosis. El ecodoppler evidencia zonas de distinta ecogenicidad en el interior de la condensación con hipoflujo o ausencia del flujo sanguíneo (9,20).
El germen que más frecuentemente causa NN es S. pneumoniae. Otros menos frecuentes son: S. aureus, H. influenzae, Streptococcus Grupo A, y M. pneumoniae (8,9).
La evolución en la mayoría de los casos es favorable. Las medidas quirúrgicas necesarias suelen ser las del empiema asociado. La resección pulmonar se puede considerar como opción en pacientes sépticos en los cuales el tratamiento médico ha fallado (21,22). El pronóstico a largo plazo es bueno. Algunos autores han reportado resolución completa radiológica y de pruebas funcionales respiratorias a los 6 meses de evolución (8,12,16).
En Uruguay, desde 1997, se aplica una pauta de diagnóstico y tratamiento de niños con NAC, que incluye hemocultivo y RxTx a los que requieren hospitalización y ecografía torácica y estudio citoquímico y bacteriológico del líquido pleural, si presentan derrame pleural. El tratamiento consiste en antibióticos empíricos y tratamiento del empiema*. En el HP-CHPR en los últimos años se han establecido criterios clínicos y paraclínicos para identificar tempranamente los niños que ingresan por NAC y desarrollan NN. Interesa conocer las características clínicas de estos pacientes para continuar optimizando los métodos diagnósticos y los tratamientos que requieren estos niños.
Objetivo
El objetivo del presente trabajo es describir las características clínicas, la etiología y la evolución de un grupo de niños hospitalizados por NAC, durante el año 2010, que desarrolló neumonía necrotizante.
Material y métodos
Se realizó un estudio descriptivo retrospectivo incluyendo a todos los niños menores de 14 años, hospitalizados en el HP-CHPR entre el 1º de enero y el 31 de diciembre de 2010 con diagnóstico de NN. Del sistema de registro informatizado se tomó la nómina de niños con diagnóstico de NAC que permanecieron hospitalizados 7 días o más. Se revisaron sus historias clínicas y se seleccionaron como casos los que cumplían con los criterios de NN.
Se definió NAC por la presencia de tos, polipnea y/o tiraje con condensación parenquimatosa con o sin derrame pleural en la RxTx. Se definió NN por la presencia de neumatoceles y uno o más de los siguientes criterios: mal estado general, fiebre que persiste o reaparece, GB mayor a 30.000 o menor a 5.000 elementos/mm3, PCR mayor a 120 mg/dl, LDH en líquido pleural mayor a 2.500 UI/l y/o FBP. Se definió como neumatoceles imágenes radiolúcidas, única o múltiples, redondeadas de paredes finas, rodeadas por una condensación parenquimatosa en la RxTx y/o TC (8,16,17). La FBP fue identificada por el barboteo de aire en el frasco que sella bajo agua el drenaje pleural (23). Se definió neumonía multilobar por la presencia de dos o más focos de consolidación en la RxTx.
De cada paciente se describió: edad, sexo, estado nutricional, enfermedades previas, tipo y número de dosis de PCV recibidas. De la presentación clínica inicial se describió: días de fiebre y antibióticos recibidos antes de la hospitalización; insuficiencia respiratoria, insuficiencia circulatoria, necesidad de ingreso a centro de terapia intensiva (CTI). De los exámenes paraclínicos realizados al momento del diagnóstico se registró: GB y PCR en sangre periférica. En los casos en los que se realizó toracocentesis se constató cifra de LDH pleural. Se describió la proporción de niños con neumonía multilobar. Se describieron los hallazgos en la ecografía torácica, ecografía con Doppler y TC. De la evolución se describió: duración de la fiebre luego del ingreso hospitalario, desarrollo de empiema, FBP, neumotórax, pioneumotórax y pioneumatoceles; necesidad de drenaje pleural y días de permanencia del mismo; necesidad asistencia ventilatoria mecánica (AVM) e ingreso a CTI. Se consignó si requirieron tratamiento quirúrgico y técnica utilizada. Se registró duración del tratamiento antimicrobiano, duración en días de la hospitalización y fallecimientos. Se comparó la presentación clínica y la evolución de los niños que asociaron empiema y FBP con los que no agregaron estas complicaciones.
Del diagnóstico etiológico se consignó germen, si se aisló de líquido pleural y/o sangre. Para S. pneumoniae se describió serotipo y susceptibilidad antimicrobiana. Se describió presencia de antígeno antineumocócico en líquido pleural. Los cultivos, la identificación del agente y la detección de antígenos en líquido pleural se realizaron siguiendo técnicas microbiológicas habituales en el Laboratorio de Microbiología del CHPR (24,25). La serotipificación de S. pneumoniae fue realizada en el Servicio Nacional de Laboratorios de Salud Pública, laboratorio nacional de referencia (Camou T, García Gabarot G).
En los casos en que se identificó S. pneumoniae se correlacionó número de dosis de PCV-7 y PCV-13 recibidas y serotipo de S. pneumoniae.
Para la valoración del estado nutricional se utilizaron criterios de la Organización Mundial de la Salud. Para el análisis estadístico de los datos se utilizó el programa estadístico Epi Info. Se utilizaron como estadísticos descriptivos media y mediana para variables continuas y proporción para variables discretas.
Resultados
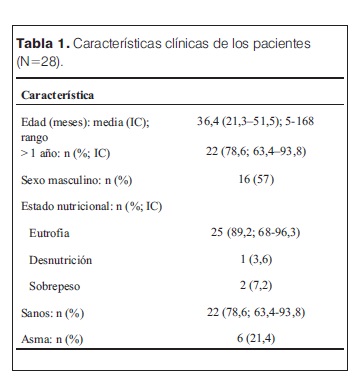
En el período estudiado hubo 10.885 egresos en el HP-CHPR, 331 con diagnóstico de NAC (3%). De estos niños, 75 (22,7%) presentaron complicaciones: 47 empiemas, 6 NN y 22 con ambas patologías. Se diagnosticó NN en 28 niños, representando el 0,26% de los egresos Estos casos se registraron durante todo el año, sin predominio estacional. Las características de los pacientes se muestran en la tabla 1. El análisis de las dosis de PCV recibidas (tabla 2) reveló que dos de los cuatro niños menores de 1 año habían recibido las dosis correspondientes para la edad (dos dosis de PCV7 y/o PCV13). Entre los 21 niños con edades comprendidas entre 1 y 5 años, 10 habían recibido tres dosis de PCV (nueve recibieron tres dosis de PCV-7 y uno recibió dos dosis de PCV-7 más una dosis de PCV-13).
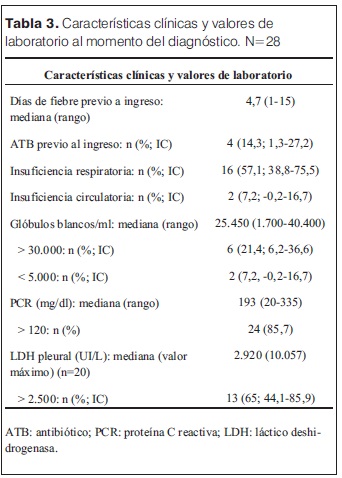
Las características clínicas y los valores de exámenes paraclínicos realizados al momento del diagnóstico se muestran en la tabla 3. En 27 niños se observaron neumatoceles en la RxTx. Los neumatoceles se identificaron al ingreso en un paciente y en la evolución en los restantes. El tiempo transcurrido entre el ingreso y el diagnóstico de neumatoceles tuvo un rango de 1 a 12 días, mediana 8 días. En 17 niños la RxTx del ingreso evidenció derrame pleural. En 18 pacientes (64%; IC 46,5-82) la neumonía fue multilobar. Se realizó ecografía con Doppler en un paciente, no mostró hallazgos compatibles con necrosis. Se realizó TC de tórax con contraste a cuatro niños, en uno diagnosticó neumatoceles no visualizados en la RxTx, en dos identificó pioneumatoceles.
La duración de la fiebre luego del inicio el tratamiento antibiótico fue de 0 a 16 días (media 7,2, mediana 7 días). Veintidós (78,6%; IC 63,4-93,8) pacientes presentaron empiema. Todos requirieron drenaje, con un promedio de 12,4 días de permanencia del mismo (mediana 9,5, rango 4 a 37 días). Nueve niños (32%; IC 14,8-49,4) desarrollaron FBP. Se diagnosticó neumotórax en seis niños, pioneumatoceles en cinco y pioneumotórax en cuatro. Diez pacientes ingresaron a CTI, seis requirieron AVM. En la tabla 4 se muestran las complicaciones presentadas por estos pacientes. En la tabla 5 se comparan las características de los niños que asociaron empiema con los que no presentaron esa complicación. En la tabla 6 se compara las características de los niños que desarrollaron FBP con los que no lo hicieron.
Se realizó tratamiento quirúrgico en 3 pacientes, en uno toilette pleural y necrostomía, en otro lobectomía del lóbulo superior derecho y en el tercero toilette pleural. La duración del tratamiento antibiótico tuvo un rango de 8 a 42 días (mediana 20). La duración de la hospitalización tuvo un rango entre 8 y 43 días (mediana 18). Ningún paciente falleció.
En 14 niños (50 %) la etiología fue neumocócica. S. pneumoniae se aisló en nueve pacientes: siete en líquido pleural, uno en sangre y uno en ambos. Todos eran sensibles a penicilina. Pertenecían a los serotipos 3 (cinco casos), 1 (dos casos), 7 F (un caso) y 14 (un caso). En 13 pacientes se encontró antígeno capsular de S. pneumoniae en líquido pleural. En 8 niños el neumococo se identificó por antígenos capsulares y por cultivos. No se aislaron otros gérmenes. En la tabla 7 se muestran los serotipos de los nueve neumococos aislados y la correlación con PCV recibidas.
Discusión
El HP-CHPR es un centro terciario, de referencia en la atención de niños usuarios del sistema público de salud de todo el país. Se asiste a niños con NAC que requieren hospitalización de Montevideo, área metropolitana y algunos derivados del interior del país. Muchos pacientes con patologías graves cómo NAC complicada son derivados al centro por su complejidad. Por esta razón los datos obtenidos en este trabajo no permiten extraer conclusiones con respecto a la prevalencia de la patología. Además, es probable que se deriven a la institución los casos más graves, lo que podría determinar un sesgo con respecto a la gravedad de los pacientes.
En comparación con datos de la institución, se constató que en los últimos años, luego de la incorporación de PCV al CEV disminuyó la cantidad de ingresos hospitalarios por NAC y sus complicaciones (5). En 2010, si bien la neumonía complicada y la NN no representaron una proporción importante de los egresos del HP-CHPR, asociaron gran morbilidad y altos costos hospitalarios. Esta mayor morbilidad de la NAC también ha sido documentada a nivel mundial (10,12,15).
Los 28 casos de NN se registraron en todos los meses, sin un claro predominio estacional, como es habitual en las infecciones respiratorias (2).
En la NN la infección del parénquima lleva a necrosis (9-12), a través de una gran reacción inflamatoria, con destrucción tisular y sustitución por cavidades llenas de aire, que constituyen neumatoceles (14,15). En las zonas periféricas del pulmón la necrosis determina el desarrollo de FBP (23,26). Algunos autores definen NN por la presencia de neumatoceles, otros incluyen en la definición la presencia de FBP (1,11). Los neumatoceles son estructuras redondeadas de pared fina, dentro de una zona de consolidación pulmonar, que radiológicamente se identifica como una lucencia (2,8,11,13,19). La FBP evidencia una comunicación anormal entre el parénquima pulmonar y el espacio pleural, debida a necrosis de aquel (23,26). Los neumatoceles pueden ser identificados en la TC, la RxTx o durante el acto operatorio (1,13,22). La TC tiene mayor sensibilidad, porque en la RxTx la presencia de consolidación o derrame puede ocultarlos (9,18). En 27 pacientes los neumatoceles fueron identificados a través de la RxTx. Esto se debe a que el protocolo pediátrico-quirúrgico que se utiliza en el HP-CHPR recomienda la valoración inicial de estos pacientes con RxTx, y reserva la TC para los casos en los que se sospecha colección supurada, y/o previo al acto quirúrgico.Las características de estos pacientes fueron similares a las reportadas por otros autores (6,9,15): 78,6% (IC 63,4-93,8) eran sanos; 89,3% (IC 68-96,3) tenían buen estado nutricional; 78,6% (IC 63,4-93,8) eran mayores de 2 años. Dieciséis de los 25 niños menores de 5 años (64%; IC 45,2-82,8) no estaban protegida contra infecciones neumocócicas, ya que la eficacia de las PCV en la prevención de enfermedad neumocócica invasiva por serotipos vacunales, tiene lugar cuando el niño recibió por lo menos 3 dosis de la vacuna (1).
La duración de la fiebre antes del diagnóstico de NAC fue prolongada, tuvo un promedio de 7 días, lo que denota retraso en el diagnóstico. En 18 niños (64,3%; IC 46,5-82) se constató neumonía multilobar. El largo período febril previo al inicio del tratamiento y la neumonía multilobar fueron documentados por otros autores como factores de asociación en el desarrollo de neumonía complicada, en relación con mayor producción de mediadores inflamatorios, que son muy importantes en la patogenia de NN (6,8,11,12). Dieciséis pacientes (51%; IC 38,8-75,5) presentaron insuficiencia respiratoria y/o insuficiencia circulatoria, lo que denota la gravedad de la enfermedad cursada. El porcentaje de niños con NN que requirió ingreso a CTI (35,7%; IC 18-53,5) es superior al de pacientes con NAC no complicada reportado por la institución en años anteriores (3,27%) (5). Entre los hallazgos paraclínicos propuestos como factores de asociación de necrosis (12,15,27), los que fueron identificados en una mayor proporción de pacientes fueron la PCR superior a 120 mg/dl y la LDH superior a 2500 UI/l en líquido pleural. Con respecto a la leucocitosis, solamente 6 pacientes tenía cifras superiores a 30.000, aunque la mayoría presentó valores de leucocitosis muy altos, y en la mitad de los pacientes se constató cifras superiores a 25.000 células/ml. La PCR y la cifra de glóbulos blancos elevados denotan una gran respuesta inflamatoria del huésped. Ésta podría ser el principal determinante de necrosis, sin necesidad de condiciones subyacentes, explicando porque la mayoría de los niños son sanos (15). Ambos parámetros podrían estar indicando una alta carga bacteriana (9,15). La PCR, además, como proteína de fase aguda, juega un rol muy importante en la inmunidad contra el polisacárido C neumocócico. La LDH refleja la injuria del tejido pulmonar, ya que es segregada por células que sufrieron necrosis (16). Tener en cuenta los hallazgos clínicos y del laboratorio que se relacionan con NN puede ayudar a predecir esta complicación (9,15,27).
En 26 niños los neumatoceles no fueron identificados en la primera RxTx, sino en la evolución. Este hecho pudo deberse a que los neumatoceles no fueran visualizados por ser la RxTx un método menos sensible que la TC (9,19). Además más de la mitad de los casos tenía al momento del diagnóstico derrame pleural, que puede ocultarlos. En un estudio retrospectivo de Donelly y colaboradores las cavidades fueron vistas en promedio 8 días antes en la TC que en la RxTx (17). También es probable que los neumatoceles se desarrollen en la evolución, ya que el proceso inflamatorio que determina la necrosis parenquimatosa continúa pese al inicio del tratamiento (16).
Habitualmente más de 90% de niños sanos que cursan una NAC mejora clínicamente, con desaparición de la fiebre y reducción del trabajo respiratorio dentro de las primeras 48 horas luego del comienzo de los antibióticos. En los casos en que esto no ocurre el niño debe ser revaluado, buscando una complicación (9). En los niños con NN la persistencia de la fiebre luego de iniciado el tratamiento antibiótico no indica falla terapéutica, sino es otra evidencia del proceso inflamatorio intenso que tiene lugar a nivel pleuro-pulmonar. Además la inflamación y la destrucción tisular liberan productos pirogénicos (12).
Veintidós niños (78,6%; IC 63,4-93,8) con NN desarrollaron empiema. Este porcentaje es muy superior al reportado en la institución para NAC (4) y al 14% que cita la bibliografía internacional (1). Varios autores han informado alta proporción de empiema en niños con NN (10-12,14,28,29), pero no se encontró en la bibliografía una hipótesis que explique esta asociación. Podría estar vinculada a dos eventos fisiopatológicos que se vinculan a ambas entidades: mayor respuesta inflamatoria del huésped y mayor carga bacteriana. Los niños con NN y empiema eran de mayor edad, con una diferencia significativa entre ambos grupos. Presentaron más días de fiebre luego de iniciado el tratamiento. Esta diferencia no fue significativa, solamente indica una tendencia. Cursaron una enfermedad significativamente más grave, con mayor proporción de niños con insuficiencia respiratoria y requerimiento de AVM. La proporción de niños que requirió CTI y tratamiento quirúrgico, así como la duración de la hospitalización fue más prolongada en los niños con empiema, pero con diferencias no significativas. Se destaca que en número pequeño de casos dificulta el análisis estadístico (tabla 5).
El 40% (IC 20,4-61,5) de los niños con empiema desarrolló FBP. Esta resulta de la expansión de la necrosis a la periferia del pulmón, alcanzando la pleura. Diversas series han informado porcentajes altos, hasta 30%-55% de niños con NN que desarrollan FBP (8,11,12,23,26). Los niños con FBP requirieron más días de drenaje pleural y más días de hospitalización; su evolución fue más grave, con mayor proporción de ingreso a CTI y AVM. La comparación de la mayoría de estas características en ambos grupos (tabla 6) no mostró diferencias significativas, por lo que no es concluyente, solamente marca una tendencia. La hospitalización significativamente más prolongada puede deberse a que la fístula broncopleural requiere más días de permanencia del drenaje pleural, lo que prolonga los días de estancia hospitalaria. Todos los niños que demandaron resección quirúrgica habían presentado FBP.
En este grupo de niños con NN la duración de la hospitalización fue prolongada, en comparación con series de pacientes con NAC y con empiema. Este hecho guarda relación con la gravedad y las complicaciones de estos pacientes (10-12,15). A pesar de su gravedad y de las complicaciones presentadas, no hubo fallecidos.
En 14 niños (50%) la etiología fue S. pneumonaie. No se aisló S. aureus ni H. influenzae. S. pneumoniae continúa siendo el principal agente de NAC y de NAC complicada en Uruguay (3-5). Una publicación que analizó la etiología de NAC en niños hospitalizados en el HP-CHPR entre 1998 y 2004 identificó a S. pneumoniae como agente etiológico en más del 91% de los aislamientos (5). En 32% de los pacientes se pudo aislar S. pneumoniae de líquido pleural y/o sangre. Este porcentaje es mayor que en la NAC sin complicaciones (1,2). Todas las cepas aisladas eran susceptibles a penicilina. Se ha demostrado que la resistencia a la penicilina de neumococo no influye sobre el número creciente de NN observado (12,28). En los últimos tiempos, se ha comprobado además una disminución de la resistencia por un mejor uso de antibióticos y la incorporación de nuevas vacunas conjugadas. Un estudio realizado en Uruguay mostró que la evolución de los menores de 24 meses con neumonía neumocócica invasiva es independiente de la susceptibilidad a la penicilina de S. pneumoniae (30).
Previamente a la introducción de PCV los serotipos neumocócicos más frecuentemente asociados a neumonía complicada eran 1, 3, 7, 14 y 19A, según lo demostraron estudios nacionales e internacionales (4,6). Los datos aportados por el Sistema Regional de Vacunas (SIREVA) de la Organización Panamericana de la Salud (OPS) indican que en la mayoría de los países de América Latina el serotipo 14 era el aislamiento más frecuente en niños con NAC (3), principalmente en menores de 2 años (4) y los serotipos 1 y 5 en los mayores de 2 años. En el presente grupo de pacientes se identificaron los serotipos 3, 1, 7F y 14. Mientras que los tres primeros integran la vacuna antineumocócica PCV13, el serotipo 14 integra la PCV7 y la PCV13. El serotipo 3 representó 55% de los aislamientos. Otras series también encontraron al serotipo 3 como el más frecuentemente aislado en niños con NN (13,28). Se postula que este serotipo es más virulento debido a su gran cantidad de polisacárido capsular y su habilidad para resistir a la fagocitosis (13). Ninguno de los niños en quienes se aislaron los serotipos 1, 3 y 7F habían recibido PCV13. El paciente con serotipo 14 solamente había recibido una dosis de PCV7. Por lo tanto se puede afirmar que ninguno de estos niños se encontraba adecuadamente protegido contra estas bacterias.
Después de iniciar la vacunación universal con vacuna PCV13 se debe mantener la vigilancia de las hospitalizaciones por NAC, la prevalencia de las complicaciones y los cambios en los serotipos de S. pneumoniae que causan NAC. Esta comunicación pretende poner en conocimiento de la comunidad científica la existencia de casos con complicaciones graves de NAC, las características y la evolución de los pacientes.
Referencias bibliográficas
1. Mani C, Murray D. Acute pneumonia and its complications. In: Long S. Principles and Practice of Pediatric Infectious Diseases, 3 ed. Philadelphia: Churchill Livingstone; Elsevier, 2008.
2. Sociedad Latinoamericana de Infectología Pediátrica. Consenso de la Sociedad Latinoamericana de Infectología Pediátrica (SLIPE) sobre Neumonía Adquirida en la Comunidad (NAC). Rev Soc Boliv Pediatr 2010; 49(3):155-209.
3. Hortal M, Camou T, Palacio R, Pérez-Giffoni G, Di Fabio JL; Grupo OPS/SIREVA Uruguay. Vigilancia de las neumococcias del niño hospitalizado: su prevención específica (1994-2000). Rev Med Urug 2002; 18(1):66-75.
4. Ferrari AM, Pírez MC, Martínez A, Algorta G, Chamorro F, Guala MJ, et al. Etiología de la neumonía bacteriana adquirida en la comunidad en niños hospitalizados: Uruguay 1998-2004. Rev Chil Infectol 2007; 24(1):40-7.
5. Pírez MC, Algorta G, Cedrés A, Sobrero H, Varela A, Giachetto G, et al. Impact of universal pneumococcal vaccination on hospitalizations for pneumonia and meningitis in children in Montevideo, Uruguay. Pediatr Infect Dis J 2011; 30(8):669-74.
6. Tan TQ, Mason EO Jr, Wald ER, Barson WJ, Schutze GE, Bradley JS, et al. Clinical characteristics of children with complicated pneumonia caused by Streptococcus pneumoniae. Pediatrics 2002; 110(1 Pt 1):1-6.
7. Pelton SI. Replacement pneumococcal disease in perspective. Clin Infect Dis 2008; 46(9):1353-5.
8. Aracil Santos JF. Neumonía complicada. Bol Pediátr 2008; 48(204):183-8.
9. Lozano Comparini J. Complicaciones respiratorias asociadas a neumonía bacteriana. Rev Neumol Pediátr 2007; 2(2):70-5.
10. Wong KS, Chiu CH, Yeow KM, Huang YC, Liu HP, Lin TY. Necrotising pneumonitis in children. Eur J Pediatr 2000; 159(9):684-8.
11. Hacimustafaoglu M, Celebi S, Sarimehmet H, Gurpinar A, Ercan I. Necrotizing pneumonia in children. Acta Paediatr 2004; 93(9):1172-7.
12. Sawicki GS, Lu FL, Valim C, Cleveland RH, Colin AA. Necrotising pneumonia is an increasingly detected complication of pneumonia in children. Eur Respir J 2008; 31(6):1285-91.
13. Hsieh YC, Hsiao CH, Tsao PN, Wang JY, Hsueh PR, Chiang BL, et al. Necrotizing pneumococcal pneumonia in children: the role of pulmonary gangrene. Pediatr Pulmonol 2006; 41(7):623-9.
14. Gadkowski LB, Stout JE. Cavitary pulmonary disease. Clin Microbiol Rev 2008; 21(2):305-33.
15. Hsieh YC, Hsueh PR, Lu CY, Lee PI, Lee CY, Huang LM. Clinical manifestations and molecular epidemiology of necrotizing pneumonia and empyema caused by Streptococcus pneumoniae in children in Taiwan. Clin Infect Dis 2004; 38(6):830-5.
16. Mahfouz M. Necrotizing pneumonia: sequential findings on chest radiography. Egyp J Bronchology 2009; 3(1):86-9.
17. Donnelly LF, Klosterman LA. Cavitary necrosis complicating pneumonia in children: sequential findings on chest radiography. AJR Am J Roentgenol 1998; 171(1):253-6.
18. Hodina M, Hanquinet S, Cotting J, Schnyder P, Gudinchet F. Imaging of cavitary necrosis in complicated childhood pneumonia. Eur Radiol 2002; 12(2):391-6.
19. Koþucu P, Ahmetoðlu A, Cay A, Imamoðlu M, Ozdemir O, Dinç H, et al. Computed tomography evaluation of cavitary necrosis in complicated childhood pneumonia. Australas Radiol 2004; 48(3):318-23.
20. Chen HJ, Yu YH, Tu CY, Chen CH, Hsia TC, Tsai KD, et al. Ultrasound in peripheral pulmonary air-fluid lesions. Color Doppler imaging as an aid in differentiating empyema and abscess. Chest 2009; 135(6):1426-32.
21. Westphal FL, Lima LC, Netto JC, Tavares E, Andrade Ede O, Silva Mdos S. Surgical treatment of children with necrotizing pneumonia. J Bras Pneumol 2010; 36(6):716-23.
22. Reimel BA, Krishnadasen B, Cuschieri J, Klein MB, Gross J, Karmy-Jones R. Surgical management of acute necrotizing lung infections. Can Respir J 2006; 13(7):369-73.
23. McKee AJ, Ives A, Balfour-Lynn IM. Increased incidence of bronchopulmonary fistulas complicating pediatric pneumonia. Pediatr Pulmonol 2011; 46(7):717-21.
24. Isenberg H D. Clinical Microbiology Procedures Handbook. Washington: American Society of Microbiology, 1994.
25. Clinical and Laboratory Standards Institute. Performance standards for antimicrobial susceptibility testing; 20th Informational supplement M100-S20. Wayne, PA: Clinical and Laboratory Standards Institute, 2010.
26. Hsieh YC, Wang CW, Lai SH, Lai JY, Wong KS, Huang YC, et al. Necrotizing pneumococcal pneumonia with bronchopleural fistula among children in Taiwan. Pediatr Infect Dis J 2011; 30(9):740-4.
27. Ulloa-Gutierrez R. Pneumococcal necrotizing pneumonia and pleural fluid lactate dehydrogenase level. Clin Infect Dis 2008; 47(5):729-30.
28. Bender JM, Ampofo K, Korgenski K, Daly J, Pavia AT, Mason EO, et al. Pneumococcal necrotizing pneumonia in Utah: does serotype matter? Clin Infect Dis 2008; 46(9):1346-52.
29. Ramphul N, Eastham KM, Freeman R, Eltringham G, Kearns AM, Leeming JP, et al. Cavitatory lung disease complicating empyema in children. Pediatr Pulmonol 2006; 41(8):750-3.
30. Pírez MC, Giachetto G, Romero C, Zabala C, Algorta G, Montano A, et al. Neumonía neumocócica invasiva en niños de 0 a 24 meses: ¿influye la resistencia bacteriana en la evolución? An Pediatr (Barc) 2008; 69(3):205-9.
Correspondencia: Dra. Karina Machado.
Correo electrónico: kmachado@hotmail.com