Servicios Personalizados
Revista
Articulo
Links relacionados
Compartir
Archivos de Pediatría del Uruguay
versión On-line ISSN 1688-1249
Arch. Pediatr. Urug. vol.83 no.1 Montevideo mar. 2012
CASOS CLÍNICOS
Arch Pediatr Urug 2012; 83(1)
Síndrome de Cushing secundario a interacción medicamentosa ritonavir/fluticasona
Mey Aguirre 1, Stella Gutiérrez 2, Jorge Quian 2, María José Ramírez 3, Virginia González 4
1. Residente de Pediatría.
2. Profesor Agregado de Pediatría.
3. Pediatra. Endocrinólogo.
4. Asistente de Pediatría.
Fecha recibido: 18 de noviembre de 2011.
Fecha aprobado: 8 de mayo de 2012.
Resumen
Se presentan tres casos clínicos de niños con infección por el virus de la inmunodeficiencia humana (en tratamiento con ritonavir/lopinavir, zidovudina y lamivudina) y asma persistente y/o rinitis alérgica (en tratamiento con propionato de fluticasona inhalado o intranasal) que luego de terapia concomitante presentan, aumento de peso, cara de luna llena y estrías en muslos. En el caso 1 el diagnóstico fue clínico no lográndose la confirmación por laboratorio. En los casos 2 y 3 el cortisol sérico y ACTH fueron consistentes con supresión adrenal. En el caso 1 al suspender la fluticasona se normalizó examen físico a los 6 meses. En el caso 2 al suspender fluticasona se normalizó examen clínico a los 6 meses, no realizándose paraclínica. En el caso 3 a los 6 meses del cambio de ritonavir se evidencia retroceso de la clínica y normalización de la ACTH y cortisolemia. Se confirma así un síndrome de Cushing iatrogénico secundario a interacción medicamentosa ritonavir/fluticasona.
Palabras clave:
SÍNDROME DE CUSHING
INFECCIONES POR VIH
ASMA
RITONAVIR-efectos adversos
CORTICOESTEROIDES- efectos adversos
INTERACCIONES DE DROGAS
Summary
We present 3 cases of children infected with human immunodeficiency virus (treated with ritonavir / lopinavir, zidovudine and lamivudine) and persistent asthma, and/or allergic rhinitis (treatment with inhaled fluticasone propionate or intranasal) that later have concomitant therapy, weight gain, moon face, and stretch marks on thighs. In case 1 the diagnosis did not achieve clinical laboratory confirmation. In cases 2 and 3, the serum cortisol and ACTH were consistent with adrenal suppression. In case 1 after discontinuation of fluticasone physical examination was normal at 6 months. In case 2 after stopping fluticasone clinical examination was normal at 6 months, no paraclinical performing. In case 3 to 6 months of ritonavir exchange of clinical regression and normalization of ACTH and cortisol levels was evident. This confirms iatrogenic Cushing's syndrome secondary to ritonavir drug interaction/fluticasone.
Key words:
CUSHING SYNDROME
HIV INFECTIONS
ASTHMA
RITONAVIR-adverse effects
ADRENAL CORTEX HORMONES-adverse effects
DRUG INTERACTIONS
Introducción
El tratamiento de la infección por el virus de la inmunodeficiencia humana (VIH) ha experimentado cambios sustanciales en los últimos 20 años. La implementación de la terapia antirretroviral (TARV) y la profilaxis y tratamiento de las infecciones oportunistas ha sido esencial en este grupo vulnerable de pacientes (1,2). Se logra de este modo que los niños afectados mejoren su calidad de vida disminuyendo la morbimortalidad, las hospitalizaciones y transformando la infección por el VIH en una enfermedad crónica (3,4).
El TARV desde la década de los 90 incluye generalmente un inhibidor de la proteasa (IP) (5-7). Todo este grupo farmacológico presenta frecuentes efectos adversos e interacciones medicamentosas (8).
Desde el inicio de la utilización de los IP se describieron efectos adversos entre los que se incluye síndrome de Cushing y seudo síndrome de Cushing. En 1999 una correspondencia de Hillebrand y col informan lo que parece ser la primera comunicación que un IP, ritonavir utilizado como tratamiento produjo el síndrome de Cushing en un paciente tratado con fluticasona (9,10).
Ritonavir es un IP que ha sufrido modificaciones en su utilización. En una primera etapa se utilizó como antirretroviral formando parte del triple plan; en los últimos años se utiliza como “booster” asociado a otro IP pero en dosis bajas con lo que potencia la acción del otro IP. Ritonavir inhibe en forma potente el sistema enzimático citocromo P450 por unión competitiva reversible a la isoenzima CYP3A4 (11). Esta potente inhibición enzimática permite alcanzar mayores concentraciones de otros IP por lo que se puede reducir el número de comprimidos al día lo que mejora la adherencia y previene fallos de tratamiento por resistencia (12,13) Los efectos adversos de ritonavir son varios entre los que se menciona el síndrome de lipodistrofia que puede confundir clínicamente con el síndrome de Cushing (14,15).
Fluticasona es un glucocorticoide inhalatorio o intranasal utilizado en la prevención de las exacerbaciones del asma persistente y de la rinitis alérgica. Habitualmente tiene efectos sistémicos mínimos a las dosis recomendadas (100-250 µg día).
Es metabolizada por el mismo sistema enzimático mencionado anteriormente por lo que la coadministración con ritonavir resulta en un incremento de las concentraciones sistémicas de fluticasona pudiendo causar supresión del eje hipotálamo-hipofiso-adrenal y síndrome de Cushing. Este síndrome ha sido reportado en pacientes que reciben esta combinación medicamentosa frecuentemente en adultos y menos en pediatría (16,17).
El objetivo de la presente comunicación es describir tres casos clínicos de Cushing exógeno, secundario a la interacción medicamentosa entre ritonavir y fluticasona y llamar la atención de quienes utilizan estos medicamentos sobre el riesgo de aparición de esta interacción medicamentosa.
Casos clínicos
Caso 1. Niño de 7 años, infectado por transmisión vertical. Buen crecimiento y desarrollo, bien inmunizado.
Tratado con zidovudina (AZT), lamivudina (3TC) y nelfinavir desde los 3 meses de vida. A los 7 años de edad (año 2008) se cambió nelfinavir por lopinavir-ritonavir. Seis meses después, en consulta con neumología pediátrica, se agregó fluticasona 250 µg cada 12 horas por asma persistente. Dos meses luego de esta indicación, aumento de peso, giba dorsal, estrías en muslos con escaso desarrollo muscular glúteo. Con planteo clínico de síndrome de Cushing secundario a interacción medicamentosa se suspendió fluticasona con retroceso de los signos clínicos, alcanzando un examen físico normal a los 6 meses. No se realizaron dosificaciones sanguíneas.
Se suspendió el tratamiento preventivo del asma quedando sólo con tratamiento de las crisis.
Caso 2. Niño de 7 años infectado por transmisión vertical. Talla baja y retraso del desarrollo; bien inmunizado. En tratamiento con AZT, 3TC y nelfinavir desde los 16 meses de vida. A los 5 años de edad se cambió el IP por lopinavir/ritonavir. En mayo 2010, a los 7 años de edad, dada la persistencia de obstrucción nasal crónica (adenoidismo) y en interconsulta con otorrinonaringólogo, se inició tratamiento con fluticasona intranasal 100 µg cada 12 horas. Dos meses después, aumento del apetito y de peso. En el examen físico cara de luna llena, hipertricosis, obesidad central y estrías rojas en muslos. Se realizó diagnóstico clínico de síndrome de Cushing secundario a interacción fluticasona/ritonavir.
Las determinaciones sanguíneas de ACTH y cortisol fueron indetectables.
Se suspendió fluticasona y se inició descenso progresivo con hidrocortisona 10 mg/día con buena evolución. Se reemplazó la fluticasona por budesonida.
Caso 3. Adolescente de 14 años de sexo femenino con antecedentes personales de neumonías reiteradas y asma persistente moderada tratada con fluticasona 250 µg cada 12 horas desde enero de 2008 con buena respuesta terapéutica. Buen crecimiento y desarrollo, inmunizaciones vigentes. En febrero 2009, candidiasis orofaríngea severa que condujo al diagnóstico de infección por VIH de mecanismo de transmisión desconocida, comenzando tratamiento con AZT, 3TC y lopinavir/ritonavir. Al mes de iniciada la TARV presentó en forma progresiva cambio de carácter con irritabilidad, aumento del apetito y de peso, cara de luna llena, brillante, estrías en cara interna de ambos muslos. Carga viral indetectable. El crecimiento se detuvo.
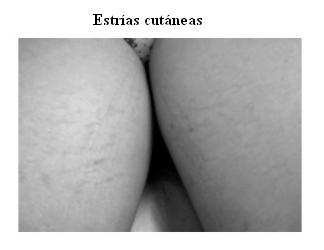
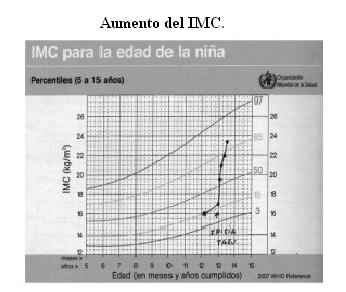
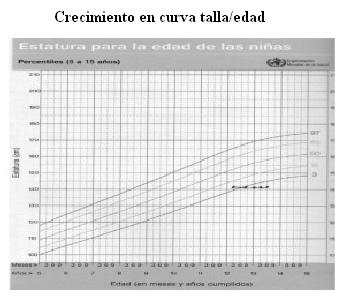
La cara de luna llena y las estrías se muestran en las figuras 1 y 2; el incremento de peso y detención de la talla en las figuras 3 y 4.
Se realizó diagnóstico de síndrome de Cushing secundario a interacción fluticasona-ritonavir. ACTH y cortisol fueron indetectables en sangre.
Dada la gravedad de su asma, continuó con fluticasona disminuyendo la dosis a 250 µg/día y se suspendió lopinavir/ritonavir sustituyéndolo por efavirenz. Se inició hidrocortisona 15 mg/día con descenso progresivo.
A los 6 meses del cambio de medicación ARV, presentó desaparición de los signos clínicos con valores de cortisol y ACTH normales.
Discusión
Los ARV utilizados en el TARV si bien tienen ya varios años de indicación en niños y adolescentes, se usan en combinaciones variables entre ellos y con medicamentos necesarios para otras patologías. Esto ha hecho dificultoso diagnosticar rápidamente los efectos adversos y las interacciones medicamentosas.
Uno de los primeros planes de TARV utilizados por los autores fue la asociación de AZT, 3TC y primero ritonavir y posteriormente nelfinavir como IP. En el año 2007 hubo una recomendación general de no utilizar mas nelfinavir por sus posibles efectos adversos graves (8) y se decidió sustituirlo por la combinación lopinavir/ritonavir que anteriormente no se disponía. En esta combinación el ritonavir se prescribe a dosis menores que cuando se utilizaba aislado (18,19).
Los IP así como la mayoría de los ARV solos o en combinación pueden provocar el síndrome de lipodistrofia, que clínicamente pueden confundirse con el síndrome de Cushing y que llevan a retardar el diagnóstico. Hay varias publicaciones al respecto y sobre todo en los pacientes pediátricos, al iniciar el TARV se observa que el paciente aumenta de peso, tiene más apetito, aparecen depósitos de grasa donde previamente existía desnutrición, elementos que pueden confundir el diagnóstico (20).
Recién en el año 2010 aparecieron las recomendaciones de no combinar ritonavir con fluticasona (21). Los pacientes presentados todos fueron tratados y diagnosticados antes de esa fecha. Pero no es sólo la fluticasona la que puede provocar este síndrome en conjunción con ritonavir. Hay publicaciones que involucran a budesonida y triamcinolona (22,23).
Por otra parte son frecuentes en los pacientes infectados con VIH la hiperreactividad bronquial y las enfermedades obstructivas de la vía aérea (24).
Son pocos los profesionales pediatras que utilizan ARV; pero son varios los que ven estos pacientes en sus consultas y los especialistas a quienes son derivados para optimizar ciertos tratamientos. Es con ese objetivo que se presentan estos tres casos de niños infectados con el VIH que tuvieron enfermedad respiratoria y requirieron consultas especializadas.
Son dos las posibilidades que se presentan para evitar esta asociación. En cuanto a los ARV es posible modificar el IP o por otro IP (aunque muchos tienen como booster a ritonavir) o a ARV de otra clase. Existen limitaciones terapéuticas, porque si bien en el mercado existen más de 20 ARV, muchos de ellos no son de uso pediátrico o no tienen presentaciones adecuadas y por tanto es necesario ser muy cuidadoso en la indicación.
Referencias bibliográficas
1. Sterne J, Hernán M, Ledergerber B, Tilling K, Weber R, Sendi P et al. Long term effectiveness of potent antiretroviral therapy in preventing AIDS and death: a prospective cohort study. Lancet 2005; 366: 378-84.
2. Kaplan J, Hanson D, Dworkin M, Frederick T, Bertolli J, Lindegren M et al. Epidemiology of the HIV associated opportunistic infections in the United States in the era of highly active antiretroviral therapy. Clin Infect Dis 2000; 30 (Suppl 1): S5-S14.
3. Quian J, Gutierrez S, Pujadas M, Gonzalez V, Mas M, Parodi A et al. Hospitalizaciones de niños infectados por el VIH. Arch Pediatr Urug 2008; 79(2): 105-12.
4. Battegay M, Nüesch R, Hirschel B, Kaufmann G. Immunological recovery and antiretroviral therapy in HIV-1 infection. Lancet Infect Dis 2006; 6: 280-7.
5. Sanchez J, Ramos J, Fernandez S, Gonzalez M, Rojo P, Ferrando P et al. Impact of highly active antiretroviral therapy on the morbidity and mortality in Spanish HIV-infected children. Pediatr Infect Dis J; 2003; 22: 863-7.
6. Giaquinto C, Morelli E, Fregonese F, Rampon O, Penazzato M, de Rossi A. Current and future antiretroviral treatment options in Paediatric HIV infection. Clin Drug Invest 2008; 28 (6): 375-97.
7. Gilkman D, Wlsh L, Valkenburg J, Mangat D, Marcinak J. Hospital-based directly observed therapy for HIV-infected children and adolescents to assess adherence to antiretroviral medications. Pediatrics 2007; 119(5): e1142-e1148.
8. Working Group on Antiretroviral Therapy and Medical Management of HIV-Infected Children. Guidelines for the use of antiretroviral agents in pediatric HIV infection. February 28, 2008. Disponible en: http://aidsinfo.nih.gov. [consulta: 23 de marzo de 2012].
9. Miller K, Daly P, Sentochink D, Dowelko J, Samore M, Basgoz N, Grinspon S. Pseudo-Cushing’s syndrome in HIV-Infected patients. Clin Infect Dis 1998; 27: 68-72.
10. Hillegrand M, Prummel M, ten Veen J. Ritonavir-induced Cushing’s syndrome in a patient treated with nasal fluticasone. AIDS 1999; 13(13): 1803.
11. Flexner C. Antirretrovíricos y tratamiento de la la infección por VIH. En: Goodman&Gilman. Las bases farmacológicas de la Terapéutica. 11ed. México: Mc Graw Hill, 2006: 1301-2.
12. Von Moltke L, Greenblatt D, Grassi J, Granda B, Duan S, Fogelman S et al. Protease inhibitors as inhibitors of human cytochromes: high risk associated with ritonavir. J Clin Pharmacol 1998; 38(2): 106-111
13. Hammer S, Saag M, Schechter, Montaner J, Schooley R, Jacobsen D et al. International AIDS Society-USA panel. Treatment for adult HIV infections: 2006 recommendations of the International AIDS Society-USA panel. JAMA 2006; 296(7): 827-43.
14. le Roux C, Beckles M, Besser G, Pinching A, Davison A. Cushing’s syndrome secondary to inhaled corticosteroids mimicking HIV-associated lipodystrophy. HIV Medicine 2001; 2: 133-5.
15. Gupta S, Dubé M. Exogenous Cushing syndrome mimicking HIV lipodistrophy Clin Infect Dis 2002; 39: e69-e71.
16. Bhumbra N, Sahloff E, Oehrtman S, Horner J. Exogenous Cushing syndrome with inhaled fluticasone in a child receiving lopinavir/ritonavir. Ann Pharmacother 2007; 41: 1305-9.
17. Valin N, de Castro N, Garrait VB, Bergeron A, Bouché C, Molina J. Iatrogenic Cushing’s syndrome in HIV-infected patients receiving ritonavir and inhaled fluticasone: description of 4 new cases and review of the literature. J IAPAC 2009; 8(2): 113-21.
18. Nachman S, Stanley K, Yogev R, Pelton S, Wiznia A, Lee S et al. Nucleoside amalogs plus ritonavir in stable antiretroviral therapy-experieenced HIV-infected children: a randomized controlled trial. Pediatric AIDS clinical trial group 338 study team. JAMA 2000; 283(4): 492-8.
19. von Rossum A, de Groot R, Hartwig N, Weermaes C, Head S, Burger D. Pharmacokinetics of indinavir and low-dose ritonavir in children with HIV-1 infection. AIDS 2000; 14(14): 2209-10.
20. Johnson S, Marion A, Vrchoticky T, Emmanuel P, Zilebermann J. Cushing syndrome with secondary adrenal insufficiency from concomitant therapy with ritonavir and fluticasone. J Pediatr 2006; 148: 386-8.
21. Panel on antiretroviral therapy and medical management of HIV-infected children. Guidelines for the use of antiretroviral agents in pediatric HIV infection. August 16, 2010. Obtenido de: http://aidsinfo.nih.gov/ContentFiles/PediatricGuidelines.pdf. [consulta: 23 de marzo de 2012].
22. Dort K, Padis S, Wispelwey B, Moore C. Adrenal suppression due to an interaction between ritonavir and injected triamcinolene: a case report. AIDS Res Ther 2009; 6: 10.
23. Gray D, Roux P. Carrihill M, Klein M. Adrenal suppression and Cushing syndrome secondary to ritonavir and budesonide. A Afr Med J 2010; 100(5): 296-7.
24. Poirier C, Inhaber N, Lalonde R, Ernst P. Prevalence of bronchial hyperreponsiveness among HIV-infected men. Am J Respir Crit Care Med 2001; 164: 542-5.
Correspondencia: Jorge Quian. Pilcomayo 5163. Montevideo, Uruguay. Correo electrónico: jorgeq@internet.com.uy