Services on Demand
Journal
Article
Related links
Share
Archivos de Pediatría del Uruguay
On-line version ISSN 1688-1249
Arch. Pediatr. Urug. vol.81 no.4 Montevideo Dec. 2010
ARTÍCULO ORIGINAL
Investigación de Metapneumovirus humano en pacientes hospitalizados:
estudio multicéntrico
Conrado Medici1, Cecilia Crapuchetti1, Alejandra Mattiauda1, Sandra Frabasile2, Andrés Pizzorno2,
Martín Masner2, Cecilia Machin3, Rosanna Silveira3, Jimena Zeballos4, Yeannette Galazka5,
Lara Batthyany6, Miguel Estevan7, Juan Arbiza2, Ivonne Rubio1, Ma Julia Saráchaga1
1. Departamento de Pediatría y especialidades. Centro Hospitalario Pereira Rossell.
2. Sección Virología. Facultad de Ciencias.
3. Hospital Central de las Fuerzas Amadas.
4. Hospital Policial.
5. Asociación Española 1ª de Socorros Mutuos.
6. Hospital Británico.
7. Departamento de Radiología Pediátrica. Centro Hospitalario Pereira Rossell
Departamento de Pediatría y Especialidades, Facultad de Medicina, Universidad de la República, Hospital Pediátrico. Centro Hospitalario Pereira Rossell.
Bulevar Artigas 1550, Montevideo, CP 11600, Uruguay
Fecha recibido: 11 de agosto de 2010.
Fecha aprobado: 10 de febrero de 2011.
Resumen
Introducción: las infecciones respiratorias agudas bajas (IRAB) son la primer causa de hospitalización a lo largo del año. La etiología viral es la más frecuente. El Metapneumovirus humano (MNVh) ha sido vinculado a las IRAB con aspirado negativo para Virus respiratorio sincicial (VRS) y Adenovirus (AD).
Objetivo: determinar la prevalencia, epidemiología, clínica y severidad de las infecciones por MNVh, e intentar detectar un patrón radiológico relacionado con el mismo.
Métodos: se estudiaron niños entre 0 y 2 años de edad internados por IRAB en el Centro Hospitalario Pereira Rossell, Hospital Central de las Fuerzas Armadas, Hospital Policial, Hospital Británico y Asociación Española Primera de Socorros Mutuos en el período 1 de abril al 30 de noviembre de 2006. Los aspirados nasofaríngeos fueron analizados en la Sección Virología de la Facultad de Ciencias.
Resultados: se estudiaron 185 pacientes, obteniéndose 17 resultados positivos para MNVh (9,2%), con 9 coinfecciones con VRS. La mayoría de los pacientes tenían 6 meses o menos de edad. Las manifestaciones clínicas principales fueron polipnea, tirajes y sibilancias. Los principales hallazgos radiológicos fueron infiltrado intersticial difuso e hiperinsuflación. Ningún paciente requirió internación en unidad de cuidados intensivos y no hubo casos fatales.
Conclusiones: la prevalencia, características clínicas y evolutivas de las infecciones por MNVh no mostraron diferencias frente a las producidas por el VRS.
Palabras clave:
INFECCIONES DEL SISTEMA RESPIRATORIO
METAPNEUMOVIRUS
SÍNTOMAS CLÍNICOS
Summary
Introduction: acute lower respiratory tract infections (ALRTI) are the first cause of hospitalization throughout the year, increasing during winter months. Viral infections are the most frequent etiology. Human metapneumovirus (hMPV) has been linked to lower respiratory tract infections with a negative nasopharyngeal aspirate for Respiratory sincytyal virus (RSV) and Adenovirus (AD).
Objectives: establish the prevalence, epidemiology, clinical presentation and severity of hMPV infections, and try to determinate a radiologic pattern related to this virus.
Methods: we studied infants between 0 to 2 years of age hospitalized with ALRTI at the Centro Hospitalario Pereira Rossell, Hospital Central de las Fuerzas Armadas, Hospital Policial, Hospital Británico and Asociación Española Primera de Socorros Mutuos during the period 01/04/06-30/11/06. The nasopharyngeal aspirates were analyzed at Sección Virología of the Facultad de Ciencias.
Results: out of the 185 samples analyzed, 17 hMPV positive cases (9.2%) were found, with 9 hMPV-RSV coinfections. Most patients were 6 months of age or less. The main clinical manifestations were tachypnea, chest indrawings and wheezing. Hyperinsuflation and diffuse interstitial infiltrates were the most frequent radiologic findings. None of the patients required admission at intensive care units and there were no fatal cases.
Conclusions: the prevalence, clinical presentation and evolution of hMPV infections didn´t show differences with RSV infections.
Key words:
RESPIRATORY TRACT INFECTIONS
METAPNEUMOVIRUS
SYMPTOMS, CLINICAL
Introducción
Las infecciones respiratorias agudas bajas (IRAB) son la primera causa de hospitalización a lo largo del año, con un aumento en los meses de invierno (1). La etiología viral es la más frecuente, siendo el Virus Respiratorio Sincicial (VRS) el agente causal de un 60-80% de las mismas (2,3). Hasta un 45% de los niños presentan investigación virológica negativa, pudiendo tener un cuadro clínico grave, que requiera internación en cuidados intensivos y que puede inclusive resultar fatal (2).
El Metapneumovirus humano (MNVh) fue descubierto en el año 2001 por Van den Hoogen y colaboradores en Holanda (4). Este virus respiratorio pertenece a la familia Paramyxoviridae, subfamilia Pneumomovirinae (5-8). Posee un genoma de ARN de hebra simple negativa no segmentada (6,8,9) envuelto por una membrana bilipídica de origen celular.
Es el agente causante de entre 5-20% de los cuadros respiratorios en niños con aspirado nasofaríngeo (ANF) negativo para VRS y Adenovirus (AD) (8-10), produciendo también IRAB en adultos (11).
Estudios de detección de anticuerpos anti-MNVh en sangre indican que este virus ha estado circulando en la población durante al menos 50 años presentando, además, una distribución mundial, ya que ha sido detectado en todos los continentes (4).
Si bien su patogenia es poco conocida, se postula que la respuesta inflamatoria es la principal responsable de los síntomas y signos (8,12). Estudios experimentales realizados en ratones infectados con MNVh mostraron que la primoinfección produciría un efecto protector contra nuevas infecciones por este virus, impidiendo las reinfecciones pero sin protección cruzada para VRS (13).
Su período de incubación es de 5 a 6 días, y su transmisión a través de gotitas de secreción respiratoria. Se ha descrito transmisión nosocomial, lo que sugiere la necesidad del aislamiento de contactos y el lavado de manos como medidas de prevención contra su diseminación (8,10).
Los síntomas clínicos son indistinguibles de los del VRS (14), provocando resfríos, bronquiolitis y neumonía. Puede incluso provocar cuadros severos, especialmente en menores de 5 años (8) o también cursar en forma asintomática. La severidad de la infección por el MNVh en niños sanos puede ser comparable con la del VRS (15), aunque algunos estudios sugieren menor severidad y menor frecuencia de neumonías e internación en cuidados intensivos (16). La coinfección MNVh-VRS produciría cuadros de mayor gravedad (5,17). Los pacientes prematuros y los transplantados son también grupos de riesgo para la infección por este virus (7).
La reacción en cadena de polimerasa de transcriptasa reversa (RT-PCR) es en este momento la prueba ideal para el diagnóstico, siendo más sensible y de resultados más rápidos que el cultivo celular (8,18). La puesta a punto de esta técnica permitió la detección de MNVh en los ANF analizados. Se han desarrollado tests rápidos para la detección de antígenos de MNVh en muestras de aspirado nasofaríngeo mediante inmunofluorescencia directa, con una especificidad de 63%-73% y un 97%-100% de sensibilidad (12,18). También existen tests rápidos de inmunocromatografía (19) con un 71%-82% de sensibilidad y 93%-95% de especificidad (20,21).
Objetivos
Determinar la prevalencia de infecciones por MNVh en los pacientes entre 0 y 2 años de vida que ingresaron por infección respiratoria aguda baja en diferentes instituciones participantes del estudio.
Evaluar la distribución a lo largo del período estudiado, la forma de presentación clínica y la severidad de los cuadros producidos por el MNVh y en las coinfecciones MNVh-VRS. Intentar detectar un patrón radiológico relacionado con la etiología.
Material y método
Estudio descriptivo, transversal, observacional, sin intervención sobre el manejo clínico de los pacientes.
Población: niños de entre 0 y 2 años que ingresaron por infección respiratoria aguda baja al Hospital Pediátrico – Centro Hospitalario Pereira Rossell (HP-CHPR), Hospital Central de las Fuerzas Armadas (HCFFAA), Hospital Policial (HP), Hospital Británico(HB) y Asociación Española Primera de Socorros Mutuos (ASESP) entre el 1 de abril y el 30 de noviembre de 2006.
En el HP-CHPR todos los niños que se incluyeron presentaron al ingreso un ANF negativo para VRS y AD por inmunocromatografía. En los restantes centros se incluyeron pacientes con ANF positivo o negativo para VRS por inmunocromatografía.
Las muestras fueron procesadas mediante RT-PCR en la Sección Virología de la Facultad de Ciencias con el fin de detectar la presencia de MNVh y/o VRS. Se realizaron estudios de secuencia de las muestras positivas para MNVh mediante la amplificación de los genes N y G del genoma viral.
Los pacientes se dividieron en cuatro grupos: VRS positivo, ANF negativo, MNVh positivo y coinfección. Se valoró la presencia de conjuntivitis, tos coqueluchoide, disfonía, imposibilidad para beber, polipnea, tiraje y sibilancias. Se definió insuficiencia respiratoria al ingreso una saturación de oxígeno menor a 95% al aire o en aquellos niños que no contamos con el dato de la saturación pero que fueron trasladados con oxígeno a las instituciones. La severidad de la obstrucción respiratoria se evaluó por el puntaje de TAL al ingreso, considerando bronquiolitis leve con valor £ 4, moderada con valor ³ 5 £ 8 y severa con valor ³ 9 (22). Las radiografías de tórax (RxTx) fueron informadas por médicos radiólogos participantes del estudio en base a las pautas para uniformar la nomenclatura diagnóstica y la codificación (CIE-10) de las neumonías y bronquiolitis del niño de la Organización Mundial de la Salud (23).
Las muestras se obtuvieron previo firma de un consentimiento informado por los padres o responsables de los niños.
El proyecto se sometió a la aprobación del comité de ética de investigación del Instituto de Pediatría.
Los datos fueron analizados con los programas de Epidemiología Informática EPI-INFO 2000 y SPSS Statistics 17.0. Para evaluar la asociación entre las variables clínicas y radiológicas con el grupo de infección se aplicó la prueba de independencia de Pearson (Chi cuadrado), con un nivel de significación de 5%. Dado el bajo número de pacientes en alguno de los grupos de estudio, se aplicó el método de simulación de Monte Carlo para calcular el valor p asociado de la prueba. Para probar la diferencia en promedio de los grupos en la edad y los días de internación de los niños se aplicó la prueba de Krustal-Wallis.
Resultados
De las 215 muestras consideradas para el estudio, 30 (13,9%) debieron ser excluidas ya que no cumplían con los criterios de inclusión o no tenían correctamente llenada la ficha de recolección de datos.
Se estudiaron 185 pacientes, 126 del HP-CHPR, 22 del HCFFAA, 10 del HP, 11 del HB y 16 de la ASESP.
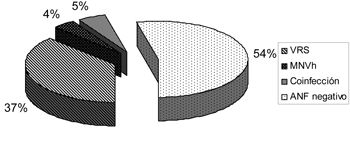
Se identificó MNVh en 17 niños (9,2%), 14 provenientes del CHPR, dos del HCFFAA y uno de la ASESP. 68 niños presentaron aspirado positivos sólo para VRS (36,7%), ocho sólo para MNVh (4,3%), nueve presentaron coinfección MNVh-VRS (4,9%) y en 100 (54%) no se identificó ningún virus.
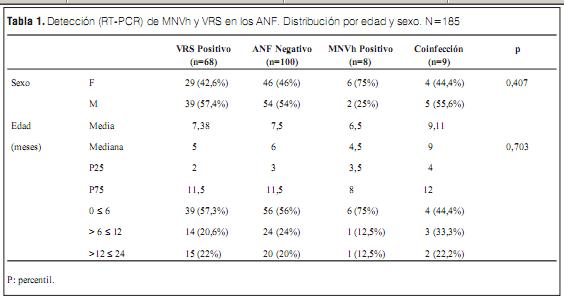
En la tabla 1 se muestran los datos de la población analizada, en cuanto a edad y sexo y los resultados obtenidos de la detección de VRS y MNVh en los ANF. La edad presenta una distribución asimétrica con predominio en menores de 6 meses en los cuatro grupos. De esta forma se justifica el uso de la mediana para describir la distribución acompañada por el primer (25%) y tercer cuartil (75%).
La figura 1 muestra los virus identificados por RT-PCR en los ANF.
Figura 1. Virus identificados en ANF. n=185
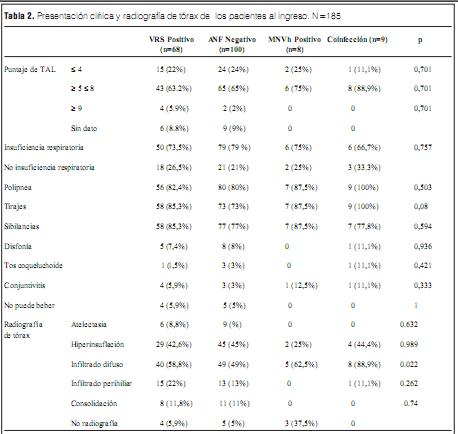
En la tabla 2 se indica la presentación clínica y los hallazgos radiográficos en los niños incluidos en el estudio. En 15 niños no contamos con el TAL y en 12 no se realizó RxTx.
Los síntomas predominantes fueron polipnea, tirajes y sibilancias, al igual que en los pacientes con infección por VRS y en los ANF negativos. Al ingreso, 6 de los pacientes MNVh positivos y 8 de las coinfecciones fueron catalogados como IRAB moderadas por puntaje de TAL. Hubo casos severos sólo en los pacientes VRS positivos (5,9%) y en los pacientes con ANF negativo (2%).
El patrón radiológico más frecuente en los cuatro grupos fue la hiperinsuflación y el infiltrado intersticial difuso. Para el infiltrado difuso existió una diferencia estadísticamente significativa a favor de las infecciones por MNVh y las coinfecciones. Ningún paciente con infección por MNVh o con coinfección presentó atelectasia o consolidación radiológica.
La distribución de los aislamientos virales en los meses evaluados (abril-noviembre 2006) se muestra en la figura 2, donde se observa un solapamiento de las infecciones producidas por VRS y MNVh.
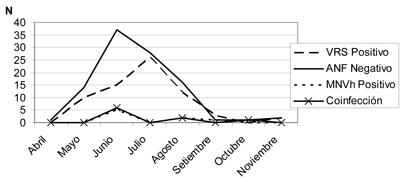
Figura 2. Distribución de los agentes virales identificados. n=185
La media de días de internación fue 6,14 (rango 2-29 días) para los casos VRS positivos, 5,62 (rango 4-7 días) para los MNVh positivos, 6,11 (rango 3-15 días) para las coinfecciones y 7 (rango 1-54 días) para los ANF negativos. El valor de p para días de internación fue 0,807, por tanto no existe diferencia entre los días de internación medios para los cuatros grupos.
En la figura 3 se resume la evolución clínica de los individuos infectados, considerando la necesidad de internación en el centro de cuidados intensivos y asistencia ventilatoria mécanica. Ningún paciente con infección por MNVh requirió internación en área de cuidados intensivos y no hubo casos fatales.
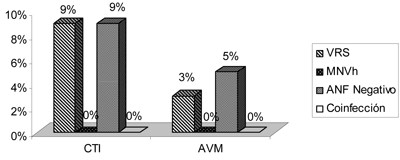
Figura 3. Evolución clínica. El valor de la p para internación en CTI es de 0,675 y para AVM de 0,853.
CTI: centro de tratamiento intensivo. AVM: asistencia ventilatoria mecánica. n=185
Discusión
El primer estudio sobre el MNVh en Uruguay fue un estudio de serología realizado por Mirazo y colaboradores en donde se demostró que este virus estuvo circulando en nuestro país por lo menos desde el año 1998 (24). La circulación de los dos grupos genéticos A y B, así como los distintos genotipos (A1, A2a, A2b, B1 y B2) y sus relaciones filogenéticas se comprobó por estudios moleculares (25).
En nuestro trabajo se constató una prevalencia de MNVh de 9,2% (n=17), coincidiendo con los registros internacionales (1,5%-20%) (8,9). Dado que la mayoría de las muestras estudiadas eran negativos para VRS y considerando la alta prevalencia de coinfección MNVh-VRS hallada (9/17), podría existir un subdiagnóstico de las infecciones por MNVh.
La distribución por sexo y edad no presentó diferencias entre los grupos.
En cuanto a la distribución estacional en el período estudiado, no se encontraron diferencias en cuanto a los meses en que predominaron las infecciones por MNVh frente al VRS y a los casos con ANF negativo. En un estudio realizado en Argentina por Laham y colaboradores (26) se mostró un patrón estacional para la infección por MNVh, con dos picos de incidencia, el primero coincidente con el VRS en el mes de junio, y el segundo durante el mes de setiembre, el cual no coincidía con VRS. Esto, según lo expresan los autores, podría haber influido de forma negativa para el hallazgo de coinfecciones (26). Las muestras analizadas en este trabajo que fueron positivas para MNVh presentaron dos picos de incidencia coincidentes con las infecciones por VRS, uno a principios del invierno (mediados de junio) y otro menor en el mes de agosto. Esta superposición con la infección de VRS puede ser una de las causas del importante porcentaje de coinfecciones MNVh-VRS encontrado.
La presentación clínica de las infecciones por MNVh no presentó diferencias con las que se observan para infecciones producidas por VRS. Por lo tanto la detección de este tipo de infección basado solamente en las manifestaciones clínicas no es suficiente para identificar el agente causal.
En cuanto al patrón radiológico las infecciones por MNVh y las coinfecciones mostraron una tendencia a presentar con mayor frecuencia infiltrado difuso respecto a las infecciones por VRS.
El tratamiento combinado con Ribavirina e Inmunoglobulina intravenosa ha demostrado eficacia para el tratamiento de infecciones graves por MNVh en pacientes inmunodeprimidos (27).
Actualmente no existe vacuna para MNVh, aunque el desarrollo de las mismas se encuentra en etapa de investigación en animales (7).
Conclusiones
La prevalencia de MNVh en el período estudiado fue similar a los reportes internacionales.
La distribución de las infecciones por MNVh, sus características clínicas y evolutivas no mostraron diferencias frente al VRS. Existió una tendencia a presentar con mayor frecuencia infiltrado intersticial difuso. Si bien no existieron diferencias estadísticas se comprobó una mayor gravedad en los pacientes con infección por VRS y en los que el aspirado fue negativo. Las coinfecciones no presentaron mayor gravedad.
Este estudio pretende servir de base para otras investigaciones sobre el MNVh dado que aún no se conoce su real prevalencia en Uruguay y su importancia clínica en los brotes epidémicos de IRAB en los meses de invierno.
Agradecimiento
A todos los que colaboraron con el trabajo: enfermeros, nurses, residentes y posgrados de pediatría, practicantes internos, sin los cuales hubiera sido imposible realizarlo.
Al Programa de Desarrollo de Ciencias Básicas (PEDECIBA) y al Sistema Nacional de Investigadores (ANII), a los cuales pertenecen el Dr. Arbiza y la Dra. Frabasile.
A Cecilia Papalardo por la colaboración en el análisis estadístico de los datos.
Al laboratorio Abbott por el apoyo económico que hizo posible el trabajo.
Referencias bibliográficas
1. Bello O, Sehabiague G, Prego J, de Leonardis D. Pediatría: urgencias y emergencias. 3 ed. Montevideo: Bibliomédica, 2009.
2. Spremolla A, Pascale I, Pirez M, Giachetto G, Chiparelli H, Sanguinetti S, et al. Investigación de virus respiratorios en niños menores de dos años hospitalizados por infección respiratoria aguda baja. Arch Pediatr Urug 2003; 74(3): 176-81.
3. Hortal M, Russi J. Virosis respiratorias en niños del Uruguay: 1983-1990. Arch Pediatr Urug 1991; 62: 47-51.
4. Van den Hoogen BG, de Jong JC, Groen J, Kuiken T, de Groot R, Fouchier RA, et al. A newly discovered human pneumovirus isolated from young children with respiratory tract disease. Nat Med 2001; 7(6): 719-24.
5. Oliveira DB, Durigon EL, Carvalho AC, Leal AL, Souza TS, Thomazelli LM, et al. Epidemiology and genetic variability of human metapneumovirus during a 4-year-long study in Southeastern Brazil. J Med Virol 2009; 81(5): 915-21.
6. Gaunt E, McWilliam-Leitch EC, Templeton K, Simmonds P. Incidence, molecular epidemiology and clinical presentations of human metapneumovirus; assessment of its importance as a diagnostic screening target. J Clin Virol 2009; 46(4): 318-24.
7. Mok H, Tollefson SJ, Podsiad AB, Shepherd BE, Polosukhin V, Johnston RE, et al. An alphavirus replicon-based human metapneumovirus vaccine is immunogenic and protective in mice and cotton rats. J Virol 2008; 82(22): 11410-8.
8. Mejias A, Chavez-Bueno S, Ramilo O. Human metapneumovirus: a not so new virus. Pediatr Infect Dis J 2004; 23(1): 1-7; quiz 8-10.
9. Carneiro BM, Yokosawa J, Arbiza J, Costa LF, Mirazo S, Nepomuceno LL, et al. Detection of all four human metapneumovirus subtypes in nasopharyngeal specimens from children with respiratory disease in Uberlandia, Brazil. J Med Virol 2009; 81(10): 1814-8.
10. Esper F, Boucher D, Weibel C, Martinello RA, Kahn JS. Human metapneumovirus infection in the United States: clinical manifestations associated with a newly emerging respiratory infection in children. Pediatrics 2003; 111(6 Pt 1): 1407-10.
11. O’Gorman C, McHenry E, Coyle PV. Human metapneumovirus in adults: a short case series. Eur J Clin Microbiol Infect Dis 2006; 25(3): 190-2.
12. Aslanzadeh J, Zheng X, Li H, Tetreault J, Ratkiewicz I, Meng S, et al. Prospective evaluation of rapid antigen tests for diagnosis of respiratory syncytial virus and human metapneumovirus infections. J Clin Microbiol 2008; 46(5): 1682-5.
13. Kolli D, Bataki EL, Spetch L, Guerrero-Plata A, Jewell AM, Piedra PA, et al. T lymphocytes contribute to antiviral immunity and pathogenesis in experimental human metapneumovirus infection. J Virol 2008; 82(17): 8560-9.
14. Boivin G, Abed Y, Pelletier G, Ruel L. Moisan D, Cote S, et al. Virological features and clinical manifestations associated with human metapneumovirus: a new paramyxovirus responsible for acute respiratory-tract infections in all age groups. J Infect Dis 2002; 186(9): 1330-4.
15. Prado M, Perret C, Montecinos L, Veloz A, Le Corre N, Habash L, et al. Metapneumovirus humano como causa de hospitalización en niños bajo 3 años de edad, con infección respiratoria aguda, durante el año 2004. Rev Chil Infectol 2007; 24(1): 19-26.
16. Boivin G, De Serres G, Cote S, Gilca R, Abed Y, Rochette L, et al. Human metapneumovirus infections in hospitalized children. Emerg Infect Dis 2003;9(6):634-40.
17. Greensill J, McNamara PS, Dove W, Flanagan B, Smyth RL, Hart CA. Human metapneumovirus in severe respiratory syncytial virus bronchiolitis. Emerg Infect Dis 2003; 9(3): 372-5.
18. Ebihara T, Endo R, Ma X, Ishiguro N, Kikuta H. Detection of human metapneumovirus antigens in nasopharyngeal secretions by an immunofluorescent-antibody test. J Clin Microbiol 2005; 43(3): 1138-41.
19. Kibuta H, Ebihara T, Endo R, Ishiguro N, Sakata C, Ochiai S, et al. Development of a rapid chromatographic immunoassay for detection of human metapneumovirus using monoclonal antibodies against nucleoprotein of hMPV. Hybridoma (Larchmt) 2007; 26(1): 17-21.
20. Kikuta H, Sakata C, Gamo R, Ishizaka A, Koga Y, Konno M, et al. Comparison of a lateral-flow immunochromatography assay with real-time reverse transcription-PCR for detection of human metapneumovirus. J Clin Microbiol 2008; 46(3): 928-32.
21. Matsuzaki Y, Takashita E, Okamoto M, Mizuta K, Itagaki T, Katsushima F, et al. Evaluation of a new rapid antigen test using immunochromatography for detection of human metapneumovirus in comparison with real-time PCR assay. J Clin Microbiol 2009; 47(9): 2981-4.
22. Tal A, Bavilski C, Yohai D, Bearman J E, Gorodischer R, Moses SW. Dexamethasone and salbutamol in the treatment of acute wheezing in infants. Pediatrics 1983; 71(1): 13-8.
23. Lagos R, di Fabio J L, Moenne K, Munoz M A, Wasserman S, de Quadros C. [The use of chest X-rays for surveillance of bacterial pneumonias in children in Latin America]. Rev Panam Salud Publica 2003; 13(5): 294-302.
24. Mirazo S, Ruchansky D, Blanc A, Arbiza J. Serologic evidence of human metapneumovirus circulation in Uruguay. Mem Inst Oswaldo Cruz 2005; 100(7): 715-8.
25. Pizzorno A, Masner M, Médici C, Saráchaga MJ, Rubio I, Mirazo S, et al. Molecular detection and genetic variability of human metapneumovirus in Uruguay. J Med Virol 2010; 82(5): 861-5.
26. Laham FR, Israele V, Casellas JM, García AM, Lac Prugent CM, Hoffman SJ, et al. Differential production of inflammatory cytokines in primary infection with human metapneumovirus and with other common respiratory viruses of infancy. J Infect Dis 2004; 189(11): 2047-56.
27. Bonney D, Razali H, Turner A, Will A. Successful treatment of human metapneumovirus pneumonia using combination therapy with intravenous ribavirin and immune globulin. Br J Haematol 2009; 145(5): 667-9.
Correspondencia: Dr. Conrado Medici. Roque Graseras 769/702. Montevideo, Uruguay.
Correo electrónico: conrado.medici@gmail.com.