Servicios Personalizados
Revista
Articulo
Links relacionados
Compartir
Archivos de Pediatría del Uruguay
versión On-line ISSN 1688-1249
Arch. Pediatr. Urug. vol.81 no.3 Montevideo set. 2010
EXPERIENCIA CLÍNICA
Arch Pediatr Urug 2010; 81(3)
Guía nacional para el seguimiento del recién nacido de muy bajo peso al nacer
Ministerio de Salud Pública. Departamento Programación Estratégica en Salud
Área Ciclos de Vida Programa Nacional de Salud de la Niñez. Uruguay 2010
Autoridades
Ministro de Salud Pública
Ec. Daniel Olesker
Director del DPES
Dr. Leonel Briozzo
Coordinadora del Área Ciclos de Vida
Dra. Ana Noble
Programa Nacional de Salud de la Niñez
Dr. Gustavo Giachetto
Autores
Grupo Redactor:
Dr. Daniel Borbonet
Dra. Susana Del Campo
Dra. Olga Ferro
Dra. Estrella Medina
Dra. Rita Rufo
Dra. Cristina Scavone
Grupo Colaborador (por orden alfabético)
Este grupo está integrado por todos aquellos profesionales que colaboraron con material, asistieron a Jornadas y por medio de sus comentarios actuaron en la corrección de este material.
Dr. John Aldao
Dra. Gilda Amen
Dra Teresa Baez
Dra. Lila Bergalo
Dra. Sandra Berta
Dr. Raúl Bustos
Dra. Mª José Cancela
Dra. Mara Castro
Dra. Aurora Delfino
Dr. Hugo Doti
Dr. Octavio Failache
Lic. en Nutrición Laura Fazio
Dra. Cristina Ferolla
Dr. Gonzalo Giambruno
Dra. Gabriela Guidobuono
Dra. Sandra Gugliucci
Dra. Cristina Hernández
Dra. Ana Lain
Dra. Mariela Larrandaburu
Dra. Coralito López
Dra. Esther López
Dra. Leonora Martinotti
Dra. Amanda Menchaca
Dra. Celia Migdal
Dra. Isabel Moreira
Dra. Liliana Palma
Dr. Ruben Panizza
Dra. Cecilia Paquiotti
Dr. Walter Pérez
Dra. Susana Pifaretti
Dra. Catalina Pinchak
Dra. Graciela Ramírez
Dra. Mariela Rizzo
Dra. Irene Rodriguez
Dra. Mª Julia Saráchaga
Dr. Jorge Selios
Dra. Ileana Soust
Dra. Elizabeth Tobler
Dra. Marina Weinberberg.
Prólogo
Entre los años 2005 y 2009 la tasa de mortalidad infantil (TMI) se redujo un 25%, de 12,7 a 9,56 0?00. Considerando que la TMI es un indicador demográfico negativo relacionado con el nivel de desarrollo humano y la pobreza, indudablemente las políticas sociales impulsadas en este periodo tuvieron un impacto positivo. La reforma sanitaria incluyo metas clave para la salud de niños, niñas y embarazadas en todos los prestadores del país. Se universalizó el acceso, se creó el Programa Nacional de Atención a la Niñez, se fortaleció ASSE (principal prestador público) y se reorientaron los servicios de los prestadores privados.
A pesar de estos logros, la mortalidad neonatal supera a la posneonatal y muestra un ligero estancamiento. Las afecciones del período perinatal, principalmente las vinculadas con prematurez y bajo peso al nacer y los defectos congénitos continúan siendo las principales causas de mortalidad neonatal.
Resulta prioritario mejorar los cuidados de la salud perinatal con enfoque de riesgo y equidad territorial. La elaboración de recomendaciones para el control y tratamiento de los niños de riesgo constituye una herramienta indispensable para orientar los equipos de salud en el logro de dicho objetivo.
Este documento contiene recomendaciones para los niños con peso al nacer menor de 1.500 gramos. Representa la síntesis del esfuerzo y trabajo iniciado en la administración anterior bajo la coordinación del Dr. Jorge Quian.
A todos muchas gracias por el compromiso.
Dr. Gustavo Giachetto
Introducción
La sobrevida de los recién nacidos ha ido mejorando a nivel mundial.
A principios del siglo XX, las principales causas de mortalidad infantil eran las enfermedades infecciosas, tan comunes que casi no se encuentran investigaciones dedicadas al recién nacido prematuro y a las causas de su morbimortalidad debido a que era “esperable” que no pudieran sobrevivir. Nuestro país no escapaba a esta realidad.
Con el advenimiento de las vacunas y antibióticos, que permitieron un mejor control de las infecciones, se logró una mayor sobrevida de los neonatos prematuros y por tanto un mejor conocimiento de los mismos.
El avance en el conocimiento científico perinatal y neonatal ha posibilitado una mayor sobrevida en prematuros moderados y extremos durante su internación en las áreas de cuidados intensivos neonatales. Esta realidad exige una responsabilidad individual, familiar, social y política, en el posterior control y seguimiento domiciliario luego del alta hospitalaria.
La prematurez, principalmente los recién nacidos de muy bajo peso al nacer -menos de 1.500 g- es la principal causa de ingreso de los CTI neonatales, contribuyendo significativamente en la mortalidad infantil de Uruguay.
El peso al nacer es utilizado como un predictor de la morbimortalidad neonatal en los países en vías de desarrollo, en donde no siempre se disponen de datos de amenorreas confiables ni de ecografías tempranas para calcular la edad gestacional al nacer. Por lo que, en estas poblaciones, el peso al nacer es más práctico como indicador que la edad gestacional.
En los últimos cuarenta años, Uruguay ha realizado una ostensible inversión en la asistencia de los prematuros, tanto en recursos humanos como económicos. Sin embargo aún no ha existido la contraparte correspondiente al seguimiento y adecuado control domiciliario luego del alta.
Si bien es cierto que han habido grupos pioneros en el trabajo interdisciplinario de seguimiento de prematuros, con énfasis en el neurodesarrollo, estos grupos han sido a iniciativa de algunas instituciones públicas y privadas.
Por lo antes expuesto, es que se crea la necesidad de que Uruguay inicie un proceso de discusión, elaboración, difusión y ejecución, de las guías para el seguimiento neonatal con el objetivo final de crear una “red de seguimiento neonatal a nivel nacional del recien nacido de muy bajo peso al nacer”.
El Programa Nacional de Salud de la Niñez del MSP, junto a la Sociedad Uruguaya de Pediatría y Neonatología Intensiva, y de la Asociación Uruguaya de Perinatología, han coordinado diversas jornadas para la discusión y elaboración de dichas guías, desde el año 2006 a la fecha. En las mismas participaron múltiples instituciones y especialidades con responsabilidades en la asistencia de esta población objetivo.
Lo que aquí se presenta es una guía, que deberá ser periódicamente revisada y actualizada en función de nuevas evidencias; no pretende ser otra cosa que una guía elemental para el seguimiento de esta población de RN por sus pediatras tratantes.
Objetivo general
- Promover la unificación de criterios en la atención y seguimiento de los RN (recién nacidos) de muy bajo peso al nacer en todo el país desde el alta hasta los 2 años de vida, en una primera etapa.
- Lograr el mayor potencial de su desarrollo, independientemente del lugar de nacimiento y de su residencia, con la detección temprana de alteraciones corregibles en las primeras etapas de su vida.
Objetivos específicos
- Lograr un crecimiento y desarrollo adecuado.
- Promover el desarrollo máximo del potencial individual del niño, favoreciendo su independencia y su adaptación familiar
- Prevenir, anticipar y detectar alteraciones en forma temprana mediante intervención oportuna.
Población
Está dirigido al seguimiento de todo aquel RN pretérmino que al nacer tenga un peso menor de 1.500 g.
Equipo de seguimiento
El Equipo de Seguimiento se sugiere que esté integrado por especialistas de diferentes disciplinas y así actuar en forma complementaria y coordinada con la asistencia brindada por el pediatra tratante
Las Policlínicas de Seguimiento no sustituyen los controles del pediatra tratante.
Alta hospitalaria
El equipo responsable de la atención del pretérmino durante su internación deberá suministrar al alta a padres o tutores el resumen de alta de la unidad neonatal, donde consten los datos relevantes referentes al período de internación, requerimientos al alta y medidas pendientes al egreso hospitalario Se deberá referir el niño a través del Sistema de Referencia y Contrarreferencia (Programa Aduana) implementado en cada una de las instituciones, informando al pediatra tratante la fecha de alta hospitalaria y las condiciones clínicas del niño.
Protocolos
La leche materna siempre será de elección, excepto que exista una contraindicación absoluta.
Duración de la leche humana:
- Leche fresca: 6 horas
- Refrigerada: 48 horas
- Congelada: 14 días
- Freezada: 6 meses
Según Norma Nacional de Lactancia Materna (Ord. 217/09).
a) Lactancia materna exclusiva o predominante (mayor de 80%)
Se recomienda un mínimo de 8 tomas lácteas por día.
En los recién nacidos alimentados con leche humana exclusiva o predominante durante los primeros 6 meses de vida, se recomienda optimizar la alimentación siguiendo dos criterios:
1. Si se encuentra disponible, complementar con fortificador de leche humana según recomendaciones del fabricante.
2. Completar la dieta con fórmula de prematuro. Sobre un total de 8 tomas diarias, se recomienda 5 o 6 con pecho directo u ordeñado y 2 o 3 con leche modificada.
Recuerde que el mayor contenido graso de la leche humana se encuentra en la leche del final por lo cual cuando fuera necesario se aconseja la extracción de la primera parte para que el niño succione el final, logrando así un mayor aporte calórico.
b) En caso de uso predominante de fórmula láctea se recomienda:
- Fórmula de prematuros hasta los 6 meses de edad corregida.
- Fórmula de término de los 6 a 12 meses de edad corregida.
En el caso de tratarse de un prematuro menor de 1.000 g al nacer o portador de broncodisplasia o cuyo ascenso de peso no sea adecuado podrá necesitar fórmula de pretérmino hasta el año de edad corregida
La alimentación de esta población requiere suplemento vitamínico y de minerales.
- Vitamina D: 400 UI diarias hasta el año de vida.
- Hierro: 2 mg/kg por día, máximo 15 mg por día, hasta los 24 meses de edad gestacional corregida (valorar si requieren este aporte los alimentados a leche de fórmula predominante).
Sugerencia: Omega 3: iniciar con 1 ml cada 8 horas pudiendo administrarse en una única dosis según tolerancia hasta los 24 meses siempre con las comidas.
Incorporación de semisólidos y sólidos
El inicio de alimentación complementaria debe realizarse a los 6 meses de edad corregida según las Guías Alimentarías para menores de 2 años implementadas por el Ministerio de Salud Pública.
Vigilancia nutricional y del crecimiento
Se debe usar edad corregida.
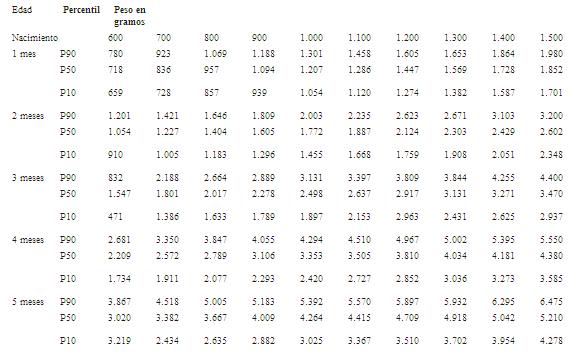
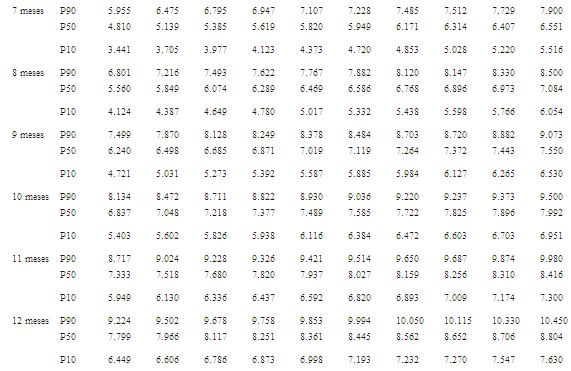
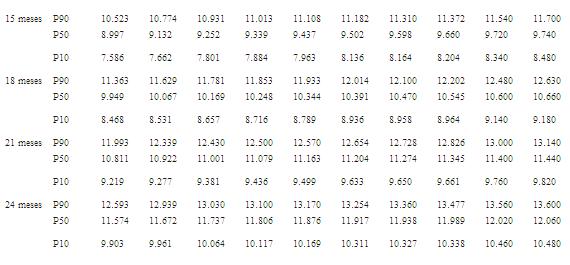
Se considera crecimiento subnormal cuando la curva de peso en gramos se mantiene por debajo del percentil 10 de las gráficas seleccionadas.
Se recomiendan las curvas de crecimiento posnatal de prematuros correalizadas por el Dr. Miguel Martell y colaboradores y concedidas a esta publicación en informe personal (tabla 1a tabla 1b tabla 1c ).
Tabla 1.
Neurodesarrollo (3,8,11,27-30)
Se sugiere que la evaluación neurológica del RN sea realizada lo más próximo al período de estabilización y obligatoriamente antes del alta.
Coordinar la primera consulta durante la internación antes del alta con neuropediatra y ambos (neonatólogo y neuropediatra) decidirán de ser necesario aquellos técnicos o especialistas que deberán trabajar en cada caso para su seguimiento (psicólogo, fisiatra, fisioterapeuta, psicomotricista, fonoaudiólogo).
Se tomará para el seguimiento la edad corregida.
De acuerdo al resultado de la evaluación pasará a uno de los grupos a saber:
1) RN sin alteraciones neurológicas.
2) RN con alteraciones neurológicas.
1) RN sin alteraciones neurológicas
El equipo de seguimiento se recomienda que esté integrado por el pediatra tratante y aquellos técnicos requeridos según cada caso en particular. Las recomendaciones específicas de seguimiento para esta población son:
- Antes del alta, emisiones otoacústicas (EOA) y control con oftalmólogo
- A los 3 meses control de la audición con EOA y PEA; control con oftalmólogo.
- A los 9 meses control con oftalmólogo.
- A los 6 meses control con neuropediatra.
- A los 12 meses control con oftalmólogo.
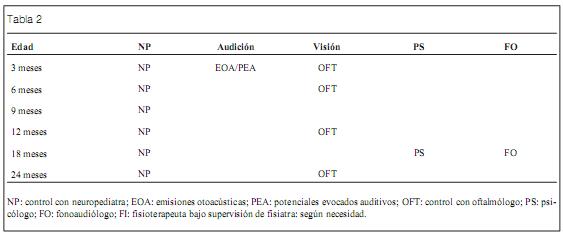
2) RN con alteraciones neurológicas
El grupo básico estará formado por pediatra tratante y neuropediatra. La presencia de los demás técnicos se valorará de acuerdo a la evolución de cada niño (tabla 2).
La complicación más importante es la broncodisplasia pulmonar *. Este grupo de pacientes requiere previo al alta definir la necesidad de oxígeno suplementario en forma intermitente o permanente, evaluar la presencia de hipertensión pulmonar y coordinar evaluación con neumólogo y eventualmente cardiólogo.
* Se considera que un RN de muy bajo peso presenta broncodisplasia pulmonar si tiene requerimientos persistentes de oxígeno asociados a cambios radiológicos crónicos a los 28 días de edad (Bancalari y colaboradores). También se emplea la definición “oxígeno dependencia a las 36 semanas de edad postconcepcional” (JL Tapia).
BCG
Se indicará una vez alcanzado los 2.500 g de peso. No se debe administrar a hijos de madres VIH positivas, aun cuando se haya cumplido con la profilaxis en forma adecuada.
VRS
En los niños con broncodisplasia pulmonar y/o cardiopatía congénita se recomienda la profilaxis con palivizumab 15 mg/kg por vía intramuscular una vez al mes por 5 meses entre abril y agosto.
El Comité de Enfermedades Infecciosas de la Academia Americana de Pediatría ha establecido realizar profilaxis con 5 dosis en los siguientes grupos de riesgo:
1. Niños con broncodisplasia pulmonar menores de 24 meses y que requieren tratamiento médico.
2. Niños con cardiopatía congénita menores de 24 meses y que requieren tratamiento médico.
3. Prematuros menores a 32 semanas.
4. Niños con anomalías congénitas de la vía aérea y enfermedades neuromusculares (Pediatrics 2009; 124; 1694-1701; originally published online Sep 7, 2009; DOI: 10,1542/peds, 2009-345).
En Uruguay, desde mayo de 2009, el Fondo Nacional de Recursos brinda cobertura a:
- Niños menores de dos años con enfermedad pulmonar crónica que han requerido tratamiento con oxigeno suplementario, broncodilatadores, diuréticos o corticoides, en los 6 meses anteriores al inicio de la estación del VRS o que son dados de alta durante la misma.
- Niños menores de un año afectados de cardiopatía congénita con alteración hemodinámica significativa que presenten: insuficiencia cardíaca actualmente en tratamiento, hipertensión pulmonar moderada a grave o hipoxemia crónica.
- Niños prematuros nacidos a las 28 semanas o menos, menores de un año de edad al inicio de la estación del VRS o dados de alta durante la misma.
Criterios a ser discutidos en forma individualizada por parte del Fondo Nacional de Recursos:
- Niños prematuros nacidos entre las 29 y 35 semanas de gestación que tengan 6 o menos meses de edad al inicio de la estación del VRS o sean dados de alta durante la misma y que presenten malformaciones de la vía aérea o enfermedad neuromuscular
- Vacunación antigripal:
- A la madre durante el embarazo y al núcleo familiar del prematuro a partir de abril.
- Al RN a partir de los 6 meses de edad cronológica.
Continuar según edad cronológica con el Esquema Actual de Vacunación.
Pesquisa neonatal (31)
Desde hace varios años, el Ministerio de Salud Pública viene impulsando la pesquisa neonatal para la prevención secundaria y terciaria de algunos defectos congénitos. La pesquisa tiene como objetivo la identificación y el tratamiento temprano de algunos trastornos congénitos de tipo endocrinológico, metabólico o genético, para reducir la mortalidad y las posibles discapacidades asociadas con esas enfermedades. Los estudios que se realizan en forma masiva, no son procedimientos diagnósticos per se, los recién nacidos con resultados sospechosos deben someterse a una o más pruebas diagnósticas confirmatorias. En los casos positivos es importante contar con los antecedentes familiares de este grupo de patologías por la posibilidad de recurrencia familiar.
El Programa Nacional de detección de Hipotiroidismo Congénito fue implementado en el país hace quince años (21/09/1994, Decreto 430/994). Posteriormente se incorporaron la investigación de fenilcetonuria e hiperplasia suprarrenal congénita en sangre de talón obtenida luego de las 40 horas de vida (Decreto 416/007). El Decreto Nº 389/008 incorporó la pesquisa de la hipoacusia congénita mediante emisiones otoacústicas. Actualmente se encuentra en fase de implementación la pesquisa de la fibrosis quística (Decreto Nº 667/009).
La población de recién nacidos menores de 1.500 g por definición es un grupo de riesgo, por tanto debe garantizarse que se haya realizado la pesquisa neonatal antes del alta hospitalaria. Los resultados de la misma deben constar en el carné del niño/a.
Todo RN menor de 1.500 g debe tener un control de TSH al nacimiento, entre los 15 y los 30 días de vida TSH y T4, considerando hipotiroidismo cuando la TSH se encuentra por encima de los siguientes valores de referencia.
Valores de referencia
Se utiliza como línea de corte para iniciar el tratamiento:
- de sangre de cordón: TSH 20 mlU/L;
- entre el 3º y 6º día de vida: TSH 15 mlU/L;
- a las 4 semanas: TSH 10 mlU/L.
Tratamiento
De presentar hipotiroidismo iniciar tratamiento con levotiroxina sódica a 12,5 mg vía oral una vez al día en ayunas alejado de la comida, coordinando control con endocrinólogo durante su internación que continuará sus controles en policlínica, previa coordinación con pediatra tratante.
Fenilcetonuria (32)
Una vez realizada la conformación diagnóstica se requiere de un estricto control nutricional y metabólico con una dieta pobre en fenilalanina. El diagnóstico, tratamiento específico y seguimiento de estos pacientes se hace a través del BPS quien cuenta con un equipo multidisciplinario para su manejo
Hiperplasia suprarrenal congénita
La pesquisa neonatal para la hiperplasia suprarrenal congénita en el grupo de pacientes menores de 1.500 g presenta algunas dificultades. La dosificación de 17 hidroxiprogesterona (17 OHP) debe repetirse en más de una oportunidad, ya que el 80% de los prematuros presentan niveles elevados de esta hormona. De confirmarse el diagnóstico, el tratamiento y seguimiento de los pacientes debe ser realizado por un equipo interdisciplinario, que debe incluir por lo menos endocrinólogo, genetista y pediatra tratante. La necesidad de otros especialistas dependerá del cuadro clínico.
Este tamizaje es uno de los más recientes (Decreto Nº 389/008). Como ya mencionado en la evaluación neurológica, el mismo deberá repetirse en más de una oportunidad de acuerdo al Protocolo. En caso de que se confirme la hipoacusia, deberá profundizarse en la búsqueda etiológica, el seguimiento de estos pacientes requiere de un equipo interdisciplinario (figura 1).
Osteopenia del prematuro (8,26,29)
La primera determinación de fosfatasa alcalina, fosfatemia, calcemia o calcio iónico se recomienda solicitarla al mes de vida.
Valores de referencia
- Fosfatasa alcalina: 400-1000 UI/dl.
- Fosfatemia: 3,5-4,5 mg/dl.
- Calcemia: 7,0-10 mg/dl.
- Ca iónico 1,2-1,4 mosm/l.
Los prematuros pueden elevar las cifras de FA (fosfato alcalina) por encima de 700 UI pero cifras mayores de 1.000 UI son indicadoras de enfermedad metabólica ósea, tomándose éstas como límite para iniciar tratamiento.
Tratamiento
- Aporte suplementario de Ca con gluconato de calcio al 10% a 200 mg/kg/día, que se aportará en forma fraccionada en todas las lactadas, ya que es irritante gástrico y su absorción no es limitada con la mezcla de alimentos
- Aportar fosfato como fosfato bibásico de sodio a la dosis de 100 ng/kg/día que se aportará en forma fraccionada y lejos de las comidas, generalmente en 3 o 4 tomas diarias
- Vitamina D 400UI/día.
Se recomienda una determinación de fosfatasa alcalina 30 días después de iniciado el tratamiento y mantener los controles mensuales hasta normalización de los valores con posterior suspensión del tratamiento.Si se prolonga por más de 30 días realizar ecografía renal para descartar elementos de nefrocalcinosis.
Referencias bibliográficas
1. Carver JD, Wu PY, Hall RT, Ziegler EE, Sosa R, Jacobs J, et al. Growth of preterm infants fed nutrient-enriched or term formula after hospital discharge. Pediatrics 2001; 107 (4): 683-9.
2. Agosti M, Vegni C, Calciolari G, Marini A; GAMMA Study Group. Post-discharge nutrition of the very low-birth weight infant: interim results of the multicentric GAMMA study. Acta Paediatr Suppl 2003; 91 (441): 39-43.
3. Maalouf E. Best practice guidelines [en línea]. Early Hum Dev 2005; 81 (2): 131. Disponible en: www.minsal.cl/ici/guiasclinicas/displasia.pdf [consulta: 11 ag. 2008]
4. Bancalari E, Wilson-Costello D, Iben SC. Management of infants with bronchopulmonary dysplasia in North America. Early Hum Dev 2005; 81(2): 171-9.
5. Torres G, Argés L, Alberto M, Figueroa R. Leche humana y nutrición en el prematuro pequeño. Nutr Hosp 2004; 19(4): 236-42.
6. Adamkin DH. Feeding the preterm infant. In: Bhatia J, ed. Perinatal Nutrition: optimizing infant health and development. New York: Marcel Dekker, 2004: 165-90.
7. Shanler RJ, Shulman RJ, Lau C, Smith EO, Heitkemper MM. Human milk Fortification for Premature Infants. Am J Clin Nutr 1996, 64: 249-25.
8. Ministerio de Salud (Chile). Depto. de Epidemiología. Situación de Salud en Chile 2001. Indicadores básicos. Pediatría al Día 2001; 17 (4): 273-6.
9. Ministerio de Salud (Chile). Guía clínica broncopulmonar del prematuro. 1a ed. Santiago: MINSAL, 2005.
10. Bancalari E. Management of Infants with Bronchopulmonary Dysplasia in North América. Early Hum Dev 2005; 81(2): 171-9.
11. Shaw NJ. Management of infant with chronic lung disease of prematurity in the United Kingdom. Early Hum Dev 2005; 81(2): 165-70.
12. Thomas W, Speer CP. Management of infants with bronchopulmonary dysplasia in Germany. Early Hum Dev 2005; 81(2): 155-63.
13. Li J, Wei K. Management of infants with chronic lung disease of prematurity in China. Early Hum Dev 2005; 81(2): 143-9.
14. Palomino MA, Morgues M, Martínez F. Management of infants with chronic lung disease of prematurity in Chile. Early Hum Dev 2005; 81(2): 135-42.
15. Valdés I. Oxigenoterapia domiciliaria. Pediatría (Santiago) 2003, 46: 100-2.
16. Ministerio de Salud (Chile). Programa oxigenoterapia ambulatoria. Santiago: MINSAL, 2003.
17. Rhodius E, Cáneva J. Consenso Argentino de Oxigenoterapia crónica domiciliaria. Medicina (Buenos Aires) 1998; 58(1): 85-94.
18. Álvarez C, Bertrand N. Monitorización continua nocturna de saturación arterial de oxígeno en pacientes pediátricos con sospecha de hipoxemia. Rev Chil Pediatr 2001; 72(2): 110-20.
19. Allen J, Zwerdling R, Ehrenkranz R, Gaultier C, Geggel R, Greennough A, et al. Statement of the care of the child with chronic lung disease of infancy and childhood. Am J Respir Crit Care Med 2003; 168 (3): 356-96.
20. Prado F, Boza M, Koppmann A. Asistencia ventilatoria no invasiva domiciliaria nocturna en pediatría. Rev Chil Enfer Respir 2003; 19 (3): 146-54.
21. Sociedad Uruguaya de Pediatría. Comité de Neonatología; Comité de Neumología. Indicaciones para el uso de Palivizumab. Bol Informativo SUP mayo 2005; 14 (1): 5.
22. Aldao J. Profilaxis de IRA por VRS. En: Aldao J, Hernández C. Manual de Neonatología. Montevideo: Bibliomédica, 2006: 103-4.
23. Lustemberg C, Aldao J, Giachetto G. Pauta de administración con palivizumab. Montevideo: CHPR; ASSE, 2008.
24. Castro M. Hipotiroidismo. En: Aldao J, Hernández C. Manual de Neonatología. Montevideo: Bibliomédica, 2006: 241-6.
25. Tylek-Lemanska D, Kumorowicz-Kopiec M, Stsrzyk J. Screening fon congenital hipothyroidism: the value of retesting after four weeks in neonates with low and very low birth weight. J Med Screen 2005; 12 (4): 166-9.
26. Culshaw B, Guido A. Osteopenia del prematuro. En: Aldao J, Hernández C. Manual de Neonatología. Montevideo: Bibliomédica, 2006: 235-7.
27. Artigas-Pallarés J. Early care of neurodevelopmental disorders. Advantages of early intervention in neurodevelopmental disorders. Rev Neurol 2007; 44 (Suppl 3): S31-4.
28. Drougia A, Giapros V, Kralli N, Theocharis P, Nikaki A, Tzoufi M, et al. Incidence and risk factors for cerebral palsy in infants with perinatal problems: A 15-year review. Early Hum Dev 2007; 83: 541-7.
29. Tapia JL, Ventura-Juncá P. Manual de neonatología. 2 ed. Santiago [Chile]: Mediterráneo, 1999.
30. Valenzuela Bonomo A, Nieto S. Ácidos grasos omega-6 y Omega-3 en la nutrición perinatal: su importancia en el desarrollo del sistema nervioso y visual [en línea]. Rev Chil Pediatr 2003; 74 (2): 149-57. Disponible en: http://www.scielo.cl [consulta: 11 ag. 2008].
31. Cerdá Mota T. Programas de cribado: Características y condiciones para su puesta en marcha. Medicine. 2003; 8 (118): 6312-17.
32. Scriver CR, Kaufmann S, Eisensmith R, Woo SLC. The hyperphenylalaninemias. In: Scriver CR, Beaudet AL, Sly WS, Valle D, eds. The metabolic and molecular bases of inherited disease. 7 ed. New York: McGraw-Hill; 1995: 1015-77.
33. American Academy of Pediatrics. Committee on Genetics: issues in newborn screening. Pediatrics 1992; 89(2): 345-9.
34. Cattani A, Reyes G, Azócar M, Soto T, Romeo E, Valdivia L, et al. Medición de 17-OH progesterona sanguínea en recién nacidos chilenos: Antecedentes para implementar un programa de detección neonatal de hiperplasia suprarrenal congénita [en línea], Rev Med Chile 2000; 128 (10): 1113-8. Obtenido de: http://www.scielo.cl [consulta: 20 jul.2010]
35. Collet L, Levy V, Vevillet E, Morgan TA. Click-evoked otoacoustic emissions and hearing threshold in sensori-neural hearing loss. J Pediatr 1993; 14: 141-9.
36. Davis A, Bamford J, Wilson I, Ramkalawan T, Forshaw M, Wright S. A critical review of the role of neonatal hearing screening in the detection of congenital hearing impairment. Health Technol Asses 1997; 1 (10): I-IV; 1-176.
37. Dent KM, Kenneson A, Palumbos JC, Maxwell S, Eichwald J, White K, et al. Methodology of a multistate study of congenital hearing loss: preliminary data from Utah newborn screening. Am J Med Genet C Semin Med Genet 2004, 15; 125C(1): 28-34.