Servicios Personalizados
Revista
Articulo
Links relacionados
Compartir
Archivos de Pediatría del Uruguay
versión On-line ISSN 1688-1249
Arch. Pediatr. Urug. vol.80 no.2 Montevideo jun. 2009
ARTÍCULO ORIGINAL
Arch Pediatr Urug 2009; 80(2)
Resultados del tratamiento de la leucemia aguda mieloblástica del niño con trasplante de progenitores hematopoyéticos en primera remisión
Dres. Gustavo Dufort y Alvarez 1,3, Mariela Castiglioni 2,3, María Carracedo 2, Carolina Pagés 2,3,
Elizabeth Simon 2, Silvana Zuccolo 2, Rodrigo Barcelona 2, Agustín Dabezies 1,3, Luis Castillo 3,4
1. Coordinador del Centro Hemato-Oncológico Pediátrico.
2. Staff del Centro Hemato-Oncológico Pediátrico.
3. Staff de la Unidad de Trasplante de Médula Ósea. Asociación Española.
4. Director del Centro Hemato-Oncológico Pediátrico
Centro Hemato-Oncológico Pediátrico. Centro Hospitalario Pereira Rossell.
Unidad de Trasplante de Médula Ósea. Asociación Española.
Fecha recibido: 22 de diciembre de 2008
Fecha aprobado: 30 de junio de 2009
Resumen
Introducción: el pronóstico de la leucemia aguda mieloblástica (LAM) en el niño ha mejorado en las últimas décadas. Estos avances son el resultado de la intensificación de los tratamientos de inducción y post remisión. Muchos grupos han investigado la utilidad del trasplante de progenitores hematopoyéticos (TPH) en la LAM en primera remisión. El objetivo de este estudio fue evaluar los resultados obtenidos con TPH alogénico y autólogo luego de dos tratamientos de consolidación intensivos.
Material y métodos: en el periodo entre enero de 1997 y diciembre de 2006, 31 pacientes menores de 15 años con LAM de novo fueron incluidos en el protocolo LAM-CHPR. Después de uno o dos tratamientos de inducción todos los pacientes en remisión completa (RC) recibieron dos tratamientos de consolidación. Luego los pacientes con hermano HLA idéntico fueron planificados para ser sometidos a TPH alogénico, mientras aquellos sin donante, recibieron TPH autólogo.
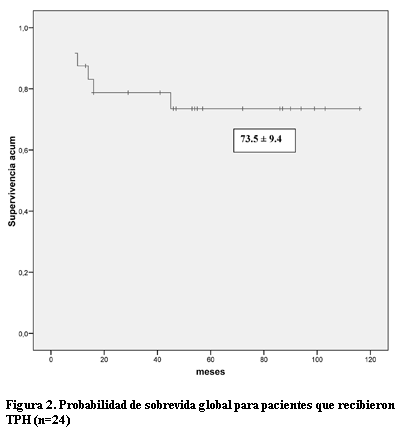
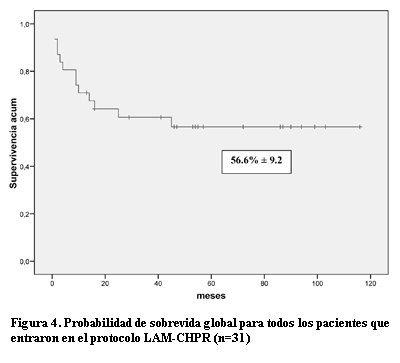
Resultados: veintinueve pacientes (93,6%) alcanzaron la RC tras uno (n=26) o dos (n=3) tratamientos de inducción. Dos pacientes tuvieron una muerte temprana. Otros cuatro pacientes tuvieron una muerte relacionada al tratamiento (MRT) debido a complicaciones infecciosas durante la fase de quimioterapia. De los 25 pacientes que entraron en la fase de trasplante 24 recibieron TPH, cuatro alogénicos y 20 autólogos. No hubo muertes relacionadas con el trasplante. Seis pacientes recayeron, todos pertenecientes al grupo de los TPH autólogos. Cuatro fallecieron por progresión de la enfermedad y dos fueron rescatados con un segundo trasplante de donante haploidéntico. La probabilidad de sobrevida global (SG) y sobrevida libre de eventos (SLE) estimada a los 10 años postrasplante fue de 73,5% ± 9,4 y 64,5% ± 10,2% respectivamente. En relación a todos los pacientes con intención de tratar incluidos en el protocolo, la probabilidad de SG y SLE estimada a los 10 años fue de 56,6% ± 9,2 y 50% ± 9,0 respectivamente.
Conclusiones: el escaso número de pacientes no permite comparar nuestros resultados con los de grupos cooperativos de referencia, sin embargo en nuestra casuística el TPH alogénico y autólogo fue un tratamiento post remisión efectivo sin mortalidad relacionada al procedimiento.
Palabras clave:
LEUCEMIA MIELOIDE AGUDA
TRASPLANTE DE CÉLULAS MADRE HEMATOPOYÉTICAS
TRASPLANTE HOMÓLOGO
TRASPLANTE AUTÓLOGO
Summary
Background: the survival of children with acute myeloid leukemia has improved in the last decades. Aggressive induction chemotherapy and postremission treatment are important for optimal results. Several groups have investigated the utility of allogeneic and autologous hematopoyetic stem cell transplantation in first remission. The main objective of this study was to evaluate the results obtained with HSCT, either allogenic o autologous, following two intensive consolidation courses.
Patients and methods: from January 1997 to December 2006, 31 children (< 15 years old) with de novo AML were prospectively enrolled in the protocol AML-CHPR. After one or two induction courses, all patients who achieved complete remission (CR) received two consolidations. Then they were submitted to allogeneic HSCT if a compatible family donor was present or autologous HSCT if there wasn´t.
Results: twenty nine patients (93,6%) achieved CR after one (n=26) or two (n=3) courses of induction treatment. Two patients had an early death. Four patients had treatment related mortality (TRM) due to fatal infections during the chemotherapy phase. The 25 patients who entered in the transplant phase, 24 underwent a HSCT; four allogeneic and 20 autologous. There was no transplant related mortality. Six patients relapsed, all in the autologous group, and four of these died due to the disease progression. Two patients were rescued with a second transplant from a haploidentical donor. 10 year - overall survival (OS) after transplant and event free survival (EFS) were 73,5% ± 9,4 and 64,5% ± 10,2% respectively. OS and EFS in all the series (31 patients) were 56,6% ± 9,2 y 50% ± 9,0 respectively, with a median follow-up of 56 months.
Conclusions: due to the limited number of patients our results are not comparable with most of the important clinical trials published. However, allogenic and autologous HSCT were an effective postremission treatment without transplant related mortality.
Key words:
LEUKEMIA, MYELOID, ACUTE
HEMATOPOIETIC STEM CELL
TRANSPLANTATION, HOMOLOGOUS
TRANSPLANTATION, AUTOLOGOUS
Introducción
El pronóstico de la leucemia aguda mieloblástica (LAM) en el niño ha mejorado en las últimas décadas (1). Con los protocolos actuales aproximadamente 80% a 90% de los pacientes alcanzan la remisión y alrededor de 50% permanecen en remisión y son sobrevivientes a largo plazo (2). Estos avances son el resultado de la intensificación de los tratamientos de inducción, seguidos de tratamientos post remisión con quimioterapia intensiva o regímenes mieloablativos seguidos de trasplante de progenitores hematopoyéticos (TPH).
Cuál es el mejor tratamiento para el niño con LAM en primera remisión es todavía tema de controversia. El rol de TPH ha sido investigado tanto por grupos europeos como norteamericanos (Estados Unidos y Canadá), aunque no ha podido ser claramente definido por estudios randomizados prospectivos. Los grupos norteamericanos están a favor del TPH alogénico en primera remisión porque todos sus estudios han demostrado menores recaídas en este grupo de pacientes (3,4). Además, sus estudios han demostrado el rol del efecto injerto versus leucemia en el mantenimiento de la sobrevida libre de enfermedad (SLE) en los pacientes con LAM (5). El TPH autólogo no ha demostrado ser superior a la quimioterapia, sin embargo, la actualización reciente de estudios randomizados están a favor de que el TPH autólogo podría ser un tratamiento post remisión efectivo en pacientes con LAM en primera remisión (6).
En contraposición, grupos cooperativos británicos y alemanes han demostrado que los pacientes con LAM pueden ser tratados efectivamente sólo con quimioterapia, y que el TPH en primera remisión debe ser reservado para aquellos pacientes con factores pronósticos de alto riesgo (7,8).
En Uruguay los TPH pediátricos se iniciaron en el año 1997 con la creación de la Unidad Pediátrica de Trasplante de Médula Ósea en la Asociación Española. En forma casi concomitante y con la intención de reproducir experiencias que habían mostrado resultados muy alentadores (10), en el Centro Hospitalario Pereira Rossell (CHPR) se desarrolló un protocolo de tratamiento de la LAM (LAM-CHPR) que incluía el TPH alogénico o autólogo en primera remisión, dependiendo si el paciente tenía un hermano histocompatible o no.
El objetivo de este trabajo es mostrar los resultados de este protocolo luego de 10 años de experiencia, y confrontarlos con la experiencia internacional con el fin de planificar estrategias futuras más adecuadas a los conocimientos actuales.
Pacientes y métodos
Pacientes
En el periodo entre enero de 1997 y diciembre de 2006, 44 pacientes menores de 15 años fueron diagnosticados de LAM de novo en el Centro Hemato-Oncológico Pediátrico del CHPR. El diagnóstico de LAM fue realizado de acuerdo a la clasificación morfológica French-American-British (FAB) (11), inmunotipificación por citometría de flujo y estudio citogenético. Dos pacientes con síndrome de Down y nueve pacientes con LAM subtipo M3 fueron excluidos del análisis ya que fueron tratados con diferentes protocolos. De los 33 pacientes restantes, dos fallecieron sin haber recibido tratamiento por lo que no se consideraron con intención de tratar. Treinta y un pacientes fueron incluidos en forma consecutiva en el protocolo LAM-CHPR. Todos los TPH fueron realizados en la Unidad de Trasplante de la Asociación Española. Las principales características de los pacientes se muestran en la tabla 1. La mediana de edad fue de 8 años, 19 eran varones y 12 niñas. La mediana de glóbulos blancos al diagnóstico fue de 22,77 x 109/L, 13% tenían más de 100 x 109/L. Enfermedad extramedular estuvo presente al diagnóstico en dos pacientes (uno en el sistema nervioso central y el otro en el espacio epidural). Se obtuvieron resultados de estudios citogenéticos en 27 pacientes (87%). Anormalidades cromosómicas de buen pronóstico, pronóstico intermedio y pronóstico pobre se vieron en 5, 16 y 5 de los pacientes respectivamente (12). Se utilizó la citogenética, la clasificación FAB y la respuesta al tratamiento de inducción como factores pronósticos para clasificar los pacientes en riesgo bajo (16%), riesgo estándar (74%) y riesgo alto (10%) (12,13).
Tratamiento
El protocolo LAM-CHPR consistió en una fase de quimioterapia y una fase de trasplante en aquellos pacientes que alcanzaron la remisión completa (RC) (tabla 2). El tratamiento fue igual para todos los pacientes independientemente del riesgo.

Quimioterapia
Tratamiento de inducción con la combinación DAE (daunorrubicina, Ara-C y etopósido) según el esquema 3-7-3. Aquellos pacientes con más de 5% de blastos en médula ósea el día 15 de la inducción, o en su defecto presencia de blastos en una médula ósea hipocelular, recibieron una segunda inducción con DAE. Todos los pacientes en RC después de uno o dos tratamientos de inducción recibieron dos tratamientos de consolidación con mitoxantrone y altas dosis de Ara-C luego de la recuperación hematológica.
Se realizó tratamiento preventivo del SNC con methotrexate y Ara-C intratecal con dosis ajustadas para la edad el día 1 de cada tratamiento de inducción y consolidación. Se utilizó G-CSF luego de cada tratamiento de quimioterapia hasta la recuperación de los neutrófilos.
Trasplante
Después de la recuperación hematológica, tras la segunda consolidación, los pacientes en RC entraron en la fase de trasplante. Los pacientes con hermano HLA idéntico fueron planificados para ser sometidos a TPH alogénico, mientras que aquellos sin donante recibieron TPH autólogo.
Todos los pacientes trasplantados recibieron el mismo régimen de acondicionamiento con busulfan 16 mg/kg, etopósido 40 mg/kg y ciclofosfamida 120 mg/kg.
Los progenitores hematopoyéticos (PH) fueron obtenidos por cosecha de médula ósea para los TPH alogénicos y de sangre periférica después de la segunda consolidación, previa estimulación con G-CSF, para los TPH autólogos. En ningún caso los PH de los trasplantes autólogos fueron sometidos a algún método de purgado in vitro.
La profilaxis de la enfermedad injerto contra huésped en los TPH alogénicos se realizó con ciclosporina.
Análisis estadístico
Los objetivos de análisis del estudio fueron: RC de la enfermedad, mortalidad relacionada al tratamiento (MRT), recaída, SLE y SG.
El análisis de la SLE y SG fue hecho por intención de tratar de todos los pacientes diagnosticados que recibieron tratamiento. Se analizó, además, la SLE y SG postrasplante tomando como punto de partida la fecha del TPH.
Las curvas de SG y SLE fueron estimadas utilizando el método Kaplan-Meier (14). Los datos se analizaron con el software SPSS versión 15,0 (15).
Definiciones: la RC fue definida por una médula ósea de celularidad normal con menos de 5% de blastos, y en sangre periférica recuento de neutrófilos mayor de 1,0 x 109/L y recuento de plaquetas mayor de 100 x 109/L. MRT fue definida como muerte en RC. Muerte temprana (MT) fue la muerte ocurrida antes de que la respuesta al tratamiento pudiera ser establecida. Recaída fue definida por la presencia de más de 5% de blastos en el aspirado de médula ósea. SG fue medida desde el diagnóstico hasta la muerte por cualquier causa. SLE fue definida como el tiempo entre el diagnóstico y la recaída, muerte por cualquier causa, o la fecha de último contacto con el paciente en RC.
La fecha usada para determinar el último contacto con el paciente fue el 31 de diciembre de 2007.
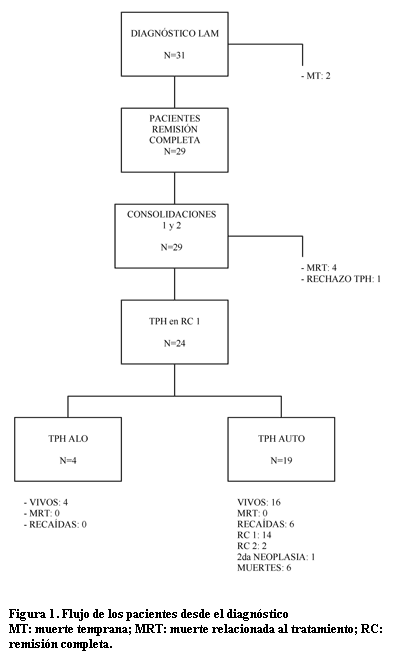
Resultados (figura 1)
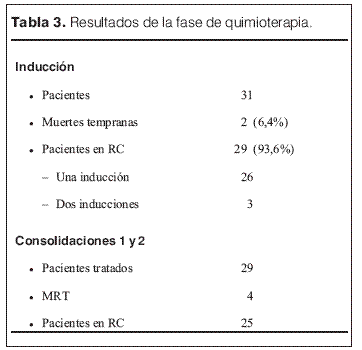
De los 31 pacientes que ingresaron en el protocolo LAM-CHPR, dos pacientes tuvieron una MT por complicaciones infecciosas. Veintinueve pacientes (93,6 %) alcanzaron RC luego de uno (26 pacientes) o dos (tres pacientes) tratamientos de inducción. Los 29 pacientes en RC recibieron dos tratamientos de consolidación. Veinticinco pacientes se mantuvieron en RC, mientras cuatro pacientes tuvieron una MRT, todos por complicaciones infecciosas en esta fase del tratamiento (tabla 3). No hubo recaídas en esta fase del tratamiento. De los 25 pacientes que llegaron a la fase de trasplante, cinco tenían un hermano HLA idéntico y 20 no tenían hermano histocompatible. Un paciente que tenía donante no recibió el TPH por falta de complacencia de la familia con el procedimiento. Veinticuatro pacientes fueron sometidos a TPH, 4 alogénicos y 20 autólogos (tabla 4). El número de células CD34+ infundidas fue levemente superior en los TPH alogénicos. La recuperación hematológica (neutrófilos > 0,5 x 109/L) tuvo una mediana de 11 y 13 días para los TPH alogénicos y autólogos respectivamente. No hubo MRT en esta fase del tratamiento. Los cuatro pacientes que recibieron TPH alogénico continúan en RC. Seis pacientes sometidos a TPH autólogo presentaron recaída medular de su enfermedad 2 a 18 meses después del trasplante (mediana: 4 meses). Cuatro de estos pacientes fallecieron por progresión de su enfermedad, mientras que dos pacientes recibieron un segundo TPH alogénico de donante haploidéntico y continúan en la segunda RC. Otros dos pacientes fallecieron, uno a causa de una segunda neoplasia (LAL), y el otro en un accidente.
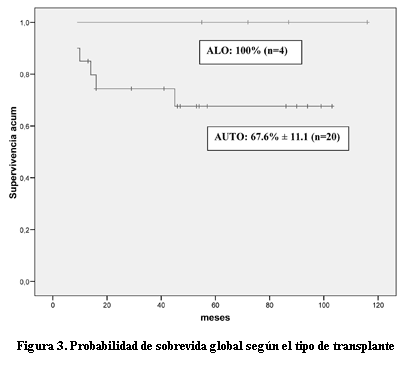
Al tiempo del análisis de los datos, con una mediana de seguimiento de 56 meses (13–116), 20 pacientes están vivos en RC (18 en primera RC y dos en segunda RC), siendo la probabilidad de SG y SLE a los 10 años postrasplante de 73,5% ± 9,4 y 64. 5% ± 10,2% respectivamente (figura 2). Los TPH alogénicos fueron sólo cuatro, y el 100% sobrevive sin eventos, mientras la probabilidad de SG y SLE para los TPH autólogos fue de 67,6% ± 11,1 y 56,5% ± 11,8 respectivamente (figura 3). El pequeño número de TPH alogénicos no permite realizar un análisis comparativo entre ambos grupos.
El paciente que no recibió el trasplante presentó una recaída tras la cual recibió un TPH alogénico en segunda RC, pero posteriormente recayó nuevamente y falleció por progresión de la enfermedad.
En relación a todos los pacientes con intención de tratar incluidos en el protocolo LAM-CHPR, la probabilidad de SG y SLE estimada a los 10 años fue de 56,6% ± 9,2 y 50% ± 9,0 respectivamente (figura 4).
Discusión
Los factores que influencian la evolución de los pacientes con LAM son la intensidad de la inducción, el tratamiento post remisión realizado y la calidad del tratamiento de soporte. Muchos grupos hoy logran tasas de RC de 80% a 90%, las tasas de recaída son de 30% a 40%, y la SLE y SG son de 50% y 60% respectivamente (16-20). Sin embargo hay muchas preguntas importantes que no han podido ser respondidas en el contexto de estudios randomizados.
Los problemas no resueltos incluyen la intensidad óptima de la quimioterapia, cuál es el mejor antraciclínico, la dosis óptima de citarabina, la dosis acumulativa de antraciclínicos que minimice la cardiotoxicidad sin comprometer los resultados, el rol del TPH en primera remisión, y el uso de tratamientos adaptados al riesgo.
Nuestro protocolo utiliza en la inducción el esquema DAE, utilizado por la mayoría de los grupos, pero con dosis de antraciclínicos comparativamente más elevadas (180 mg/m2). Los resultados fueron muy buenos ya que todos los pacientes, salvo dos que fallecieron por complicaciones infecciosas, alcanzaron la RC, y sólo tres requirieron una segunda inducción. La importancia de la intensidad del tratamiento de inducción está demostrada en los trabajos del Cancer Children Group que logran mejores tasas de SLE en aquellos pacientes que recibieron tratamientos de inducción más intensos con ciclos de quimioterapia secuenciales sin esperar la recuperación hematológica, comparados con aquellos que recibieron tratamientos estándar (24).
En relación a los antraciclínicos, los estudios que han comparado los diferentes agentes no han demostrado que ninguno sea superior (25,26). Más importantes son las dosis acumulativas y su potencial cardiotoxicidad. Dosis superiores a 375 mg/m2 se relacionan con mayor riesgo de cardiotoxicidad, y dosis inferiores se relacionan con menor SLE. En nuestro protocolo la dosis acumulativa de antraciclínicos utilizada durante la fase de quimioterapia fue de 540 mg/m2. A pesar de tratarse de una dosis muy elevada, hasta el momento no hemos registrado casos de cardiotoxicidad manifiesta clínicamente.
Los tratamientos post remisión con quimioterapia se basan en el uso de altas dosis de AraC. Sin embargo las dosis óptimas aún no han sido determinadas. Nuestro protocolo utiliza dosis acumulativas relativamente bajas (19,9 g/m2), pero todos los pacientes recibieron, además, TPH. Otros grupos que no realizan TPH han utilizado dosis más altas que en algunos casos han llegado a 60 g/m2 (1).
Los TPH alogénico y autólogo representan una forma de intensificación de dosis con el objetivo de erradicar la leucemia residual. Esto se logra a través de la administración de regímenes de condicionamiento en ambas modalidades de trasplante y a través del efecto injerto versus leucemia en el TPH alogénico. El TPH alogénico es el tratamiento de la LAM que se asocia con mayor SLE y SG (9). Sin embargo el rol del TPH alogénico, particularmente si debe ser realizado en primera RC o reservado para una segunda remisión, sigue siendo motivo de controversia en la LAM del niño. La mayoría de los grupos están de acuerdo que las LAM con la t(15;17), t(8;21) o inv(16) son de buen pronóstico, y no son candidatos para TPH en primera RC, pero las opiniones difieren respecto a las LAM de riesgo estándar o alto riesgo que son las que constituyen el grupo más numeroso (21-23). Una de las principales razones que esgrimen los grupos en contra del TPH alogénico en primera RC, además de las toxicidades a largo plazo, es la alta MRT. Sin embargo el mejoramiento en los cuidados de soporte de los pacientes sometidos a TPH y la optimización de los regímenes de condicionamiento han disminuido significativamente la MRT en los TPH de hermanos compatibles e incluso de donantes alternativos. En relación a los TPH autólogos, el análisis de estudios randomizados ha fallado en demostrar superioridad de éste sobre la quimioterapia intensiva (27,28). También estudios de metaanálisis concluyen que los datos son insuficientes para determinar si el TPH autólogo es superior a la quimioterapia no-mieloablativa (9). Recientemente, la actualización de un importante estudio randomizado confirma el TPH autólogo como un tratamiento efectivo (6). En nuestra serie, el número de pacientes y su distribución no nos permite hacer un análisis comparativo entre ambas modalidades de TPH. Tampoco el escaso número de pacientes permite comparar nuestros resultados con otras series publicadas. Destacamos que el procedimiento no ha tenido mortalidad y que la SG y SLE post trasplante son muy alentadoras. Sin embargo cuando analizamos la sobrevida de los pacientes con intención de tratar nuestros resultados son semejantes a los publicados. En nuestra experiencia esto se debe a que durante la fase de quimioterapia hubo dos MT (6%) y cuatro muertes en RC (13%), todas por complicaciones infecciosas. La MRT es una de las principales causas de fracaso en el tratamiento de los niños con LAM. Las complicaciones infecciosas son la mayor causa de morbilidad y mortalidad al diagnóstico y durante el tratamiento. Las MT en las publicaciones europeas y norteamericanas van de un 2% a un 10%, y las muertes en RC de un 2% a 16% (incluidos pacientes que recibieron TPH) (1).
Seis pacientes recayeron luego del TPH (25%). Todos eran de riesgo estándar, que fue el grupo predominante, y habían recibido un TPH autólogo. Destacamos que 2 pacientes pudieron ser rescatados con un trasplante alogénico de donante alternativo. Estos pacientes recibieron un trasplante haploidéntico de uno de sus padres.
Por último, merece especial mención dentro de las complicaciones tardías, el caso de un paciente que presentó una segunda neoplasia. Ésta fue una leucemia aguda linfoblástica, situación extremadamente infrecuente en la literatura.
Conclusiones
En estos 10 años hemos tratado las LAM, independientemente del riesgo, con un mismo protocolo basado en tratamientos de quimioterapia intensiva y TPH en primera remisión. Más del 80% de los pacientes pertenecían al riesgo estándar o alto. Los resultados obtenidos aunque no comparables, son equivalentes a los logrados por grupos cooperativos de referencia que incluyen el TPH en primera remisión, o sólo utilizan tratamientos con quimioterapias no mieloablativas. Aproximadamente 20% de los pacientes fallecieron de causas infecciosas que en un futuro pueden disminuirse con mejores estrategias de soporte. Los TPH alogénicos fueron muy pocos, como era de esperar, teniendo en cuenta que sólo uno de cuatro pacientes tendrá un hermano compatible. Los resultados en los pacientes que recibieron TPH autólogo son buenos pero debe considerarse que dos pacientes fueron rescatados con un segundo trasplante. Es importante destacar el hecho de que no hubo MRT en los pacientes trasplantados. Pero no debemos olvidar las posibles secuelas a largo plazo como segundas neoplasias, enfermedad injerto versus huésped crónica, esterilidad, etcétera.
En el futuro, no parece justificado el TPH en pacientes de bajo riesgo donde los resultados sólo con quimioterapia son muy buenos. El TPH autólogo probablemente no juegue un rol en el tratamiento de la LAM en el niño salvo situaciones particulares. Los pacientes con factores pronósticos de alto riesgo sin donante histocompatible conforman un grupo donde la quimioterapia aun con dosis mieloablativas juega un rol insuficiente. Tratamientos con nuevos citostáticos o agentes dirigidos molecularmente se encuentran bajo investigación. El TPH de donantes alternativos que permita desarrollar una actividad antitumoral a través del efecto injerto versus leucemia es una estrategia con posibilidades en nuestro medio.
Referencias bibliográficas
1. Kaspers G, Creutzig U. Pediatric AML: long term results of clinical trials from 13 study groups worldwide. Leukemia 2005; 19: 2025–146.
2. Kaspers GJ, Creutzig U. Pediatric acute myeloid leukemia: international progress and future directions. Leukemia 2005; 19(12): 2025–9.
3. Ravindranath Y, Yeager AM, Chang MN, Steuber CP, Krischer J, Graham-Pole J, et al. Autologous bone marrow transplantation versus intensive consolidation chemotherapy for acute myeloid leukemia in childhood. Pediatric Oncology Group. N Engl J Med 1996; 334: 1428–34.
4. Woods WG, Neudorf S, Gold S, Sanders J, Buckley JD, Barnard DR, et al. A comparison of allogeneic bone marrow transplantation, autologous bone marrow transplantation, and aggressive chemotherapy in children with acute myeloid leukemia in remission. Blood 2001; 97: 56–62.
5. Neudorf S, Sanders J, Kobrinsky N, Alonzo TA, Buxton AB, Gold S, et al. Allogeneic bone marrow transplantation for children with acute myelocytic leukemia in first remission demonstrates a role for graft versus leukemia in the maintenance of disease-free survival. Blood 2004; 103: 3655–61.
6. Neudorf S, Sanders J, Kobrinsky N, Alonzo A, Buxton A, Buckley JD, et al. Autologous bone marrow transplantation for children with AML in first remission. Bone Marrow Transplant 2007; 40: 313–8.
7. Creutzig U, Reinhardt D. Current controversies: which patients with acute myeloid leukaemia should receive a bone marrow transplantation? A European view. Br J Haematol 2002; 118: 365–77.
8. Burnett AK, Wheatley K, Golgstone AH, Stevens RF, Hann IM, Rees JH. The value of allogeneic bone marrow transplant in patients with acute myeloid leukaemia at differing risk of relapse: results of theUK MRC AML 10 trial. Br J Haematol 2002; 118: 385–400.
9. Bleakley M, Lau L, Shaw PJ, Kaufman A. Bone marrow transplantation for paediatric AML in first remission: a systematic review and meta-analysis. Bone Marrow Transplant 2002; 29(10): 843–52.
10. Ortega JJ, Olivé T, Díaz de Heredia C, Coll MT, Bastida P, Massuet L. Allogenic and autologous bone marrow transplantation in AML in first remission. The Spanish experience. Bone Marrow Transplant 1996; 18 Suppl 2: 53-58.
11. Bennett JM, Catovsky D, Daniel MT, Flandrin G, Galton DA, Gralnick HR, et al. Proposed revised criteria for the classification of acute myeloid leukemia. A report of the French-American-British Cooperative Group. Ann Intern Med 1985; 103: 620-5.
12. Grimwade D, Walker H, Oliver F, Wheatley K, Harrison C, Harrison G, et al. The importance of diagnostic cytogenetics on outcome in AML: analysis of 1,612 patients entered into the MRC AML 10 trial. The Medical Research Council Adult and Children’s Leukaemia Working Parties. Blood 1998; 92: 2322-33.
13. Creutzig U, Zimmermann M, Ritter J, Henze G, Graf N, Löffler H, et al. Definition of a standard-risk group in children with AML. Br J Haematol 1999; 104: 630-9.
14. Kaplan GL, Meier D. Non parametric estimation from incomplete observations. J Am Stat Assoc 1958; 53: 457-81.
15. SPSS for Windows. Release 15,0. Chicago, IL: SPSS Inc. 2006.
16. Gibson BE, Wheatley K, Hann IM, Stevens RF, Webb D, Hills RK, et al. Treatment strategy and long-term results in paediatric patients treated in consecutive UK AML trials. Leukemia 2005; 19(12): 2130–8.
17. Pession A, Rondelli R, Basso G, Rizzari C, Testi AM, Fagioli F, et al. Treatment and long-term results in children with acute myeloid leukaemia treated according to the AIEOP AML protocols. Leukemia 2005; 19(12): 2043–53.
18. Lie SO, Abrahamsson J, Clausen N, Forestier E, Hasle H, Hovi L, et al. Long-term results in children with AML: NOPHOAML Study Group–report of three consecutive trials. Leukemia 2005; 19(12): 2090–100.
19. Ravindranath Y, Chang M, Steuber CP, Becton D, Dahl G, Civin C, et al. Pediatric Oncology Group (POG) studies of acute myeloid leukemia (AML): a review of four consecutive childhood AML trials conducted between 1981 and 2000. Leukemia 2005; 19(12): 2101–16.
20. Ribeiro RC, Razzouk BI, Pounds S, Hijiya N, Pui CH, Rubnitz JE. Successive clinical trials for childhood acute myeloid leukemia at St Jude Children’s Research Hospital, from 1980 to 2000. Leukemia 2005; 19(12): 2125–9.
21. Creutzig U, Reinhardt D. Current controversies: which patients with acute myeloid leukaemia should receive a bone marrow transplantation? A European view. Br J Haematol 2002; 118(2): 365–77.
22. Chen AR, Alonzo TA, Woods WG, Arceci RJ. Current controversies: which patients with acute myeloid leukaemia should receive a bone marrow transplantation? An American view. Br J Haematol 2002; 118(2): 378–84.
23. Wheatley K. Current controversies: which patients with acute myeloid leukaemia should receive a bone marrow transplantation? A statistician’s view. Br J Haematol 2002; 118(2): 351–6.
24. Smith FO, Alonzo TA, Gerbing RB, Woods WG, Arceci RJ; Children's Cancer Group. Long-term results of children with acute myeloid leukemia: a report of three consecutive phase III trials by the Children’s Cancer Group: CCG 251, CCG 213 and CCG 2891. Leukemia 2005; 19(12): 2054–62.
25. Creutzig U, Ritter J, Zimmermann M, Hermann J, Gadner H, Sawatzki DB, et al. Idarubicin improves blast cell clearance during induction therapy in children with AML: results of study AML-BFM 93. AML-BFM Study Group. Leukemia 2001; 15(3): 348–54.
26. O'Brien TA, Russell SJ, Vowels MR, Oswald CM, Tiedemann K, Shaw PJ. Results of consecutive trials for children newly diagnosed with acute myeloid leukemia from the Australian and New Zealand Children’s Cancer Study Group. Blood 2002; 100(8): 2708–16.
27. Stevens RF, Hann IM, Wheatley K, Gray RG. Marked improvements in outcome with chemotherapy alone in paediatric acute myeloid leukemia: results of the United Kingdom Medical Research Council’s 10th AML trial. MRC Childhood Leukaemia Working Party. Br J Haematol 1998; 101(1): 130–40.
28. Ravindranath Y, Yeager AM, Chang MN, Steuber CP, Krischer J, Graham-Pole J, et al. Autologous bone marrow transplantation versus intensive consolidation chemotherapy for acute myeloid leukemia in childhood. Pediatric Oncology Group. N Engl J Med 996; 334(22): 1428–34.
Correspondencia: Dr. Gustavo Dufort y Alvarez. Centro Hemato-Oncológico Pediátrico. Centro Hospitalario Pereira Rossell.
Correo electrónico: gdufort@chasque.net