Services on Demand
Journal
Article
Related links
Share
Archivos de Pediatría del Uruguay
On-line version ISSN 1688-1249
Arch. Pediatr. Urug. vol.79 no.3 Montevideo Sept. 2008
ARTÍCULO ORIGINAL
Arch Pediatr Urug 2008; 79(3)
Sobrevida y morbilidad en recién nacidos que pesaron menos de 1.000 gramos
Ruty Keshishian 1, Miguel Martell 2
1. Ex asistente de Neonatología.
2. Prof. de Neonatología.
Fecha recibido: 18 de setiembre de 2008.
Fecha aprobado: 10 de octubre de 2008.
Resumen
Introducción: la mejoría en la sobrevida de los nacidos de 28 semanas o menos y menores de 1.000 gramos de peso hace necesario el conocimiento de la morbimortalidad por grupos de peso y edad gestacional que ayude a las decisiones obstétricas y a la información brindada a los padres.
Objetivo: describir en nuestro medio la expectativa de vida y las morbilidades más frecuentes y graves en estos niños.
Material y métodos: es un estudio observacional descriptivo y retrospectivo donde se evaluaron 123 neonatos que pesaron menos de 1.000 gramos al nacer por un período de 5 años. Grupo 1 constituido por 13 neonatos que tenían 29 semanas o más, todos de bajo peso para la edad gestacional (puntaje "z" entre –2,1 y –2,4). Grupo 2 constituido por 110 pretérminos de 28 semanas o menos y la distribución de peso para la edad por encima del percentil 90 y por debajo del 10 era la esperada. Se describen las complicaciones más frecuentes y la sobrevida de estos niños. Se usó como definición de DBP los que aún necesitan oxígeno a las 36 semanas.
Resultados: en el grupo 1 la sobrevida fue del 100% y en el grupo 2 de 63%. En este grupo la complicación más frecuente fue la DBP que se presentó en el 77% de los casos, 39% la forma leve y 27% la forma moderada o severa. Se encontró una asociación significativa entre el tiempo de ventilación mecánica y la DBP. Los niños de menor peso y menor edad gestacional requirieron mayor tiempo de ventilación mecánica (VM). La primera extubación fracasó en un 58% de los casos, pero cuando se ventilaron nuevamente los parámetros requeridos en las primeras 24 horas de reintubación no fueron diferentes de aquellos que tenían en las 24 horas previas al destete. En los neonatos ventilados que no se podían destetar del respirador se usó la administración de corticoides tardíos en un 54%. Permitieron bajar la FiO2 en 30% y la PMVA en 2 cm de agua a las 48 horas de la primera dosis. Así fue pasible destetar el 50% de los casos. Si se repetía la serie después de un intervalo libre se tenía el mismo resultado. Cuando se compararon la frecuencia de las complicaciones del estudio actual con la literatura se encuentra que la hemorragia intraventricular severa está por debajo de la mediana, la sepsis en la mediana y todas las demás por encima de la misma (cercano a lo que sería el percentil 75).
Conclusiones: prácticamente todas las complicaciones se asociaron a la DBP y ésta se asocia a la prolongación de la VM por lo que se deben mejorar los cuidados respiratorios de estos niños durante la ventilación y el destete para evitar el deterioro clínico que los lleve a la reintubación.
Palabras clave:
RECIÉN NACIDO DE MUY BAJO PESO
MORBILIDAD
DISPLASIA BRONCOPULMONAR
CORTICOSTEROIDES-uso terapéutico
SOBREVIDA
Summary
Introduction. the survival rate of newborns with gestational age of 28 weeks or less and with a weight lower than 1.000 g has improved, making necessary a better knowledge about morbidity and mortality. The classification is by weight and gestational age in order to help the obstetric decisions and the information given to parents.
Objective: to describe life expectancy and the most frequent and severe pathologies in these newborns in our country.
Methods: this is an observational descriptive and retrospective study in which 123 newborns weighing less than 1.000 g were evaluated in a 5 year period. Group 1 was conformed by 13 newborns with 29 weeks of gestational age at birth or more, all of them being small for the gestational age (score "z" between -2, 1 and -2, 4). Group 2 was constituted by 110 preterm newborns less than 29 weeks of gestational age, adequate for gestational age when analyzed by weight at birth.
A description of the most frequent complications and the survival of these children is presented. The definition of bronchopulmonary dysplasia (BPD)applied was the persistent requirement of oxygen at 36 weeks of age.
Results. group 1 survival was 100% and the group 2 survival was 63%. In the last group the most frequent complication was BPD which appeared in 77%; 39% was mild and 27% had moderate or severe forms. A significant relationship between the mechanical ventilation period and the development of this pathology was found. Newborns who had less weight and lower gestational age required more time of mechanical ventilation. The first extubation failed in 58% of the patients, however the ventilation parameters required after the first extubation were no different from those of the last 24 h of ventilation. In those newborns which could not be weaned from ventilator, corticoids were administered in 54% of patients decreasing the FiO2 in 30% and the airway medium pressure in 2 cm H2O after 48 h. The weaning process was favored in 50% of patients. If corticoid administration was required after a free interval the result was the same. The frequency of complications was compared with updated literature showing severe intraventricular hemorrhage is less than the media, sepsis the same as the media and all the other complications over this point (near 75%).
Conclusion. almost all complications were associated to BPD, and this pathology is in relationship with the prolongation of mechanical ventilation. It is necessary to improve the respiratory aspects related to ventilation and weaning in order to prevent the clinical deterioration which requires reintubation.
Key words:
INFANT, VERY LOW BIRTH WEIGHT
MORBIDITY
BRONCHOPULMONARY DYSPLASIA
ADRENAL CORTEX HORMONES-therapeutic use
SURVIVORSHIP
Introducción
El avance en la neonatología ha sido muy rápido a partir de 1960 donde se incorporan conductas y procedimientos que tuvieron un impacto significativo en la letalidad especialmente en los nacidos con bajo peso, que motivó el uso de diferentes definiciones para este grupo de niños. En esa época se definía como bajo peso a todo recién nacido cuyo peso al nacer fuera menor de 2.500 gramos. En 1963 Usher (1) propone abandonar el clásico ayuno y comienza con una hidratación parenteral en las primeras horas de vida y corrige la acidosis metabólica con bicarbonato. Esta conducta produjo una reducción de un 20% de la mortalidad de los nacidos con un peso entre 1.000 y 2.500 gramos. En los menores de 1.000 gramos la mortalidad estaba, en ese período, entre 85 y 95% y no tuvo cambios con esta norma. En la década del 70 se producen dos hechos que fueron determinantes en el futuro de la neonatología. Uno fue la introducción de la presión positiva continua en la vía aérea (PPC) para el tratamiento de la dificultad respiratoria por Gregory en 1971 (2) y la incorporación de esta tecnología a la ventilación mecánica en 1973 por Cumarasamy (3).
El otro hecho fue la administración de corticoides para inducir la maduración pulmonar a las madres con amenaza de parto prematuro en 1972 (4). El grupo de peso entre 1.000 y 1.500 gramos tuvo los mayores cambios positivos. A este grupo de 1500 gramos o menos se le denominó muy bajo peso al nacer (VLBW: very low birth weight, en la literatura anglosajona). La década del 80 comienza con la administración del surfactante artificial por Fujivara (5) la mortalidad baja a más del 50% especialmente en los menores de 1.500 gramos y mas aún en los menores de 1.000 gramos. Aquí surge la terminología de extremo bajo peso al nacer para los menores de 1.000 gramos (ELBW en la literatura anglosajona). En este período se introdujeron dos tecnologías para la evaluación de la función respiratoria: la pO2 y pCO2 cutánea (6) y luego el oxímetro de pulso (7). También en la década del 80 se comienza la administración de esteroides para el destete del respirador cuando este procedimiento era muy difícil realizarlo por los altos requerimientos de FiO2 (8). Este fármaco se usa en la actualidad aunque es discutido por los efectos a largo plazo que puede producir en el niño (9).
En 1984 en los países desarrollados la mortalidad entre 500 y 1.000 gramos era de 39% descendiendo a 27% en el 2002. Con la edad gestacional se observaron los mismos efectos aumentando la sobrevida en las edades más bajas (10). No sólo han mejorado las tecnologías usadas sino que también mejoró el cuidado y el mejor manejo de quienes se encargan de administrarlo, así como la infraestructura de los servicios. La mejoría en la mortalidad ha aumentado el número de niños más inmaduros que sobreviven y las secuelas tempranas como la displasia broncopulmonar (DBP) y las tardías como la parálisis cerebral y retardo mental permanecen incambiadas o han aumentado levemente. También el hecho que aumenta la sobrevida de niños muy pequeños que pueden tener secuelas graves hace que se planteen problemas éticos tratando de establecer un límite de peso y edad gestacional de quienes deben ser tratados (11,12). El conocimiento en nuestro medio de la mortalidad y la morbilidad en este grupo de niños de extremo bajo peso (<1.000 gramos) es importante para el manejo obstétrico, para la información a los padres del pronóstico así como mejorar y adecuar los recursos que se tienen o deben incorporarse para el mejor manejo del neonato y la planificación del cuidado luego del alta. El estudio actual pretende describir la sobrevida y la morbilidad, especialmente respiratoria, de este grupo de niños.
Población y métodos
Es un estudio observacional, descriptivo y retrospectivo. Se evaluaron 126 neonatos que pesaron menos de 1.000 gramos al nacer, en dos unidades de cuidado intensivo neonatal de Montevideo (Centro Uruguayo de Perinatología y Unidad Pediátrica del Círculo Católico) por un período de 5 años, comprendido entre enero del año 2002 a diciembre del 2006. La información se obtuvo de la historia clínica. De acuerdo a la edad gestacional se clasificaron en dos grupos. Grupo 1 aquellos que tenían 29 semanas o más y grupo 2 cuando la edad gestacional era de 28 semanas o menos. El grupo 1 estuvo constituido por 13 neonatos, con un promedio de 31 semanas (entre 29 y 33), todos fueron de bajo peso para la edad gestacional (puntaje "z" entre -2,1 y –4,0).Se usó como referencia la curva de Usher (13). El grupo 2 fueron 113 neonatos con un promedio de 26 semanas de edad gestacional (rango entre 24 y 28), un peso promedio al nacer de 846 gramos (rango entre 600 y 999). El valor promedio del puntaje z de peso al nacer para el grupo 2 fue de –0.41 (DE=0,74; entre –1,8 y + 1,06 con un 95% de confianza). Cuarenta y cinco por ciento de los neonatos nacieron dentro de la institución y el 55% provenían de otras maternidades. Se usó ventilación asistida intermitente en sus dos variedades, sincronizada y/o asistida controlada. No se usó alta frecuencia. El tiempo de ventilación mecánica se estudió por grupos de peso y edad gestacional. La presión positiva continua nasal (PPCN) se aplicó a través de la introducción de dos tubos intranasales que llegaban hasta la faringe posterior. La extubación se trató de realizar lo más tempranamente posible. Cuando el neonato se estabilizó con una FiO2 de 0,4 a 0,30 o menos y una PMVA entre 5 y 6 cm de H2O, de acuerdo al estado del niño se conectó al CPAP nasal y se retiró la sonda endotraqueal. En algunos casos se dejó un breve período de tiempo de presión positiva intratraqueal y se observó la evolución antes de la colocación de la misma por vía nasal. Previo a la extubación se hizo una dosis carga de aminofilina de 5 mg/kg/dosis y se continuó con 1,5 a 3 mg/kg/dosis cada 8 horas como mantenimiento. En el período inmediato post-extubación se observó el estado clínico del neonato especialmente la frecuencia y trabajo respiratorio, aumento de los requerimientos de FiO2 (para mantener una saturación mínima de 90-92%) y la presencia de apneas. Además se usó la gasometría arterial o capilar como apoyo a la información clínica y a la radiología. Si los parámetros evaluados se agravaban se procedía nuevamente a la intubación. La mayoría de las veces la reintubación se realizó en base a la información clínica. Se consideró exitosa la extubación cuando el niño por una semana no tuvo necesidad de la misma. La administración de corticoides sólo se realizó cuando el destete del respirador era muy difícil o el neonato estaba muy lábil. Las dosis de dexametasona fueron más altas en el período 2002-2004, fue de 0,25 mg/kg/día (repartida en dos dosis cada 12 horas) durante tres días, luego se reduce al 50% cada tercer día hasta alcanzar un máximo de 10 días. A partir del año 2005 la dosis fue más baja. Se administró dexametasona 0,15 mg/kg/día cada 12 horas los primeros tres días; 0,10 mg/kg/día los siguientes tres días; 0,05 mg/kg/día durante dos días y 0,02 los últimos dos días de tratamiento. Para evaluar las complicaciones de la administración de corticoides se realizó un dextrotix cada 12 horas evaluación clínica y hemograma con conteo de glóbulos blancos, plaquetas, PCR y hemocultivo si se tenía sospecha de infección. Para el diagnóstico de broncodisplasia pulmonar (DBP) se usó la nomenclatura propuesta por el NICHD/NHLBI working Summary (14) para los menores de 32 semanas que considera la dependencia de oxígeno en los primeros 28 días y a las 36 semanas. Establecen tres categorías: 1) DBP leve, aquellos que hayan requerido la administración de oxígeno por lo menos en los primeros 28 días pero a las 36 semanas están respirando aire; 2) DBP moderada, requieren oxígeno en los primeros 28 días y a las 36 semanas requieren la administración de oxígeno a una concentración menor del 30%, y 3) DBP severa, igual que la anterior pero a la semana 36 requieren una FiO2 ³ al 30%. Esta clasificación tiene un valor pronóstico con la morbilidad en los primeros años de vida, especialmente la forma grave (15). Para las otras morbilidades se tomaron las siguientes definiciones: 1) sepsis tardía cuando se tuvo un hemocultivo positivo después del tercer día de vida; 2) se consideró enterocolitis necrotizante (NEC) cuando estaba en la etapa IIA o más alta de la clasificación de Bell’s; 3) se diagnosticó hemorragia intraventricular por ecografía transfontanelar. Se describe de acuerdo a la clasificación propuesta por Papile; para la retinopatía se usó la clasificación internacional de retinopatía.
Estadística
Para describir los datos cuantitativos se usó como medida de resumen central el promedio y la mediana. Como medida de dispersión se usó desvío estándar cuando la distribución fue simétrica y los percentiles o el rango intercuartílico en las distribuciones asimétricas. Para comparar el tiempo de ventilación mecánica y presión positiva nasal (CPAP) entre los diferentes grupos de peso y edad gestacional se usó el método actuarial de Kaplan-Meier y como prueba estadística el logrank test. Para comparar dos grupos se usó la prueba de "t" y, si fueron más de dos, el análisis de varianza para las distribuciones simétricas y la prueba de Kruskal-Wallis para las asimétricas. Para estudiar la asociación de variables cualitativas se usó la prueba de Chi cuadrado y para las cuantitativas la regresión lineal. Se tomó como nivel de significación un error alfa del 5% (p<0,05).
Resultados
Sobrevida
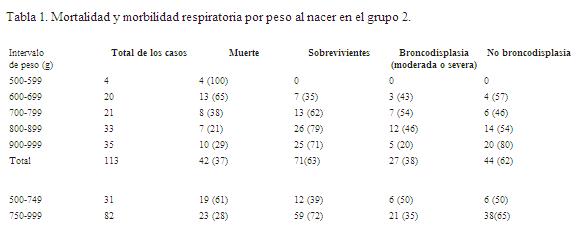
En el grupo 1 la sobrevida fue de 100%. En el grupo 2 de 28 semanas o menos fue de 63% (tabla 1 y 2). Cuando se consideraron el grupo 1 y 2 juntos la sobrevida fue de 67%. La distribución de la edad al fallecer presentó una distribución asimétrica, fue más alta en los primeros días de vida. La mediana fue de 7 días; el percentil 25 el primer día y el percentil 75 el día 23. No hubo diferencias en la edad al fallecer entre los nacidos con menos de 750 gramos y aquellos entre 751 y 999. La expectativa de vida fue aumentando en las primeras 4 semanas. 62, 72, 74, 80 y 87% para los días 1, 4, 7,21 y 30 respectivamente. El cambio mayor fue entre el nacimiento y los 7 días.

Ocupación de camas
El número de días de internación para los sobrevivientes del presente estudio fue de 5.445 (grupo 1 más grupo 2) y para los fallecidos en el mismo período de 874 días. Así se obtuvo el porcentaje de tiempo de ocupación de los pacientes que fallecieron que fue del 13,8%.
Grupo 1. De los 13 neonatos de este grupo, sólo dos requirieron ventilación mecánica y surfactante. La duración de la ventilación para éstos fue de un día para uno y de cuatro para el otro. No hubo broncodisplasia pulmonar en este grupo.
Grupo 2. Ventilación y surfactante. El 95,7% (68/71) requirió ventilación mecánica (VM) y se le administró surfactante. La mediana del tiempo de ventilación fue de 21 días, percentil 10 de 1 día y percentil 90 de 61 días.
Ventilación y peso al nacer. El tiempo de ventilación de acuerdo al peso al nacer, sin tener en cuenta la edad gestacional, fue más prolongado en los de menor peso. La regresión muestra un aumento de 8,4 días de ventilación con una variabilidad entre 1 y 16 días, intervalo de confianza (IC) de 95% por cada 100 gramos que desciende por debajo de 1.000 gramos (p<0,02). El comportamiento del grupo de 600 a 699 gramos fue similar al de 700 a 799. Lo mismo ocurrió con el grupo de 800 a 899 y el de 900 a 999 g (figura 1). La mediana del tiempo de ventilación en el grupo de 800 a 999 gramos fue de 4,5 días mientras que en el grupo de 600 a 799 fue de 40 días. Estas diferencias fueron significativas, logrank test p = 0,023.
Ventilación y edad gestacional. El tiempo de ventilación mecánica fue muy variable con la edad gestacional, existe una tendencia significativa que es más prolongada en los de menor edad gestacional (prueba de logrank test: p<0,05) (figura 1). La mediana de duración de la VM fue de 10; 21; 27; 39 y 42 días a las 28, 27, 26, 25 y 24 semanas respectivamente. La recta de regresión muestra una disminución de 7,5 días (entre 1 y 13 días con un IC de 95%) de VM por cada semana que aumenta la edad gestacional a partir de la 24 semana. El tiempo que requirieron presión positiva continua (PPCN) no fue diferente entre las 24 y 28 semanas.
Extubación. En los primeros 10 días se extubaron 43 neonatos (63%), en 25 (58% de los extubados) se tuvo éxito. El peso fue mayor (p<0,05) en el grupo que la extubación fue exitosa: 845 g versus 831 g. Después de los 10 días de ventilación el porcentaje de éxito de la primera extubación varió entre el 60 y 80%. Un 4,4% de las extubaciones fueron no programadas y exitosas. La causa de la reintubación más frecuente fueron la apnea y el trabajo respiratorio. En los niños que fueron reintubados, independientemente de la edad, el promedio de la PMVA en las 24 horas previas a la extubación fue de 6,9 ± 1,1 cm agua y la FiO2 de 0,34 ± 0,10 no fue significativamente diferente (p>0,05) a la que requirieron en las primeras 24 horas de la reintubación: 7,3 ± 1,5 para la PMVA y 0,42 ± 0,13 para la FiO2. El porcentaje de fracaso para las extubaciones tempranas y tardías fue de 50%. Un solo niño (25 semanas de edad gestacional y 788 gramos al nacer) ventilado durante 67 días presentó estenosis traqueal y fue tratado con intubación endotraqueal durante 37 días sin requerimiento de ventilación asistida ni de oxígeno. Ningún paciente fue traquetomizado.
Broncodisplasia. No presentaron ningún tipo de DBP 22,5% de neonatos (16/ 71), sólo requirieron oxígeno por un tiempo menor de 28 días. En los 55 restantes (77,5%) los requerimientos fueron de 28 días o más. Veintiocho (39,5%) se destetaron del oxígeno antes de las 36 semanas, es el grupo de BDP leve. Los 27 restantes (38%) aún tenían necesidad de oxígeno a las 36 semanas o más (tablas 1 y 2). De estos 27 neonatos, 11 (41%) fueron BDP moderada y 16 (59%) fueron severas. En los menores de 900 gramos la proporción de DBP moderadas o severas fue de 48% (22/46) más elevada que en los mayores de 900 gramos donde fue del 20% (p<0,05) (tabla 1). Los neonatos que presentaron BDP leve, moderada o severa tenían menor edad gestacional (26 ± 1) que aquellos que no tuvieron (27 ± 1 sem), p<0,05 (tabla 3). La semana de edad gestacional corregida que se hizo el destete del oxígeno en las BDP leves fue 34 ± 0,8 semanas y en las moderadas y/o severas fue a las 40 ± semanas. El promedio de peso fue 46 ± 27 gramos más bajo en los que tenían algún tipo de BDP (p<0,05: una cola). El tiempo de ventilación mecánica fue significativamente mayor (promedio 46 días) en los que presentaron BDP moderada o severa que aquellos que presentaron BDP leve (18,9 días) y éstos, a su vez, mayor que los que no tuvieron, que fue de siete días. No se encontró asociación entre el tiempo de administración PPCN y los diferentes grupos de DBP.

Con respecto a la evolución de los requerimientos de FiO2 se encontró una disminución significativa entre los requerimientos entre el primer día y los días 3 y 5 (figura 2). A partir de este momento los requerimientos comienzan a elevarse llegando a un promedio máximo de FiO2 de 0,55 entre los 15 y 25 días en los neonatos que hicieron DBP. La diferencia no fue significativa en la concentración de FiO2 requerido en los primeros 28 días en aquellos que hicieron la forma leve con los que tuvieron la forma moderada o grave de DBP: No se encontró diferencia en la distribución de morbilidades como sepsis, ductus arterioso o hemorragia ventricular en los diferentes grupos de DBP. Tampoco se encontró diferencia por sexo. El porcentaje de DBP no fue diferente en los neonatos que requirieron traslado de los nacidos en la maternidad.
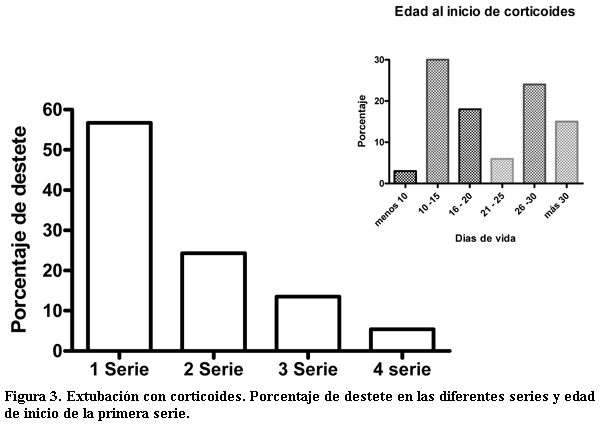
Extubación con corticoterapia. Se administraron corticoides en 37 (54%) neonatos. Sólo en un caso la administración se realizó antes de los 10 días (figura 3). En todos los niños se observó una disminución significativa (p<0.0001) de la fracción inspirada de oxígeno. El promedio de las diferencias entre 48 horas antes de recibir el corticoide y 48 después de su administración fue de 0,33 (IC95% 0,20-0,40) (figura 4). También disminuyó significativamente la PMVA en el mismo período. Con la primera serie se pudieron destetar 21 (57%), en la segunda nueve,(24,3%), en la tercera cinco (13,5%) y dos (5,4%) requirieron cuatro series. La probabilidad de realizar el destete después de cada serie oscila entre un 40 y 70%. En los neonatos con DBP moderada o severa recibieron corticoides el 92.5% (25/27) y los que tuvieron una BDP leve 42% (12/28).
Otras morbilidades en el grupo 2. Sepsis. La frecuencia de sepsis fue del 28% (20/71). En todos los casos se asoció a DBP (leve, moderada o grave). Retinopatía. Fue observada en 12 niños (17%), siete fueron moderadas o graves y cinco leves. Hemorragia intraventricular. Se presentó en 26 neonatos (37%); 19 (27%) fueron grado 1 o 2 y siete (10%) grado 3 o 4. La enterocolitis necrotizante estuvo presente en 9 niños (12,6%). Doce neonatos (17%) presentaron tres morbilidades o más.
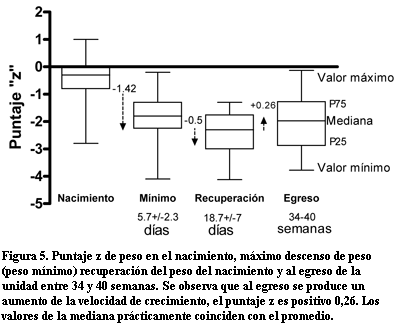
Crecimiento (figura 5). En el grupo 2 el promedio de puntaje "z" de peso al nacer fue de –0,43 (DE= 0,72). Al alcanzar el máximo descenso de peso el puntaje "z" fue de –1,86 (DE= 0,76). El descenso de "z" fue de –1,42 (entre –1,29 y –1,55). En el momento de la recuperación del peso al nacimiento el valor de "z" fue de –2,36 (DE=0,68), esto significó un descenso de "z" de –0,5 (entre 0,34 y 0,38) con respecto al valor mínimo, éste fue el valor más alejado de la curva patrón. A las 36 (entre 30 y 42) semanas el puntaje "z" fue de –1,98 (DE 1,0),subió 0,26 (entre 0,59 y 0,07) con respecto al valor en el momento de la recuperación del peso al nacer. El puntaje "z" del peso al nacimiento y máximo descenso de peso, no fue diferente en los neonatos con y sin DBP. El tiempo en recuperar el peso del nacimiento fue significativamente más prolongado, 19 (entre 9 y 39) días en los neonatos con DBP moderada o severa que los que no tuvieron o la DBP era leve que fue de 15 días (entre 9 y 23). También el grupo con DBP moderada o grave recibió alimentación parenteral por un período más prolongado 23±10 versus 12±8 días que en los demás niños.
Discusión
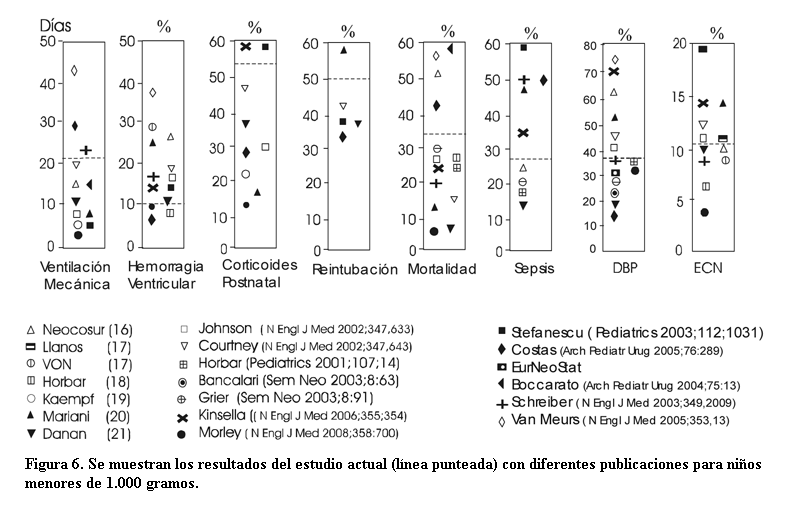
Los resultados en las diferentes variables estudiadas en este trabajo corresponden a todos los ingresos con un peso al nacer menor de 1.000 gramos en dos unidades de cuidado intensivo neonatal. Cuando se comparan estos resultados con los descritos en la literatura (16-21), se plantean dificultades metodológicas que deben ser aclaradas. Las cifras publicadas no son de todo el servicio sino de grupos que forman parte de diferentes estudios, habitualmente son randomizados, es decir que han tenido un criterio de selección para ingresar y corresponden a dos grupos, uno placebo y el otro en el que se realiza la intervención. Estos estudios dejan fuera un grupo importante de niños y los datos que se publican son los resultados del estudio específico y no los del servicio. Esto hace que la variabilidad puede ser importante, más aún cuando las diferencias son significativas entre los mismos. Hacen excepción los datos de los grupos que trabajan con la metodología del Vermont Oxford Network (VON) citado por Llanos (17). Cuando se describen separadamente los nacidos entre 500 y 749 g de aquellos entre 750 y 999 g se encuentra que la mortalidad y otras complicaciones son el doble o más en los que pesan entre 500 y 749 g (18). En el siguiente comentario, a los efectos de sintetizar la información, cuando eran dos muestras (control e intervenido o mayor y menor de 750 g) y se tenía el número de neonatos complicados en cada grupo se hizo una proporción común. La figura 6 muestra un dispersograma que describe los resultados de diferentes autores comparados con el estudio actual.
Excepto en la hemorragia intraventricular y la sepsis, donde el estudio actual se encuentra por debajo de la mitad de las publicaciones en el resto se encuentra por encima. En nuestro estudio la mayoría de las complicaciones estuvieron asociadas a los pacientes broncodisplásicos, especialmente las infecciones. Dada la asociación significativa entre ventilación mecánica y DBP, se debe tratar de hacer tempranamente el destete del respirador. La ventilación prolongada es causa de lesión pulmonar producida por el barotrauma, volutrauma e inflamación producida por infección e hiperoxia, que aunque transitoria siempre está presente. En un trabajo previo realizado en este mismo centro (22) se encontró que los neonatos que evolucionaban a la DBP tenían un promedio de 36 días de ventilación mecánica y 8 los que no hacían la enfermedad. En los menores de 1.000 gramos se producen 6,3 infecciones pulmonares por cada 1.000 días de ventilación mecánica (23). La extubación temprana puede ser una alternativa para mejorar los tiempos de ventilación, pero se debe ser muy cuidadoso con la vigilancia del paciente ya que la reintubación es requerida alrededor del 50% de los casos. En estos casos si el niño no se deteriora durante el tiempo que permanece extubado, nuestros hallazgos muestran que no es necesario un aumento franco de los parámetros del respirador cuando se reintuba, lo que indicaría que no se produce una agravación del paciente cuando se hace el destete y se controla en forma correcta. Como se observa en la figura 2 la FiO2 cae en todos los niños en forma significativa entre el tercer y quinto día, pero luego comienza a elevarse. La causa de este ascenso podría ser explicada por el comienzo del proceso inflamatorio pulmonar como respuesta a la injuria que produce la ventilación y que se traduce por aumento TGF-b1 (factor transformador del crecimiento) y aumento de leucocitos en el exudado traqueal (14). El TGF-b1 es una citoquina que interviene en la diferenciación celular que actúa a nivel de las células tipo II inhibiendo la síntesis de surfactante. Es interesante destacar que no todos los niños que tienen severa injuria pulmonar hacen DBP. Se ha encontrado en gemelares que un 53% de la varianza es atribuible a factores genéticos en la DBP, cuyo mecanismo de acción es variable, desde la activación de la enzima de angiotensina que retiene agua y sodio a aquellos factores genéticos que intervienen de una u otra manera en sustancias que regulan los procesos inflamatorios (24). En cuanto a la administración de corticoides el uso de la dexametasona como corticoide más usado en el período posnatal parece haber sido arbitrariamente basado en su mayor efecto antiinflamatorio (8). La inflamación produce un daño alveolar y de la vía aérea que contribuye al desarrollo de la DBP y determina la entrada de células inflamatorias al pulmón durante la ventilación posnatal, oxigenoterapia y exposición a antígenos microbianos. La activación de neutrófilos y nigración transepitelial secundaria a la inflamación e independiente de la sepsis clínica ha sido implicada en el síndrome de dificultad respiratoria que precede el desarrollo de la DBP. La migración de neutrófilos al alvéolo implica una adhesión transitoria mediada por moléculas de adhesión: CD 11b, CD18 y CD62L (25). Luego ocurre la migración transendotelial. La dexametasona disminuye el nivel de moléculas de adhesión impidiendo la migración de neutrófilos al alvéolo, cortando el círculo de la injuria pulmonar progresiva. En cuanto al inicio de la corticoterapia lo ideal es no antes de los 14 días de vida dado que ha sido visto mayor posibilidad de daño neurológico cuanto mas tempranamente se administran, especialmente en los primeros cuatro días de vida (19). El objetivo de elegir una estrategia terapéutica debe ser administrar las mínimas dosis efectivas durante el menor período de tiempo para alcanzar los efectos deseados. En nuestro estudio es alta. Algunos autores (19,20) han bajado el porcentaje de niños que reciben corticodes en un 50% con una serie de medidas que comprenden una ventilación "gentil" con volumen corriente bajo, destete temprano, PPC, hipercapnia permisiva y administración de vitamina A (5.000 UI intramuscular, tres veces por semana, 12 dosis en total) a todo niño que requiera ventilación, PPCN o FiO2 mayor de 0,3. Los corticoides en este estudio se realizaron en forma tardía para ser cuidadoso con las complicaciones descritas en el neurodesarrollo. Después del nacimiento todos los neonatos tuvieron una pérdida de peso (promedio de puntaje z = –1,42), que luego se recupera a una velocidad más lenta. Éste descenso del peso se debería en parte a la pérdida de agua extracelular que varía entre un 7 y 10% del peso (26,27). Cuando la pérdida de peso sobrepasa este valor se deben buscar otras causas. A las 36 semanas ya comienza un aumento de la velocidad de crecimiento con respecto al peso fetal, el puntaje "z" incrementa 0,26 unidades con respecto al que tenía cuando recuperó el peso del nacimiento. El valor de "z" a las 36 semanas es similar a lo que han encontrado otros autores (21,28) e indica el comienzo del catch-up. A esta edad la mayoría de estos niños mejoran de sus complicaciones y toleran un aporte enteral adecuado de nutrientes. Es en este período que se debe hacer una estricta vigilancia del crecimiento ya que en la mayoría de las unidades estos niños son transferidos o dados de alta y disminuye el cuidado, especialmente térmico, y control adecuado del aporte, lo que puede alterar el incremento en la velocidad de crecimiento que se está produciendo.
El porcentaje de sobrevivientes fue de 63%. La expectativa de vida aumenta desde el nacimiento hasta el séptimo día, luego mejora levemente. Es un dato muy valioso en la comunicación diaria con los padres porque permite hacer un pronóstico dinámico. Estos datos son similares a los publicados por Meadow (11). El promedio de edad al fallecer fue de 21 días, similar al de Meadow (12). Este mismo autor encontró en la última década (a partir del año 1991) un aumento lineal de la edad de muerte. Los niños más graves sobreviven más tiempo que hace 17 años. Las causas de muerte más frecuentes descritas en estos niños son la infección, el síndrome de dificultad respiratoria complicado con DBP, anomalías congénitas acompañado por el síndrome de dificultad respiratorio y/o hemorragia ventricular.
El tiempo de ocupación de las unidades neonatales por menores de 1.000 gramos que posteriormente fallecen es muy importante porque cuantifica un hecho usado con fines económicos y éticos (11). En el presente estudio se describe que un 15,5% de los días de internación en los menores de 1.000 gramos corresponde a niños que van a fallecer en su estadía. Si se extrapolan estos datos se puede decir que por cada 22 camas ocupadas por menores de 1.000 gramos, 17 de ellos van a sobrevivir. Extrapolando la información en lo que sería el presupuesto de estos niños es del 10% a 15% de lo gastado con los sobrevivientes. El no tratar posiblemente deje niños que podrían sobrevivir y podrían tener secuelas más graves.
El estudio actual nos muestra que se tiene una frecuencia de complicaciones y mortalidad por encima de la mediana, muy cercano al percentil 75 lo que nos indica claramente que debemos mejorar nuestra atención. El 17% de nuestros niños presentó más de tres complicaciones y se ha demostrado que cuando esto ocurre se asocia con secuelas severas (29). Lo importante es que en base a estos resultados se realicen estrategias para mejorar: DBP e infección son aquellos factores que llevan a la mayoría de las complicaciones. Se debe planificar el cuidado respiratorio para evitar o disminuir las causas de daño. Una opción sería monitorizando el volumen corriente, balanceando la necesidad de presión media y FiO2, la presión de aspiración (que lesiona la mucosa y colapsa los alvéolos) así como el cuidado en los procedimientos que se realizan estos niños que producen episodios de desaturación (30). Actualmente la mayoría de los monitores ofrecen tendencias lo que permite el análisis, por ejemplo de los episodios de caídas de saturación o bradicardia, con los diversos procedimientos, lo que permite autoevaluar el cuidado de las personas que lo manipulan e incluso de la unidad en tiempos variables. De esta forma el equipo de la unidad puede analizar en forma crítica los cuidados.
Referencias bibliográficas
1. Usher R. Reduction of mortality from respiratory distress syndrome of prematurity with early administration of intravenous glucose and sodium bicarbonate. Pediatrics 1963; 32: 966-75.
2. Gregory GA, Kitterman JA, PhibbsRH, Tooley WH, Hamilton WK. Treatment of the idiopathic respiratory-distress síndrome with continuous positive airway pressure. N Eng J Med 1971; 284: 1333-40.
3. Cumarasamy N, Nüssli R, Vischer D,Dangel PH, Duc GV. Artificial ventilation in hyaline membrane disease: the use of positive end-expiratory pressure and continuous positive airway pressure. Pediatrics 1973; 51: 629-40.
4. Liggins GC, Howie RN. A trolled trial of antepartum glucocorticoid treatment for prevention of the respiratory distress syndrome in premature infants.Pediatrics 1972; 50: 515-24.
5. Fujivara T, Chida S, Watabe Y, Maeta H, Morita T, Abe T. Artificial surfactant therapy in hyaline-membrane disease. Lancet 1980; 1: 55-9.
6. Le Souef PN, Morgan AK, Soutter LP,Reynolds EOR, Parker D. Comparison of transcutaneous oxygen tension with arterial oxygen tension in newborn infants with severe respirators illnesses. Pediatrics 1978; 62: 692-7.
7. Fanconi S, Doherty P, Edmonds J, Barker G, Bohn DJ. Pulse oximetry in pediatric intensive care: Comparison with measured saturations and transcutaneous oxigen tension. J Pediatr 1985; 107: 362-66.
8. Mammel MC, Green TP, Johnson DE,Thompson TR. Controlled trial of dexamethasone therapy in infants with bronchopulmonary dysplasia. Lancet 1983; 1: 1356-8.
9. Yeh TF, Lin YJ, Lin HC, Huang CC, Hsied WS, Lin CH, et al. Outcomes at school age after postnatal dexamethasone therapy for lung disease of prematurity. N Engl J Med 2004; 350: 1304-13.
10. Synnes AR, Ling EWY, Whitfield MF, Mackinnon M, Lopes L,Wong G, et al. Perinatal outcomes of a large cohort of extremely low gestational age infants (twenty-three to twenty-eight completed weeks of gestation).J Pediatr 1994; 125: 952-60.
11. Meadow W, Reimshisel T, Lantos J. Birth weight-specific mortality for extremely low birth weight infants vanishes by four days of life: epidemiology and ethics in the neonatal intensive care unit. Pediatrics 1996; 97: 636-43.
12. Meadow W, Lee G, Lin K, Lantos J. Changes in mortality for extremely low birth weight infants in the 1990s: implications for treatment decisions and resource use. Pediatrics 2004; 113: 1223-9.
13. Usher R, McLean F. Intrauterine growth of live-born caucasian infants at sea level: standarts obtained from measurements in 7 dimensions of infants born between 25 and 44 weeks of gestation. J Pediatr 1969; 74: 901-10.
14. Jobe AH, Bancalari E. Bronchopulmonary dysplasia. NICHD/NHLBI/ORD workshop summary. Am J Respir Crit Care Med 2001; 163: 1723-29.
15. Eherenkranz RA, Walsh MC, Vohr BR, Jobe AH, Wright LL, Fanaroff AA, et al. Validation of the national institutes of health concensus definitionof bronchopulmonary dysplasia. Pediatrics 2005; 116: 1353-60.
16 Grupo colaborativo Neocosur. Very-low-birth-weight infant outcomes in 11 south american NICUs. J Perinatol 2002; 22: 2-7.
17. Llanos MA. Morbilidad y mortalidad del recién nacido menor de 1.500 gramos. Experiencia de un hospital regional de la red internacional de Vermont Oxford Network. Arch Pediatr Urug 2008; 76-85.
18. Horbar JD, Badger GJ, Carpenter JH, Fanaroff AA, Kilpatrick S, LaCorte M, et al. Trends in mortality and morbidity for very low birth weight infants,1991-1999. Pediatrics 2002; 110: 143-51.
19 Kaempf J, Campbell B, Sklar RS, Arduza C, Gallegos R, Zabari M, et al. Implementing potentially better practices to improve neonatal outcomes after reducing postnatal dexamethasone use in infants born between 501 and 1250 grams. Pediatrics 2003; 111: e534-41.
20 Mariani G, Cifuentes J, Carlo WA. Randomized trial of permissive hypercapnia in preterm infants. Pediatrics 1999; 104: 1082-88.
21. Danan C, Durrmeyer X, Brochard L, Decobert F, Benami M, Dassieu G. A randomized trial of delayed extubation for the reduction of reintubation in extremely preterm infants. Pediatr Pulmonol 2008; 43: 117-24.
22. Bidegain M, Martell M, Martínez G. Evaluación de 35 niños ventilados. Neonatos que requirieron asistencia ventilatoria mecánica por mas de 48 horas. Arch Pediatr Urug 1988; 60: 139-46.
23. Apisarnthanarak A, Holzmann-Pazgal G, Hamvas A, Olsen MA, Fraser VJ. Ventilator-associated pneumonia in extremely preterm neonates in a neonatal intensive care unit: characteristics,risk factors,and outcomes. Pediatrics 2003; 112: 1283-9.
24. Bhandari V, Bizzarro MJ, Shetty A, Zhong X, Page GP, Zhang H, et al. Familialand genetic susceptibility to mayor neonatal morbidities in preterm twins. Pediatrics 2006; 117: 1901-6.
25 Ballabhp, Simm M, Kumari J. Neutrophil and monocyte adhesion molecules in bronchopulmonary dysplasia,and effects of corticosteroids. Arch Dis Child Fetal Neonatal Ed 2004; 89: F76-F83.
26 Bauer K, Versmold H. Postnatal weight loss in preterm neonates less than 1500g is due to isotonic dehydration of the extracellular volume. Acta Paediatr Scand Suppl 1989; 360: 37-42.
27. Singhi S, Sood V, Bhakoo ON, Ganguly NK, Kaur A. Composition of postnatal weight loss & subsequent weight gain in preterm infants. Indian J Med Res 1995; 101: 157-62.
28. Niklasson A, Engström E, Härd AL, Wikland KA, Hellström A. Growth in very preterm children: a longitudinal study. Pediatric Research 2003; 54: 899-905.
29. Martell M, Burgueño M, Arbón G, Weinberger M, Balbi C, Munyo A, et al. Asociación entre morbilidad neonatal y desarrollo en pretérminos a la edad escolar. Arch Pediatr Urug 2007; 78: 99-109.
30 Nuñez S, Casini R, De Mattos S, Acland R, Olivera L, López R, et al. Epidemiología de la hipoxia en las unidades de cuidado intensivo neonatal. Rev Med Uruguay 1992; 8: 34-7.
Correspondencia: Dr. Miguel Martell
Correo electrónico: migale@multi.com.uy