Services on Demand
Journal
Article
Related links
Share
Archivos de Pediatría del Uruguay
Print version ISSN 0004-0584On-line version ISSN 1688-1249
Arch. Pediatr. Urug. vol.79 no.2 Montevideo Aug. 2008
ARTÍCULO ORIGINAL
Arch Pediatr Urug 2008; 79(2)
Miocardiopatía dilatada en la edad pediátrica por marcapasos con estimulación en el ápex del ventrículo derecho
Dres. Pedro Chiesa 1, Alejandro Cuesta 2, Suci Dutra 1, Silvia Matto 3, Jorge Morales 3, Javier Giudice 4, Beatriz Ceruti 5
1. Cardiólogo Pediatra.
2. Cardiólogo. Electrofisiólogo.
3. Cardiólogo. Ecocardiografista.
4. Pediatra. Intensivista Pediátrico.
5. Cardiólogo Pediatra. Neonatólogo. Intensivista Pediátrico.
Servicio de Estudio y Tratamiento de las Arritmias Cardíacas. I.C.I – M.U.C.A.M.
Servicio de Ecocardiografía “Dr. R. Canessa”. Hospital Italiano.
Servicio de Cardiología Pediátrica. Centro Hospitalario Pereira Rosell.
Fecha recibido: 25 de marzo de 2008.
Fecha aprobado: 11 de agosto de 2008.
Resumen
El electrodo ventricular de los marcapasos definitivos se implanta, habitualmente, desde el inicio de la aplicación de esta técnica en el ápex del ventrículo derecho. Existe, en la actualidad, información respecto a los efectos adversos de la desincronización que ello determina y los riesgos de evolucionar a una falla ventricular. Este problema está subdiagnosticado particularmente en la edad pediátrica.
Se presenta un análisis de los pacientes que requirieron implante de marcapasos definitivo en nuestra población pediátrica (n=85), evaluando aquellos que tuvieron una evolución a la miocardiopatía dilatada, sin otra causa que la vinculada a la forma de estimulación. Se describen sus características clínicas, enfermedades de base, evolución, conducta terapéutica adoptada y seguimiento en el primer año de efectuado el tratamiento de su miocardiopatía dilatada. Un paciente fue evaluado con ecocardiograma Doppler tisular color con Q análisis de curvas de velocidades para evidenciar la desincronía electromecánica y su evolución en el tiempo.
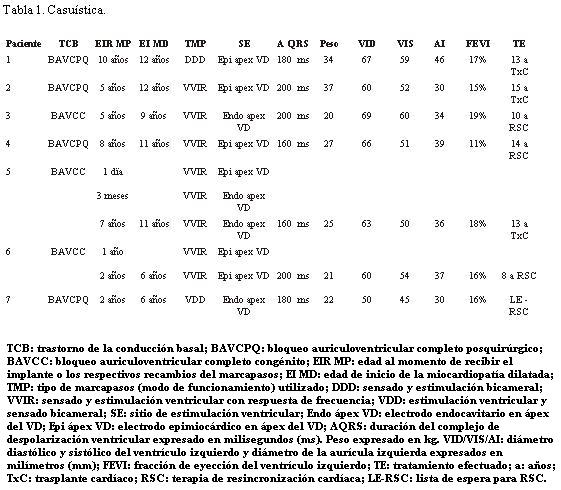
Se estudiaron siete pacientes (8%), tres del sexo masculino, con edades entre 2 y 10 años al momento del implante. Tres pacientes tenían bloqueo auriculoventricular completo congénito y cuatro bloqueo auriculoventricular completo adquirido luego de una cirugía cardíaca. En cinco se implantó un marcapasos con modo VVIR (sensado y estimulación ventricular), uno VDD (sensado atrioventricular y estimulación ventricular) y uno DDD (sensado y estimulación atrioventricular); en tres pacientes el electrodo fue implantado por vía endocárdica y en cuatro por vía epicárdica. Los electrocardiogramas basales mostraban estimulación del 100% de los QRS (complejo electrocardiográfico que indica la despolarización ventricular) los cuales tenían una duración de 179 ms (160-200 ms). El deterioro de su clase funcional se hizo evidente transcurrido entre 2 y 7 años del implante (media de 3 años). Todos tenían diámetro y función normales observando dilatación de cavidades izquierdas y caída de la fracción de eyección a 16% (11%-19%). En tres pacientes se realizó un trasplante cardíaco, en tres la conducta resuelta fue el cambio de marcapasos a un tratamiento de resincronización cardíaca y el restante falleció en espera de obtener un donante. El ecocardiograma Doppler tisular color con análisis de curvas de velocidades mostró valores muy significativos de desincronía intra e interventricular, en el paciente realizado, que se normalizaron luego de la terapia de resincronización.
La miocardiopatía dilatada muy probablemente inducida por marcapasos con estimulación en el ápex del ventrículo derecho no es un evento raro, ocurre en pacientes estimulados 100%, con QRS anchos y luego de transcurrido un determinado período de tiempo desde el implante.
Palabras clave:
DISFUNCIÓN VENTRICULAR IZQUIERDA
CARDIOMIOPATÍA DILATADA
MARCAPASO ARTIFICIAL
NIÑO
Summary
Since the beginning of the implementation of this technique, the ventricular pacemaker electrode is usually implanted at the apex of the right ventricle. There is now enough information about the side effects of the desyncronization which determines the risk of having ventricular failure. This problem is under diagnosed particularly in the pediatric age.
An analysis of patients that required the implantation of a definitive pacemaker in our pediatric population (n = 85) evaluating those who had an evolution to dilated miocardiopathy without any other cause linked to the form of stimulation is presented. The clinical features, the basic diseases, evolution, therapy adopted and follow up in the first year of treatment is described. One patient was evaluated with Doppler Tissue Color Echocardiogram with Q analysis curves speeds to see the electromechanic desyncronizations and its evolution over time. We studied 7 patients (8%), 3 male who were between 2 and 10 years old at the time of the implant. 3 patients had a congenital complete atrioventricular blockade and 4 had an acquired complete atrioventricular blockade after the cardiac surgery. In 5 of them a VVIR (ventricular sensing and paced) pacemaker was implanted, in 1 a VDD (atrioventricular sensing and ventricular paced) and in 1 a DDD (atrioventricular sensing and paced). In 3 patients the electrode was implanted via the endocardium and 4 via the pericardium. The baseline electrocardiograms showed stimulation of 100% of the QRS (electrocardiography complex indicating ventricular depolarization) with 179 ms of duration. (160-200 ms).
The deterioration of its functional class was evident after 2 to 7 years of the implant (average 3 years). All had normal function and diameters without dilation of left chambers and there was a 16% drop in the ejection fraction (11-19%). 3 patients underwent a heart transplant and in 3 patients the pacemaker was replaced by a cardiac resyncronization treatment. The remaining died waiting for a donor.
The tissue Doppler color echocardiogram with velocity curve analysis showed clearly the desyncronization values both intra and interventricular, which disappeared once the patient underwent the resyncronization therapy.
Dilated miocardiopathy induced a pacemaker stimulation located at the apex of the right ventricle is not a rare event. It occurs in patients stimulated 100%, with wide QRS and after a certain period of time since the implant.
Key words:
VENTRICULAR DYSFUNCTION, LEFT
CARDIOMYOPATHY, DILATED
PACEMAKER, ARTIFICIAL
CHILD
Introducción
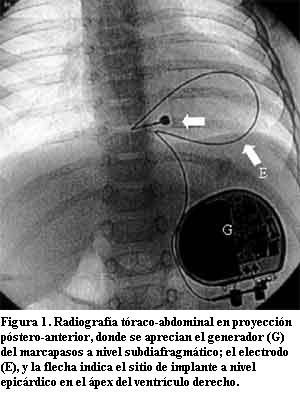
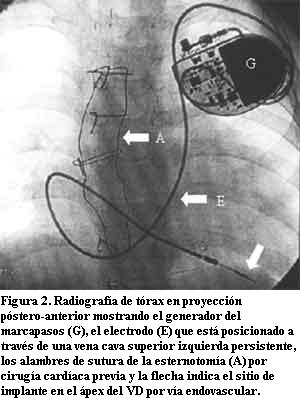
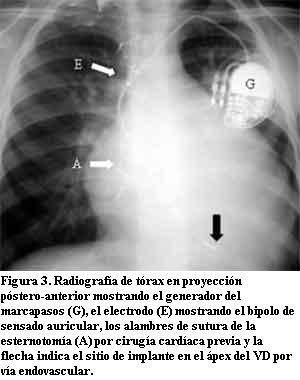
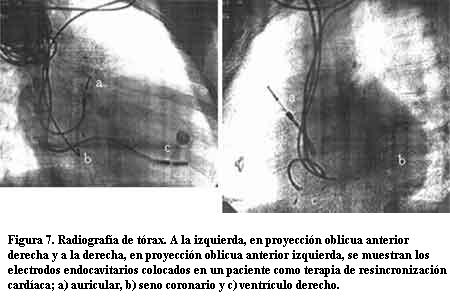
Con el advenimiento de las técnicas de estimulación cardíaca artificial el sitio elegido para la estimulación ventricular fue el ápex del ventrículo derecho (VD) y esto se mantiene en la actualidad para la mayoría de los pacientes. El motivo de dicha elección radica en su fácil acceso ya sea por vía endovascular o quirúrgica, permitiendo obtener, habitualmente, buenos umbrales de estimulación y sensado con baja frecuencia de dislocación del electrodo (figuras 1, 2 y 3).
Sin embargo, la estimulación en el ápex del VD puede tener numerosos efectos adversos, tal como se describe en la literatura (1) y fundamentalmente por los datos aportados por el ecocardiograma, en especial con el desarrollo del ecocardiograma Doppler tisular color (EDT) con análisis de curvas de velocidades (Q análisis) para medir la desincronía electromecánica, hechos refrendados por los buenos resultados obtenidos con las técnicas de resincronización cardíaca (TRC) (2,3).
El inicio de la depolarización en el ápex ventricular con propagación hacia la base determina una desincronización intraventricular e interventricular. En el caso de los marcapasos definitivos (MPD) unicamerales se suman los efectos deletéreos de la desincronización auriculoventricular. Existe una alteración de la función sistólica y un movimiento paradojal del septum interventricular, con disminución de la capacidad de generar presión (descenso de la pendiente dp/dt). Se altera también la función diastólica que se retrasa y realiza en distintos sectores a distintos tiempos entorpeciendo el llenado ventricular. Estos cambios y los que ocurren a nivel de los músculos papilares llevan a una alteración de la función de las válvulas auriculoventriculares con insuficiencia tanto en agudo como a largo plazo.
Frente a la existencia de pacientes en la edad pediátrica que requirieron el implante de un MPD con estimulación ventricular en el ápex del VD y que evolucionaron a una miocardiopatía dilatada (MD), habiendo sido descartadas otras causas, quedó como entidad causal la desincronización generada por el tipo de estimulación empleado. En todos los casos los marcapasos presentaron una función normal durante toda la evolución.
Se analizan la patología de base, su evolución, la conducta terapéutica adoptada y su seguimiento en el curso del primer año posterior al tratamiento de su MD, así como los datos publicados en la literatura. Se completó el estudio en un caso, con EDT que objetivó la desincronía a través de valores significativos en el estudio de las curvas de velocidades miocárdicas, comprobando su normalización luego de la TRC.
Material y método
Se realizó un estudio observacional, descriptivo retrospectivo, analizando las historias clínicas de todos los pacientes menores de 18 años que requirieron el implante de un MPD, en el período enero 1990 a enero 2007, en el Instituto de Cardiología Infantil (ICI) (n=85).
Se incluyen todos los pacientes que evolucionaron a la falla cardíaca clínica y dilatación de cavidades cardíacas (miocardiopatía dilatada) sin otra etiología causal. Siete pacientes (8%) cumplieron con el criterio de inclusión referido (tabla 1). Tres pacientes requirieron el implante de MPD por bloqueo auriculoventricular completo (BAVC) congénito y cuatro por BAVC luego de una cirugía cardíaca. En todos los pacientes el electrodo de estimulación ventricular fue posicionado en el ápex del VD. En seis casos se implantó un solo electrodo (cinco modo VVIR- sensado y estimulación ventricular con respuesta de frecuencia y uno modo VDD-sensado auricular y ventricular con estimulación ventricular) y en un caso dos electrodos (modo DDD-sensado y estimulación auriculoventricular). Todos los casos presentaban una frecuencia cardíaca marcapasos dependiente, siendo la función del sistema y los umbrales (resistencia a la transmisión de corriente en la unión electrodo-endocardio/epicardio) normales durante toda la evolución.
Todos los pacientes tenían realizado ecocardiogramas convencionales en el inicio y en su evolución. A uno de los pacientes (caso 6) se le realizó un ecocardiograma Doppler tisular color con análisis de curvas de velocidades.
Una vez hecho el diagnóstico de MD, se instauró a todos los pacientes el tratamiento fisiopatológico completo de la insuficiencia cardíaca (diuréticos, vasodilatadores, inotrópicos, betabloqueantes, antiagregantes plaquetarios) careciendo de respuesta al mismo por lo que se optó, según los casos, en elegir una terapéutica invasiva alternativa TRC o TC.
Casos clínicos
A continuación se describen las características clínicas de los pacientes, sus patologías de base, la terapéutica adoptada y su evolución:
Caso 1
Paciente de sexo masculino, portador de una comunicación interventricular (CIV) restrictiva, a los 8 años de edad presentó una endocarditis sobre la válvula tricúspide nativa, provocando destrucción parcial e insuficiencia severa de la misma, sintomática, por lo que se efectuó plastia valvular quirúrgica y cierre de la CIV. Resultado inicial aceptable con evolución posterior a la insuficiencia tricuspídea severa. A los 10 años de edad se realizó una segunda cirugía cardíaca implantando una prótesis valvular mecánica modelo Bicarbo M29. Como complicación presentó bloqueo auriculoventricular completo (BAVC) intraoperatorio, que requirió implante de un MP definitivo bicameral (modo DDD) con electrodo ventricular epimiocárdico en ápex del VD sin otras complicaciones. Permaneció asintomático, con insuficiencia tricuspídea leve–moderada. La presión arterial sistólica pulmonar (PASP), las dimensiones de las cavidades cardíacas y la función del ventrículo izquierdo (VI) fueron normales en los dos años siguientes.
A los 12 años comenzó con disminución de su capacidad de ejercicio llegando a clase funcional IV de la Asociación del Corazón de Nueva York (NYHA). El ECG presentaba un ritmo de MP permanente, con una duración del complejo QRS de 180 ms. El ecocardiograma mostró dilatación e hipocontractilidad progresivas del VI, que no se logró revertir con el tratamiento médico. Alcanzando el VI un diámetro diastólico (DD) de 67 mm, sistólico (DS) de 59 mm, una fracción de eyección (FEVI) de 17% y la aurícula izquierda (AI) 46 mm. No hubo progresión del grado de insuficiencia tricuspídea con cavidades derechas levemente dilatadas. A los 13 años se le realizó trasplante cardíaco pasando a una clase funcional I.
Caso 2
Paciente de sexo femenino, portadora de enfermedad de Ebstein con severa insuficiencia tricuspídea por lo que a los 5 años de edad requirió una plastia quirúrgica complicada con un BAVC intraoperatorio, realizándose el implante de un marcapasos unicameral (VVIR) con electrodo ventricular epimiocárdico en el ápex del ventrículo derecho (VD). En ese momento las dimensiones y la contractilidad del VI eran normales. Evolucionó con insuficiencia tricuspídea leve-moderada con PASP y cavidades cardíacas izquierdas de dimensiones normales en los siete años siguientes.
Comenzó a los 12 años con progresiva dilatación e hipocontractilidad del VI que no se logró revertir con tratamiento médico, alcanzando un DD de 60 mm y un DS de 52 mm, AI de 30 mm con una FEVI de 15%, y un ancho del QRS de 200 ms, estando en clase funcional III-IV, siempre con insuficiencia tricuspídea leve-moderada, lo que obligó a la realización a los 15 años de edad de un trasplante cardíaco, el cual tuvo una buena evolución.
Caso 3
Paciente de sexo femenino que a los 5 años de edad debutó con un síncope, habiendo mostrado el ECG un BAVC. No se identificó una causa primaria reversible, planteándose un BAVC congénito no diagnosticado previamente. En el ecocardiograma se comprobó que la anatomía cardíaca y la función ventricular eran normales. Teniendo en cuenta el tamaño del paciente se implantó un MP unicameral con respuesta de frecuencia (VVIR), con electrodo por vía endovascular en ápex del VD, con buena evolución en los cuatro años siguientes.
A los 9 años de edad comenzó con disnea que evolucionó rápidamente a clase funcional III-IV. El ritmo cardíaco fue 100% estimulado y la duración del complejo QRS de 200 ms. En el seguimiento ecocardiográfico se observó dilatación progresiva y disminución de la función sistólica del VI, alcanzando un DD de 69 mm, DS de 60 mm, FEVI del 19% y AI de 34 mm de diámetro. A los 10 años de edad se decidió TRC, realizando recambio de generador e implante de un segundo electrodo a través del seno coronario para la estimulación desde la cara lateral del VI. La paciente tuvo una buena evolución, con mejoría clínica, disminución de los diámetros del VI y recuperación de la contractilidad ventricular izquierda (FEVI 51%).
Caso 4
Paciente de sexo femenino con síndrome de Down, portadora de un canal auriculoventricular completo que requirió corrección quirúrgica a los dos años de edad. Buena evolución clínica inicial con insuficiencia mitral (IM), la cual es lentamente progresiva hasta hacerse severa. A los 7 años se realizó plastia valvular mitral con insuficiencia progresivamente en aumento por lo que requirió, a los 8 años, la sustitución valvular mitral por una prótesis St. Jude Nº 25, procedimiento complicado con BAVC intraoperatorio que no se logró revertir y obligó a realizar implante de un MP (VVIR) con electrodo epimiocárdico en ápex del VD. Durante tres años la paciente estuvo asintomática, con un VI de dimensiones y función normales y una IM residual leve.
El seguimiento clínico-ecocardiográfico mostró que a los 11 años comenzó con progresiva dilatación y disminución de la contractilidad del VI y deterioro progresivo de la clase funcional. El DD del VI alcanzado fue de 66 mm, el DS de 51 mm, FEVI del 11% y AI de 39 mm. La duración del QRS alcanzó los 160 ms.
A los 14 años de edad se resolvió realizar TRC. Se realizó recambio de generador e implante de un segundo electrodo a través del seno coronario para la estimulación desde la cara lateral del VI. La evolución fue buena con mejoría clínica, disminución de los diámetros del VI y recuperación de la contractilidad ventricular izquierda (FEVI 56%).
Caso 5
Paciente de sexo masculino portador de BAVC congénito, con repercusión hemodinámica que requirió implante de MPD (VVIR) a las 24 horas de vida, con colocación por vía quirúrgica de un electrodo epicárdico en el ápex del VD. No presentaba cardiopatía estructural. A los 3 meses por infección del bolsillo de alojamiento del generador se explantó todo el sistema, implantando un MPD con electrodo por vía endocavitaria en ápex del VD. A los 7 años, por agotamiento de batería, se realizó recambio de generador, conservando y utilizando el mismo electrodo. Se mantuvo asintomático y con ecocardiogramas normales durante los cuatro años siguientes.
A los 11 años de edad comenzó con disnea de esfuerzo progresiva. En el ECG estaba 100% estimulado y con una duración del QRS de 160 ms. Se observó dilatación e hipocontractilidad del VI rápidamente progresivas, alcanzando DD de 63 mm, DS de 50 mm, FEVI del 18% y AI de 36 mm. A los 13 años se efectuó trasplante cardíaco, presentando una buena evolución.
Caso 6
Paciente de sexo masculino que se presentó con bradicardia sintomática a los 16 meses de edad, diagnosticándose BAVC que se plantea como congénito de diagnóstico tardío. Se realizó implante de MPD unicameral con respuesta de frecuencia (VVIR) con electrodo epicárdico en ápex ventricular derecho. A los 2 años de edad y por agotamiento del generador se realizó recambio del mismo conservando el electrodo original. Hasta los 6 años se mantuvo asintomático, con dimensiones y función ventricular izquierdas normales.
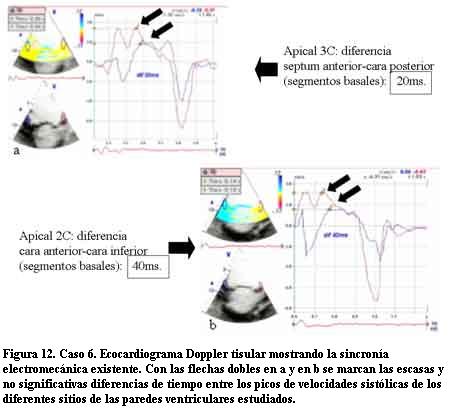
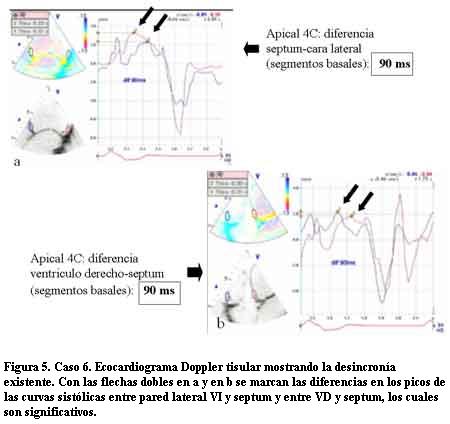
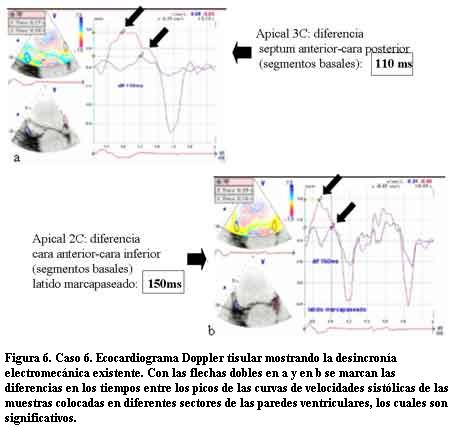
A los 7 años de edad comenzó con dilatación progresiva y disminución de la contractilidad del VI con un DD de 60 mm, DS de 54 mm, AI de 37 mm y FEVI de 16%. La duración del QRS era de 200 ms. Se controló irregularmente (medio socioeconómico y cultural muy deficitario) agregando en la evolución un accidente vascular encefálico de etiología isquémica, por émbolo originado a partir de trombosis intraauricular izquierda, quedando con una hemiplejia izquierda secuelar. Una vez estabilizado se efectuó TRC con buena evolución. En este paciente pudo realizarse eco Doppler tisular (ver Discusión y figuras 4 a 12).
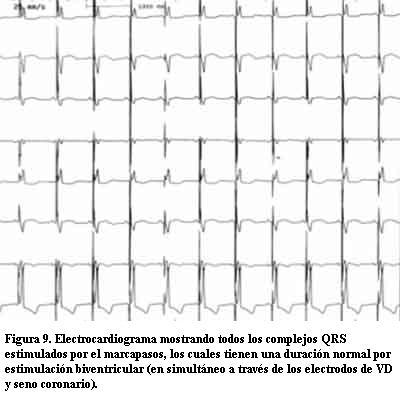
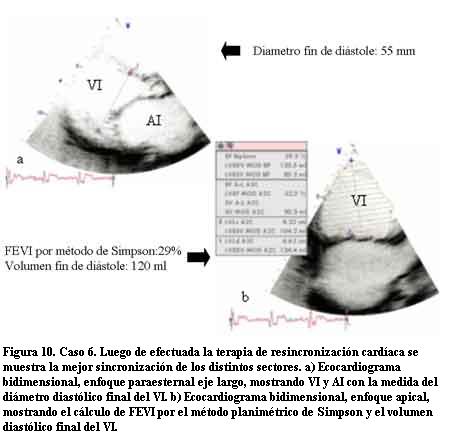
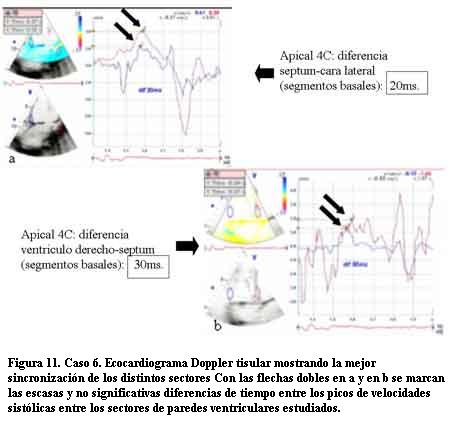
Caso 7
Paciente de sexo femenino portadora de canal auriculoventricular completo congénito que requirió corrección quirúrgica a los 8 meses de edad. Evolucionó con IM progresiva por lo que se efectuó plastia quirúrgica de su válvula mitral a los 17 meses. Persistió con IM severa y a los 2 años de edad se indicó cirugía de sustitución valvular, colocándose una prótesis Bicarbo M23. El procedimiento se complicó con un BAVC, por lo que se implantó un MPD con modo de estimulación ventricular y sensado bicameral (modo VDD), empleando un solo electrodo que se posicionó en ápex del VD por vía endovascular. Tuvo buena evolución clínica posterior y en sucesivos ecocardiogramas se observó un VI de dimensiones y contractilidad dentro de límites normales.
A los 6 años de edad comenzó con disnea de esfuerzo y dilatación progresiva de cavidades izquierdas. A los 7 años de edad el DD fue de 50 mm, el DS de 45 mm, la AI de 30 mm y FEVI de 16%. La duración del QRS era de 180 ms. La alternativa de una terapia de resincronización se vio imposibilitada debido a que en la cirugía correctiva el seno coronario quedó conectado con la aurícula izquierda, por ello se colocó en lista de espera de trasplante, falleciendo por progresividad de su falla cardíaca antes de obtener un donante.
Resultados
Los hechos que caben ser destacados referente a la casuística presentada son los siguientes:
Se trata de siete pacientes portadores de BAVC, en tres casos congénito y en cuatro poscirugía cardíaca, teniendo todos en común la estimulación por marcapasos del ápex del ventrículo derecho, con distintos modos de funcionamiento: VVIR, DDD, VDD.
Todos desarrollaron la MD (dilatación progresiva de las cavidades izquierdas con deterioro progresivo de la función ventricular izquierda, VI con pérdida de su forma elíptica, adoptando una forma esférica, sin respuesta al tratamiento médico) tras un período de entre 2 y 7 años (promedio 3 años) entre el implante del marcapasos y el inicio de la entidad, con dimensiones de cavidades cardiacas izquierdas y FEVI normales previo al implante de los respectivos marcapasos.
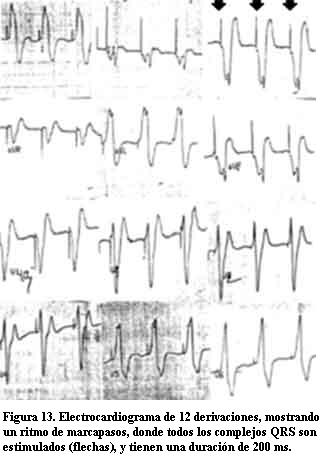
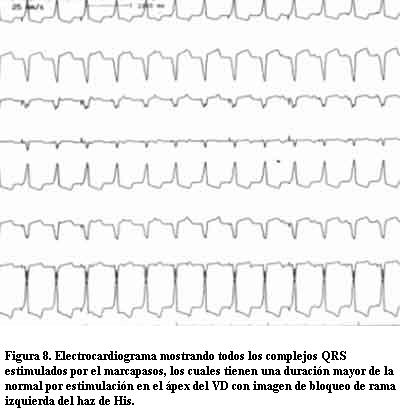
La estimulación ventricular se evidenciaba en el electrocardiograma basal con un patrón de estimulación del ápex del VD (imagen de bloqueo completo de rama izquierda) y un ancho del QRS mayor a 160 ms, expresando la desincronización existente entre ambos ventrículos (figura 13).
La aparición de esta entidad es independiente de la vía de implante del electrodo (endocavitaria o epimiocárdica).
Los cuatro casos que requirieron de cirugías cardíacas previas mostraron una buena evolución quirúrgica sin secuelas de significación hemodinámica al momento de instalarse la MD, con PASP normal y con las prótesis valvulares (dos casos en posición mitral y un caso en posición tricuspídea) normofuncionantes, con lesiones residuales mínimas no siendo causa de la MD.
En todos los casos, y previo al inicio de la MD, los marcapasos eran normofuncionantes, con sensado y captura normales, sin la presencia de un síndrome de marcapasos (estimulación auricular retrógrada) en aquellos cuya estimulación era unicameral.
El deterioro de la función ventricular izquierda fue progresivo hasta considerarse severa, con valores de FEVI entre 11%-19%, asociando un estado nutricional inferior al que le debería corresponder por edad, explicable por el descenso del gasto cardíaco, pues no estaba presente previo al inicio de la entidad, presentando todos una clase funcional III-IV de la NYHA, aplicada a pacientes pediátricos de acuerdo a los pesos respectivos.
En tres casos se efectuó un trasplante cardíaco con éxito (por no poder contar con TRC) no presentando signos de rechazo con posterior FEVI normal y clase funcional I en el primer año de seguimiento. En tres casos se realizó la resincronización ventricular con electrodo para el VI a través del seno coronario en una vena postero-lateral izquierda. En las figuras 4 a 12 se presenta el caso 6, donde el ecocardiograma convencional en la evolución mostró dilatación de cavidades izquierdas e hipocontractilidad del VI. El EDT reveló la desincronización electromecánica existente entre los diferentes sectores de las paredes ventriculares. Los ECG mostraban los QRS anchos por estimulación del ápex del VD y luego de efectuada la TRC los QRS disminuyeron su duración debido a la estimulación biventricular. Un mes después se efectuó un nuevo EDT que reveló disminución del tamaño de las cavidades izquierdas con mejoría de la FEVI llegando a valores normales y en el Doppler tisular se apreció una correcta sincronía en la contracción de los diferentes sectores de las paredes ventriculares (disminución de los valores time to peak en las curvas) con franca mejoría clínica llegando a una Clase Funcional I-II en el primer año de seguimiento.
Una paciente falleció en lista de espera del trasplante.
Discusión
Las alteraciones cardíacas, anatómicas y funcionales, tras el implante de un marcapasos definitivo en el ápex del VD son un problema real a considerar al momento de decidir el implante de un MPD. Diversos hechos así lo demuestran (1).
Muchos de los pacientes que requieren un MPD en la edad pediátrica son portadores de cardiopatías congénitas complejas y/o han sido sometidos a procedimientos de cirugía cardíaca que por sí mismos pueden condicionar su pronóstico.
El EDT permite medir el tiempo desde el inicio del QRS al pico de la curva sistólica (time to peak) en diferentes segmentos de las paredes ventriculares, lo que posibilita valorar sector a sector, tanto la desincronía intraventricular como la interventricular, ya que toma en cuenta también la pared libre del VD (en vista apical 4C) (2,3).
Se ha comprobado mediante estudios de EDT que la presencia de bloqueo completo de la rama izquierda del haz de His (BCRI), como entidad aislada, se relaciona con asincronía electromecánica intraventricular, disminución de la fracción de eyección ventricular izquierda e incremento de la mortalidad de causa cardíaca (4). Así mismo la duración del QRS tiene una relación directamente proporcional con el grado de disfunción ventricular izquierda (5).
Los efectos deletéreos de la estimulación por marcapasos a nivel apical ventricular derecho se muestran en la tabla 2

La estimulación desde el ápex del VD modifica en forma drástica la secuencia de depolarización y repolarización (contracción y relajación del ventrículo izquierdo) que en lugar de ser desde la base al ápex, es desde el ápex a la base, con el agregado de un movimiento septal paradojal, lo cual conduce a una pérdida en la sincronización de la activación de ambos ventrículos. Esto lleva a una importante modificación del VI con alteraciones de la estructura celular, geometría ventricular, disfunción sistólica y diastólica, regurgitación mitral, dilatación auricular izquierda y pobre respuesta al ejercicio, hecho demostrado en los trabajos de Wiggers (6) y Finney y Waltson (7,8), con cambios histopatológicos tales como desorganización miofibrilar y mitocondrial, existencia de células de Purkinje prominentes, calcificación miocárdica (9), determinando una verdadera “miocardiopatía inducida por marcapasos” (10-13). También se ha comprobado que el implante por vía transvenosa de un electrodo endocárdico para estimulación permanente produce en la mayoría de los pacientes un mínimo daño miocárdico evidenciado por un pico temprano de elevación de los niveles de troponina 1 cardíaca (14), así como también se ha detectado un incremento en los niveles del péptido natriurético N-terminal (NT-BNP) en pacientes portadores de marcapasos que presentan signos y síntomas de insuficiencia cardíaca (15). Biopsias pre y pos implante de un MPD han demostrado la presencia de variación del tamaño de las miofibrillas, fibrosis, infiltración grasa, cambios morfológicos mitocondriales y alteración del crecimiento miocelular (16). Mediante un estudio de tomografía por emisión de positrones (PET) se ha demostrado la existencia de cambios en el flujo sanguíneo miocárdico y en el metabolismo de la glucosa con descenso de sus niveles en las regiones adyacentes al sitio de estimulación ventricular (17).
O’Keefe demuestra que la presencia de un marcapasos permanente en el ápex del ventrículo derecho es el mayor predictor independiente de deterioro de la función ventricular izquierda, con cálculo de la fracción de eyección basal determinada mediante tomografía computarizada por emisión de fotón único, que pasó de 35% a 25% a los 18 meses del implante (18).
Diversos estudios clínicos han mostrado los efectos adversos de la estimulación apical del VD, en pacientes adolescentes y adultos jóvenes, en un seguimiento de entre 5 a 10 años (19-21).
Aunque la estimulación apical derecha haya sido la más comúnmente utilizada desde hace más de 50 años para el tratamiento de la bradicardia ligada al BAV con excelentes resultados, en la actualidad debemos realizar la estimulación del ápex del VD sólo cuando sea estrictamente necesario (22,23). Diferentes estudios demuestran que la estimulación ventricular desde otros puntos diferentes al ápex del VD (tracto de salida del VD, haz de His) consigue un gran beneficio hemodinámico (24-28).
A pesar de estos hechos esclarecedores, algunos autores sostienen que parece prematuro abandonar la estimulación apical derecha en favor de otros puntos para preservar la función ventricular izquierda (29-36), necesitando aun de estudios más estandarizados, extensos, multicéntricos y a más largo plazo (37-38).
Los algoritmos disponibles hasta ahora de extensión del intervalo AV han mostrado resultados modestos en cuanto a la disminución de la estimulación ventricular (39), además presentan algunos inconvenientes, como son la posibilidad de interferir con otros ciclos del marcapasos, limitar la frecuencia máxima de seguimiento, favorecer el desarrollo de taquicardias de asa cerrada y dificultar el reconocimiento de arritmias auriculares. Finalmente, en pacientes con desfibrilador puede dar lugar a defectos de detección de taquicardia ventricular debido a los períodos de blanking (40).
Estudios mas recientes demuestran que la estimulación del ápex del VI es hemodinámicamente superior a la estimulación del ápex del VD o de la pared libre del VI en niños, ya que induce una rápida y sincrónica activación del mismo con una función cardíaca adecuada y con mejor performance, de tal modo que la estimulación del ápex del VI parece ser el sitio más favorable luego de la cirugía cardíaca pediátrica (41).
Un hecho más que demuestra que la estimulación ventricular derecha puede generar efectos deletéreos radica en la observación de que una extrasistolía frecuente originada en el VD puede generar una MD y ésta retroceder luego de realizar la ablación por radiofrecuencia del foco ectópico (42), de igual manera aquellos pacientes portadores de un bloqueo completo de la rama izquierda del haz de His tienen un patrón de activación y contracción ventricular izquierda de índole similar, pudiendo generar una dilatación e hipocontractilidad ventricular izquierda (43).
Se han establecido factores de riesgo predictores de MD, como ser:
a) Factores dependientes del paciente: existencia de fibrilación auricular, estado de la conducción AV, presencia de insuficiencia cardíaca, infarto de miocardio y alteraciones de la fracción de eyección.
b) Factores dependientes del marcapasos: desincronización ventricular, porcentaje acumulativo de estimulación ventricular, desincronización AV (44).
La estimulación ventricular permanente a nivel parahisiano preserva la sincronía interventricular y la función ventricular izquierda (45).
La desincronización ventricular inducida por marcapasos implica, además, un aumento del riesgo de desarrollar fibrilación auricular, insuficiencia cardíaca, arritmias ventriculares y muerte, como se ha demostrado en ensayos clínicos sobre marcapasos y cardiodesfibriladores implantables (46,47).
El motivo por el cual este fenómeno se produce en un grupo de pacientes y no en otro con características similares aún no es bien conocido.
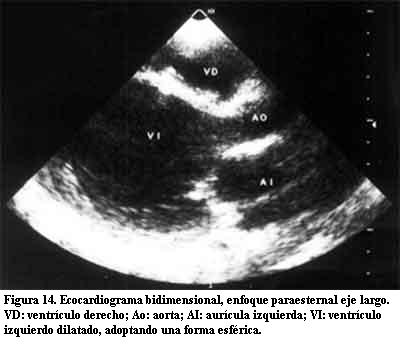
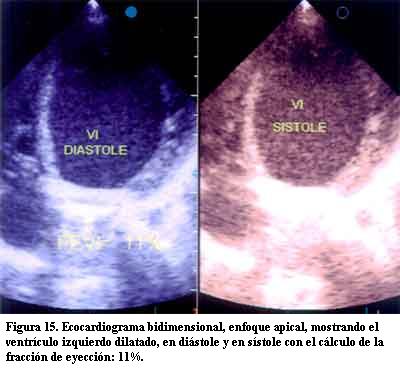
En nuestra casuística de un total de 85 pacientes, siete evolucionaron a una MD, teniendo en común la estimulación por marcapasos del ápex del VD, sin otra causa responsable de dicha evolución (figuras 14 y 15).
Debemos resaltar que ninguno de los pacientes de nuestra serie posee estudio de anticuerpos anti Rho y anti La (ya que se trata de un estudio retrospectivo) lo que nos impide descartar formalmente la presencia de una enfermedad degenerativa del sistema de conducción de causa genética y por ende una progresividad vinculada a la misma.
En suma
La estimulación artificial en el ápex del ventrículo derecho altera la secuencia de activación eléctrica del ventrículo izquierdo de forma similar a lo que ocurre en el bloqueo de rama izquierda del haz de His. Esta desincronización se manifiesta por una prolongación de la duración del QRS y una alteración en la contracción ventricular izquierda (desincronía electromecánica), que determina deterioro de la función ventricular izquierda con disminución del gasto cardíaco, insuficiencia valvular mitral e incremento de los diámetros de la aurícula y ventrículo izquierdos.
Estos efectos adversos de la estimulación artificial del ápex del ventrículo derecho en la estructura y función cardíacas son comunes a todos los modos de estimulación ventricular siendo independientes de la sincronización atrioventricular, produciendo una miocardiopatía marcapasos dependiente.
La estimulación del ápex del VD puede ser contraproducente en algunos pacientes, hecho que no debemos ignorar, es por ello que se deben buscar sitios alternantes de estimulación ventricular en pos de disminuir los riesgos de afectación ventricular izquierda.
En esta patología es de gran utilidad la minuciosa valoración con el ecocardiograma y fundamentalmente con el EDT para cuantificar la desincronía electromecánica, que al parecer sería una guía útil en las diferentes etapas diagnósticas y terapéuticas, hecho que deberá ser refrendado con estudios futuros.
Referencias bibliográficas
1. Manolis AS. The Deleterious Consequences of Right Ventricular Apical Pacing: Time to Seek Alternate Site Pacing. Pacing Clin Electrophysiol 2006; 29(3):298-315
2. Dubin AM, Janousek J, Rhee E, Strieper MJ, Cecchin F, Law IH, et al. Resynchronization Therapy in Pediatric and Congenital Heart Disease Patients: An International MultiCenter Study. J Am Coll Cardiol 2005; 46: 2277-83.
3. Moak JP, Hasbani K, Ramwell C, Freedenberg V, Berger JT, Dirusso G, et al. Dilated Cardiomyopathy Following Right Ventricular Pacing for AV Block in Young Patients: Resolution After Upgrading to Biventricular Pacing Systems. J Cardiovasc Electrophysiol 2006; 17(10): 1068-71.
4. Melek M, Metin Esen A, Barutcu I, Onrat E, Kaya D. Tissue Doppler Evaluation of Intraventricular Asynchrony in Isolated Left Bundle Branch Block. Echocardiography 2006; 23(2): 120-6.
5. Shenkman HJ, Pampati V, Khandelwal AK, Mc Kinnon J, Nori D, Kaatz S, et al. Congestive heart failure and QRS duration: Establishing prognosis study. Chest 2002; 122: 528-34.
6. Wiggers CJ. The muscle reactions of the mammalian ventricles to artificial surface stimuli. Am J Physiol 1925; 73: 346-78.
7. Finney J. Hemodynamic alterations in left ventricular function consequent to ventricular pacing. Am J Physiol 1965; 208: 275-82.
8. Waltson A, Starr J, Greenfield J. Effect of different epicardial ventricular pacing sites on left ventricular function in awake dogs. Am J Cardiol 1973; 32: 291-4.
9. Adomian GE, Beazell J. Myofibrillar disarray produced in normal hearts by chronic electrical pacing. Am Heart J 1986; 112: 79-83.
10. Boucher CA, Pohost GM, Okada RD, Levine FH, Strauss HW, Harthorne JW, et al.Effect of ventricular pacing on left ventricular function assessed by radionuclide angiography. Am Heart J 1983; 106: 1105-11.
11. Lee MA, Dae MW, Langberg JJ, Griffin JC, Chin MC, Finkbeiner WE, et al. Effects of long-term right ventricular apical pacing on left ventricular perfusion, innervation, function and histology. J Am Coll Cardiol 1994; 24: 225-32.
12. Leclercq Ch, Gras D, Le Helloco A, Nicol L, Mabo Ph, Daubert C. Hemodynamic importance of preserving the normal sequence of ventricular activation in permanent cardiac pacing. Am Heart J 1995; 129: 1133-41.
13. Prinzen FW, Peschar M. Relationship between the pacing induced sequence of activation and left ventricular pump function in animals. Pacing Clin Electrophysiol 2002; 25: 484-98.
14. Nikolaou NI, Spanodimos SG, Tsaglis EP, Antonatos DG, Patsilinakos SP, Fournarakis GM, et al. Biochemical evidence of cardiac damage following transvenous implantation of a permanent antibradycardia pacemaker lead. Pacing Clin Electrophysiol 2005; 28(11): 1174-81.
15. Thackray S, Witte K, Ghosh J, Nikitin N, Anderson A, Rigby A, et al. N-terminal brain natriuretic peptide as a screening tool for heart failure in the pacemaker population. Eur Heart J 2005; 27(4): 447-53.
16. Karpawich PP, Rabah R, Haas JE. Altered cardiac histology following apical right ventricular pacing in patients with congenital atrioventricular block. Pacing Clin Electrophysiol 1999; 22(9): 1372-7.
17. Preumont N, Jansens JL, Berkenboom G, van de Borne Ph, Stoupel E, Goldman S. Effects of right ventricular pacing on regional myocardial glucose metabolism. Europace 2005; 7(6): 584-91.
18. O’Keefe JH, Abuissa H, Jones PG, Thompson RC, Bateman TM, McGhie AL. Effect of chronic right ventricular apical pacing on left ventricular function. Am J Cardiol 2005; 95: 771-3.
19. Karpawich P, Justice C, Cavitt D, Chang C. Developmental sequelae of fixed-rated ventricular pacing in the inmature canine heart. An electrophysiologic, hemodynamic and histopathologic evaluation. J Am Coll Cardiol 1990; 119: 1077-82.
20. Tantengco MV, Thomas RL, Karpawich PP. Left ventricular dysfunction after long-term right ventricular apical pacing in the young. J Am Coll Cardiol 2001; 37: 2093-100.
21. Thambo JB, Bordachar P, Garrigue S, Laphitte S, Sanders P, Reuter S, et al. Detrimental ventricular remodeling in patients with congenital complete heart block and chronic right ventricular apical pacing. Circulation 2004; 110(25): 3766-72.
22. Rosenqvist M, Isaaz K, Botvinick EH, Dae MW, Cockrell J, Abbott JA, et al. Relative importance of activation sequence compared to atrioventricular synchrony in left ventricular function. Am J Cardiol 1991; 67: 148-56.
23. Peters RW, Gold MR. Pacing for patients with congestive heart failure and dilated cardiomyopathy. Cardiol Clin 2000; 18 (1): 55-66.
24. De Cock CC, Giudici MC, Twisk JW. Comparison of the hemodynamic effects of right ventricular outflow-tract pacing with right ventricular apex pacing: a cuantitative view. Europace.2003; 5:275-8.
25. Víctor F, Leclercq C, Mabo P, Pavin D, Deviller A, de Place C, et al. Optimal right ventricular pacing site in chronically implanted patients: a prospective randomized crossover comparison of apical and outflow tract pacing. J Am Coll Cardiol 1999; 33(2): 324-6.
26. Tse HF, Yu C, Wong KK, Tsang V, Leung YL, Ho WY. Functional abnormalities in patients with permanent right ventricular pacing: the effect of sites of electrical stimulation. J Am Coll Cardiol 2002; 40: 1451-8.
27. Zimmerman FJ, Starr JP, Koenig PR, Smith P, Hijazi ZM, Bacha EA. Acute hemodynamic benefit of multisite ventricular pacing after congenital heart surgery. Ann Thorac Surg 2003; 75: 1775-80.
28. Deshmukh PM, Romanyshyn M. Direct His-bundle pacing: present and future. Pacing Clin Electrophysiol 2004; 27:862-70.
29. Gammage MD, Marsh AM. Randomized trials for selective site pacing: do we know where we are going? Pacing Clin Electrophysiol 2004; 27: 878-82.
30. Schwaab B, Fröhlig G, Alexander C. Influence of right ventricular stimulation site on left ventricular function in atrial synchronous ventricular pacing. J Am Coll Cardiol 1999; 33: 317–23.
31. Szili-Torok T, Thornton A. The effects of right ventricular apical pacing on left ventricular function stimulation of the right ventricular apex: should it still be the gold standard? Indian Pacing Electrophysiol J 2003; 3(2): 74-80.
32. Takasugi H, Watanabe K, Ono Y, Echigo S. Improvement of left ventricular function after changing the pacing site in a child with isolated congenital complete atrioventricular block and dilated cardiomyopathy. Pediatric Cardiology 2005; 26(1): 87-9.
33. Manolis AS, Simeonidou E, Sousani E, Chiladakis J. Alternate sites of permanent cardiac pacing: A randomized study of novel technology. Hellenic J Cardiol 2004; 45: 147-51.
34. Victor F, Mabo PH, Mansour H, Pavin D, Kabalu G, De Place Ch, et al. A randomized comparison of permanent septal versus apical right ventricular pacing: short-term results. J Cardiovasc Electrophysiol 2006; 17(3): 238-42.
35. Simantirakis EN, Kochiadakis GE, Vardakis KE, Igoumenidis NE, Chrysostomakis SI, Vardas P. Left ventricular mechanics and myocardial blood flow following restoration of normal activation sequence in paced patients with long-term right ventricular apical stimulation-clinical investigations. Chest 2003; 124: 233-41.
36. Sweeney MO, Prinzen FW. A new paradigm for physiologic ventricular pacing. J Am Coll Cardiol 2006; 47(2): 282-8.
37. Riedlbauchova L, Kautzner J, Hatala R, Buckingham TA. Is right ventricular outflow tract pacing an alternative to left ventricular/biventricular pacing? Pacing Clin Electrophysiol 2004; 27: 871-7.
38. Silverman R, Casavant D, Loucks S, Lundstrom R, Lynn T. Atrioventricular interval search: a dual-chamber pacemaker feature to promote intrinsic AV conduction. Pacing Clin Electrophysiol 1998; 22: 873-6.
39. Deering TF, Wilensky M, Tondato F, Dan D, Tyler J. Autointrinsic conduction search algorithm: a prospective analysis. Pacing Clin Electrophysiol 2003; 26: 10-80.
40. Vanagt WY, Verbeek XA, Delhaas T, Mertens L, Daenen WJ, Prinzen FW. The left ventricular apex is the optimal site for pediatric pacing: correlation with animal experience. Pace 2004; 27(II): 837-43.
41. Vanagt WY, Verbeek XA, Delhaas T, Gewillig M, Mertens L, Wouters P, et al. Acute hemodynamic benefit of left ventricular apex pacing in children. Ann Thorac Surg 2005; 79: 932-6.
42. Redfearn DP, Hill JD, Keal R, Toff WD, Stafford PJ. Left ventricular dysfunction resulting from frequent unifocal ventricular ectopics with resolution following radiofrequency ablation. Europace 2003; 5(3): 247-50.
43. Verbeek XA, Vernooy K, Peschar M, Van Der Nagel T, Van Hunnik A, Prinzen FW. Quantification of interventricular asynchrony during LBBB and ventricular pacing. Am J Physiol Heart Circ Physiol 2002; 283: H1370-8.
44. Sweeney MO, Hellkamp AS. Heart failure during cardiac pacing. Circulation 2006; 113: 2082-8.
45. Occhetta E, Bortnik M, Magnani A, Francalacci G, Piccinino C, Plebani L, et al. Prevention of ventricular desynchronization by permanent para-hisian pacing after atrioventricular node ablation in chronic atrial fibrillation. A crossover, blinded, randomized study versus apical right ventricular pacing. J Am Coll Cardiol 2006; 47 : 1938-45.
46. Connolly SJ, Kerr CR, Gent M, Roberts RS, Yusuf S, Gillis AM, et al. Effects of physiologic pacing versus ventricular pacing on the risk of stroke and death due to cardiovascular causes. Canadian Trial of Physiologie Pacing Investigators. N Engl J Med 2000; 342: 1385-91.
47. Shukla HH, Hellkamp AS, James EA, Flaker GC, Lee KL, Sweeney MO, et al. Heart failure hospitalization is more commom in pacemaker patients with sinus node dysfunction and a prolonged paced QRS duration. Heart Rhythm 2005; 2: 245-51.
Correspondencia: Dr. Pedro Chiesa
Correo electrónico: chiecam@adinet.com.uy