Services on Demand
Journal
Article
Related links
Share
Archivos de Pediatría del Uruguay
Print version ISSN 0004-0584On-line version ISSN 1688-1249
Arch. Pediatr. Urug. vol.79 no.2 Montevideo Aug. 2008
ARTÍCULO ORIGINAL
Arch Pediatr Urug 2008; 79(2)
Epidemiología molecular deNeisseria meningitidis serogrupo C (1993-2006)
Mag. Gabriela García Gabarrot 1, Lic. Gabriel Pérez Giffoni 2, PhD. Teresa Camou 3
1. Responsable del Área de Infecciones Respiratorias2. Responsable del Área de Meningitis
3. Encargada de la Unidad de Bacteriología, Servicio Nacional de Laboratorios de Salud Pública.
Unidad de Bacteriología, Servicio Nacional de Laboratorios de Salud Pública. Montevideo, Uruguay.
Fecha recibido: 7 de diciembre de 2007.
Fecha aprobado: 5 de agosto de 2008
Resumen
En la década del 90, Neisseria meningitidis serogrupo C tuvo una actividad creciente en el país. A brotes epidémicos (Rivera 1993, Paysandú 1994) les siguió un aumento progresivo de casos, hasta llegar a una tasa de 6/100.000 habitantes, lo que motivó en 1996 la aplicación masiva de una vacuna polisacarídica A-C. El éxito de esa vacunación se reflejó en una disminución sustancial de los casos de meningitis causados por ese serogrupo. En 1990 también se había registrado un brote por meningococo C en el estado de San Pablo, Brasil, mientras que en 1995 en Argentina se observaba una sustitución del serogrupo B por el C.
El objetivo de este trabajo fue evaluar la diversidad genética y describir la epidemiología molecular de una colección de 123 aislamientos de N. meningitidis serogrupo C (1993-2006), que incluía cepas de los brotes mencionados y de casos esporádicos. Además se analizaron dos cepas aisladas en Argentina (1995) y una cepa prototipo del brote de Brasil (1990). Se les estudió la susceptibilidad a la penicilina, se les tipificó por Dot Blot y se les caracterizó genéticamente por Box-PCR y PFGE.
Las cepas pertenecientes al brote de Rivera 2b:P1.6 susceptibles a penicilina, tuvieron el mismo perfil electroforético, que el del brote de San Pablo, que no persistió en el tiempo. Otro perfil compartido por las cepas de Paysandú, de casos esporádicos y de Argentina, mayoritariamente 2b: P1.5 y con susceptibilidad disminuida a penicilina, se continuó aislando en los años sucesivos aunque en menor frecuencia.
Palabras clave:
NEISSERIA MENINGITIDIS SEROGRUPO C
MENINGITIS MENINGOCÓCICA
EPIDEMIOLOGÍA MOLECULAR
Summary
In the early 1990s, Neisseria meningitidis serogroup C had an increasing prevalence in Uruguay. Two outbreaks occurred in Rivera (1993) and in Paysandú (1994), which were followed by a raise in the total number of cases all over the country, reaching an incidence of 6/100,000 inhabitants. This motivated in 1996 a mass immunization with A-C polysaccharidic vaccine.
The vaccine success was reflected in a substantial decrease in the incidence rate of meningitis caused by serogroup C. In 1990 an outbreak was also reported in the state San Pablo, Brazil. Meanwhile during 1995 in Argentina, a substitution of serogroup B by the serogroup C was observed.
The objective of the present study was to evaluate the genetic diversity and describe the molecular epidemiology of a collection of 123 N. meningitidis serogroup C isolates (1993-2006), including the ones in the outbreaks mentioned and others from sporadic cases. Two strains isolated in Argentina in 1995, and one prototype strain of the Brazilian outbreak were also studied. Analysis on susceptibility to penicillin, serotyping and serosubtyping by Dot Blot, and molecular characterization by Box-PCR and PFGE was undertaken.
The strains isolated during the Rivera outbreak, were 2b:P1.6, all of them penicillin susceptible. They shared the same electrophoretic profile with the San Pablo outbreak strain, which was mainly not found beyond the next year. Another profile was observed in the isolates from the Paysandú outbreak, the sporadic cases and the isolates from Argentina. These isolates were mostly 2b:P1.5 and showed reduced susceptibility to penicillin. This profile persisted in the following years, although with decreased frequency.
Key words:
NEISSERIA MENIGITIDIS, SEROGROUP C
MENINGITIS, MENINGOCOCCAL
EPIDEMIOLOGY, MOLECULAR
Introducción
Neisseria meningitidis (Nm) es agente causal de meningitis aguda supurada y con menor frecuencia de formas hemorrágicas, o “púrpura fulminans”, que afecta principalmente a los niños menores de dos años (1). Aunque se registran casos de meningitis en todo el mundo, ocurren importantes variaciones geográficas y temporales. La enfermedad meningocócica puede manifestarse de diferentes formas epidemiológicas: endemia, hiperendemia, brote localizado y epidemia (2). Las epidemias son causadas por los serogrupos capsulares A y C, en tanto que, generalmente, el serogrupo B mantiene una endemia o hiperendemia, con casos esporádicos o brotes epidémicos en áreas limitadas, a veces con un crecimiento progresivo de su frecuencia en varios años (3).
En Uruguay, todos los casos de meningitis aguda supurada deben de ser obligatoriamente denunciados al Ministerio de Salud Pública dentro de las 24 horas de efectuado el diagnóstico del caso índice, a los efectos de tomar medidas profilácticas para evitar los casos secundarios.
Desde la década del 90 el Servicio Nacional de Laboratorios de Salud Pública (SNLSP) recibe las cepas aisladas en los laboratorios clínicos. La mayor parte de las meningitis por Nm han correspondido a dos serogrupos: B y C. En la década del 70, se registró una epidemia de Nm serogrupo C (NmC) con una tasa de ataque global de 17,5/100.000 habitantes, la que fue controlada mediante la administración de una vacuna polisacarídica A-C (4). En los años posteriores a esa vacunación predominó Nm serogrupo B (NmB), pero a partir de la década del 90 la tasa anual de meningitis meningocócica fue aumentando gradualmente hasta alcanzar 6/100.000 habitantes (5). Entre 1993 y 1996 volvió a predominar el serogrupo C con 73% de los casos. Durante ese período ocurrió además un brote por NmC en el departamento de Rivera (6), seguido por otro en el departamento de Paysandú (7). Como respuesta al aumento de los casos en todo el país, en 1996 se administró nuevamente una vacuna polisacarídica A-C a niños mayores de dos años y a adultos jóvenes menores de 20, obteniéndose un descenso progresivo de las meningitis causadas por NmC (4).
El objetivo de este trabajo fue evaluar la diversidad genética y describir la epidemiología molecular de NmC para ampliar la visión proporcionada por los estudios fenotípicos que sustentan habitualmente a la vigilancia epidemiológica.
Materiales y método
Material biológico
Entre 1993 y 2006 se recibieron en el SNLSP 274 cepas de NmC, para este trabajo se seleccionaron 123 (44,9%), en su mayoría correspondientes a población infantil (promedio= 3,5 años, rango 13 días a 15 años). Se seleccionaron cepas representativas de la situación epidemiológica correspondiente al período a analizar, es decir del brote de Rivera (1993-1994, n= 20), de Paysandú (1994-1995, n= 26) y aislamientos de casos aparentemente no relacionados con los brotes, pre y pos-vacunación A-C (n= 77): se incluyeron cepas de todos los años de estudio y de todos los serotipos y serosubtipos identificados según resultados previos por ELISA. También se incluyeron cepas NmC recuperadas durante una hiperendemia en Argentina (dos cepas cedidas por el Instituto Malbrán) y de un brote ocurrido en el mismo período en Brasil (una cepa proporcionada por el Instituto Adolfo Lutz). Como control del poder discriminatorio de las técnicas, se analizaron además cinco cepas del serogrupo B: una de Brasil, una de Noruega y 3 de Uruguay.
Técnicas fenotípicas
La identificación de las cepas fue confirmada por técnicas bacteriológicas convencionales, se determinó la concentración inhibitoria mínima (CIM) para la penicilina por E-test® (AB BIODISK, Solna, Suecia) según normas internacionales (8) y se confirmó el serogrupo por aglutinación con antisueros específicos (Difco) para el polisacárido capsular. El serotipo (proteína de membrana externa de clase 2 y 3: PorB) y el serosubtipo (proteína de membrana externa de clase 1: PorA), se determinaron por Dot-Blot con células enteras (9) y anticuerpos monoclonales producidos por JT Poolman en el Instituto Nacional de Salud Pública y Medio Ambiente (RIVM, Bilthoven, Holanda) y otros producidos en el Instituto Adolfo Lutz (IAL, San Pablo, Brasil).
Para la determinación del serotipo se dispuso de los siguientes monoclonales: 1, 2a, 2b, 4, 14, 15 (RIVM) y 7, 9, 10, 17 (IAL); y para la determinación de serosubtipos de: P1.1, P1.2, P1.4, P1.5, P1.6, P1.7, P1.9, P1.10, P1.12, P1.13, P1.14, P1.15, P1.16 (RIVM) y P1.22-1 (IAL). Las cepas no serotipables (NT) o no serosubtipificables (NST) son aquellas que no reaccionan con ninguno de los anticuerpos monoclonales utilizados.
Técnicas genotípicas
Para la caracterización genética de las cepas se emplearon dos técnicas. En primer lugar se utilizó la técnica de Box-PCR, que consiste en la amplificación exponencial de fragmentos del ADN bacteriano a partir de determinadas secuencias repetidas a lo largo del genoma, denominadas Box (10). Los productos logrados fueron posteriormente separados en gel de agarosa produciendo perfiles de bandas, que permitieron establecer diferencias entre las cepas. Esos resultados se confrontaron con otra técnica molecular considerada de referencia: Electroforesis en campos pulsados (PFGE). El método consiste en la digestión del cromosoma bacteriano empleando una enzima de restricción de corte poco frecuente (NheI), que genera megafragmentos de ADN separados por tamaño en un gel de agarosa. La electroforesis genera diferentes perfiles de bandas o pulsotipos que se revelan con bromuro de etidio (11).
Los perfiles de bandas generados por ambos métodos se estudiaron por inspección visual, reconociendo identidad o grados de diferencias entre los perfiles.
Definiciones
Para la clasificación de los perfiles logrados por PFGE se siguió el criterio de Tenover (12): considerando como pertenecientes a un mismo perfil aislamientos idénticos, aislamientos estrechamente relacionados a los que difieren en una a tres bandas, y aislamientos posiblemente relacionados a los que tienen de cuatro a seis bandas de diferencia. Estos pulsotipos similares pero no idénticos constituyen subtipos dentro de un mismo perfil.
El término clon se empleó para agrupar aislamientos bacterianos obtenidos de fuentes, lugares o tiempos diferentes, pero con características genotípicas similares cuya explicación más probable es que compartan un mismo origen o ancestro (13).
Análisis estadístico y construcción del dendrograma
Con la finalidad de establecer las distancias genéticas y el grado de parentesco entre las cepas se analizaron los perfiles y los subtipos electroforéticos generados por PFGE, asignando a la presencia o ausencia de bandas una puntuación de 1 o 0 respectivamente. Se utilizó el índice de Dice para generar matrices de similitud y posteriormente se usó el algoritmo “unweithted pair-group method of averages algorithm” (UPGMA) para la construcción del dendrograma (programa PAST (14)).
Resultados
Se recuperaron las 123 cepas de NmC seleccionadas que estaban conservadas a –70ºC y se confirmaron o completaron datos de identificación.
Fenotípicos
La caracterización fenotípica por Dot-Blot evidenció que 90,2% de los aislamientos estudiados expresaban el serotipo 2b y que la mayoría de esas cepas (98,2%) se asociaron a los serosubtipos P1.5, P1.6 y a un grupo de cepas que eran NST (tabla 1). El serosubtipo P1.6 (18,0%) sólo se encontró durante los años 1993 y 1994, en las cepas del brote de Rivera (n=20). Las cepas 2b:P1.5 (66,6%) se aislaron durante todo el período de estudio, aunque predominaron entre 1994 y 1996. El aislamiento de cepas 2b:NST (13,5%) mantuvo una frecuencia estable hasta el año 2000.
Ninguna de las cepas del brote de Rivera (n=20) presentó el serosubtipo P1.5, tampoco ninguna cepa del brote de Paysandú (n=26) mostró el serosubtipo P1.6. No se halló ninguna correlación entre las cepas que eran NST y el lugar de aislamiento de las mismas.
Hacia el final del período de estudio, se observó una mayor dispersión de combinaciones de serotipos y serosubtipos con aparición de nuevos fenotipos. Cabe destacar que en el período entre 2003 y 2006, cinco de siete cepas aisladas presentaron la combinación 2a:P1.5.
Ninguna de las cepas estudiadas tuvo una CIM para penicilina mayor a 0,25 µL/mL, valor que se interpreta como de resistencia intermedia (8). Esas cepas (82/123) con susceptibilidad disminuida predominaron entre 1994 y 2000. Las cepas susceptibles a penicilina se aislaron mayoritariamente en 1993 (provenientes de Rivera) y a partir de 2001.
Genotípicos
Mediante Box-PCR se estudiaron 97 cepas NmC obteniéndose cinco perfiles electroforéticos representados por más de un aislamiento y cinco perfiles distintos con solo un aislamiento cada uno. El 100% de las cepas del brote de Rivera tuvieron perfil Box-1. Las cepas del brote Paysandú presentaron una mayor diversidad de perfiles: Box-2 (n=5), Box-3 (n=6), Box-4 (n=5) y Box-5 (n=4). Al analizar los aislamientos de los casos esporádicos de los años 1997 al 2001, no se encontró el perfil Box-1, cuya presencia se mantuvo hasta 1994, lo que aparentemente indicaría que este perfil genético no persistió en el tiempo. Mientras tanto los perfiles genéticos del brote de Paysandú se encontraron también en los años posteriores a la vacunación. Las cepas de NmB (n=5) compartían un mismo perfil Box-11.
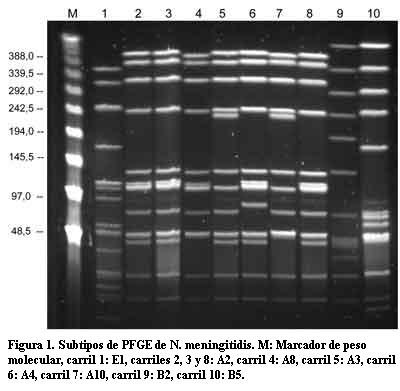
Por PFGE se analizó la totalidad de las cepas (n=123), cuya digestión con la enzima de restricción generó entre 10 y 14 fragmentos de ADN genómico (figura 1). El análisis de las bandas reveló cinco perfiles diferentes no relacionados entre sí (A, B, C, D, F). El perfil A fue el más frecuente (93/123) e incluyó tanto las cepas del brote de Paysandú (n=26) como cepas de casos esporádicos pre y posvacunación (n=67). Las cepas que presentaban este perfil se incluyeron dentro de lo que se denominó clon Paysandú. Las cepas del perfil B (27/123) correspondían al brote de Rivera (n=20) y algunos casos esporádicos (n=7). A las cepas de dicho perfil se las agrupó dentro del clon Rivera. Sólo tres cepas de NmC, una aislada en 2000 y dos en 2001, presentaron perfiles diferentes al A o B, y se denominaron C, D y F (tabla 1).
Las cepas de NmB procedentes de Brasil y Noruega conjuntamente con las cepas serogrupo B aisladas en Uruguay, utilizadas para comprobar el poder discriminatorio de la técnica, presentaron un mismo perfil, denominado E, con 2 subtipos (E1, E2).
Clon Rivera (perfil B). Entre las 27 cepas de este clon se encontraron 9 subtipos. El subtipo B1 fue el predominante (70,3%). La mayor parte de las cepas aisladas del brote de Rivera (19/20) eran genéticamente idénticas entre sí con subtipo B1. Esas cepas tenían características fenotípicas bien definidas, el 100% de los aislamientos fueron susceptibles a la penicilina y expresaron mayoritariamente la combinación de serotipo: serosubtipo 2b:P1.6. Las dos cepas restantes eran B0 y B5. La cepa brasilera, causante de un brote en San Pablo en el año 1990, también presentaba el subtipo B0 (una banda de diferencia con B1).
El resto de los subtipos estaban representados por un único aislamiento: B2, B3, B4 y B6 fueron aislados entre 1993 y 1994 en otros departamentos y se diferenciaban de B1 en 4 a 6 bandas. Solamente dos cepas del clon Rivera fueron aisladas en años posteriores al brote: pulsotipos B7 y B8.
Clon Paysandú (perfil A). Entre las 93 cepas de este clon se hallaron 11 subtipos, siendo el subtipo A2 el predominante (76,0%), seguido por el subtipo A8 (8,7%). Las cepas aisladas en Paysandú, tenían además susceptibilidad disminuida a penicilina, serotipo: serosubtipo 2b:P1.5 (19/20) y estaban genéticamente relacionadas con las dos cepas de NmC aisladas en Argentina de los subtipos A2 y A3 (dos bandas de diferencia). Solamente un aislamiento del clon era subtipo A3, recuperado en el año 1994.
A partir de 1996, año de mayor frecuencia de aislamientos de NmC, fueron surgiendo lentamente nuevos subtipos, aunque el A2 continuó recuperándose hasta 2004. Los nuevos subtipos correspondían a aislamientos únicos: en 1996 surge A4 que difiere en tres bandas con respecto al pulsotipo predominante; en 1997: A5 con cuatro bandas de diferencia; en 1998: A6 con tres bandas de diferencia; en 2000 A7 (tres bandas) y A9 (dos bandas); y en 2001: A10 (dos bandas). En el año 2002 no hubo aislamientos de NmC.
En 2003 se aísla un nuevo subtipo A12 que persiste hasta 2005. Las cinco cepas estudiadas eran de Montevideo, presentaban el fenotipo 2a:P1.5 y eran susceptibles a penicilina. La única cepa aislada en 2006 era A11.
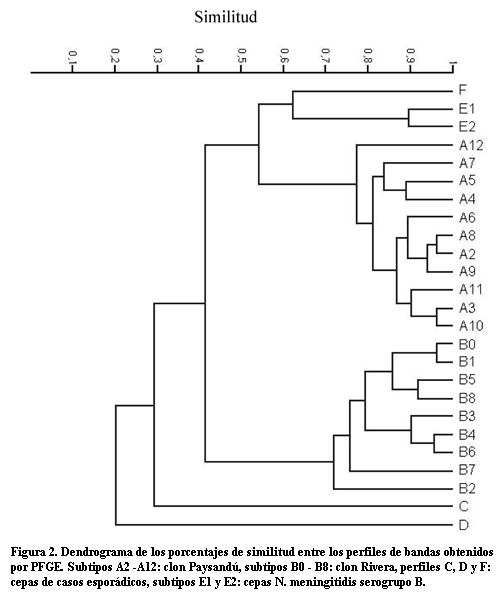
El dendrograma (figura 2), basado en los resultados por PFGE, permitió visualizar tres grandes agrupamientos: el ramal superior que corresponde al perfil E compuesto por todas las cepas NmB analizadas y una cepa NmC que presentó el perfil F; el ramal del medio incluye cepas con el perfil A y sus variantes. El subtipo A8 presenta el mayor grado de similitud con A2, el subtipo predominante. El ramal inferior agrupa cepas con el perfil B y sus variantes. El subtipo B0, al que pertenece la cepa del brote de San Pablo es el de mayor grado de similitud con B1, el subtipo predominante.
El porcentaje de similitud entre subtipos dentro de cada uno de los ramales medio e inferior era similar y superior a 75%, aunque el mayor grado de similitud se observó entre los subtipos del ramal medio que correspondían al clon A o clon Paysandú.
Las cepas que presentaron también perfiles únicos tanto por PFGE: perfiles C y D, como por Box-PCR: Box-8 y Box-9, no se agruparon con ninguno de los tres ramales ni entre sí.
Discusión
La investigación retrospectiva de trece años de la epidemiología de NmC, permitió documentar la variabilidad genética subyacente en las cepas estudiadas más allá de los resultados fenotípicos habituales.
Resulta oportuno destacar que Nm es una bacteria naturalmente transformable, es decir, que tiene la capacidad de incorporar material genético proveniente de otros microorganismos de su misma especie u otras especies relacionadas. Las presiones selectivas (vacunas, antibioterapias) pueden promover estos intercambios, involucrando, entre otros, a los genes que codifican los polisacáridos capsulares. La colonización nasofaríngea crea un ambiente propicio para que se efectúen esos eventos de transferencia, únicamente revelados mediante el uso de técnicas moleculares. Publicaciones recientes documentan la transferencia de genes de cápsula de Nm del serogrupo C al B, posiblemente asociada a la presión selectiva ejercida por la aplicación de la vacuna C conjugada (15-17).
La cepa de NmC aislada en 2001, que presentaba el perfil F por PFGE y se agrupaba junto con las cepas NmB en el dendrograma, podría constituir un ejemplo de esa transferencia horizontal de genes capsulares.
Los análisis feno y genotípicos efectuados en la colección de NmC estudiada, permitieron evaluar la variabilidad expresada por las cepas aisladas entre 1993 y 2006. Una situación epidemiológica especial con brotes en Rivera (1993) y Paysandú (1994) y un aumento general de casos de meningitis agudas supuradas, pudo ser develada al constatar la introducción y diseminación en el país de dos clones internacionales diferentes. Se puso en evidencia que el clon Rivera se diseminó desde Brasil, ya que la cepa prototipo del extenso brote ocurrido en la región de San Pablo en 1990 (18), estaba íntimamente relacionada con las cepas aisladas en Rivera. Este clon se caracterizó por una actividad localizada, con un escaso potencial de diseminación y permanencia.
Los aislamientos del brote de Paysandú, fueron idénticos a los de Argentina, a pesar de que en ese país a diferencia de Uruguay sólo se registró una hiperendemia (19). La gran diseminación de ese clon en Uruguay provocó una alarma epidemiológica que llevó a la decisión de aplicar una vacunación masiva con vacuna A-C. Los escasos aislamientos posteriores a la vacunación presentaban genotipos similares, lo que sugiere una mayor capacidad adaptativa de este clon que la del clon Rivera.
La susceptibilidad disminuida a la penicilina tal vez favoreció su persistencia, ya que ésta constituye una ventaja selectiva para sobrevivir en la nasofaringe de los portadores sanos. Los aislamientos hacia finales del período estudiado presentaban menor porcentaje de similitud con el subtipo predominante, de modo que también se documentó la paulatina diversificación genética del clon a través del tiempo.
El serotipo 2b, al que pertenecían la mayor parte de las cepas de ambos clones, fue disminuyendo progresivamente también entre las cepas de NmB, pues sólo se aislaron dos cepas B:2b desde el año 2000 a la fecha [Pérez Giffoni, comunicación personal]. Esta observación sugiere que la vacunación eliminó efectivamente la circulación de los genotipos correspondientes a ambos clones ya que si bien no se han analizado los perfiles genéticos de las cepas serogrupo B, la ausencia del serotipo 2b sugiere que no se realizó un cambio de serogrupo para evadir la presión ejercida por la vacuna.
En suma, el estudio genotípico permitió esclarecer el patrón de circulación y diseminación de dos clones responsables de dos situaciones epidemiológicas contrastantes. El brote de Rivera fue autolimitado, causado por un genotipo que no persistió en el tiempo, tal vez por ser susceptible a la penicilina y por una menor capacidad de evolucionar exitosamente. En cambio el clon de Paysandú fue básicamente el responsable del aumento de los casos en todo el país y persistió al menos hasta el 2006. Probablemente, la susceptibilidad disminuida a la penicilina favoreció su persistencia en la nasofaringe de portadores sanos, ofreciendo nuevas oportunidades de intercambio genético y continuando su diversificación en el tiempo, aunque las cepas de NmC causantes de meningitis pasaron a ser aislamientos esporádicos.
Al realizar un análisis retrospectivo utilizando métodos moleculares se creó una línea de base para interpretar en el futuro situaciones en las que los datos epidemiológicos y fenotípicos sugieren la introducción de nuevos clones con alto potencial de diseminación.
Agradecimientos
A la Dra. María Hortal por haber corregido el manuscrito y haber sido tutora de la Tesis de Maestría en la que se basó este trabajo.
Al Programa de Desarrollo de las Ciencias Básicas (PEDECIBA) por el otorgamiento de beca y alícuota de apoyo a la Tesis.
Referencias bibliográficas
1. Hermans PWM, Hibberd MI, Booy R, Daramola O, Hazelzet JA, de Groot R, et al. 4G/5G promoter polymorphism in the plasminogen-activator-inhibitor-1 gene and outcome of meningococcal disease. Lancet. 1999; 354: 556-60
2. Maiden MC, Feavers IM. Population genetics and global epidemiology of the human pathogen Neisseria meningitidis. En: Baumberg S, Young JPW, Saunders SR, Wellington EMH, eds. Population genetics of bacteria. Cambridge: University Press, 1995: 269-93.
3. Wenger JD. Serogroup B menigococcal disease. JAMA 1999; 281: 1541-3.
4. Hortal M, Di Fabio JL. Vigilancia microbiológica de infecciones por bacterias capsuladas y su inmunoprevensión. Rev Med Uruguay 2001; 17: 200-5.
5. Hortal M, Ruocco G. Vacunas anti-Streptococcus pneumoniae. En: Avances multidisciplinarios para el control integral de Streptococcus pneumoniae. Montevideo: OPS, 2004: 145-59.
6. Guevara R, Pisano A, Giordano P, De Los Santos M, Pérez G. Brote por N. meningitidis C en Rivera. Rev Med Uruguay 1994; 10: 39-44.
7. Diez R, López G, Pisano A, Giordano P, Pérez G. Enfermedad meningocócica en Paysandú. Período 1993-1996. Proveniente del 1º Congreso Uruguayo de Tecnólogos en Laboratorio Clínico; 1997; Montevideo, Uruguay.
8. Clinical and Laboratory Standards Institute. Performance Standards for Antimicrobial Susceptibility Testing. CLSI document M100-S17. Wayne, Pa. 2007
9. Wedege E, Hoiby EA, Rosenqvist E, Froholm LO. Serotyping and subtyping of Neisseria meningitidis isolates by co-agglutination, dot-blotting and ELISA. J Med Microbiol 1990; 31: 195-201.
10. Woods RCh, Koeuth T, Estabrook MM, Lupski JR. Rapid determination of outbreak-related strains of Neisseria meningitidis by repetitive element-based polymerase chain reaction genotyping. J Infect Dis 1996; 174: 760-7.
11. Popovic T, Schmink S, Rosenstein NA, Ajello GW, Plikaytis B, Hunter SB, et al. Evaluation of pulsed-field gel electrophoresis in epidemiological investigations of meningococcal disease outbreaks caused by Neisseria meningitidis serogroup C. J Clin Microbiol 2001; 39: 75-85.
12. Tenover FC, Arbeit RD, Goering RV, Mickelsen PA, Murray BE, Persing H, et al. Interpreting chromosomal DNA restriction patterns produced by pulsed-field gel electrophoresis: criteria for bacterial strain typing. J Clin Microbiol 1995; 33: 2233-9.
13. Orskov F, Orskov I. Summary of a workshop on the clone concept in the epidemiology, taxonomy, and evolution of the Enterobacteriaceae and other bacteria. J Infect Dis 1983; 148: 346-57.
14. Hammer O, Harper DAT, Ryan PD. PAST: Paleontological Statistics Software Package for Education and Data Analysis. Palaeontologia Electronica 2001; 4(1): 9pp. Disponible en: http://palaeo-electronica.org/2001_1/past/issue1_01.htm [Consulta: 03 mayo 2007].
15. Alcalá B, Arreaza L, Salcedo C, Uría MJ, de la Fuente L, Vázquez JA. Capsule switching among C:2b:P1.2,5 maningococcal epidemic strains after mass immunization campaign, Spain. Emerg Infect Dis 2002; 8: 1512-4.
16. Stefanelli P, Fazio C, Neri A, Tonino S, Mastrantonio P. First report of capsule replacement among electrophoretic type 37 Neisseria meningitidis strains in Italy. J Clin Microbiol 2003; 41: 5783-6.
17. Lancellotti M, Guiyoule A, Ruckly C, Hong E, Alonso J-M, Taha M-K. Conserved virulence of C to B capsule switched Neisseria meningitidis clinical isolates belonging to ET-37/ST-11 clonal complex. Microbes Infect 2006; 8: 191-6.
18. Tavares Sacchi C, Cobo Zanella R, Caugant DA, Frasch CE, Hidalgo NT, Gonçalves M, et al. Emergence of a new clone of serogroup C Neisseria meningitidis in São Paulo, Brazil. J Clin Microbiol 1992; 30: 1282-6.
19. Regueira M, Ruzic AB, Chavez E, Correa C, Mollerach M. Vigilancia de Neisseria meningitidis en Argentina 1993-2003. Proveniente del 17º Congreso Latinoamericano de Microbiología; 10º Congreso Argentino de Microbiología; 2004, oct 17-21; Buenos Aires, Argentina.
Correspondencia: Dra. Gabriela García Gabarrot
Correo electrónico: gargaby@adinet.com.uy