Services on Demand
Journal
Article
Related links
Share
Archivos de Pediatría del Uruguay
On-line version ISSN 1688-1249
Arch. Pediatr. Urug. vol.78 no.2 Montevideo June 2007
ARTÍCULO ORIGINAL
Arch Pediatr Urug 2007; 78(2)
Cirugía cardíaca correctiva con circulación extracorpórea en lactantes de bajo peso e hiperflujo pulmonar
Dres. Diego Abdala 1, Luis Pedrozo 2, Guillermo Touyá 3,
Luis Ligüera 4, Guillermo Pose 5, Serrana Antúnez 6, Dante Picarelli 7
1. Pediatra. Cardiólogo infantil.
2. Pediatra. Pediatra intensivista.
3. Cirujano cardíaco.
4. Residente de cirugía cardíaca.
5. Pediatra, neonatólogo, cardiólogo infantil.
6. Cardiologa infantil. Jefa de Cuidados Postoperatorios.
7. Cirujano cardíaco. Jefe del Departamento de Cirugía de Cardiopatías Congénitas.
Departamento de Cardiopatías Congénitas. Centro Cardiológico Americano. Sanatorio Americano. Isabelino Bosch 2466 Montevideo, Uruguay
Resumen
Introducción: tradicionalmente los lactantes portadores de cardiopatías con hiperflujo pulmonar, bajo peso e infecciones respiratorias, eran sometidos a cirugía paliativa (banding de arteria pulmonar) al fracasar el tratamiento médico. Evidencias recientes han mostrado mejores resultados con la cirugía correctiva de primera intención.
Material y método: se analizó retrospectivamente la base de datos del Departamento de Cardiopatías Congénitas del Centro Cardiológico Americano durante un periodo de 36 meses con el fin de identificar aquellas cardiopatías con hiperflujo pulmonar y peso < 6 kg sometidos a cirugía correctiva con CEC de primera intención por no responder al tratamiento médico máximo. Se analizó la morbimortalidad antes del alta hospitalaria.
Resultados: se incluyeron 22 lactantes corregidos consecutivamente, con una edad promedio de 151 días y 4.405 g de peso. Un 36,3% presentó al menos una complicación postoperatoria y apenas uno falleció (4,5%).
Conclusiones: la evolución en el manejo perioperatorio permite efectuar cirugías correctivas con CEC de primera intención en lactantes de bajo peso e hiperflujo pulmonar, con bajo riesgo quirúrgico evitando la cirugía en dos tiempos.
Palabras clave:
PROCEDIMIENTOS QUIRúRGICOS CARDíACOS
CARDIOPATíAS CONGéNITAS-cirugía
CIRCULACIÓN EXTRACORPóREA
CIRCULACIÓN PULMONAR
LACTANTE
Summary
Introduction: after unsuccessful medical treatment, infants with congenital heart disease (large left to right shunt, low weight and pulmonary infections) had palliative surgery (pulmonary artery banding). However, recent evidence suggest excellent results with early corrective surgery.
Methods: we reviewed retrospectively the database of the Congenital Cardiac Department at the American Cardiac Center, during a 36-month period in order to identify all infants who weighed less than 6 kg with congenital heart deffect and large left to right shunt, who underwent early surgical repair with cardiopulmonary bypass after unsuccessful medical management. We evaluated the morbidity and mortality before hospital discharge.
Results: 22 infants were included; average age and weight were 151 days and 4.405 g respectively. At least one postoperative complication was found in 36,3%; a single death (4,5%) occured.
Conclusions: continuous progress in perioperative management encouraged early corrective surgical repair with cardiopulmonary bypass in low weight infants with large left to right shunts decreasing operation risks and avoiding two stage surgeries.
Key words:
CARDIAC SURGICAL PROCEDURES
HEART DEFECTS, CONGENITAL-surgery
EXTRACORPOREAL CIRCULATION
PULMONARY CIRCULATION
INFANT
Introducción
Hasta hace algunos años se consideraba que el bajo peso, la desnutrición y la infección respiratoria no resuelta eran factores de riesgo que contraindicaban la realización de una cirugía cardíaca con circulación extracorpórea (CEC) en lactantes con cardiopatías congénitas e hiperflujo pulmonar.
En consecuencia, con el fin de disminuir el riesgo quirúrgico, la tendencia era evitar la corrección de primera intención y favorecer el tratamiento médico y/o la cirugía paliativa (banding de la arteria pulmonar) esperando que el peso del lactante fuera el adecuado para ser sometido a una cirugía definitiva (1).
Sin embargo, evidencias recientes han mostrado mejores resultados con la cirugía correctiva realizada de primera intención (1-6) que en dos tiempos. A su vez, prolongar el tratamiento médico con el fin de obtener un incremento ponderal adecuado no ha demostrado mejorar la sobrevida, representando un riesgo adicional al retardar la corrección del defecto (2).
Apoyados en esas constataciones decidimos revisar nuestra experiencia con esa población de pacientes.
Material y método
Durante un período que comprendió 36 meses (enero de 2003 a enero de 2006) se revisó retrospectivamente la base de datos del Departamento de Cardiopatías Congénitas del Centro Cardiológico Americano (Sanatorio Americano) con el fin de identificar aquellas cardiopatías con hiperflujo pulmonar y peso inferior a los 6 kg que fueron sometidas a cirugía cardíaca correctiva de primera intención (con CEC) por no responder al tratamiento médico máximo.
Se excluyeron las cardiopatías complejas con hiperflujo pulmonar por constituir un grupo claramente diferenciado en cuanto a la estratificación de riesgo (7) y al tipo de cirugía (paliativa o correctiva).
Asimismo se excluyó el único lactante portador de comunicación interventricular que al comienzo de nuestra experiencia se le practicó un banding de la arteria pulmonar.
Consideramos no respuesta al tratamiento médico máximo cuando, a pesar de un hematocrito mayor a 45% y dosis máximas de diuréticos y vasodilatadores, persistían elementos de insuficiencia cardíaca.
El criterio considerado para definir infección respiratoria preoperatoria fue la presencia de al menos cuatro de los siguientes hallazgos: temperatura axilar mayor o igual a 38°C, signos de insuficiencia respiratoria con o sin asistencia ventilatoria mecánica (AVM), leucocitosis mayor a 15.000 elementos/mm3, proteína C reactiva y/o velocidad de sedimentación positivas o evidencia radiológica de infección.
La no resolución total de la misma no fue una contraindicación para la realización de la cirugía correctiva.
Sin embargo, se exigieron los siguientes criterios mínimos: ausencia de fiebre en las últimas 48 horas, descenso significativo de la curva de leucocitosis, negativización de los cultivos, mejoría radiológica y gasométrica y shunt intracardíaco predominantemente de izquierda a derecha (6).
Se utilizaron las tablas percentilares habituales para evaluar el estado nutricional de los lactantes. Cuando el peso se encontraba por debajo del percentil 3 para edad y sexo se clasificaron como desnutridos.
La morbimortalidad considerada fue la acontecida antes del alta hospitalaria.
Procedimiento quirúrgico
Todos los pacientes fueron sometidos a CEC con la técnica estándar utilizada en nuestro servicio: canulación bicava y de aorta ascendente e hipotermia moderada (29-30°C).
El hematocrito y la saturación de oxígeno de la sangre venosa se mantuvieron durante el período de CEC por encima de 25% y 75% respectivamente.
Los flujos oscilaron entre 70 a 180 ml/kg/min, tratando de mantener una lactacidemia menor a 3 mmol/l.
Luego del clampeo aórtico se infundió en forma anterógrada cardioplegia cristalina extracelular que se repitió cada 20 minutos.
La corrección del defecto fue efectuada en todos los casos por atriotomía derecha.
Solamente en los pacientes con canal atrioventricular completo (CAVC) se utilizó parche sintético (Hemashield) para el cierre del defecto interventricular; en el resto de los defectos se empleó parche de pericardio autólogo tratado con glutaraldehido al 10%.
En todos los casos se efectuó hemofiltración continua durante la CEC con el fin de extraer los factores proinflamatorios y obtener un hematocrito entre el 42% y el 45% a la salida de la perfusión.
Exceptuando el cierre de las comunicaciones interauriculares (CIA) luego del declampeo y al comienzo del calentamiento, se realizó dosis carga de milrinona (50 gamas/kg), seguido de infusión continua a una dosis de 0,34 a 0,70 gamas/kg/min según la hemodinamia del paciente.
Luego de la protaminización se le administró a todos los pacientes plaquetas de donante único.
La sangre empleada fue en todos los casos irradiada y deleucocitada con el fin de reducir al mínimo la reacción inflamatoria producida por la superficie no biológica del circuito de CEC (8).
Manejo postoperatorio
Todos los pacientes fueron ventilados por volumen a una frecuencia respiratoria no mayor a 40/min.
Para evitar la hemodilución, salvo que existiera una alteración severa de la crasis y/o sangrado clínico, no se utilizó plasma para la reposición de volumen.
Cuando se requirió, y en función del hematocrito, se empleó concentrado de eritrocitos y/o albúmina al 20% con el fin de no provocar una hipooncosis intravascular que favorecería el pasaje de volumen al tercer espacio (por aumento de la permeabilidad capilar), con el consiguiente edema parenquimatoso.
La antibioticoterapia consistió en cefuroxime a dosis de 100 mg/kg/día durante las primeras 24 horas de manera profiláctica, salvo en los pacientes que ya estaban recibiendo antibióticos por una infección previa, en los que se prosiguió con la terapia que venía siendo administrado hasta su finalización.
La vía oral fue reiniciada en forma temprana (a las 6 horas de la extubación) en función de la tolerancia gástrica.
Exclusivamente aquellos pacientes con intolerancia digestiva y/o infección severa recibieron alimentación parenteral total.
Los elementos de bajo gasto fueron monitorizados clínica (diurésis menor a 1 ml/kg/h, presión arterial media menor a 45 mmHg, tiempo de relleno periférico mayor a 3 segundos) y paraclínicamente (lactacidemia mayor a 5 mmol/l).
El diagnóstico de síndrome inflamatorio producido por la CEC fue realizado cuando estuvieran presentes al menos tres de los siguientes hallazgos:
1. Aumento de la permeabilidad capilar (hipertermia y/o trastornos neurológicos con hiperexitabilidad; edema pulmonar y miocárdico (falla contráctil); ascitis).
2. Tórax abierto de causa no cardiogénica.
3. Hipoglicemia refractaria.
4. Insuficiencia renal.
Los únicos fármacos inotrópicos empleados fueron milrinona (0,37-0,70 gamas/kg/min) y adrenalina como regulador del tono vasomotor (dosis menor a 0,10 gamas/kg/min).
Se definió hipertensión arterial pulmonar cuando la presión sistólica superó el 50% de la sistémica. En los pacientes en quienes se constató se trató con óxido nítrico y sildenafil por vía oral.
Resultados
Tomando en cuenta los criterios establecidos, se incluyeron para su estudio los registros médicos y quirúrgicos de 22 lactantes portadores de comunicación interventricular (CIV): 12; CAVC: 7 y CIA: 3 corregidos de primera intención con CEC y en forma consecutiva en un período de 36 meses (enero de 2003 a enero de 2006).
Las características clínicas de los pacientes se muestran en la tabla 1.
El promedio de edades y peso fue respectivamente de 151 días (50 días-270 días) y 4.405 gramos (2.080 g-5.800 g).
16 pacientes (73%) presentaban una desnutrición severa (tabla 2); cinco asociaban, además, una infección respiratoria no resuelta, requiriendo tres de ellos AVM de la cual no pudieron ser desconectados previo a la cirugía.
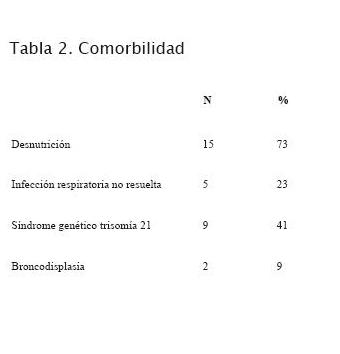
En nueve pacientes (41%) se diagnosticó un síndrome genético asociado (trisomía 21).
36,3 % (ocho pacientes) presentaron al menos una complicación en el postoperatorio (tabla 3), resultando fatal solamente en un caso (sepsis).
El síndrome inflamatorio post CEC no estuvo presente en la serie analizada.
La presencia de bajo gasto cardíaco a la salida de la CEC determinó que tres pacientes (13,6%) salieran de block quirúrgico con el tórax abierto (tabla 3).
18% (4 pacientes) requirieron del empleo de óxido nítrico y sildenafil por haber presentado hipertensión pulmonar en el postoperatorio inmediato.
No se requirió la colocación de marcapasos por bloqueo aurículo-ventricular permanente.
La taquicardia nodal ectópica (tabla 3), complicación grave y esperable en este grupo de pacientes, se resolvió con medidas físicas y suspensión de fármacos inotrópicos. En ningún caso fue necesaria la administración de amiodarona.
Debimos deplorar un solo deceso (4,5%); dicho paciente de 1 mes y 29 días, portador de trisomía 21 y CAVC presentaba desnutrición severa (2.980 g) e infección respiratoria no resuelta, por lo que no podía ser desconectado de AVM antes de la corrección quirúrgica.
Fallece a los 26 días de postoperatorio de falla multiorgánica de etiología infecciosa (sepsis).
El ecocardiograma de control no mostró defectos residuales significativos.
Salvo nuestro único deceso el empleo de inotrópicos y AVM tuvieron una duración promedio de 2,7 días (0-18 días) y 3,4 días (4 horas –35 días) respectivamente (tabla 1).
El 73% de los pacientes fueron extubados en las primeras 24 horas del postoperatorio.
De los tres pacientes con desnutrición e infección respiratoria no resuelta que estaban en AVM previo a la corrección quirúrgica, dos fueron extubados a las 15 horas y 5 días respectivamente.
El tercero fue nuestro único deceso, siendo a su vez el único de los cinco pacientes con desnutrición e infección respiratoria no resuelta que no evolucionó favorablemente.
Las tres CIA incluidas en el estudio debieron ser corregidas a pesar de la corta edad por el bajo ascenso ponderal y el severo compromiso respiratorio (4,5).
Discusión
Si bien es frecuente que en los países en vías de desarrollo los lactantes con cardiopatías congénitas e hiperflujo pulmonar se presenten con desnutrición e insuficiencia respiratoria por infecciones pulmonares recurrentes, aún no esta claramente establecido cuál es el mejor tratamiento para este grupo de pacientes (6).
Lo habitual es tratar de diferir la cirugía correctiva por el eventual riesgo adicional que implicaría someter a estos enfermos críticos, a las complicaciones de una CEC.
Las cardiopatías con hiperflujo pulmonar suelen manifestarse en el lactante con síntomas respiratorios y mal ascenso ponderal (2-4).
En los países como el nuestro, en vías de desarrollo, este grupo se presenta con mayor gravedad debido a la desnutrición y a la consulta tardía y/o irregular como consecuencia del perfil socioeconómico (6).
En nuestra serie de lactantes, el 73% eran desnutridos severos.
Si además tomamos en cuenta que el compromiso pulmonar causado por el hiperflujo y la reactividad arteriolar aumentada predisponen a las infecciones reiteradas y a la necesidad muchas veces de AVM (tres de los cinco pacientes con infección respiratoria no resuelta no podían destetarse de la AVM) podemos comprender que la decisión de la oportunidad quirúrgica resulte difícil de tomar.
Actualmente se ha demostrado que en ausencia de respuesta al tratamiento médico, prolongarlo con el fin de obtener un mejor crecimiento y desarrollo no sólo se ha revelado ineficaz al no aumentar la sobrevida, sino que además expone a una mayor morbilidad debido a que se perpetúa el círculo vicioso entre el mal progreso ponderal, las infecciones respiratorias y su repercusión debido al hiperflujo (2,3).
Por esa razón nosotros compartimos la conducta adoptada por otros equipos (2,6,10-12) en cuanto a la corrección del defecto en forma temprana, aún en lactantes pequeños con desnutrición, a pesar de una infección respiratoria preoperatorio no resuelta, basados en la constatación clínica de que la infección pulmonar en presencia de un hiperflujo significativo tiene escasas chances de éxito (6).
La serie de Bhalt (6) refuerza estos conceptos, sobre todo por tratarse de una publicación de un país en vías de desarrollo.
En algunos centros existe aún la tendencia de favorecer la estrategia del tratamiento quirúrgico en dos etapas (paliativo primero y correctivo después) cuando existe un significativo shunt de izquierda a derecha a nivel ventricular. Cuando se trata de shunts a nivel auricular, como en el caso de nuestros tres lactantes con CIA, el banding de la arteria pulmonar no tiene indicación. En nuestros pacientes, la cirugía correctiva debió indicarse para cortar el circulo vicioso de desnutrición, hiperflujo pulmonar e infecciones respiratorias recurrentes (4,5).
El banding de la arteria pulmonar fue introducido en 1951 (9), y brindó gran utilidad, en una época en la cuál la mortalidad de este procedimiento, sumada a la de la extracción en el momento de la corrección y a la de aquellos pacientes que fallecían entre las dos cirugías, era menor, que la de la corrección temprana con CEC (10).
Este tipo de estrategia está basado en el viejo precepto de que someter a este grupo de pacientes a una CEC, aumentaría el riesgo quirúrgico al exacerbar el edema pulmonar y generalizar la infección en lactantes con defensas disminuidas (3,6).
Sin embargo, los continuos progresos obtenidos en las técnicas de CEC (miniaturización del circuito, tipo de “Priming”, hemofiltración, hipotermia moderada > 28°C) anestesia y postoperatorio, han logrado descender significativamente el riesgo quirúrgico, permitiendo corregir la mayoría de las cardiopatías en etapas tempranas de la vida sin necesidad de pasar por una cirugía paliativa previa (1,2,3,10,11).
Cuando analizamos la mortalidad de la estrategia en dos etapas, banding y posteriormente desbanding con reparación de la cardiopatía y de la arteria pulmonar estenosada, vemos que las cifras publicadas son significativas: 16% y 10% respectivamente (10).
Las mismas no han cambiado demasiado a lo largo del tiempo, en cambio sí ha habido una marcada reducción en la mortalidad en las cirugías con CEC en neonatos y lactantes pequeños, cuando son realizados de primera intención. Para el cierre de CIV, por ejemplo, la mortalidad intrahospitalaria en la mayoría de los centros no supera el 3% (7,10) y para la reparación de los CAVC series recientes refieren para los lactantes menores de 5 kg cifras del orden del 7,8% (3). Vemos entonces que la sobrevida en la actualidad es mayor con la corrección temprana de primera intención, que con la estrategia en dos etapas, la cuál posee una mortalidad del 26% si hacemos la sumatoria de los dos procedimientos (16% y 10%).
En nuestra serie de 22 lactantes con cirugía correctiva de primera intención solamente tuvimos un deceso, lo que determinó una mortalidad intrahospitalaria del 4,5%.
Por esta razón la tendencia actual es reservar la cirugía paliativa para casos muy puntuales: algunos tipos de CIV múltiple, CAVC con ventrículos disbalanceados o pacientes que asocien otras anomalías cardíacas o extracardíacas (1-3,6,9-12).
La realización de un solo acto quirúrgico no solo disminuye la morbimortalidad sino que además optimiza los costos de la atención médica.
El argumento de que estos pacientes (muchas veces en AVM) se beneficiarían con la realización de un banding de la arteria pulmonar, esgrimiendo la ventaja teórica de evitar una CEC, debe ser confrontado con la dificultad que plantea ajustar precisamente un banding en un lactante con infección respiratoria, la cuál a su vez lleva al aumento transitorio de las resistencias pulmonares agravando la hipoxia (6).
Dos de los problemas más graves relacionados con el empleo de CEC en este grupo de pacientes son, por un lado, la escasa reserva funcional como consecuencia de la inmadurez de ciertos órganos y sistemas y por otro, la importante reacción inflamatoria desencadenada por la exposición del organismo a una superficie no biocompatible desproporcionadamente mayor a la de la superficie corporal (13,14).
Cuando lactantes de bajo peso son sometidos a una CEC no sólo se ven enfrentados a situaciones biológicas extremas en términos de temperatura, flujos sanguíneos y condiciones hemodinámicas, sino que también, a la hemodilución, al contacto con superficies no biológicas y al efecto mecánico ejercidos sobre los elementos formes de la sangre (14).
Todos estos fenómenos deben ser atenuados con un apropiado manejo perioperatorio para evitar una desproporcionada respuesta inflamatoria, la cuál en este grupo de pacientes se traduciría en severas alteraciones de la coagulación, del sistema nervioso central y de la hemodinamia (14).
Los avances de la bioingeniería han permitido contar con materiales más adaptados (14,15) mejorando su rendimiento y logrando así disminuir la inflamación provocada por éstos.
Sin embargo, el avance más importante se debe al perfeccionamiento de las técnicas de perfusión, miniaturizando los circuitos y evitando el bajo gasto (saturaciones venosas y hematocritos > de 75% y 25% respectivamente y lactacidemias < a 3 mmol/l) y la hipotermia profunda.
El empleo de sangre deleucocitada y de plaquetas de donante único, así como el empleo de la ultrafiltración continua y/o modificada con el fin de extraer factores proinflamatorios del circuito (16-18) han resultado de fundamental importancia.
El síndrome inflamatorio post CEC puede causar efectos deletéreos en varios parénquimas, sobre todo en el pulmón que ya tiene edema previo, riñón (insuficiencia renal), miocardio (falla cardíaca) y encéfalo (excitación e hipertermia).
No se diagnosticó en nuestra serie síndrome inflamatorio post CEC, lo cuál fue uno de los factores determinantes para que en este grupo extremadamente grave, solo el 36.3% presentara complicaciones postoperatorias y uno solo falleciera.
Por su parte tomando en consideración la desnutrición de este grupo de pacientes, (73%) en el postoperatorio, se trató de mantener una presión oncótica intravascular lo más cercana a lo normal, evitando por todos los medios causar mayor hemodilución. En este sentido se mantuvo un hematocrito entre 42% a 45% y salvo alteración de la crasis no se utilizó plasma como expansor. Unicamente se emplearon glóbulos rojos y albúmina en función del hematocrito. Varias publicaciones han resaltado la importancia de estos aspectos cuando se realiza una CEC en lactantes con bajo peso y desnutrición (19-21).
Este manejo postoperatorio determinó que el 66%, a pesar de su gravedad, pudiese ser extubado en las primeras 24 horas de la cirugía y que la duración promedio de la AVM fuera de tan solo 3,4 días.
Además, cuatro de los cinco pacientes con desnutrición e infección respiratoria, evolucionaron satisfactoriamente, contrastando con la serie de Bhalt (6) en la cual fallecieron cinco de los seis pacientes que no pudieron ser sometidos a cirugía correctiva.
Conclusiones
En suma, nuestros resultados confirman la tendencia actual, reflejada en la literatura, de que la evolución en el manejo perioperatorio permite efectuar cirugías correctivas con CEC de primera intención en lactantes en bajo peso e hiperflujo pulmonar, sin necesidad de realizar una cirugía paliativa previa, evitando así exponer al paciente a dos procedimientos quirúrgicos. El banding de la arteria pulmonar queda reservado para casos puntuales.
Referencias bibliográficas
1. Bove T, Francois K, De Groote K, Suys B, De Wolf D, Verhaaren H, et al. Outcome analysis of major cardiac operations in low weight neonates. Ann Thorac Surg 2004; 78(1): 181-7.
2. Chang AC, Hanley FL, Lock JE, Castaneda AR, Wessel DL. Management and outcome of low birth weight neonates with congenital heart disease. J Pediatr 1994; 124(3): 461-6.
3. Prifti E, Bonacchi M, Bernabei M, Crucean A, Murzi B, Bartolozzi F, et al. Repair of complete atrioventricular septal defects in patients weighing less than 5 kg. Ann Thorac Surg 2004; 77(5): 1717-26.
4. Lammers A, Hager A, Eicken A, Lange R, Hauser M, Hess J. Need for closure of secundum atrial septal defect in infancy. J Thorac Cardiovasc Surg 2005; 129(6): 1353-7.
5. Motz R, Grässl G, Trawöger R. Dependence on a respiratory ventilator due to an atrial septal defect. Cardiol Young 2000; 10(2): 150-2.
6. Bhatt M, Roth SJ, Kumar RK, Gauvreau K, Nair SG, Chengode S, et al. Management of infants with large, unrepaired ventricular septal defects and respiratory infection requiring mechanical ventilation. J Thorac Cardiovasc Surg 2004; 127(5): 1466-73.
7. Jenkins KJ, Gauvreau K, Newburger JW, Spray TL, Moller JH, Iezzoni LI. Consensus-based method for risk adjustment for surgery for congenital heart disease. J Thorac Cardiovasc Surg 2002; 123(1): 110-8.
8. Shen I, Giacomuzzi C, Ungerleider RM. Current strategies for optimizing the use of cardiopulmonary bypass in neonates and infants. Ann Thorac Surg 2003; 75(2): S729-34.
9. Albus RA, Trusler GA, Izukawa T, Williams WG. Pulmonary artery banding. J Thorac Cardiovasc Surg 1984; 88(5 Pt 1): 645-53.
10. Merrick AF, Lal M, Anderson RH, Shore DF. Management of ventricular septal defect: a survey of practice in the United Kingdom. Ann Thorac Surg 1999; 68(3): 983-8.
11. Bando K, Turrentine MW, Sun K, Sharp TG, Ensing GJ, Miller AP, et al. Surgical management of complete atrioventricular septal defects. A twenty-year experience. J Thorac Cardiovasc Surg 1995; 110(5): 1543-54.
12. Kirklin JW. Atrioventricular canal defect. In: Kirklin JW, Baratt-Boyes BG, eds. Cardiac Surgery. 2 ed. New York: Churchill Livingstone, 1993: 749-825.
13. Suzuki T, Fukuda T, Ito T, Inoue Y, Cho Y, Kashima I. Continuous pulmonary perfusion during cardiopulmonary bypass prevents lung injury in infants. Ann Thorac Surg 2000; 69(2): 602-6.
14. Kozik DJ, Tweddell JS. Characterizing the inflammatory response to cardiopulmonary bypass in children. Ann Thorac Surg 2006; 81(6): S2347-54.
15. Deptula JJ, Fogg SK, Glogowski KR, Fenton KN, Duncan KF. Extended support with the Terumo Baby-RX oxygenator. J Extra Corpor Technol 2004; 36(4): 364-7.
16. Daggett CW, Lodge AJ, Scarborough JE, Chai PJ, Jaggers J, Ungerleider RM. Modified ultrafiltration versus conventional ultrafiltration: a randomized prospective study in neonatal piglets. J Thorac Cardiovasc Surg 1998; 115(2): 336-42.
17. Finn A, Naik S, Klein N, Levinsky RJ, Strobel S, Elliott M. Interleukin-8 release and neutrophil degranulation after pediatric cardiopulmonary bypass. J Thorac Cardiovasc Surg 1993; 105(2): 234-41.
18. Journois D, Israel-Biet D, Pouard P, Rolland B, Silvester W, Vouhé P, et al. High-volume, zero-balanced hemofiltration to reduce delayed inflammatory response to cardiopulmonary bypass in children. Anesthesiology 1996;85(5): 965-76.
19. Shin’oka T, Shum-Tim D, Laussen PC, Zinkovsky SM, Lidov HG, du Plessis A, et al. Effects of oncotic pressure and hematocrit on outcome after hypothermic circulatory arrest. Ann Thorac Surg 1998; 65(1): 155-64.
20. Elliot MJ. Ultrafiltration and modified ultrafiltration in pediatric open heart operations. Ann Thorac Surg 1993; 56: 1518-22.
21. Schroth M, Plank C, Meissner U, Eberle KP, Weyand M, Cesnjevar R, et al. Hypertonic-hyperoncotic solutions improve cardiac function in children after open-heart surgery. Pediatrics 2006; 118(1): e76-84.
Correspondencia: Dr. Dante Picarelli.
Isabelino Bosch 2466. Montevideo, Uruguay.
Correo electrónico: picarelli54@hotmail.com














