Services on Demand
Journal
Article
Related links
Share
Archivos de Pediatría del Uruguay
On-line version ISSN 1688-1249
Arch. Pediatr. Urug. vol.78 no.1 Montevideo Mar. 2007
CASO CLÍNICO
Arch Pediatr Urug 2007; 78(1)
Agranulocitosis por dipirona:
a propósito de un caso clínico
Dres. Mylene Davrieux 1, Stella Gutiérrez 2, Daniel Marín 3, Daniel Pieri 4, Tito Pais 5
1. Residente de Pediatría.
2. Prof. Agdo Pediatría. Pediatra. Pediatra Grado III CASMU.
3. Cirujano Plástico Titular CASMU.
4. Hematooncólogo Pediatra CASMU.
5. Prof. Agdo. Pediatría. Pediatra Grado IV CASMU.
Fecha recibido: 11 de setiembre de 2006.
Fecha aprobado: 13 de marzo de 2007
Resumen
La agranulocitosis es un trastorno hematológico grave con una mortalidad aproximada de hasta un 25%. Puede ser producida por una gran variedad de fármacos, entre ellos la dipirona que se utiliza en forma amplia en nuestro país.
Su diagnóstico requiere de un alto índice de sospecha y el cumplimiento de criterios diagnósticos preestablecidos.
El objetivo fue describir la presentación clínica y evolución de un paciente de 2 años que cumple los criterios para el planteo de esta entidad y una revisión bibliográfica del tema.
Se destaca la importancia del conocimiento de este fármaco para lograr un uso racional del mismo.
Palabras clave:
AGRANULOCITOSIS
DIPIRONA-efectos adversos
Summary
Agranulocytosis is a severe hematologic affection with a mortality rate of 25% approximately. It is due to a variety of drugs being dipirone the most frequently associated in our country.
Its diagnosis requires certain preestablished diagnostic criteria and a high level of suspicion.
The objectives were to describe a case of a two year old patient, a bibliographic revision of the topic and to promote a more conscious use of the drug.
Key words:
AGRANULOCYTOSIS
DIPYRONE-adverse effects
La agranulocitosis es un trastorno hematológico grave caracterizado por una reducción severa y selectiva de los neutrófilos circulantes que determina riesgo vital con una mortalidad aproximada entre 3 a 25% (1-4).
La agranulocitosis por medicamentos es una reacción adversa grave, poco frecuente, segunda causa de neutropenia adquirida en la infancia luego de la infecciosa (5). Puede ser producida por una amplia variedad de fármacos, entre ellos la dipirona, que es ampliamente utilizada en nuestro medio (tabla 1).
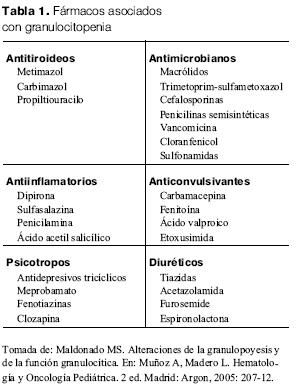
Se define como una reacción adversa de tipo B, es decir aquella reacción independiente de la acción farmacológica, que no se puede predecir, de incidencia baja y alta morbimortalidad (6).Su planteo requiere un alto índice de sospecha y el cumplimiento de criterios diagnósticos bien definidos: recuento granulocítico menor a 500 elementos por mm3, hemoglobina mayor o igual a 10 g/dl y plaquetas mayor o igual a 100.000 elementos por mm3 (7) o, en forma más estricta, recuento granulocítico menor a 500 elementos/mm3, hemoglobina mayor o igual a 6,5 g/dl, plaquetas mayor o igual a 100.000 elementos por mm3 con valores hematológicos previos normales, síntomas compatibles con agranulocitosis, mielograma que confirme el diagnóstico con un aumento del recuento de granulocitos a más de 1.500 elementos/mm3 dentro de los 30 días de suspendido el fármaco sospechoso (2).
Se requiere, además, exposición al fármaco sospechoso dentro de los 7 días previos al inicio de los síntomas característicos de odinofagia, fiebre, escalofríos, cefalea e infecciones. Se excluye de la definición a los menores de 2 años que frecuentemente presentan una neutropenia transitoria asociada a infecciones virales, a los pacientes con enfermedades sistémicas que pueden asociar neutropenia como lupus eritematoso sistémico, mononucleosis infecciosa, neoplasias y la agranulocitosis secundaria a tratamiento poliquimioterápico (7).
La dipirona, también conocida como metamizol, aminopirina o metampirona es un analgésico, antipirético, con ligera acción relajante de la musculatura lisa, derivado de las pirazolonas cuya acción farmacológica es la inhibición de la síntesis de prostaglandinas y el bloqueo de receptores del dolor a nivel central y periférico (8).
Su incidencia es variable, con diferencias regionales importantes. En el caso de Suecia, la incidencia es alta (1 cada 1.700 consumidores), por lo que se prohibió definitivamente su consumo en 1999 (9).
Se desconocen las causas de esta variabilidad regional y personal. Puede corresponder a polimorfismo genético que explicaría las diferencias en la biotransformación del fármaco, interacciones medicamentosas, el estado general del paciente, enfermedades concomitantes, edad y sexo (10,11).
En Uruguay, si bien se describen casos anecdóticos de neutropenia o agranulocitosis por dipirona, no existen casos publicados en la bibliografía.
El objetivo de la siguiente presentación es realizar la primera comunicación de este probable efecto adverso en la bibliografía nacional y recordar su eventual aparición en el tratamiento de los niños con fiebre o dolor.
Observación clínica
M.M. 2 años. Sexo masculino, raza blanca, que ingresa a sala de internación por lesión en palma de mano.
Comienza cinco días antes del ingreso con una infección respiratoria alta y baja con broncoobstrucción y fiebre por lo que se le indica tratamiento con amoxicilina 100 mg/kg/día, salbutamol inhalador 200 µg cada 6 horas y dipirona 10 mg/kg/dosis cada 6 horas.
Agrega a las 48 horas lesión periungueal en el primer dedo de la mano del miembro superior derecho con edema y rubor. Frente a la progresión de la lesión con aparición de área necrótica que abarca eminencia tenar y primer dedo, consulta en el servicio de urgencia pediátrica desde donde ingresa a sala de internación.
Antecedentes personales: desde hace un año, asma intermitente. Ha recibido previamente salbutamol y amoxicilina. Nunca había recibido dipirona.
No hay antecedentes familiares ni ambientales a destacar.
Al examen físico: buen estado general, temperatura axilar de 38 grados. Eupneico, bien hidratado y coloreado. En la zona palmar de la mano derecha presenta zona de edema y rubor que involucra eminencia tenar y todo el primer dedo, tensa, dolorosa, con zona necrótica periungueal, sin supuración ni áreas fluctuantes a la palpación.
El resto de la piel es normal. No hay trazos de linfangitis ni adenitis regional.
A nivel pleuropulmonar presenta sonoridad y murmullo alveolovesicular normales con escasas sibilancias al final de la espiración. La cavidad oral no presenta lesiones. El resto del examen es normal.
Los diagnósticos al ingreso fueron infección de partes blandas de mano e infección respiratoria con crisis asmática leve.
El cirujano plástico realiza drenaje quirúrgico en sala de operaciones que no evidencia la presencia de pus a ese nivel enviando material obtenido al laboratorio de bacteriología para examen directo y cultivo. Se inicia tratamiento antibiótico empírico con cefradina y gentamicina continuando con dipirona vía oral como antitérmico - analgésico y salbutamol inhalatorio dos disparos (200 µg) cada 6 horas.
Estudios complementarios
Hemograma: glóbulos blancos 2.100 elementos/mm3, neutrófilos 33 elementos/mm3, linfocitos 1.948 elementos/mm3, hemoglobina 13,2 g/dl, plaquetas 322.000. PCR: 155 mg/l.
A las 48 horas del ingreso, se reitera hemograma que muestra 1.900 glóbulos blancos elementos/mm3, neutrófilos 19 elementos/mm3, linfocitos 1.881 elementos/mm3, hemoglobina 12,5 g/dl y 391.000 plaquetas. Se recibe cultivo de exudado de lesión de mano y hemocultivo que informa Staphylococcus aureus meticilino sensible.
Con el diagnóstico de neutropenia severa de etiología aún no determinada, se aísla el paciente y se inicia factor estimulante de colonias granulocíticas (rhG-CSF-filgastrim) a dosis de 5 mg/kg/día. Continúa con cefradina, gentamicina y dipirona por vía intravenosa.
A las 48 horas de filgrastim persiste con picos febriles de 39ºC y mantiene la neutropenia severa, por lo que se suspende la dipirona. Se mantienen antibióticos, se indica paracetamol como antitérmico y se realiza nueva limpieza quirúrgica de la lesión.
Al 4º día de filgastrim se realiza mielograma que muestra una médula ósea de celularidad y maduración conservada en los sectores eritropoyético y megacariocítico. Prácticamente no se observa sector granulocitario, sólo algún mieloblasto y algún promielocito, no evidenciándose otros elementos del sector granulocitario más maduros. La relación gránulo eritropoyética es de 1 a 120 (normal de 2-3 a 1) y el sector linforretículo plasmocitario está de acuerdo con la edad. No se observan células extrahematopoyéticas. En suma, hipoplasia severa de la serie granulocitaria.
Al octavo día del ingreso persiste igual sintomatología. Los cultivos de control son estériles. Se decide asociar inmunoglobulina polivalente por vía intravenosa por 5 días a la dosis de 0,5 g/kg día.
A los 11 días de tratamiento persiste febril, con lesión en mano y dedo sin cambios. En el hemograma persiste la granulocitopenia con 2.400 glóbulos blancos, 24 neutrófilos/mm3, 2.256 linfocitos, hemoglobina de 9,5 g/dl y plaquetas de 819.000.
Se suspende la inmunoglobulina intravenosa, se continua con filgastrim, antibióticos y se agrega hidrocortisona intravenosa a 100 mg cada 6 horas.
A las 48 horas de tratamiento se observa mejoría de la lesión con disminución del edema y rubor de mano y el niño entra en apirexia. El hemograma de control muestra 1.600 glóbulos blancos/mm3, sin neutrófilos, 1.472 linfocitos/mm3, 64 monocitos/mm3, hemoglobina de 10,4 g/dl y plaquetas de 625.000. Se duplica dosis de filgastrim e hidrocortisona
A los 18 días de hospitalización (15 días de filgastrim, 13 días de suspensión de la dipirona y cuarto día de hidrocortisona), el niño presenta mejoría del estado general, se mantiene en apirexia, sin edema ni rubor en la mano. El hemograma muestra 5.900 glóbulos blancos/ml con la siguiente distribución: 2 mieloblastos, 5 promielocitos, 3 metamielocitos, 2 cayados neutrofilos, 6 segmentados neutrofilos, 77 linfocitos, 5 monocitos, la hemoglobina 10,8 g/dl y 662.000 plaquetas.
A los 25 días de hospitalización, se otorga el alta a domicilio con recuento de 39.700 glóbulos blancos, 28.584 neutrófilos/ml, 6.352 linfocitos/ml, hemoglobina 10,2 g/dl y 426.000 plaquetas.
Los diagnósticos de egreso fueron:
- infección respiratoria con crisis de asma;
- neutropenia severa secundaria a dipirona;
- celulitis de mano y bacteremia a Staphylococcus aureus.
Discusión
Este niño de 2 años ingresó con una celulitis de partes blandas de mano y una bacteremia secundarias a una neutropenia severa.
Se define neutropenia a la disminución absoluta del número de neutrófilos, sabiendo que en los niños mayores a 1 año el límite inferior de normalidad es de 1500 neutrófilos/mm3 (4). Es una neutropenia severa dado que presenta menos de 200 neutrófilos/mm3, lo que tiene connotación terapéutica y pronóstica ya que el riesgo de infecciones severas aumenta cuando el número de neutrófilos es menor a 500 elementos/mm3 y el riesgo infeccioso es muy elevado por debajo de 200 neutrófilos/mm3 (5).
Es una neutropenia adquirida, ya que el niño nunca tuvo infecciones severas y se cuenta con un hemograma normal en el curso de una infección respiratoria 8 meses previos.
La alteración básica es a nivel medular como mostró el mielograma, con afectación selectiva de la serie granulopoyética e indemnidad de las series roja y plaquetaria.
Dentro de las causas posibles de neutropenia adquirida, el niño recibía fármacos capaces de desencadenarla como los betalactámicos y la dipirona. Sin embargo, se pensó en este caso en la dipirona, por ser más frecuente y era la primera vez que la recibía.
En la neutropenia inducida por fármacos, el mecanismo patogénico por el cual se determina la agranulocitosis es discutido, pudiendo participar mecanismos inmunológicos y/o tóxicos (12).
El uso de la dipirona está prohibido en más de 20 países, entre ellos Estados Unidos, Reino Unido y Suecia. En Alemania, país de origen del medicamento, su uso está restringido a indicaciones puntuales luego de que otras alternativas terapéuticas hayan fracasado y el prescriptor será legalmente responsable de aquellos casos en que se sospeche daño inducido por el fármaco (9).
En Barcelona, en un estudio caso control de agranulocitosis y anemia aplásica en mayores de 2 años, la dipirona ocupó el cuarto lugar para agranulocitosis luego de la ticlopidina, el dobesilato de calcio y los fármacos antitiroideos con un OR de 25,76 (IC 95% 8,39-179) (13).
Desde 2005 se encuentra en marcha el Latin Study “Neutropenia, agranulocitosis y dipirona”, iniciado en San Pablo como programa piloto, pero que ha sido aprobado para realizarse en forma de estudio multicéntrico caso-control, abarcando cuatro países: Brasil, Argentina, Colombia y México. El mismo tiene como primer objetivo conocer la probable asociación de fármacos, enfermedades y factores ambientales y ocupacionales con agranulocitosis y anemia aplásica y como segundo objetivo estimar la incidencia de agranulocitosis y anemia aplásica en América latina y las posibles diferencias regionales asociadas a los factores antes mencionados (14).
La mayoría de los estudios poblacionales concluyen que la agranulocitosis por dipirona es un efecto adverso grave pero poco frecuente, siendo importante destacar el conocimiento de la epidemiología local para la promoción del uso racional de este medicamento.
En Uruguay, si bien se describen casos anecdóticos de neutropenia o agranulocitosis por dipirona, no existen casos publicados en la bibliografía, siendo éste un fármaco ampliamente utilizado tanto en tratamientos ambulatorios como intrahospitalarios.
Es el único antipirético de uso intravenoso existente en el mercado uruguayo. Además la dipirona reúne ciertas características como: eficacia, bajo costo, múltiples presentaciones (suspensión, comprimido, supositorio, ampolla para uso intramuscular o intravenosa) y venta libre que explican su frecuente utilización.
En este caso, posiblemente, la dipirona produjo una supresión de la producción de la serie granulocítica a nivel de la médula ósea. La disminución de esta reserva medular se acompaña de mayor peligro de infección, ya que los neutrófilos constituyen la primera línea de defensa contra las infecciones bacterianas, que es en definitiva el problema clínico principal de este paciente.
En cuanto al cuadro infeccioso que cursaba este niño, se trataba de una inflamación aguda, invasiva, que comprometía la dermis y el tejido celular subcutáneo con bacteriemia. El germen implicado era Staphylococcus aureus, germen Gram positivo frecuentemente aislado en las infecciones invasivas de partes blandas y el más comúnmente aislado junto con bacterias Gram negativas en los pacientes neutropénicos (15).
En los casos de neutropenia severa (menor de 100 neutrófilos/mm3), el riesgo de aparición de infecciones severas aumenta cuando la duración de la misma supera los 7-10 días (5). Desde el inicio, la lesión de la mano no presentó supuración, solamente áreas necróticas, lo cual coincide con la severa neutropenia ya que son los neutrófilos activados los principales componentes del pus.
En muchos casos es difícil identificar si la infección en curso fue causa de la neutropenia o si la neutropenia fue causa de la infección ya que los síntomas mayores de neutropenia, como odinofagia, fiebre, escalofríos, infecciones severas o shock séptico pudieron ser la causa del uso del medicamento sospechoso (7,15).
Para aclarar esta situación es necesario evaluar el día de inicio clínico de la enfermedad o día índice, que se define como el día en que el paciente reporta por primera vez un signo mayor de neutropenia y buscar en los 10 días previos al día índice si se produjo utilización de fármacos sospechosos de neutropenia (2).
En el caso de este paciente el inicio de consumo de dipirona fue 5 días previos al día índice, considerando el mismo al día en que se iniciaron los síntomas de celulitis de mano.
El paciente en forma concomitante recibía amoxicilina, antibiótico betalactámico, que también puede determinar esta reacción adversa (1,5,7,15), pero se cuenta con el dato clínico de exposición anterior a este medicamento y sería la evolución posterior con la utilización de otro antibiótico betalactámico como la cefradina que no se suspendió a diferencia de la dipirona, la que descartaría este planteo.
Con todos los elementos mencionados de infección severa de inicio brusco; hemograma con neutropenia severa sin afectación del resto de las series, médula ósea con afectación selectiva de la serie granulopoyética y con el antecedente de un hemograma previo sin neutropenia y el uso por primera vez de un fármaco muy relacionado con esta complicación hematológica; se realizó diagnóstico de probable agranulocitosis inducida por dipirona.
Sabiendo que este diagnóstico requiere alto índice de sospecha y que es de probabilidad no definitivo (16).
El tratamiento de la agranulocitosis por dipirona se basó en la suspensión del fármaco y la utilización de paracetamol como antipirético. La dipirona se retiró en forma tardía, ya que no se tomó en cuenta en un primer momento la contraindicación formal de su utilización en una neutropenia severa.
En caso de que el fármaco responsable de la neutropenia fuera pilar terapéutico imprescindible sin posibilidad de cambio, el mismo podría ser reanudado si el paciente no presentara datos clínicos de infección y la cifra de neutrofilos permaneciera por encima de 100 células por mm3, siendo necesaria una vigilancia periódica y cuidadosa del estado del paciente y de la cifra de neutrófilos (5). No fue el caso de este paciente.
Se realizó, además, aislamiento de tipo protector con habitación individual y precauciones estándar que son todas aquellas que se aplican a los pacientes inmunodeprimidos independientemente de su motivo de ingreso, que incluyen lavado de manos, uso de guantes, tapabocas y sobretúnica y correcta disposición de materiales utilizados (17).
Además del tratamiento antibiótico de la celulitis se utilizaron medicamentos tendientes a aumentar el número de neutrófilos, en primer término el factor de crecimiento de colonias granulopoyéticas. Éste es un grupo complejo de glucoproteínas encargadas de la regulación, proliferación y maduración de las células hematopoyéticas granulocíticas (18) que estaría asociado a una más rápida recuperación hematológica y menor mortalidad en pacientes con agranulocitosis severa inducida por drogas (19-26).
Dado que la respuesta al filgastrim no se produjo en forma rápida, se utilizaron inmunoglobulinas y corticoides intravenosos. Si bien no hay datos que apoyen la utilización de estos fármacos en el tratamiento de la neutropenia inducida por medicamentos, se utilizaron en un intento de revertir una agranulocitosis severa sospechando probable mecanismo inmunológico. Tampoco se puede decir que la reversión de la agranulocitosis se debió a estos últimos fármacos.
Este paciente presentaba algunos de los factores asociados a pobre recuperación hematológica como son un recuento inicial menor a 1.000 neutrófilos/mm3, presencia de bacteriemia, shock séptico o infección severa por lo que el pronóstico vital inmediato era grave con una mortalidad cercana al 10% (23,27).
La dipirona puede producir también otras discrasias sanguíneas y esto determina peor pronóstico que la agranulocitosis aislada (28). No fue el caso de este paciente.
La recuperación hematológica, y por consecuencia clínica, se logró a los 13 días de retirado el fármaco sospechoso, sabiendo que la recuperación absoluta en los casos de agranulocitosis por fármacos se logra en menos de 30 días luego de su suspensión.
El paciente fue dado de alta en buenas condiciones clínicas y hematológicas, con la prohibición de la utilización de derivados pirazolónicos en cuadros febriles. Los posteriores hemogramas de control fueron normales.
En la base de una terapéutica razonada se destaca la importancia del conocimiento de los medicamentos que se utilizan, sabiendo que “cada prescripción que hagamos es como una piedra que cae en un estanque, creando ondas concéntricas que llegan a la lejana superficie” como refiere el Dr. Elías de la Cátedra de Farmacología y Terapéutica de Mendoza, Argentina. El Premio Nobel de Fisiología en el año 1988, el Dr. James W Black, farmacólogo inglés, declaró que “los medicamentos son venenos útiles” y todo depende del uso que de ellos hagamos (9). El uso racional del medicamento permite elegir el mejor tratamiento posible con menores riesgos para el paciente. Para lograr este objetivo, el conocimiento de los medicamentos más utilizados es el requisito indispensable del buen ejercicio de la medicina (29).
Si bien en nuestro país no existe una recomendación específica en relación al uso de dipirona, el uso racional de la misma se basa en el conocimiento de este efecto adverso, raro pero posible, cada vez que se realiza su prescripción.
Referencias bibliográficas
1. Kiono W, Coates T. Estrategias prácticas en trastornos de neutrófilos. Clin Pediatr Norteam 2003; 49(5): 889-934.
2. Van der Klauw M, Goudsmit R, Halie MR, Van´t Veer M, Herings R, Wilson JH, et al. A population-based case-cohort study of drug associated agranulocytosis. Arch Intern Med 1999; 159: 369-74.
3. Andres E, Kurtz JE, Maloisel F. Nonchemoterapy drug-induced agranulocytosis: experience of the Strasbourg, France. Clin Lab Haematol 2002; 24(2): 99-106.
4. Banchero P, Giachetto G. Agranulocitosis inducida por medicamentos. Arch Pediatr Urug 2002; 73(2): 74-7.
5. Maldonado MS. Alteraciones de la granulopoyesis y de la función granulocítica. En: Muñoz A, Madero L. Hematología y Oncología Pediátrica. 2 ed. Madrid: Argon, 2005: 207-12.
6. Laporte JR. Reacciones adversas a medicamentos y fármaco vigilancia. Med Clin Barc 1989; 92: 536-8.
7. International Agranulocitosis and Aplastic Anemia Study. Risk of agranulocitosis and aplastic anemia. A first report of their relation to drug use with special references to analgesics. JAMA 1986; 256 (13): 1749-57.
8. Feria M. Fármacos analgésicos, antitérmicos y antiinflamatorios no esteroideos. Antiartríticos. En: Florez J, Ramijo JA, Mediavilla A. Farmacología Humana. 3 ed. Barcelona: Masson; 1997: 355-7.
9. Elías PA. Uso de dipirona en Argentina [en línea]. E-fármacos 2003; 1 (568). <http://www.medicentro.com> [consulta: 22 feb 2006].
10. Ibáñez L, Vidal X, Ballarin E, Laporte JR. Agranulocytosis associated with dipyrone (metimazol). Eur J Clin Pharmacol 2005; 60(11): 821-9.
11. Benet L, Keroetz D, Sheiner L. Farmacocinética dinámica de la absorción, distribución y eliminación de fármacos.En: Hardman J, Limbrid L, Molinoff P, Ruddon R, Goodman Gilman A. Las Bases Farmacológicas de la Terapéutica. 9 ed. Mexico: Mc Graw Hill, 1996: 3-30.
12. Castiglioni F, Broggini M, Baratelli E, Battaglia A, Besozzi M, Gorini L. Agranulocytosis caused by dipyrone. Case reports. Clin Ther 1989; 130 (3-4): 179-83.
13. Ibañez L, Vidal X, Ballarin E, Laporte JR. Population-Based Drug-Induced Agranulocytosis. Arch Intern Med 2005; 165(8): 869-74.
14. Hamerschlak N, Biassi A. Neutropenia, agranulocitosis and dipyrone. Med J 2005; 123(5): 247-9.
15. Boxer L. Leucopenia. En: Behrman R, Kliegman R, Jenson H. Nelson Tratado de Pediatría. 16 ed. Madrid: Mc Graw-Hill, 2000: 681-8.
16. Edwars R, Arunson JK. Adverse drug reactions: definitions, diagnosis and management. Lancet 2000; 356: 1255-59.
17. Algorta G, Galiana A, Icardi A, Misa A, Pirez C. Manual de normas y procedimientos para el control de infecciones intrahospitalarias: normas de aislamiento. Montevideo: Comité de Infecciones Intrahospitalarias, 2001 [no publicado]
18. Fernández-Paza S, Sevilla Navarro J, Madero López L. Factores de Crecimiento Hematopoyético. En: Muñoz A., Madero L. Hematología y Oncología Pediátrica. 2 ed. Madrid: Argon, 2005: 207-12.
19. Andrés E, Maloisel F, Kurtz JE, Kaltenbach G, Alt M, Weber JC, et al. Modern management of non-chemotherapy drug-induced agranulocytosis: a monocentric cohort study of 90 cases and review of the literature. Eur J Intern Med 2002; 13 (5): 324-8.
20. Sprikkelman A, De Wolf JT, Vellenga E. The application of hematopoietic growth factord in drug-induced agranulocytosis:a review of 70 cases. Leukemia 1994; 8 (12): 2031-6.
21. Julia A, Olona M, Bueno J, Revilla E, Rossello J, Petit J, et al. Drug-induced agranulocitosis: prognostic factors in a series of 168 episodes. Br J Haematol 1991; 79 (3): 366-71.
22. Andrés E, Kurtz JE, Martin-Hunyadi C, Kaltenbach G, Alt M, Weber J C, et al. Nonchemotherapy drug-induced agranulocytosis in elderly patients: the effects of granulocyte colony-stimulating factor. Am J Med 2002; 112 (6): 460-4.
23. Maloisel F, Andres E, Kaltenbach G, Noel E, Martin-Hunyadi C, Dufour P. Prognostic factors of hematological recovery in life-threatening nonchemotherapy drug-induced agranulocytosis. A study of 91 patients from a single center. Presse Med 2004; 33 (17): 1164-8.
24. Celeketic D, Trpkovic A, Cvetkovic Z. Agranulocytosis induced by metamizole and its management with granulocyte growth factor. Vojnosanit Pregl 2005; 62(1): 79-82.
25. Beauchesne Mf, Shalansky SJ. Nonchemotherapy drug-induced agranulocytosis: a review of 118 patients treated with colony-stimulating factors. Pharmacotherapy 1999; 19(3): 299-305.
26. Wickramanayake PD, Scheid C, Josting A, Katay I, Schulz A, Diehl V. Use of granulocyte colony-stimulating factor (filgrastim) in the treatment of non-cytotoxic drug-induced agranulocytosis. Eur J Med Res 1995; 1(3): 153-6.
27. Maloisel F, Andrès E, Kaltenbach G, Noel E, Koumarianou A. Prognostic factors of haematologic recovery in nonchemoterapy drug induced. J Hematol 2003; 88(4): 470-1.
28. Hedenmalm K, Spigset O. Agranulocytosis and other blood dyscrasias associated with dipyrone (metamizole). Eur J Pharmacol 2002; 58(4): 265-74.
29. De Vries T, Herring R, Hogerzeil H, Fresle D. El proceso de la terapéutica razonada. En: Guías de la buena prescripción. Ginebra: OMS/DAP, 1998: 6-11.
Correspondencia: Dra. Mylene Davrieux
Correo electónico: mylenedavrieux@yahoo.com.ar














