Serviços Personalizados
Journal
Artigo
Links relacionados
Compartilhar
Archivos de Pediatría del Uruguay
versão On-line ISSN 1688-1249
Arch. Pediatr. Urug. vol.77 no.3 Montevideo out. 2006
ARTÍCULO ORIGINAL
Arch Pediatr Urug 2006; 77(3): 250-256
Eficacia de la sacarosa oral en la analgesia para procedimientos dolorosos habituales en neonatología
Dres. Giselle Ettlin 1, Ana Lain 2, Jhon Aldao 3, Raúl Bustos 4
1. Pediatra. Neonatóloga.2. Asistente del Departamento de Neonatología del Centro Hospitalario Pereira Rosell.
3. Prof. Adjunto del Departamento de Neonatología del Centro Hospitalario Pereira Rosell.
4. Prof. Director del Departamento de Neonatología del Centro Hospitalario Pereira Rosell.
Fecha recibido: 20 de julio de 2006.
Fecha aprobado: 12 de setiembre de 2006.
Resumen
Es conocida la presencia de dolor en el recién nacido de término o pretérmino. La analgesia frena mecanismos inflamatorios y apoptóticos neuronales.
La expresión de dolor es medida subjetivamente, dado que aun utilizando escalas de evaluación del mismo, éstas no son totalmente fiables. Se realiza un estudio experimental analítico en base a un ensayo clínico controlado, aleatorizado, doble ciego, con una población predeterminada, para evaluar la eficacia de sacarosa al 24% por vía enteral, como sedoanalgesia. Se consideró en el análisis el tiempo de llanto y el tiempo de disconfort, medidos en segundos, realizando test de “t”. De los pacientes evaluados (N=82), luego de conocer las muestras respectivamente administradas, a 40 recién nacidos (RN) se realizó sacarosa al 24% y a 42 RN les correspondió agua destilada.
En relación al disconfort, el efecto de la analgesia fue estadísticamente significativo (p=0,01), disminuyendo en un 36% en aquéllos que recibieron sacarosa al 24%. No fue claramente significativo (si bien fue un 30% menor el tiempo de llanto como habíamos planteado inicialmente) en relación al llanto (p=0,06). No hay diferencias con respecto al sexo en cuanto a tiempo de llanto o disconfort con las distintas medidas realizadas.
Palabras clave: SACAROSA-uso terapéutico
ANALGESIA
RECIÉN NACIDO
Summary
The presence of pain is known either in the full-term or preterm newborn. With painkillers we can refrain swelling or apoptosis mechanisms.
Pain expression is subjective because the scales used to evaluate it, are not very reliable.
An analytic experimental study based on a clinical controlled essay was done randomly and double blinded with a predetermined population, to evaluate the effects of oral 24% sucrose solution as a pain reliever. During the experiment crying duration and discomfort were analyzed, measured in seconds, realizing a "t" test. The number of patients were N= 82, 40 received 24% sucrose solution, and 42 newborns were given sterile water.
Analizing discomfort the effect of the pain relief was statistically significant (p=0.001), diminishing 36% on those who received 24% sucrose solution. It was not so significant,30% less crying time, as we stated previously (p=0,06). There are no differences between males and females.
Key words: SUCROSE-therapeutic use
ANALGESIA
INFANT, NEWBORN
Introducción
Se reconoce actualmente la importancia del dolor ante determinadas noxas, se trate de un recién nacido de término o pretérmino. Sin embargo no se han determinado las variables de expresión del mismo en forma fidedigna por la clínica o la paraclínica. La experiencia de dolor es individual y está determinada por la madurez del sistema nervioso central o la vivencia previa del dolor, entre otros. La experiencia de dolor en el recién nacido se reconoce desde Platón en el año 400 a.C. Fue el Dr. Anand quien dio un impulso al reconocimiento del mismo y la necesidad de analgesia en el año 1986. Estudió que todos los niños experimentaban una respuesta de estrés masiva en quienes se realizaba como rutina el cierre del ductus con relajantes muscular, pero sin anestesia. El dolor es reconocido incluso en etapas fetales. En estudios de comparación se realizó analgesia con fentanilo ante la canulación de la vena intrahepática en fetos de 22-35 semanas de amenorrea, con disminución de la respuesta al estrés; esto es, aumento del nivel de cortisol y beta endorfinas. Además del llanto y/o disconfort que un recién nacido expresa frente a una agresión tisular, existen otras variables como: aumento de la frecuencia respiratoria, presión sanguínea, saturación de oxígeno, tono vagal, sudoración, así como modificación de la frecuencia cardíaca. Sin embargo no son específicas de dolor y además disminuyen con la reiteración del mismo o el paso del tiempo (1-4).
Las distintas escalas de dolor para calificar clínicamente el mismo no han tenido una fiabilidad completa, por distintos parámetros de evaluación y su practicidad (2,5).
Cuantificar el dolor en lactantes es una tarea difícil; se reconoce por estudios bioquímicos, cambios hormonales y metabólicos, (activación del eje hipófiso-suprarrenal, con aumento de cortisol y aldosterona, así como insulina, glucagón y hormona de crecimiento). Está en debate si el incremento de la respuesta es un signo de dolor o si la disminución de éste es un elemento de reducción del mismo. Los agentes anestésicos amortiguan la respuesta al estrés (6). Estudios realizados en ratas, ante el dolor crónico, mostraron un comportamiento distinto, con umbrales para el dolor más bajos durante la lactancia, comportamiento defensivo de retirada y estado de alerta excesivo durante su vida adulta. Se puede deber a alteraciones en el desarrollo de un sistema receptor del dolor inmaduro, que lleva a un aumento de la apoptosis neuronal fisiológica. Esto puede vincularse a: a) aumento en la excitotoxicidad neuronal, por activación de los receptores N-metil-D-aspartato (que permite la entrada de CA2+ en la célula) y b) apoptosis, mediada por receptores de las citocinas inflamatorias o por lesión mitocondrial (7-9).
El problema que enfrentamos es qué analgésicos emplear, con mínimo efecto colateral, fáciles de utilizar, etcétera; considerando se trate de procedimientos menores o mayores que ocasionen el dolor. En estudios realizados en crías de rata las respuestas al dolor fueron mitigadas por infusiones con azúcar, grasa o leche. Estos cambios se revirtieron por naltrexona, un antagonista de los opioides. Por lo que esto considera a la leche, azúcar o grasa como medidadores opiodes endógenos, lo cual elevaría el umbral de dolor (10,11). El mecanismo de acción de la analgesia con sacarosa no es completamente conocido, pero se observó en un estudio doble ciego en pretérminos en quienes se administró en boca versus sonda intragástrica que en esta última no hubo disminución de respuesta frente al dolor (12). Un estudio inmunohistoquímico realizado en ratas recién nacidas, demuestra una activación luego de la administración de sacarosa del núcleo rostral del tracto solitario (vía ascendente gustativa), y sustancia gris periacueductal, además del núcleo del rafe magnus, sitios moduladores de vías descendentes del dolor (13).
Objetivos
Como objetivo general se observó la manifestación del dolor en recién nacidos.
Como objetivo específico se evaluó la efectividad de sacarosa vía enteral como método antinociceptivo, durante procedimientos dolorosos menores y necesarios en una población de recién nacidos procedentes en el sector Recién Nacidos del CHPR. Como profesionales de la salud, una meta es disminuir el dolor para confort del paciente, con medicación de fácil uso, costos bajos, con efectos colaterales mínimos o nulos. Afianzar este método podrá servir para ser aplicado en algunos recién nacidos de pretérmino, en quienes el dolor puede generar efectos contraproducentes (hipertensión arterial, alteración del flujo sanguíneo cerebral, con la consiguiente hemorragia intracraneana, entre otros).
Hipótesis
Analizamos que el uso de sacarosa vía oral previo a punciones periféricas logra reducir el tiempo de llanto y el disconfort (calculado en segundos) próximo a un 30% del mismo; en relación al uso de agua destilada, esterilizada. Esto evalúa en forma indirecta la analgesia frente al procedimiento doloroso.
Pacientes y método
Se trató de un estudio experimental analítico en base a un ensayo clínico controlado, aleatorizado, doble ciego, con una población predeterminada de acuerdo a los criterios de inclusión, realizada por médicos del sector previamente entrenados, y personal de enfermería.
Se consideraron como criterios de inclusión las siguientes características: recién nacidos entre las primeras horas de vida y los 29 días de vida; pretérmino leve o término (mayor o igual a 35 semanas de edad gestacional y menor de 41 semanas, definido por test de Capurro), con un peso al nacer mayor de 2.500 g, con test de Apgar mayor o igual a 7 a los 5 minutos de vida, sin síndrome de dificultad respiratoria o síndrome de dificultad respiratoria leve (puntaje de Silverman menor o igual a 3), ventilando espontáneamente al aire o con oxigenoterapia, hemodinámicamente estable con frecuencia cardíaca normal (mayor a 100 y menor a 160 ciclos/min), con tonos bien golpeados, pulsos palpables, y tiempo de recoloración menor de 3 s. Se debía encontrar eutérmico (con temperatura axilar entre 36,4 y 37 grados) y haber iniciado alimentación enteral entre 30-120 minutos de la misma. Los pacientes fueron valorados en el alojamiento madre-hijo o en cuidados mínimos. Los criterios de exclusión considerados fueron: los opuestos a los mencionados y además haber recibido fármacos analgésicos 6 horas previas, o RN cuyas madres recibieron sedoanalgesia 6 horas previo al parto. Quienes presentaban otras causas de dolor (fractura de clavícula, etcétera), compromiso metabólico, como hipoglucemia, o que fueran portadores de malformaciones mayores.
Procedimiento e intervención
El procedimiento se realizó mientras el recién nacido permanecía en su cuna, dado que es conocida la intervención materna como factor coadyuvante en el aumento del umbral del dolor. Por lo mismo se evitó el uso de tetinas. Se accionó el mismo si la última lactada fue con un intervalo mayor a 30 minutos.
Las muestras fueron preparadas por el laboratorio de química farmacéutica del CHPR, con un número identificatorio, en tubos esterilizados idénticos, conociendo ellos las características de las mismas, lo que garantiza la aleatorización. Al finalizar el trabajo de campo, las muestras fueron reveladas.
Se solicitó la autorización del Servicio de Neonatología del CHPR, aprobando la Cátedra correspondiente la realización del estudio, dado que el mismo es experimental, tipo ensayo clínico controlado.
Se solicitó el consentimiento materno para la administración de la toma, explicando las características del trabajo. Se administró por vía oral a la población seleccionada al azar, tanto sacarosa al 24% como agua destilada, mediante succión, de tal forma que el observador desconoce la solución administrada. La cantidad fue de 2 ml y se realizó su aporte 2 minutos previo al procedimiento doloroso. El técnico en salud realizó la inmunización del bacilo de Calmette Guerin en miembro superior derecho, como lo hace habitualmente, y un observador cronometró tiempo de llanto, facies de dolor y disconfort.
Se grabó el sonido de llanto para corroborar el tiempo del mismo e intensidad. Se analizó principalmente:
1) Duración del llanto desde el inicio del procedimiento, 2 minutos luego de administrada la solución.
2) Facies de dolor y/o mueca de llanto, que identificamos como disconfort.
El estudio se ejecutó en dos etapas, vinculado a la elaboración de la muestra de solución sacarosa-placebo. Se limitó el procedimiento doloroso a la inmunización para homogeneizar las características del dolor.
El tiempo de la punción para la inmunización fue de 4 segundos, dado que implica la punción subcutánea y la aplicación de la vacuna. Se realizó el estudio en 90 pacientes que se encontraban en el sector de alojamiento madre-hijo y que aún no habían sido inmunizados, con los criterios descriptos de inclusión. Ocho de ellos se excluyeron por razones técnicas, ya fuera que no se logró administrar bien la muestra o el control no pudo realizarse en forma adecuada. Como la actividad de llanto es variable en cada niño se utiliza, además, la actividad facial. Se observa el fruncimiento del entrecejo, contracción de los párpados, profundización del surco nasolabial, verticalización y horizontalización de los labios y protrusión de la lengua, que en nuestro caso hemos definido como “disconfort”.
Resultados
Se consideró en el análisis el tiempo de llanto y el tiempo de disconfort, medidos en segundos, realizando test de “t”. Se incluye en el estudio: edad, peso y sexo como covariables (o covarianza), para observar principalmente si esto pudiera modificar resultados. De los pacientes evaluados (N=82), luego de conocer las muestras respectivamente administradas, a 40 recién nacidos (RN) se administró sacarosa al 24% y a 42 RN les correspondió agua destilada. 45 niños fueron de sexo masculino y 37 de sexo femenino. La distribución por sexo y correspondiente solución fue: 22 RN de sexo masculino recibieron sacarosa, 18 RN de sexo femenino recibieron sacarosa, 23 RN de sexo masculino recibieron placebo y 19 RN de sexo femenino recibieron placebo.
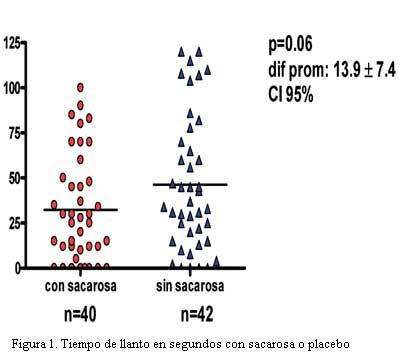
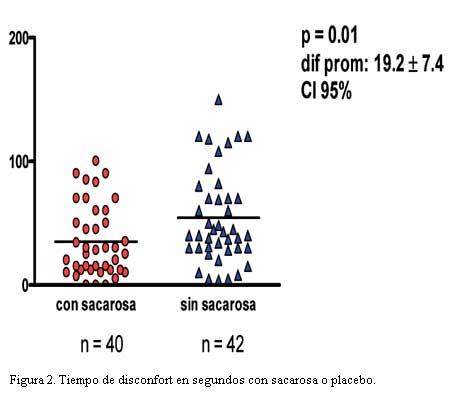
De todos los niños que recibieron sacarosa (n=40), 17 no emitieron llanto (42,5%), y 3 (7,5%) no expresaron disconfort. De todos los niños que recibieron placebo (n=42), cuatro no emitieron llanto (9,5%), y ninguno dejó de expresar disconfort (0%), es decir todos emitieron algún disconfort. De los 82 pacientes incluidos en nuestra muestra, creemos importante destacar que el promedio de peso fue de 3.315 g con un desvío estándar de 444,4 g. Con respecto a las horas de vida, el promedio fue de 23 horas, con un desvío estándar de 15,5 horas. De los 40 pacientes en quienes se evaluó llanto con sacarosa al 24%, mostraron una media de tiempo de llanto de 32,5±4,7 s, en cambio la media de tiempo de llanto sin sacarosa (n=42) fue de 46,4±5,8 s. Si bien hubo diferencia de tiempo (-14±7,5 s), no fue significativa (p=0,06), con intervalo de confianza de 95% (figura 1). Por el contrario, de los pacientes en quienes se evaluó disconfort con sacarosa al 24% (n=40) mostraron una media de 34,9±4,6 s, frente a los que recibieron placebo (n=42) de 54,2±5,8 s. Con una diferencia de la media de –19,3±7,4 s en quienes recibieron sacarosa. Esto demuestra una diferencia estadísticamente significativa (p= 0,01), calculado por prueba de T para muestras independientes (figura 2).
Si consideramos el porcentaje de tiempo vinculado a la media de tiempo de llanto en segundos, observamos una disminución de 30% de llanto, en aquellos que recibieron sacarosa al 24%. Si consideramos el porcentaje de tiempo vinculado a la media de tiempo de disconfort en segundos, observamos una disminución del 36% en aquellos que recibieron analgesia.
Se representaron en gráficas los valores analizados por medio de frecuencias relativas, en ambas circunstancias y en estos términos, se observa una tendencia favorable a la analgesia con sacarosa al 24%, comparativamente (figuras 3 y 4).
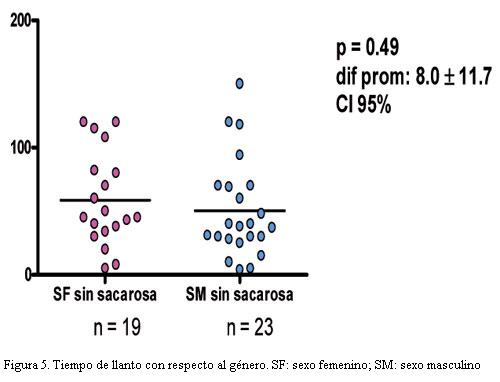
Analizamos como covariables, la distribución por sexo, comparando si existían diferencias entre tiempo de llanto o disconfort en los distintos géneros, tanto hayan recibido o no la solución. Con respecto al tiempo de llanto con placebo, correlacionándolo con sexo, obtuvimos una media de 58,5 s en el sexo femenino (n=19), con respecto a una media de 50,5 s en el sexo masculino (n=23). Del análisis de estos datos surge que no hay una diferencia significativa con respecto al sexo, siendo el valor de p=0,49 con un intervalo de confianza de 95% (figura 5).
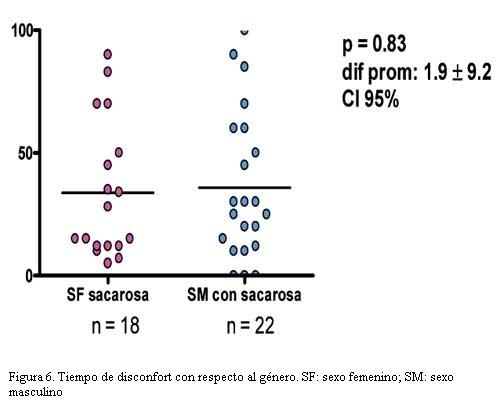
El tiempo de disconfort con sacarosa fue de 33,8 s en el sexo femenino (n=18) y de 35,8 s en el sexo masculino (n=22); por lo que no fue estadísticamente significativa (p=0,83) la diferencia entre géneros, con un intervalo de confianza del 95% (figura 6).
Comentarios
- Si bien no se conoce íntimamente el mecanismo de la analgesia con sacarosa (se supone que un estímulo oral tiene efecto en el sistema nervioso central), es efectiva en recién nacidos en quienes se practica un procedimiento doloroso menor (punciones venosas periféricas, punción de talón, por ejemplo) (1,3,5,11).
- La expresión de dolor es medida subjetivamente, dado que las escalas de evaluación del mismo no son totalmente fiables.
- Los recién nacidos muestran, como los adultos, distintos umbrales de dolor, observables en este estudio en niños que no expresaron llanto ni disconfort ante un procedimiento doloroso menor, pero invasivo. Estos elementos pueden modificar los resultados del estudio, ya que siguen siendo datos cualitativos.
Conclusiones
- Pudimos comprobar nuestra hipótesis inicial en relación al disconfort, que fue estadísticamente significativa (p=0,01), disminuyendo en un 36% en aquellos que recibieron sacarosa al 24%. No fue claramente significativa (si bien fue un 30% menor el tiempo de llanto como habíamos planteado inicialmente) en relación al llanto (p=0,06).
- En números absolutos, hubo 17 niños versus cuatro que no expresaron llanto con y sin sacarosa, respectivamente. En todos los casos en que se administró placebo hubo algunos segundos de disconfort. Demuestra las características cualitativas del estudio así como las variaciones del umbral, por un lado, y por otro, que siempre existió algún grado de analgesia mientras se usara sacarosa.
- No hay diferencias con respecto al sexo en cuanto a tiempo de llanto o disconfort con las distintas medidas realizadas.
Sugerencias
- Opinamos que es aconsejable el uso de sacarosa al 24% en el recién nacido de término, vigoroso, ante procedimientos dolorosos menores (1,3,5,11).
- Se puede utilizar como coadyuvante una succión no nutritiva o nutritiva, en brazos de su madre mientras se realiza la misma (1,5).
- Si bien utilizamos principalmente la inmunización como procedimiento doloroso, puede ser utilizada ante punciones de talón, extracción de muestras de sangre o colocación de vías percutáneas, como se ha realizado en otros estudios (3).
- El uso puede ser extendido a otros recién nacidos de pretérmino, mayores a 30 semanas de edad gestacional corregida, en quienes no se han observado efectos colaterales. Queda sin definir aún el uso reiterado de la solución de sacarosa (9, 14-18).
Reconocimientos
Al Departamento de Farmacia del Centro Hospitalario Pereira Rossell, Quím. farmacéutica Luciana Nanny.
Al equipo de vacunadores del CHPR, CHLA, quienes colaboraron en forma incondicional con el estudio permitiendo cumplir con el protocolo del mismo.
A la Dra. Mariela Costas, por la colaboración en el procesamiento de datos referentes al estudio.
Referencias bibliográficas
1. Blass EM. Pain-reducing properties of sucrose in human newborns. Chem Senses 1995; 20: 29-35.
2. Craig K, Korol Ch. Dificultades para la evaluación del dolor en los lactantes vulnerables. Clin Perinatol 2002; 3: 427-40.
3. Harrison D, Johnston L, Loughan P. Oral sucrose for procedural pain in sick hospitalized infants: randomized-controlled trial. J Paediatr Child Health 2003; 39(8): 591-7.
4. Oberlander T, Saul P. Consideraciones metodológicas para el uso de la variabilidad de la frecuencia cardíaca como parámetro para determinar la reactividad frente al dolor en los lactantes vulnerables. Clin Perinatol 2002; 3: 407-25.
5. Carvajal R, Chauvet X, Courderc S, Olivier-Martin M. Randomised trial on analgesic effect of sucrose and pacifier in term neonates. BMJ 1999; 319 (7222): 1393-7.
6. Goldman D, Koren G. Marcadores biológicos del dolor en el lactante vulnerable. Dolor en los lactantes vulnerables. Clin Perinatol 2002; 3: 395-406.
7. Fernandez M, Blass EM. Sucrose attenuates a negative electroencephalographic respons to an aversive stimulus for newborns. J Dev Behav Pediatr 2003; 24(4): 261-6.
8. Bhutta A, Anand K. Vulnerabilidad del cerebro en desarrollo: mecanismos neuronales. Dolor en los lactantes vulnerables. Clin Perinatol 2002; 3: 331-47.
9. Grunau R. Dolor en las fases iniciales de la vida de los lactantes prematuros: un modelo de los efectos a largo plazo. Dolor en lactantes vulnerables. Clin Perinatol 2002; 3: 349-72.
10. Lingen R, Simons S, Anderson B. Efectos de la analgesia en el lactante vulnerable durante el período perinatal. Dolor en lactantes vulnerables. Clin Perinatol 2002; 3: 497-21.
11. Blass E, Hoffmeyer L. Sacarosa como analgésico en el recién nacido humano. Pediatrics (ed. esp) 1991; 31; 2: 67-70.
12. Rameghi LA, Evans DJ, Levene MI. Sucrose analgesia: absortive mechanisme or taste perception? Arch Dis Child Fetal Neonatal 1999; 80(2): F146-7.
13. Anseloni VC, Ren K, Dubner R. A brainstem substrate for analgesia elicited by intraoral sucrose. Neuroscience 2005; 133(1):231-43.
14. Abad F, Díaz NM, Doménech E, Robayna M, Rico J. Oral sweet solution reduces pain related behaviour in preterm infants. Acta Paediatr 1996; 85: 854-8.
15. Acharya AB, Annamali S, Taub NA, Field D. Oral sucrose analgesia for preterm infant venepuncture. Arch. Dis Fetal Neonatal 2004; 89: F17-18.
16. Johnston CC, Filion F, Zinder L. Routine sucrose analgesia during the first week of life in neonates younger than 31 weeks posconceptional age. Pediatrics 2002; 110(l3): 523-8.
17. Stevens B, Yamada J, Ohlsson A. Sucrose for analgesia in newborn infants undergoing painful procedures. (Cochrane Review). The Cochrane Library, Issue 1, 2006.
18. Gibbins S, Stevens B. The influence of gestational age on the efficacy and short-term safety of sucrose for procedural pain relief. Adv Neonatal Care 2003; 3(5): 241-9.
Correspondencia: Dra. María Giselle Ettlin Guazzo.
José Culta 2121. Montevideo, Uruguay.
E-mail: fmontes @ adinet.com.uy