Servicios Personalizados
Revista
Articulo
Links relacionados
Compartir
Archivos de Pediatría del Uruguay
versión On-line ISSN 1688-1249
Arch. Pediatr. Urug. vol.76 no.4 Montevideo dic. 2005
ARTÍCULO ORIGINAL
Arch Pediatr Urug 2005; 76(4): 289-304
Morbimortalidad y crecimiento de los niños con muy bajo peso al nacer hospitalizados
DRES. MARIELA COSTAS 1, SUSANA DOMíNGUEZ 2, GONZALO GIAMBRUNO 3, MIGUEL MARTELL 4
1. Pediatra neonatóloga. Ex Asistente de Clínica de Neonatología, Hospital de Clínicas.
2. Pediatra neonatóloga de la Clínica de Neonatología, Hospital de Clínicas.
3. Ex Profesor Adjunto de la Clínica de Neonatología, Hospital de Clínicas.
4. Ex Profesor Director de la Clínica de Neonatología, Hospital de Clínicas. Facultad de Medicina. Universidad de la República.
Departamento de Neonatología, Hospital de Clínicas. Unidad Neonatal, Asociación Española Primera de Socorros Mutuos. Montevideo. Uruguay.
Fecha recibido. 29 de noviembre de 2005.
Fecha aprobado. 28 de diciembre de 2005.
Resumen
Introducción: las prácticas corrientes de manejo perinatal han resultado en un incremento en la sobrevida de los niños con muy bajo peso al nacer, no obstante estos niños están en riesgo de desarrollar morbilidad a corto y largo plazo debido a su prematurez, así como a complicaciones secundarias al manejo asistencial.
Objetivo: estudiar la morbimortalidad y el crecimiento de los niños con muy bajo peso al nacer de dos unidades de cuidados intensivos neonatales.
Material y método: se realizó un estudio retrospectivo, descriptivo y analítico de todos los recién nacidos con peso al nacer menor o igual a 1.500 gramos del Hospital de Clínicas en el período comprendido entre enero de 2001 a diciembre de 2003, y de la Asociación Española Primera de Socorros Mutuos en el período comprendido entre enero de 2002 y diciembre de 2004. Se estudiaron un total de 130 neonatos. Se obtuvieron las historias completas de 118 niños, que fueron analizadas en su totalidad.
Resultados: el porcentaje de sobrevida total para todo el grupo fue de 82% (106 de 130 neonatos). Hubo un 100% de letalidad para los neonatos con 23 semanas o menos de edad gestacional al nacer, luego la sobrevida aumenta progresivamente a partir de las 24 semanas, llegando a un 100% a las 30 semanas de edad gestacional. Estos datos son comparables a partir de las 24 semanas a los de la red Vermont Oxford (362 instituciones de EE.UU.). Para el estudio de la morbilidad se identificaron las enfermedades más salientes. El 78% de los niños requirió la administración de surfactante pulmonar. El 28% de los niños tuvo diagnóstico de broncodisplasia pulmonar. Presentó sepsis tardía el 26%, ductus arterioso permeable el 22%, retinopatía del prematuro el 10%, hemorragia intracraneana grado III-IV el 3% y enterocolitis necrotizante el 1%. Hasta las 26 semanas el 100% de los niños presentó alguna morbilidad definida, a partir de las 27 semanas aumentó progresivamente el número de niños sin ninguna morbilidad, siendo este porcentaje mayor al 90% para los niños con más de 30 semanas de edad gestacional al nacer. En cuanto al crecimiento, todos los grupos de diferente edad gestacional tuvieron una pérdida de peso inicial de aproximadamente dos desvíos de puntaje z; una vez que se recuperó el peso al nacer todos crecieron a una velocidad de crecimiento semejante a la intrauterina pero por debajo del percentil 10 del feto de referencia. La mayor velocidad de crecimiento se observó con aportes calóricos entre 100-125 calorías/kg/día.
Conclusión: la morbimortalidad fue inversamente proporcional a la edad gestacional y al peso al nacer. La mayor morbilidad estuvo determinada por la presencia de broncodisplasia pulmonar y las enfermedades asociadas a ésta, principalmente la sepsis tardía. Serán necesarios futuros estudios en los que se optimice el manejo respiratorio, el crecimiento posnatal y se disminuya la morbimortalidad.
Palabras clave: RECIÉN NACIDO DE MUY BAJO PESO
-crecimiento y desarrollo
PREMATURO
MORBILIDAD
MORTALIDAD INFANTIL
Summary
Background: due to the combined efforts of obstetricians and neonatologists in optimizing perinatal and neonatal care, survival of infants with extremely low birth weight (ELBW) has improved remarkably in the last decade. However, improved survival of premature infants has been accompanied by increasing recognition of log-term neurological deficits, chronic lung complications and other morbidities.
Objective: to evaluate the mortality, morbidity and growth in weight of infants with ELBW in two level III neonatal intensive care units (NICUs).
Methods: a 3-year retrospective review of 130 infant’s £ 1500 g birth weights who were admitted in two level III neonatal intensive care units (Hospital de Clinics and AEPSM).
Results: of 130 infants, 106 (82%) were discharged from the hospital. The survival rates for all infants admitted to a NICU were, respectively, 0% for £ 23 weeks, 43% for 24 weeks, 83% for 25 weeks, 70% for 26 weeks, 80% for 27 weeks, 93% for 28 weeks, 81% for 29 weeks and 100% for ³ 30 weeks. 78% of the infants received treatment with surfactant, 28% have chronic lung disease, 26% late sepsis, 22% patent ducts arteriosus, 10% retinopathy of prematurity, 3% intraventricular hemorrhage grade III-IV, and 1% necrotizing enterocolitis. 100% of the infants with 26 weeks have some morbidity, however only 10% of the infants with = 30 weeks have some morbidity. Most ELBW infants did nor achieve catch-up growth during the neonatal intensive care unit hospitalization when compared with the median birth weight of a reference fetus of the same postmenstrual age. Average daily weight gain (g/kg body weight/d) after regaining birth weight was similar to the reported intrauterine weight gain.
The factor significantly associated with a higher growth velocity was a caloric intake = 100 to 125 cal/Kg/d.
Conclusions: the mortality and morbidity decreased dramatically with the increment of the gestational age. The morbidity most significative was chronic lung disease and their pathology associated: the late sepsis. Studies using calories closer to the upper ranges of the recommendations and designed to reduce the incidence of/or severity of chronic lung disease need to be conducted in the extremely premature population.
Key words: INFANT, VERY LOW BIRTH WEIGHT
-growth & development
INFANT, PREMATURE
MORBIDITY
INFANT MORTALITY
Introducción
Los avances de las intervenciones perinatales en los últimos decenios; como el uso de esteroides prenatales, las técnicas ventilatorias, el surfactante y una mejor nutrición; han producido una mejoría en la supervivencia de los recién nacidos con muy bajo peso al nacer.
La incidencia nacional de recién nacidos con muy bajo peso al nacer en el Uruguay para el año 2004 fue del 1,8%, abarcando el sector público y privado (1).
Estos nacimientos de niños con muy bajo peso al nacer contribuyen con la mayor parte de la mortalidad y morbilidad vinculadas con el parto, por lo que uno de los mayores retos de la atención de salud es la prevención del nacimiento de productos muy prematuros.
Estos niños tienen un riesgo mayor de desarrollar una amplia variedad de morbilidades a largo plazo, que incluyen parálisis cerebral, retardo mental, desempeño escolar deficiente, déficit del crecimiento y morbilidad respiratoria aumentada (2).
Las tres morbilidades reportadas con mayor frecuencia con impacto significativo en la morbimortalidad son la broncodisplasia pulmonar (BDP), la hemorragia intraventricular severa (HIV), la leucomalacia periventricular (LPV) y la retinopatía severa del prematuro (ROP) (3).
Cada una contribuye por sí sola a la morbilidad, pero su asociación predice fuertemente el riesgo de muerte tardía y déficit neurosensorial (3).
También se deben tener presentes otros factores de crucial importancia en el manejo de estos niños, como el mantenimiento de una nutrición adecuada. La desnutrición fetal y durante el período neonatal afecta el crecimiento del sistema nervioso central y causa cambios microscópicos, así como alteraciones en la maduración funcional del cerebro determinando efectos permanentes sobre la capacidad cognitiva y el comportamiento (4).
Por otro lado los niños con deterioro del estado nutricional están más susceptibles de desarrollar broncodisplasia pulmonar y sepsis tardía (5).
Por lo que el objetivo de este trabajo es estudiar la morbimortalidad y el crecimiento de los niños con peso de hasta 1.500 g al nacer, para intentar predecir la evolución y desarrollo neurológico a largo plazo en una unidad neonatal de un hospital universitario y de un centro privado con características asistenciales similares, manejados por el mismo equipo neonatal y con conductas obstétricas muy similares.
Material y método
Se realizó un estudio retrospectivo, descriptivo y analítico de todos los recién nacidos con peso al nacer menor o igual a 1.500 gramos del Hospital de Clínicas en el período comprendido entre enero de 2001 a diciembre de 2003 y de la Asociación Española Primera de Socorros Mutuos (AEPSM) en el período comprendido entre enero de 2002 a diciembre de 2004.
Todos los nacimientos se produjeron en la misma maternidad (ambas maternidades tienen cuidado intensivo neonatal).
Se estudiaron un total de 130 neonatos. Se obtuvieron las historias completas de 118 niños, que fueron analizadas en su totalidad.
Para la realización de este estudio se utilizó una ficha precodificada confeccionada para tal fin.
Características generales de la población
Para el cálculo de la edad gestacional (EG) se utilizó la fecha de última menstruación y la ecografía temprana, y en el caso de faltar estos datos el método clínico de Ballard (6).
Se consignaron datos de sexo, peso, score de Apgar, presencia de malformaciones congénitas, mortalidad (hasta los 28 días y hasta el alta), uso de corticoides prenatales, vía de parto y estudio de la placenta.
Se realizó el puntaje de riesgo (CRIB) a todos los neonatos (7).
Para el estudio de la morbilidad se estudiaron las enfermedades más salientes.
El soporte respiratorio fue valorado por el uso de surfactante, número de días de asistencia ventilatoria mecánica (AVM), presión positiva continua (CPAP), concentración de oxígeno y días de duración de la oxigenoterapia.
Se estimó la presencia de complicaciones, entre las que se encuentran:
- Enterocolitis necrotizante (ECN), definida por la presencia de un estadio II de Bell (8).
- Ductus arterioso permeable (DAP), diagnosticado por ecocardiograma con Doppler.
- Broncodisplasia pulmonar (BDP), utilización de oxígeno por más de 28 días, clínica y cambios radiológicos compatibles (9).
- Uso de corticoides posnatales y días de tratamiento.
- Sepsis confirmada por diagnóstico bacteriológico con la presencia de dos hemocultivos positivos.
- Hemorragia intracraneana (HIC) grados III y IV, según la clasificación de Papile (10).
- Retinopatía del prematuro (ROP), con la realización de fondo de ojo (11).
Desde el punto de vista nutricional:
- Variación de peso diaria.
- Definición de pequeño para la edad gestacional (PEG): peso al nacer por debajo del percentil 10 de la curva de referencia (12).
- Fluidos aportados, ya sea en forma intravenosa (i/v) o por vía oral (v/o), tipo de fórmula, concentración y volumen que fueron convertidos a calorías por kilo y por día, (cal/kg/d).
- Inicio, duración y finalización de alimentación parenteral (APT).
Las curvas de crecimiento de los pacientes de la muestra se compararon con los datos de referencia de la población femenina y masculina canadiense (12).
Se calculó el puntaje z y la diferencia de z para el peso en relación al peso al nacer semanalmente para todos los pacientes de la muestra (13).
Análisis estadístico
Para los datos descriptivos se usó el promedio como medida de resumen central y el desvío estándar como medida de dispersión. Para los datos cualitativos se utilizo el Chi cuadrado (c2). Para comparar datos cuantitativos se utilizó el test de t para muestras dependientes e independientes según el caso. Cuando se trató de tres o más grupos de variables se usó el ANOVA, y si éste era significativo se evaluaron los grupos diferentes con la prueba de Bonferroni (14).
Para la asociación del crecimiento en g/kg/día con las calorías aportadas en cal/kg/día se realizó un análisis de regresión simple (14).
Resultados
Durante el período de tiempo en que se llevó a cabo el estudio:
1. Hospital de Clínicas (enero de 2001 a diciembre de 2003): nacieron 57 niños con peso menor o igual a 1.500 g. Total de nacimientos del Hospital de Clínicas (2001–2004): 3.045 nacimientos.
2. AEPSM (enero de 2002 a diciembre de 2004): nacieron 73 niños con peso menor o igual a 1.500 gramos. Total de nacimientos de la AEPSM (2002–2004): 6.245 nacimientos.
El análisis de la sobrevida por edad gestacional e intervalos de peso al nacer y la valoración de la vía del parto y el uso de corticoides prenatales se hizo para la totalidad de los 130 neonatos.
En el resto de las variables se estudiaron en 118 neonatos, porque en 12 neonatos (Hospital de Clínicas) no se dispuso de las historias clínicas completas.
En la tabla 1 se muestran los datos comparativos entre ambos centros. No se encontraron diferencias estadísticamente significativas en ninguna de las variables analizadas con el Chi cuadrado (c2=NS).
Ningún niño presentó malformaciones congénitas, ni fue trasladado fuera de la unidad.
Distribución por sexo: 62 de sexo femenino y 68 de sexo masculino.
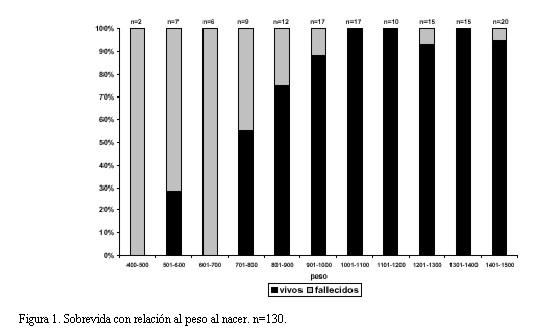
Distribución por peso: 53 niños tuvieron un peso al nacer menor o igual a 1.000 g (41%) y los 77 restantes (59%) tuvieron un peso mayor a 1.000 g.
Dentro del grupo de neonatos con menos de 1.000 g, 23 niños (18%) tenían hasta 750 g de peso al nacer.
El porcentaje de sobrevida global fue del 82%, 106 de 130 .
Sobrevida por peso: el grupo con peso de hasta 1.000 g tuvo una sobrevida del 57% (30 niños de 53); el grupo con peso mayor a 1.000 g tuvo una sobrevida del 97% (75 niños de 77).
El grupo con peso al nacer menor o igual a 750 g tuvo una sobrevida del 26% (6 niños de 23); mientras que el grupo entre 750-1000 g tuvo una sobrevida del 80% (24 niños de 30).
La distribución y sobrevida discriminada por grupo de peso cada 100 g se muestra en la figura 1.
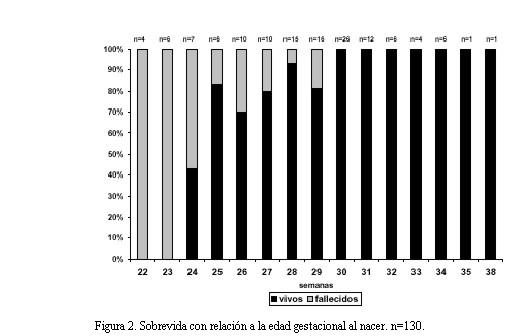
La sobrevida por edad gestacional se ve en la figura 2. No hubo sobrevida en el grupo de hasta 23 semanas de edad gestacional al nacer (n=10).
A partir de las 30 semanas la sobrevida fue del 100% (figura 2).
Se observó 67% (n=16) de letalidad en los primeros cuatro días de vida, siendo este porcentaje mayor (50%) en el primer día de vida, lo que coincide con los pacientes de menor edad gestacional y peso al nacer (tabla 2).
Tres niños (12%) fallecieron luego de los primeros 28 días de vida: dos debido a hemorragia intracraneana grado III-IV y uno por broncodisplasia pulmonar severa.Se obtuvieron 14 estudios anatomopatológicos de la placenta (niños fallecidos, AEPSM), en el 82% de éstos se confirmó el diagnóstico de corioamnionitis difusa aguda
Se encontró una asociación significativa entre la depresión neonatal severa (Apgar menor o igual a 3 al primer minuto) y la mortalidad. (p < 0,001).
El 64% de los neonatos fallecidos con menos de 1.000 g de peso al nacer tuvo un score de Apgar al primer minuto menor o igual a 3 (OR = 6,8, CI 95% 2,5 a 18,0).
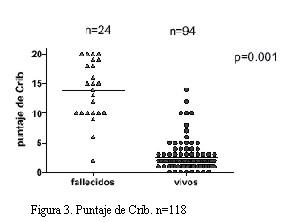
El puntaje de Crib fue significativamente mayor en los fallecidos, promedio = 13,7 ± 1,3, versus 2,7 ± 0,4 para los sobrevivientes, p < 0,0001 (figura 3).
Las características generales de los niños vivos analizados (n = 94) se muestran en la tabla 3.
El peso promedio de la población fue de 1.140 g (SD: 289). La edad gestacional promedio fue de 29 semanas. En cuanto a la vía del parto, 89 niños (90%) nacieron por cesárea. Se administraron corticoides prenatales al 78% de los niños.
Se obtuvo el estudio anatomopatológico de la placenta de 50 niños (procedentes de la AEPSM): 29 (58%) con diagnóstico de corioamnionitis difusa aguda, nueve (18%) con signos placentarios de sufrimiento fetal crónico, cinco (10%) con infartos y calcificaciones, y siete (14%) normal.
El porcentaje global de score de Apgar £ 3 al primer minuto en los sobrevivientes fue del 17%, siendo del 50% en el grupo con peso al nacer £ 750 g.
Soporte respiratorio: se administraron dos dosis de surfactante pulmonar al 78% de los niños.
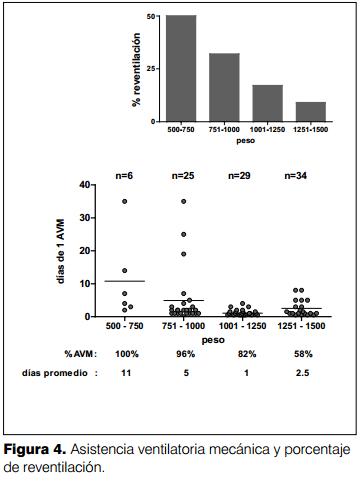
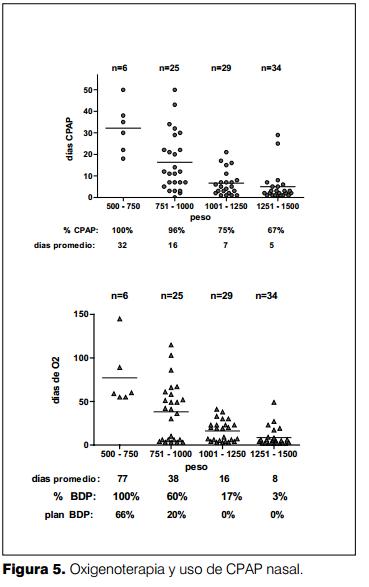
En la tabla 3 y figuras 4 y 5 se muestran los días de ventilación, uso de CPAP nasal y aporte de oxígeno discriminados por grupo de peso. El porcentaje de reventilación fue del 50% para el grupo entre 500-750 g de peso al nacer, luego este porcentaje decrece progresivamente.
Los niños con menor peso al nacer fueron los que requirieron la asistencia ventilatoria mecánica, CPAP nasal y oxigenoterapia más prolongada.
El porcentaje de niños con diagnóstico de broncodisplasia pulmonar (BDP) fue del 28%.
Este porcentaje fue del 67% para los neonatos con peso al nacer entre 500-1.000 g.
Se administraron corticoides posnatales a nueve niños (9%), el 66% (4/6) de los niños con menos de 750 g de peso al nacer requirió su administración para el destete del ventilador.
La sepsis tardía fue la enfermedad asociada a la broncodisplasia pulmonar más frecuente (59%) (figura 6). El 56% de estos niños tuvo una sola morbilidad asociada a la broncodisplasia pulmonar (figura 6).
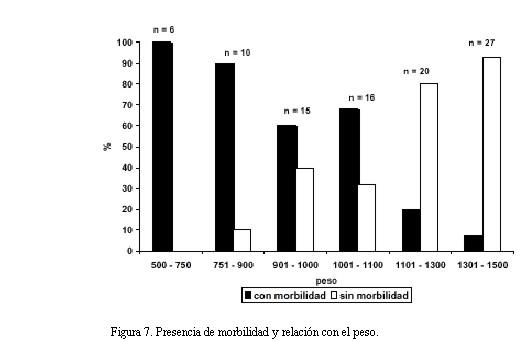
El 100% de los niños con peso al nacer entre 500-750 g (£ 26 semanas) tuvo alguna morbilidad asociada, este porcentaje decreció progresivamente; luego de los 1.100 gramos (> 28 semanas) menos del 20% de los niños presentaron alguna morbilidad asociada (figura 7).
Retinopatía del prematuro (ROP): el porcentaje de niños con diagnóstico de retinopatía del prematuro fue del 10%, todos con menos de 1.000 g de peso al nacer y menores o iguales de 28 semanas de edad gestacional al nacer (tabla 4).
Sepsis tardía: el porcentaje de niños con diagnóstico de sepsis tardía fue del 26%. Este porcentaje fue del 66% para los niños con menos de 750 gramos de peso al nacer.Los gérmenes hallados fueron: estafilococo coagulasa negativo 69%, Acinetobacter 8%, Enterobacter cloacae 8% y Candida albicans 15% (tabla 3, figura 8).
Enterocolitis necrotizante (ECN): el porcentaje fue del 1% (n=1) (tabla 3).
Ductus arterioso permeable (DAP): el porcentaje fue del 22%. Este porcentaje fue del 83% para los menores de 750 g de peso al nacer. Requirió cierre quirúrgico el 19% (cuatro de 21).
Se administró indometacina profiláctica a 30 niños; de éstos 5 (16%) presentaron ductus arterioso permeable (edad promedio en días al diagnóstico: 10 días).
De los 64 niños a los cuales no se les administró indometacina profiláctica; 18 niños (28%) presentaron ductus arterioso permeable (edad promedio en días al diagnóstico: 2,5 días) (tabla 2, figura 9).
Hemorragia intraventricular grado III-IV (HIV): el porcentaje de niños que presentó HIV grado III-IV fue del 3% (tablas 3 y 5).
Valoración del aporte calórico y del crecimiento
Todos los pacientes recibieron alimentación parenteral, el promedio de días de duración fue de 15 días. Los pacientes con menor peso al nacer la recibieron por más días y tuvieron una recuperación del peso al nacer más tardía (tabla 3).
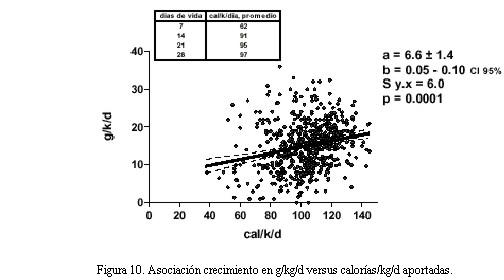
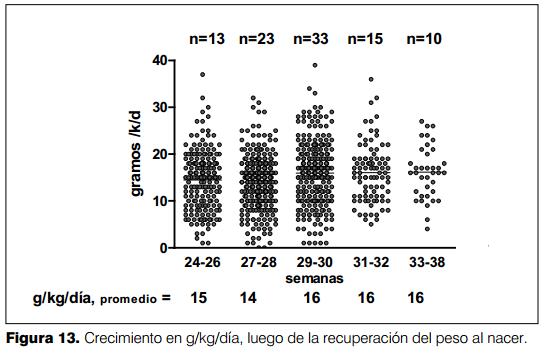
La correlación entre la velocidad de crecimiento en g/kg/día versus las calorías/kg/día aportadas fue estadísticamente significativa (CI 95%, p<0,0001), por cada caloría aportada el crecimiento en gramos fue de 0,05 a 0,10. La mayor velocidad de crecimiento se observó con aportes entre 100 a 125 cal/kg/día (figura 10).
Crecimiento
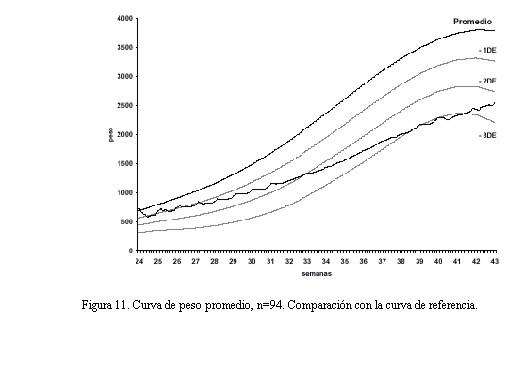
La curva de peso promedio (con relación a la curva de referencia) de los pacientes estudiados muestra que a las 42-43 semanas ésta se encuentra por debajo del percentil 10 (figura 11).
El descenso de peso máximo (promedio) ocurrió al cuarto día de vida (promedio= 4,0, DE = 0,68).
No hubo diferencias significativas a diferentes edades gestacionales.
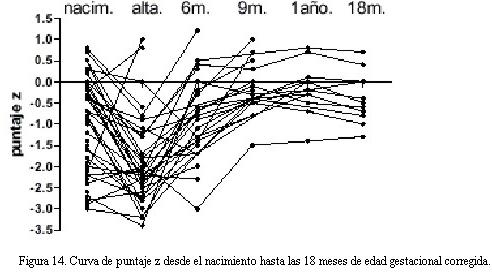
La diferencia en puntaje z promedio entre el nacimiento y el máximo descenso de peso fue de -0,72 (p < 0,01), alcanzando un puntaje z promedio a la c
uarta semana de vida posnatal de -2,2 (figura 12).
En el grupo de menor edad gestacional al nacer (< 27 semanas) el momento en que se alcanzó el máximo descenso de puntaje z fue entre la cuarta y quinta semana de vida posnatal. A medida que la edad gestacional aumenta, el valor del descenso no fue significativamente diferente, pero el tiempo en el que se alcanzó este descenso fue menor (figura 12).
Una vez que se recupera el peso al nacer, alrededor de la tercera semana de vida posnatal, la velocidad de crecimiento no tiene diferencias con la curva de referencia, pero se mantiene aproximadamente dos desvíos por debajo (figuras 11 y 12).
El promedio del crecimiento en g/kg/día, una vez estabilizado éste, fue de 14 a 16 g/kg/día (figura 13).
Cerca de las 40 semanas, el valor de z se hace cada vez menos negativo, es decir la velocidad de crecimiento es mayor que la del feto de referencia (figura 12).
Entre el alta y el año de vida la velocidad de crecimiento es muy rápida, recuperándose aproximadamente dos puntajes de desvío. Entre los 12 y 18 meses de edad gestacional corregida alcanzan el desvío normal (figura 14).
Comentarios
El porcentaje de niños prematuros con 1.500 g de peso o menos al nacer, para la población de usuarios de salud pública del Hospital de Clínicas en el período estudiado, es de 1,87%, similar a la reportada para el año 2004 en todo el país; en la AEPSM fue de 1,2% (1).
Los resultados obtenidos corresponden al análisis de un escaso número de pacientes (n=130), a pesar de lo cual encontramos datos similares a los resultados publicados por otros autores a nivel internacional que abarcan el estudio de poblaciones más numerosas (15,16).
Los datos de la literatura previos muestran un aumento progresivo de la sobrevida en todas las edades gestacionales (17-19).
En nuestro estudio las primeras 24 horas de vida son las de mayor vulnerabilidad para la supervivencia y es aquí donde encontramos el mayor porcentaje de mortalidad a menor edad gestacional y menor peso al nacer. No se observó en nuestra población sobrevida para los que tenían 23 semanas o menos de edad gestacional al nacer.
La morbimortalidad en los niños estudiados es inversamente proporcional a la edad gestacional y al peso de nacimiento, alcanzando su máximo en el grupo con menos de 750 g de peso al nacer y/o 26 semanas o menos de edad gestacional al nacer. Esto se relaciona directamente con la inmadurez de todos los sistemas que lleva a intervenciones terapéuticas más agresivas y prolongadas, así como a la aparición de complicaciones.
Se constató que todos los niños a partir de las 30 semanas de edad gestacional sobrevivieron y fueron dados de alta a domicilio sin ninguna complicación.
La depresión neonatal estuvo asociada significativamente a la mortalidad neonatal, especialmente en el grupo con menos de 1.000 g de peso al nacer. El porcentaje de uso de corticoides prenatales así como el porcentaje de nacimiento por cesárea fue significativamente bajo en estos niños.
Esto implica que frente a un feto extremadamente prematuro, especialmente con menos de 750 g de peso al nacer, se realicen todas las medidas de manejo perinatal necesarias para que nazca en las mejores condiciones. La actitud del equipo perinatal es crucial para la sobrevida de estos niños. Un manejo perinatal activo dado por el uso de corticoides prenatales, tocolíticos, antibióticos, la monitorización fetal, el parto vía cesárea, la presencia de un neonatólogo experimentado y la resucitación universal en la sala de partos previa información a los padres aumenta la chance y calidad de sobrevida de estos niños (15,16).
En estudios de seguimiento se ha encontrado que los neonatos con menos de 1.000 g de peso al nacer, cuando están libres de enfermedad severa durante la etapa neonatal, tienen un riesgo de resultado adverso a los 18 meses de edad gestacional corregida del 18% (3).
Este porcentaje se incrementa al 42% en los niños que presentan una de las tres morbilidades más frecuentes (BDP, HIV III-IV/LPV y/o ROP), al 62% si presentan dos y al 88% si presentan las tres (3).
En nuestro estudio, el 100% de los neonatos con 750 g o menos de peso al nacer (< 27 semanas) tuvo alguna morbilidad asociada, luego este porcentaje decreció progresivamente y a partir de los 1.100 g (> 28 semanas) el 80% de los niños estuvo libre de enfermedad (figura 7) (17).
Datos comparables a los publicados por Cust y colaboradores en las unidades norteamericanas y canadienses, donde el 69-72% de los niños con menos de 1.500 g de peso al nacer sobreviven al alta sin ninguna de las morbilidades mayores descriptas anteriormente (17).
La incidencia global de broncodisplasia pulmonar fue del 28%, en el grupo con menos de 750 g de peso al nacer fue del 100% y entre 751-1.000 gramos fue del 60%. La mayoría de los pacientes tuvieron una primera instancia de asistencia ventilatoria mecánica (AVM) entre 11 y 5 días respectivamente (figura 4).
El 50 y 32% de estos pacientes respectivamente requirieron una segunda instancia de AVM, ya que presentaron complicaciones como sepsis, ductus arterioso permeable y/o apneas.
La broncodisplasia pulmonar y la sepsis fueron las enfermedades más frecuentes y la asociación entre ambas fue del 59% (figura 6). De acuerdo a estos datos sería importante el planteo de nuevas estrategias para mejorar el manejo perinatal, disminuir la frecuencia de asistencia ventilatoria mecánica, utilizando más CPAP nasal inicial, al mismo tiempo que se evite la infección y se aumente el aporte calórico en las primeras semanas de vida (9).
La asociación a infección (sin meningoencefalitis) aumenta por sí sola el riesgo de retardo mental (2,20,21).
Dado que la relación riesgo-beneficio del empleo de corticoides posnatales para el tratamiento de la broncodisplasia pulmonar es controversial (afectan la mielinización y la migración neuronal), su uso fue limitado a los nueve pacientes (9%) que no se lograban destetar del ventilador (21-24).
Destacamos un estudio recientemente publicado que muestra que el uso posnatal de hidrocortisona para la broncodisplasia pulmonar no tuvo efecto adverso sobre el volumen tisular cerebral, sobre el desarrollo del hipocampo y sobre el desarrollo cognitivo a los ocho años (39).
La complicación infecciosa se encontró en el 26% de los niños. Este porcentaje aumenta a medida que disminuye el peso al nacer. Los porcentajes encontrados son similares a los descriptos por Kaufman en las unidades neonatales de EE.UU. (25-27).
En nuestro estudio, ésta predominó en las primeras tres semanas de vida, momento en que la mayoría de los niños están recibiendo alimentación parenteral.
Destacamos el bajo porcentaje de enterocolitis necrotizante encontrado. Es práctica corriente en nuestras unidades el empleo de leche humana y la administración de la alimentación oral en forma temprana y de forma continua, especialmente en los menores de 1.000 g. Esta práctica aumenta la tolerancia gastrointestinal, promueve el crecimiento y que se alcance la alimentación enteral completa en un menor tiempo (40).
Si bien los resultados obtenidos con el uso de indometacina profiláctica no son estadísticamente significativos en nuestra estudio, los niños que la recibieron tuvieron una edad al momento del diagnóstico de DAP significativamente mayor (edad promedio en días al diagnóstico: 10 días, p = 0,01), y éste estuvo asociado a un cuadro séptico (28).
El crecimiento posnatal de los pacientes prematuros con muy bajo peso al nacer ha sido motivo de múltiples estudios a lo largo de los años. A pesar de esto, aún hoy no se ha establecido una medida estándar del crecimiento extrauterino para estos niños. Los cambios de peso durante la primera semana de vida reflejan primariamente la fluctuación del agua corporal total, mientras que los cambios luego de la primera semana de vida reflejan el crecimiento en respuesta al soporte nutricional y a las prácticas médicas (29-35).
Los factores que se identifican con una mayor incidencia negativa para el crecimiento de estos pacientes, son: la severidad de la enfermedad, el uso de corticoides posnatales, y las prácticas nutricionales empleadas, sobre todo en lo que se refiere al aporte proteico (5).
En nuestro estudio se observó un descenso de peso inicial en todos los niños alrededor del cuarto día de vida promedio, dato similar a lo encontrado en la literatura (29).
Luego la velocidad de crecimiento visualizada por medio del puntaje de desvío y comparada con la del feto de referencia se encuentra francamente disminuida hasta la cuarta semana de vida, alcanzando un puntaje z de -2.2, más negativo que el descrito por Niklasson (36).
Este déficit inicial del crecimiento podría explicarse: 1) por un aporte calórico bajo en las primeras cuatro semanas de vida (no sobrepasa las 100 cal/kg/día); 2) el catabolismo aumentado de estos niños relacionado con el hecho de nacer prematuros y su morbilidad asociada.
Por lo tanto, debería ser una meta la administración temprana (en el primer día de vida) de aminoácidos y lípidos y el alcanzar las 100-120 cal/kg/día en la primera semana de vida.
Sumado a esto, debería ser un objetivo disminuir la morbilidad asociada a la prematurez.
Una vez que se recupera el peso al nacer, alrededor de la tercera o cuarta semana de vida posnatal, la velocidad de crecimiento no tiene diferencias con la curva de referencia, pero ésta se mantiene aproximadamente 2 desvíos por debajo.
Cerca de las 40 semanas el valor de z se hace cada vez menos negativo, es decir la velocidad de crecimiento es mayor que la del feto de referencia.
Destacamos aquí que la alveolización pulmonar se lleva a cabo dentro de los primeros dos años de vida. Por lo que este momento de gran velocidad de crecimiento es de suma importancia; momento en el que se deben extremar las medidas de vigilancia domiciliaria para permitir que estos niños alcancen el catch-up y disminuya la morbilidad luego del alta. Entre el alta y el año de vida la velocidad de crecimiento es muy rápida recuperándose aproximadamente dos puntajes de score de desvío. Entre los 12 y 18 meses de edad gestacional corregida alcanzan el desvío normal.
Las recomendaciones actuales para el aporte calórico varían entre 120 y 165 cal/kg/día, observándose la máxima velocidad de crecimiento con los valores cercanos al límite superior (38).
De igual manera se recomienda el inicio de la alimentación enteral en forma temprana, ya que promueve la maduración intestinal, reduce el tiempo necesario para alcanzar la alimentación enteral completa, acortando la hospitalización y previniendo infecciones graves (38).
Destacamos la importancia del momento del alta y el cuidado post alta. En la tabla 3 se muestra el peso al alta en relación a la edad gestacional y al peso al nacer. Con estos pesos no hubo reingresos precoces y el catch-up fue satisfactorio entre los 12 y 18 meses de edad gestacional corregida en los niños en los que se obtuvo el dato.
Estos resultados provienen de neonatos nacidos en el mismo lugar donde se realizó la atención perinatal, no tuvieron transporte y su atención se inició con el equipo responsable del manejo obstétrico y neonatal. Esta forma de trabajo debería incrementarse, refiriendo a la madre a maternidades que cuenten con unidad de manejo perinatal.
Agradecimientos
A todo el personal médico y de enfermería quienes hicieron posible la atención de estos niños y la obtención de los datos.
Citas bibliográficas
1. Ministerio de Salud Pública (Uruguay). Dirección General de Salud. Departamento de Información Poblacional. Estadísticas vitales. Nacimientos y tasa de mortalidad infantil, neonatal y postneonatal. Informe anual [en línea]. Montevideo : MSP, 2004. <http://www.msp.gub. uy >
2. Perlman JM. Neurobehavioral deficits in premature graduates of intensive care. Potential medical and environmental risk factors. Pediatrics 2001; 108: 1339-48.
3. Schmidt B, Asztalos EV, Roberts RS, Robertson CM, Sauve RS, Whitfield MF. Impact of bronchopulmonary dysplasia, brain injury and severe retinopathy on the outcome of extremely low-birth-weigth infants at 18months: results from the trial of indomethacin prophylaxis in preterms. JAMA 2003; 289 (9): 1124-9.
4. Hayakawa M, Okumura A, Hayakawa F, Kato Y, Ohshiro M, Tauchi N, et al. Nutritional state and growth and functional maturation of the brain in extremely low birth weight infants. Pediatrics 2003; 111(5 Pt 1): 991-5.
5. Olsen IE, Richardson DK, Schmid CH, Ausman LM, Dwyer JT. Intersite differences in weight growth velocity of extremely premature infants. Pediatrics 2002; 110(6): 1125-32.
6. Ballard JL, Khoury JC, Wedig K, Wang L, Eilers-Walsman BL, Lipp R. New Ballard Score, expanded to include extremely premature infants. J Pediatr 1991; 119(3): 417-23.
7. Wilkinson AR. Scoring Systems for neonatal illness. In: Hansen NT, McIntosh N, eds. Current topics in neonatology. London: Saunders, 1997; 2: 1-20.
8. Bell MJ, Ternberg JL, Feigin RD, Keating JP, Marshall R, Barton L, et al. Neonatal necrotizing enterocolitis. Therapeutic decisions based upon clinical staging. Ann Surg 1978; 187(1): 243-4.
9. Jobe AH, Bancalari E. Bronchopulmonary dysplasia. Am J Respir Crit Care Med 2001; 163(7): 1723-9.
10. Papile LA, Burstein J, Burstein R, Koffler H. Incidence and evolution of subependymal and intraventricular hemorrhage: a study of infants with birth weights less than 1.500 g. J Pediatr 1978; 92(4): 529-34.
11. The Stop-ROP Multicenter Study Group. Supplemental Therapeutic Oxygen for Prethreshold Retinopathy Of Prematurity (STOP-ROP), a randomized, controlled trial. I: primary outcomes. Pediatrics 2000; 105(2): 295-310.
12. Kramer M, Platt RW, Wen SW, Joseph KS, Allen A, Abrahamowicz M, et al. A new and improved population-based Canadian reference for birth weight for gestational age. Pediatrics 2001; 108(2): e35.
13. Martell M, Belitzky R, Gaviria J. Velocidad de crecimiento en niños nacidos pretermino y con bajo peso. En: Cusminsky M, Moreno EM, Suarez EN. Crecimiento y desarrollo. Washington: OPS; 1988: 164-83 (Publicación Científica Nº 510).
14. Martell M. Introducción a la metodología de la Investigación Científica. 2da ed. Montevideo: Oficina del Libro, 2003.
15. Serenius F, Ewald U, Farooqi A, Holmgren PA, Hakansson S, Sedin G. Short-term outcome after active perinatal management at 23-25 weeks of gestation. A study from two Swedish tertiary care centres. Part 2: infant survival. Acta Paediatr 2004; 93(8): 1081-9.
16. Cartlidge PH, Stewart JH. Survival of very low birthwigth and very preterm infants in a geographically defined population. Acta Paediatr 1997; 86: 105-10.
17. Cust AE, Darlow BA, Donoghue DA; Australian and New Zealand Neonatal Network (ANZNN). Outcomes for high risk New Zealand newborn infants in 1998-1999: a population based, national study. Arch Dis Child Fetal Neonatal Ed 2003; 88(1): F15-22.
18. Ho S, Saigal S. Current Survival and Early Outcomes of Infants of Borderline Viability. NeoReviews 2005; 6(3): e123-132.
19. Vohr BR, Wright L, Dusick AM, Perritt R, Poole WK, Tysom JE, et al. Center differences and outcomes of extremely low birth weight infants. Pediatrics 2004; 113(4): 781-9.
20. Stoll BJ, Hansen NI, Adams-Chapman I, Fanaroff AA, Hintz SR, Vohr B, et al. Neurodevelopmental and growth impairment among extremely low-birth-weight infants with neonatal infection. JAMA 2004; 292(19): 2357-65.
21. Barrington KJ. Postnatal steroids and neurodevelopmental outcomes: a problem in the making. Pediatrics 2001; 107: 1425-6.
22. Grier DG, Halliday HL. Management of bronchopulmonary dysplasia in infants : guidelines for corticosteroid use. Drugs 2005; 65 (1): 15-29.
23. Shinwell ES, Karplus M, Bader D, Dollberg S, Gur I, Weintraub Z, et al. Neonatologists are using much less dexamethasone. Arch Dis Child Fetal Neonatal Ed 2003; 88(5): F432-3.
24. Murphy BP, Inder TE, Huppi PS, Warfield S, Zientara GP, Kikinis R, et al. Impaired cerebral cortical gray matter growth after treatment with dexamethasone for neonatal chronic lung disease. Pediatrics 2001; 107(2): 217-21.
25. Shalak LF, Laptook AR, Sofri HS, Ramilo O, Perlman JM. Clinical choreoamnionitis, elevated cytokines, and brain injury in term infants. Pediatrics 2002; 11: 1673-80.
26. Kaufman D, Fairchild KD. Clinical microbiology of bacterial and fungal sepsis in very-low-birth-weight infants. Clin Microbiol Rev 2004; 17(3): 638-80.
27. Kilbride HW, Powers R, Wirtschafter DD, Sheehan MB, Charsha DS, LaCorte M, et al. Evaluation and development of potentially better practices to prevent neonatal nosocomial bacteremia. Pediatrics. 2003; 111(4 Pt 2): e504-18. .
28. Narayanan M, Cooper B, Weiss H, Clyman RI. Prophylactic indomethacin: factors determining permanent ductus arteriosus closure. J Pediatr 2000; 136(3):330-7.
29. Ehrenkranz RA, Younes N, Lemons JA, Fanaroff AA, Donovan EF, Wright LL, et al. Longitudinal growth of hospitalized very low birth weight infants. Pediatrics 1999; 104(2 Pt 1): 280-9.
30. Clark RH, Thomas P, Peabody J. Extrauterine growth restriction remains a serious problem in prematurely born neonates. Pediatrics 2003; 111(5 Pt 1): 986-90.
31. Radmacher PG, Looney SW, Rafail ST, Adamkin DH. Prediction of extrauterine growth retardation (EUGR) in VVLBW infants. J Perinatol 2003; 23(5): 392-5.
32. Embleton NE, Pang N, Cooke RJ. Posnatal malnutrition and growth retardation: an inevitable consequence of current recommendations in preterm infants? Pediatrics 2001; 107(2): 270-3.
33. Carlson SJ, Ziegler EE. Nutrient intakes and growth of very low birth weight infants. J Perinatol 1998; 18(4): 252-8.
34. Bloom BT, Mulligan J, Arnold C, Ellis S, Moffitt S, Rivera A, et al. Improving growth of very low birth weight infants in the first 28 days. Pediatrics 2003; 112(1 Pt 1): 8-14.
35. McClellan R, Novak D. Fetal nutrition: how we become what we are. J Pediatr Gastroenterol Nutr 2001; 33(3): 233-44.
36. Niklasson A, Engstrom E, Hard AL, Wikland KA, Hellstrom A. Growth in very preterm children: a longitudinal study. Pediatr Res 2003; 54(6): 899-905.
37. Ziegler EE, Thureen PJ, Carlson SJ. Alimentación intensiva del lactante con muy bajo peso al nacer. Clin Perinatol 2002; (2): 205-24.
38. Bersth CL. Minimal enteral feeding. Clin Perinatol 1995; 22 (1): 195-205.
39. Lodygensky GA, Rademaker K, Zimine S, Gex-Fabry M, Lieftink AF, Lazeyras F, et al. Structural and functional brain development after hydrocortisone treatment for neonatal chronic lung disease. Pediatrics 2005; 116(1): 1-7.
40. Dsilna A, Christensson K, Alfredsson L, Lagercrantz H, Blennow M. Continuous feeding promotes gastrointestinal tolerance and growth in very low birth weight infants. J Pediatr 2005; 147(1): 43-9.
Correspondencia: Dr. Miguel Martell.
Avenida Italia 2731, Apto 601. Montevideo. Uruguay.
E-mail: migale@multi.com.uy.