Services on Demand
Journal
Article
Related links
Share
Archivos de Pediatría del Uruguay
On-line version ISSN 1688-1249
Arch. Pediatr. Urug. vol.75 no.4 Montevideo Dec. 2004
ARTÍCULO ORIGINAL
Arch Pediatr Urug 2004; 75(4): 300-306
Infecciones de piel y partes blandas en pacientes ambulatorios
DRES. JAVIER PREGO 1, ÁLVARO GALIANA 2, MóNICA PUJADAS 3, KARINA ALMADA 4, MARIE BOULAY 4,
MARíA JOSé CARUGATI 4, MARIANA CASTRO 4, MARCOS DELFINO 4, BETINA FERREIRO 4, PAULA GANDARO 4,
ADRIANA IHITZ 4, ANTONIO LUSTEMBERG 4, MARIANA MAS 4, DANIELA TELECHEA 4, ROSANA PAIVA 4
1. Ex Profesor Adjunto de Pediatría. Facultad de Medicina. Coordinador del Departamento de Emergencia Pediátrica. Centro Hospitalario Pereira Rossell.
2. Ex Profesor Adjunto de Pediatría. Facultad de Medicina. Jefe del Servicio de Aislamientos Infecciosos. Clínica Pediátrica “C”. Centro Hospitalario Pereira Rossell.
3. Profesor Adjunto de Pediatría. Clínica Pediátrica “C”. Facultad de Medicina. Centro Hospitalario Pereira Rossell. Profesor Adjunto del Departamento de Medicina Preventiva y Social.
4. Residente de Pediatría. Centro Hospitalario Pereira Rossell.
Centro Hospitalario Pereira Rossell. Departamento de Emergencia Pediátrica.
Trabajo presentado en las VII Jornadas Integradas de Emergencia Pediátrica. Montevideo, Uruguay. Octubre de 2004. Premio al mejor trabajo científico.
Fecha recibido: 29 de noviembre de 2004
Fecha aprobado: 28 de diciembre de 2004
Resumen
Introducción: en la última década se ha informado a nivel mundial la emergencia de infecciones causadas por cepas de Staphylococcus aureus meticilino-resistente (SAMR) sin los factores de riesgo clásicos descritos para portar este germen, con un patrón de susceptibilidad diferente a los antibióticos y adquirido en la comunidad. En nuestro país las primeras comunicaciones de infecciones producidas por este germen fueron en el año 2001 en niños con infecciones de piel y partes blandas internados en el Centro Hospitalario Pereira Rossell (CHPR).
Objetivo: 1) Analizar las características clínicas y la etiología de las infecciones de piel y partes blandas en pacientes ambulatorios. 2) Determinar en estas infecciones la prevalencia de Staphylococcus aureus meticilino-resistente adquirido en la comunidad (SAMR-com) y su sensibilidad a los antibióticos.
Material y métodos: se realizó un estudio descriptivo, prospectivo, de pacientes que consultaron en el Departamento de Emergencia Pediátrica del CHPR por infecciones de piel y partes blandas adquiridas en la comunidad, en el período 24 de marzo de 2004 al 31 de julio de 2004, tratados en forma ambulatoria y en los que se aisló una bacteria de las muestras obtenidas para estudio bacteriológico. Se incluyeron pacientes con impétigo, forúnculo, absceso, celulitis a punto de partida cutáneo, panadizo y herida o quemadura sobreinfectada. Se analizaron datos demográficos, factores de riesgo para portar SAMR, características clínicas de los pacientes y análisis bacteriológico de los resultados de las muestras obtenidas de acuerdo al informe realizado por el Laboratorio Central del CHPR, sección Bacteriología.
Resultados: se incluyeron 297 pacientes. Los diagnósticos clínicos realizados fueron: impétigo 122 (48,4%), forúnculo 29 (11,5%), celulitis 19 (7,5%), absceso 30 (11,9%), panadizo ocho (3,2%), heridas o quemaduras infectadas seis (2,4%) y coexistencia de algunas de las anteriores 38 (15%). Se identificó Staphylococcus aureus (SA) en el 71,8% del total las infecciones, ya sea como único germen o asociado a Streptococcus pyogenes, de los cuales el 47% correspondieron a SAMR-com. En las infecciones cutáneas profundas (forúnculo, absceso y celulitis) se aisló SAMR-com en el 73% de las infecciones estafilofócicas, en tanto que en las infecciones superficiales (impétigo) estuvo presente en el 10%; diferencia estadísticamente significativa (p<0,001). Streptococcus pyogenes fue el germen más común en las infecciones superficiales (75%). En los pacientes con infecciones por SAMR-com no se encontraron los factores de riesgo para portar este germen comparándolos con los que tenían infecciones por SA sensible (p>0,10). En cuanto a la sensibilidad de SAMR-com a los antibióticos, no se informó de ningún caso de resistencia a vancomicina y trimetoprim-sulfametoxazol (TMP-SMX). Hubo un caso de resistencia a gentamicina. Ninguno tenía resistencia consititutiva a clindamicina y se observó resistencia inducible al grupo macrólidos, lincosaminas y streptograminas (MLS) en el 54%.
Conclusiones: en las infecciones cutáneas superficiales el germen más frecuente fue Streptococcus pyogenes, en tanto que en las infecciones más profundas predomina SA. El germen más frecuente, ya sea solo o asociado, en el total de las infecciones cutáneas es SA. La presencia de SAMR-com fue del 47% del total de las infecciones estafilocócicas, en tanto que en las profundas fue mayor (73%), mientras que en las superficiales tiene poca frecuencia (10%). No se detectó resistencia de SAMR-com a vancomicina ni a TMP-SMX. Uno solo fue resistente a gentamicina y no se detectó resistencia constitutiva a clindamicina. La presencia de resistencia inducible al grupo MLS fue de 54%.
Palabras clave: INFECCIONES CUTÁNEAS ESTAFILOCÓCICAS
INFECCIONES DE TEJIDOS BLANDOS
STAPHYLOCOCCUS AUREUS
RESISTENCIA A LA METICILINA
Summary
Introduction: the emergence of community-acquired methicillin-resistant Staphylococcus aureus (CA-MRSA ), without classics risk factors, with different antibiotic susceptibility patterns of community-acquired, have increased dramatically in the last decade. In 2001 the first CA-MRSA infections of skin and soft tissue in Uruguay were reported at Pereira Rossell Hospital Center (CHPR).
Objectives: 1) Analyse clinical characteristics, and etiology of outpatients with skin and soft tissues. 2) Report prevalence and antibiotic susceptibility of CA-MRSA.
Methods: this was a prospective, descriptive study in children presenting to the Pediatric Emergency Department (DEP) of CHPR with skin and soft tissues infection community-acquired, from March 24, 2004, through July 31, 2004. Outpatients received antibiotic therapy before culture results. Children presenting to the DEP with impetigo, furuncles, abscesse, cellulites, paronychia, burn and wound infections were included. Patients demographics, MRSA risk factors, clinical characteristics and culture results from Bacteriology Laboratory CHPR, were reported.
Results: 297 patients were included. The spectrum of disease observed was: impetigo 122 (48,4%), furuncles 29 (11,5%), cellulites 19 (7,5%), abscesse 30 (11,9%), paronychia 8 (3,2%), burn and wound infections 6 (2,4%) and twice of the last disease 38 (15%). Staphylococcus aureus was isolated in 71,8% alone or with Streptococcus pyogenes. CA-MRSA belong to 47%. CA-MRSA was isolated in 73% of furuncles, abscesse and cellulites, 10% impetigo (p<0,001). In surface infections 75% Streptococcus pyogenes was isolated. No significant risk factors for CA-MRSA were identified, and no significant differences in children with susceptible SA (p>0,10). All CA-MRSA were susceptible to trimethoprim-sulfamethoxazole (TMP-SMX) and vancomycin. One case was gentamicin resistance. Inducible resistance was found in: macrolids, lincosamides and streptogramines (MLS) (54%). Clindamycin constitutive resistance was not found.
Conclusions: in surface skin infections Streptococcus pyogenes was the microrganisms most frequently isolated, although SA was in deep infections. All of the skin infections SA alone or associated was the most frequently. CA-MRSA belong to 47% of skin infections, 73% were deep infections. One case was gentamicin resistance. All were susceptible to TMP-SMX and vancomycin. Clindamycin constitutive resistance was not found. 54% inducible resistence to MLS group.
Key words: STAPHYLOCOCCAL SKIN INFECTIONS
SOFT TISSUE INFECTIONS
STAPHYLOCOCCUS AUREUS
METHICILLIN RESISTANCE
Introducción
Las infecciones de piel y partes blandas en niños son causa frecuente de consulta en todas las edades y estratos sociales. Determinan enfermedades con variable nivel de gravedad, desde formas clínicas banales hasta otras graves que ponen en riesgo la vida del niño (1).
En el Centro Hospitalario Pereira Rossell (CHPR), representan en el Área de Aislamientos Infecciosos el 40% de los ingresos anuales, siendo una de las principales causas del uso de antibióticos del hospital (2).
Staphylococcus aureus (SA) y Streptococcus pyogenes (beta hemolítico del grupo A) (EBH) son los gérmenes que con mayor frecuencia determinan las infecciones de piel y partes blandas (1).
Las modificaciones en los patrones de susceptibilidad-resistencia de los gérmenes causantes de las infecciones de piel y partes blandas han generado la necesidad de modificar las pautas empíricas de tratamiento, adecuándolas a las nuevas situaciones epidemiológicas para evitar fracasos terapéuticos (3,4).
Merecen especial atención los cambios epidemiológicos suscitados en los últimos años en la susceptibilidad de SA a diferentes antibióticos.
Las primeras comunicaciones de SA meticilino resistente (SAMR) fueron realizadas hace más de 30 años (5), estableciéndose en la última década como un patógeno importante de infecciones hospitalarias (SAMR- hosp), tanto en niños como en adultos (6).
Varios factores de riesgo se han descrito para adquirir infecciones por SAMR-hosp: hospitalización en unidades de cuidado intensivo; internación hospitalaria prolongada; hemodiálisis; enfermedad subyacente severa (diabetes, cáncer, inmunodepresión); procedimientos invasivos; presencia de catéteres o prótesis; exposición prolongada o recurrente a antibióticos y contacto estrecho con personal de la salud (7).
A partir de 1990 se comunicó la emergencia de SAMR adquirido en la comunidad (SAMR-com) como un patógeno diferente, que afecta a adultos y a niños sin los tradicionales factores de riesgo descritos para la adquisición de SAMR-hosp (8,9).
Otro elemento que diferencia a SAMR-com de SAMR-hosp, es el patrón de sensibilidad-resistencia a los antibióticos. Mientras que SAMR-hosp es multirresistente, siendo sensible a la vancomicina, SAMR-com es sensible a trimetoprim-sulfametoxazol, gentamicina, vancomicina, clindamicina y en forma variable a eritromicina (10).
La resistencia de SAMR-com a la meticilina está determinada por la sustitución de la actividad enzimática de la PBP (penicillin binding proteins) por la PBP2a, la cual tiene baja afinidad por los antibióticos beta-lactámicos. La PBP2a es codificada por el gen cromosómico mecA. Este gen se encuentra en elementos genéticos, llamados casettes cromosómicos estafilocócicos (SCC), siendo el tipo IV el que se encuentra en los SAMR-com, otorgándole un mecanismo de superadaptación en la comunidad (11).
La presencia de SAMR-com en niños fue detectada en Uruguay en el año 2001 en niños internados en el Servicio de Aislamientos Infecciosos del CHPR con infecciones de piel y partes blandas (12). Desde entonces se ha producido un aumento significativo en la incidencia de infecciones por este germen en los pacientes admitidos al hospital por infecciones de piel y partes blandas. Actualmente el porcentaje de infecciones estafilocócicas por SAMR-com es más elevado que el causado por SA meticilino sensible (SAMS), llegando a 56,4% (13).
Otro aspecto a destacar de SAMR-com es el comportamiento frente a los antibióticos del grupo MLS (macrólidos, lincosamidas, streptograminas). Los porcentajes de resistencia de SAMR-com a eritromicina (macrólido) son en general mayores que los de SAMS. Las cepas de SAMR-com resistentes a eritromicina en general son sensibles a la clindamicina (lincosamida), pero presentan en porcentaje variable la denominada “resistencia inducible” a la misma (14). En los aislamientos de SAMR-com de infecciones de piel y partes blandas de pacientes admitidos en el CHPR, el porcentaje de cepas con este mecanismo de resistencia es elevado, alcanzando el 34,9% (13).
Se ha informado una mayor virulencia del SAMR-com, que produce enfermedades más severas tanto a nivel cutáneo (15) como en otras localizaciones. SAMR-com ha sido causante de neumonías graves en pacientes jóvenes, siendo causa de muerte en algunos casos (16). Esta mayor virulencia está vinculada a la presencia de la toxina “killing leucocyte” codificada por el factor Panton Valentine leukocidine (PVL), que le otorga mayor virulencia e invasividad (17).
La diseminación de esta clona en nuestra población hace posible que se instale en forma definitiva, desplazando al clásico SAMS, transformándose en la nueva “flora normal” de los individuos.
La información reciente en Uruguay sobre infecciones de piel y partes blandas en niños es a partir de pacientes admitidos al CHPR. No existen publicaciones de pacientes ambulatorios en edad pediátrica desde la emergencia de SAMR-com en nuestro país. El conocimiento de los gérmenes causantes de las infecciones cutáneas y de los patrones de susceptibilidad-resistencia en los pacientes ambulatorios, sumado a la información disponible, permitirá la elaboración de normas de tratamiento e iniciar un tratamiento empírico acorde a la nueva situación epidemiológica.
Objetivo
1) Analizar las características clínicas y la etiología de las infecciones de piel y partes blandas en pacientes ambulatorios.
2) Determinar la prevalencia de SAMR-com y su sensibilidad a los antibióticos en estas infecciones.
Material y métodos
Se realizó un estudio descriptivo prospectivo en el que se incluyeron los pacientes que consultaron en el Departamento de Emergencia Pediátrica (DEP) del CHPR durante el período desde el 24 de marzo de 2004 hasta el 31 de julio de 2004, con diagnóstico de infecciones de piel y partes blandas adquiridas en la comunidad, tratados en forma ambulatoria y en los que se aisló una bacteria de las muestras obtenidas para estudio bacteriológico.
Se consideró infección de piel y partes blandas a las siguientes entidades clínicas: impétigo, forúnculo, absceso, celulitis (a punto de partida cutáneo), panadizo y herida o quemadura sobreinfectada.
Se consideró infección adquirida en la comunidad a la infección que se presenta en un niño procedente de la comunidad, que no hubiera estado internado en las últimas 72 horas.
Los médicos residentes de pediatría del DEP-CHPR fueron los encargados de la recolección de los datos mediante ficha precodificada, de la obtención de la muestra para estudio bacteriológico (exudado de las lesiones cutáneas o de pus obtenido del drenaje de la lesión), así como de la decisión de tratamiento en forma ambulatoria.
Se analizaron las siguientes variables: datos demográficos, antecedentes previos (inmunodepresión, enfermedad crónica subyacente), convivencia con personas con infección de piel o con presencia de factores de riesgo para infección por SAMR: convivencia con personal de la salud, concurrir a guardería; internaciones, cirugía, colocación de vía venosa, catéter urinario, intubación orotraqueal o haber recibido antibióticos en los últimos seis meses.
Los resultados bacteriológicos fueron analizados de acuerdo al informe del estudio realizado en el Laboratorio Central del CHPR-Sección Bacteriología. Fueron considerados meticilino-resistentes aquellos aislamientos de SA que fueran resistentes a la oxacilina. Se consideró resistencia inducible a la clindamicina cuando ocurría una rectificación en el halo de la clindamicina cercano al disco de eritromicina (efecto D). El análisis estadístico se estableció en base a distribución de frecuencias y pruebas de significancia estadística (x2) cuando correspondiera.
Resultados
Se captaron 297 pacientes con infección de piel y partes blandas en el período considerado.
Cumplían con los criterios de inclusión 252 (52,4% varones; media de edad 5 años, rango 14 días a 14 años).
Los diagnósticos clínicos realizados fueron los siguientes: impétigo 122 (48,4%), forúnculo 29 (11,5%), celulitis 19 (7,5%), absceso 30 (11,9%), panadizo 8 (3,2%), heridas o quemaduras infectadas 6 (2,4%), coexistencia de alguna de las anteriores 38 (15%).
Los gérmenes aislados según el tipo de infección se muestran en la tabla 1.
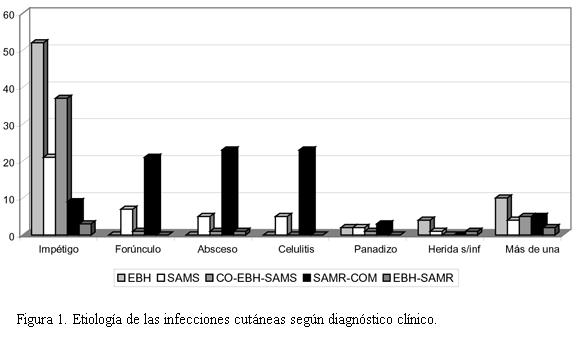
En los pacientes con impétigo, EBH se aisló en 52 (42,6%), coinfección SAMS + EBH en 37 (30,3%), SAMS en 21 (17,2%), SAMR-com en nueve (7,4%), coinfección SAMR-com + EBH en tres (2,4%). En este tipo de infección EBH (solo o asociado a otro germen) estuvo presente en 92 de 122 casos (75,4%) y SA en 70 (solo o asociado a otro germen); de éstos 58 fueron SAMS y 12 SAMR-com.En el resto de las infecciones cutáneas consideradas en conjunto (n=92) que correspondieron a forúnculo, absceso, celulitis, panadizo y heridas o quemaduras infectadas, se aisló SAMR-com en 59 casos (64,1%), SAMS en 20 (21,7%), EBH en 8 (8,6%), SAMS + EBH 3 (3,3%), SAMR-com + EBH 2 (2,2%). En estas infecciones SAMR-com estuvo presente en el 66,3%.
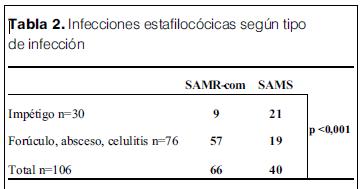
De estos resultados se evidencia que SAMR-com tiene mayor incidencia en este tipo de infecciones que en el impétigo, y si se compara infecciones superficiales (impétigo) con infecciones más profundas (forúnculo, absceso, celulitis), SAMR-com es el germen en causa más frecuente en las infecciones profundas (73%) versus 10% en las superficiales (p<0,001) (tabla 2).
En el total de las infecciones de piel y partes blandas, se identificó como agente causal a SA en 181 pacientes (71,8%), dentro de los que SAMR-com constituyó el 47%.
Dentro de los factores de riesgo analizados para adquirir infecciones por SAMR en el total de infecciones estafilocócicas, éstos se detectaron en el 73% de las causadas por SAMR-com y en el 61,4% de las originadas por SAMS. No hubo diferencia significativa entre ambos grupos (p>0,10) (tabla 3).
En cuanto a la sensibilidad a los antibióticos, no se informó resistencia en los aislamientos de EBH.
Dentro de las infecciones por SA, en los casos de SAMS la resistencia se distribuyó de la siguiente forma: resistentes a eritromicina 22 (23%), a gentamicina dos (2%). No se informó de resistencia constitutiva a clindamicina y presentaron el fenotipo de resistencia inducible cinco (5,2%). No hubo resistencia a TMP-SMX.
SAMR-com se mostró uniformemente sensible al TMP-SMX y a vancomicina. Se informó un caso de resistencia a gentamicina. La resistencia de SAMR-com a eritromicina se presentó en 50 casos (59%). No se detectó ningún caso de resistencia constitutiva a clindamicina y se observó la presencia de resistencia inducible en 46 aislamientos (54%). De los SAMR-com eritromicino-resistentes, el 92% presentaron resistencia inducible a clindamicina.
Discusión
La emergencia de SAMR-com es motivo de preocupación a nivel mundial. Sus propiedades de superadaptación a la comunidad han provocado un aumento significativo en las infecciones causadas por este germen. Además, su mayor virulencia e invasividad determinan mayor riesgo de desarrollar enfermedades graves que pueden poner en peligro la vida de los pacientes (18-24).
La presencia de SAMR-com como agente causal de infecciones de piel y partes blandas en niños ha aumentado significativamente en Uruguay. Desde que se reportaron los cuatro primeros casos en el año 2001 (en un período de 11 meses) (12), se ha registrado un aumento notorio de su incidencia como agente causal en infecciones de piel y partes blandas (85 casos en los cuatro meses de la realización del presente análisis).
En nuestro estudio se identificó la presencia de SA en el 71,8% del total de las infecciones de piel y partes blandas de los pacientes tratados en forma ambulatoria, de los que el 47% correspondió a SAMR-com.
En los pacientes admitidos al hospital por infecciones de piel y partes blandas en el Área de Aislamientos Infecciosos del CHPR el porcentaje de infecciones estafilocócicas por SAMR-com es algo mayor, encontrándose en el 56,4% de los casos (13).
Considerando la etiología según las diferentes presentaciones clínicas, se observó que en el impétigo, el EBH sigue siendo el agente predominante; por otra parte en los casos de coinfección con SA se trata en su amplia mayoría de SAMS (37 versus 3 de EBH + SAMR-com). SAMR-com se aisló como agente único en nueve casos solamente.
Los forúnculos, abscesos y celulitis, en cambio, resultaron causados predominantemente por SAMR-com (73%). Esta diferencia entre infecciones cutáneas superficiales e infecciones cutáneas más profundas resultó estadísticamente significativa, hecho que debe tenerse en cuenta al decidir el tratamiento de este tipo de lesiones, lo que se muestra en la figura 1.
Aunque en las infecciones causadas por SAMR-com se detectaron varios de los factores de riesgo mencionados para la adquisición de SAMR (7), estos pacientes no presentaron diferencias significativas con respecto a los pacientes con infecciones causadas por SAMS.
Si bien en muchos casos es suficiente el tratamiento local y/o el drenaje quirúrgico (25), cuando se decide iniciar un tratamiento con antibióticos en forma empírica debe tenerse en cuenta el patrón de sensibilidad de los posibles agentes involucrados. Varios autores informan que en el huésped normal con infecciones superficiales por SA, el rol del tratamiento con antibióticos para su resolución probablemente no sea tan importante como lo es para las infecciones invasivas (26).
En nuestra serie las cepas aisladas de SAMR-com fueron sensibles al TMP-SMX, gentamicina y vancomicina.
Aunque no se detectó resistencia constitutiva a clindamicina, debe tenerse en cuenta la presencia del fenotipo de resistencia inducible. Este efecto estuvo presente en 54% de los casos.
La clindamicina es uno de los agentes de primera línea para el tratamiento presuntivo de infecciones estafilocócicas cuando la prevalencia de SAMR-com es elevada en determinada comunidad, como sucede en las infecciones de piel y partes blandas en niños asistidos en el CHPR (27,28).
Cuando está presente el fenotipo de resistencia inducible al grupo MLS, en ocasiones puede desarrollarse rápidamente resistencia a clindamicina en el curso del tratamiento y llevar a falla terapéutica. Algunos autores sugieren que ante cepas de SAMR-com eritromicino-resistentes y clindamicino-susceptibles no debe utilizarse la clindamicina en caso de infecciones severas hasta que el laboratorio informe la presencia o ausencia de resistencia inducible al grupo MLS. En enfermedades poco severas, en las cuales probablemente el tratamiento no vaya a ser prolongado, la clindamicina es una opción válida con probabilidad de pocas fallas terapéuticas. De todas formas debe disponerse rápidamente el informe de resistencia inducible y, de estar presente, el clínico debe tener en cuenta esta situación y estar alerta ante una eventual falla terapéutica. En cambio, ante situaciones clínicas de infección grave o ante un tratamiento que se asume sea prolongado, la utilización de la clindamicina es desaconsejada, recomendándose utilizar antibióticos que no presenten resistencia (TMP-SMX, vancomicina) (14,26,29,30).
En nuestra serie se detectó que el 54% de cepas de SAMR-com presentaban el mecanismo de resistencia inducible a la clindamicina. Los porcentajes de este mecanismo de resistencia en diferentes comunidades varían ampliamente, desde mínimos porcentajes hasta 93% (26).
Es de fundamental importancia que el laboratorio de bacteriología informe la presencia o ausencia de la resistencia inducible al grupo MLS en las infecciones por SAMR-com que sean eritromicino-resistentes.
Los pediatras deben tener un alto índice de sospecha de SAMR-com en niños con infecciones presumiblemente estafilocócicas que están severamente enfermos, en los que falló el tratamiento con antibióticos beta-lactámicos o que presentan infecciones recurrentes. En estas situaciones deben realizarse estudios bacteriológicos en forma sistemática.
Conclusiones
En los pacientes con infecciones de piel y partes blandas asistidos en forma ambulatoria el impétigo fue la forma clínica de presentación más frecuente. En ésta, el EBH como agente único o asociado a SAMS fue el germen con mayor prevalencia. SAMR-com es un agente poco frecuente en el impétigo.
En el total de las infecciones cutáneas, el porcentaje de SA fue de 71,8% y de éstas SAMR-com constituyó el 47%.
En las infecciones más profundas (forúnculo, absceso, celulitis), el germen más frecuente fue SA (97,4%), de los cuales el 73% fueron SAMR-com.
En las infecciones por SAMR-com no se presentaron factores de riesgo para infección por SAMR diferentes a los encontrados en las infecciones por SAMS.
En las infecciones por SAMR-com no hubo resistencia a TMP-SMX ni vancomicina, informándose un solo aislamiento resistente a gentamicina. No se detectó resistencia constitutiva a clindamicina, y resistencia inducible al grupo MLS estuvo presente en el 54%.
Agradecimientos
A la Dra. Gabriela Algorta y a todo el equipo técnico de Laboratorio Central del CHPR, Sección Bacteriología.
Bibliografía
1. Melish ME. Staphylococcal infections. En: Feigin R, Cherry J. Pediatric Infectious Diseases. 3 ed. Philadelphia: Saunders; 1992: 1240-67.
2. Uruguay. Centro Hospitalario Pereira Rossell. Servicio Informático. Sistema de Información Hospitalaria. Montevideo: CHPR, 2004.
3. Lowy F. Staphylococcus aureus infections. N Engl J Med 1998; 339(8): 520-32.
4. Bratcher D. Methicillin-resistant Staphylococcus aureus in the community. Pediatr Infect Dis J 2001; 20: 1167-8.
5. Barrett FF, McGehee RF, Finland M. Methicillin-resistant Staphylococcus aureus at Boston City Hospital. N Engl J Med 1968; 279: 441-8.
6. Speller DCE, Johnson AP, James D, Marples RR, Charlett A, George RC. Resistance to methicillin and other antibiotics in isolates of Staphilococcus aureus from blood and cerebrospinal fluid, England and Wales, 1989-95. Lancet 1997; 350: 323-5.
7. Sattler CA, Mason EO Jr, Kaplan SL. Prospective comparison of risk factors and demographic and clinical characteristics of community-acquired, methicillin-resistant versus methicillin-susceptible Staphylococcus aureus infection in children. Pediatr Infect Dis J 2002; 21: 910-7.
8. Boyce JM. Are the epidemiology and microbiology of methicillin-resistant Staphylococcus aureus changing? JAMA 1998; 279: 623-4.
9. Herold BC, Immergluck LC, Maranan MC, Lauderdale DS, Gaskin RE, Boyle-Vavra S, et al. Community-acquired methicillin-resistant Staphyloccocus aureus in children with no predisposing risk. JAMA 1998; 279: 593-8.
10. Hussain FM, Boyle-Vavra S, Baethel CD, Daum RS. Current trends in community-acquired methicillin-resistant Staphylococcus aureus at a tertiary care pediatric facility. Pediatr Infect Dis J 2000; 19: 1163-6.
11. Georgopapadakou NH. Penicillin-binding proteins and bacterial resistance to B-lactams. Antimicrob Agents Chemoter, 1993; 37(10): 2045-53.
12. Galiana A. Infección por Staphylococcus aureus meticilino resistente adquirido en la comunidad. Arch Pediatr Urug 2003; 74(1): 26-9.
13. Galiana A, Pujadas M, Ferreiro B, Lustemberg A, Telechea D, Kenny J, et al. Infecciones de piel y partes blandas en Área de Aislamientos Infecciosos-CHPR. Mesa redonda: Infecciones Estafilocócicas. Congreso Uruguayo de Pediatría Ambulatoria y Social, 2; Congreso Uruguayo de Lactancia Materna, 2. 2004 set. 1-4; Montevideo, Uruguay.
14. Frank AL, Marcinak JF, Mangat PD, Tjhio JT, Kelkar S, Schreckenberger PC, et al. Clindamycin treatment of methicillin-resistant Staphyloccocus aureus infections in children. Pediatr Infect Dis J 2002; 21(6): 530-4.
15. Eady EA, Cove JH. Staphylococcal resistance revisited: community-acquired methicillin-resistant Staphylococcus aureus. An emerging problem for the management of skin and soft tissue infections. Curr Opin Infect Dis 2003; 16(2): 103-24.
16. Johnston BL. Methicillin-resistant Staphylococcus aureus as a cause of community-acquired pneumonia-a critical review. Semin Respir Infect 1994; 9(3): 199-206.
17. Dufour P, Gillet Y, Bes M, Lina G, Vandenesch F, Floret D, et al. Community-acquired methicillin-resistant Staphylococcus aureus infections in France: emergence of a single clone that produces Panton-Valentine leucocidin. Clin Infect Dis 2002; 35: 819-24.
18. Simor AE, Ofner-Agostini M, Bryce E, Green K, McGeer A, Mulvey M, et al. The evolution of methicillin-resistant Staphylococcus aureus in Canadian hospitals: 5 years of national surveillance. CMAJ 2001; 165(1): 21-5.
19. Groom AV, Wosley DH, Naimi TS, Smith K, Johnson S, Boxrud D, et al. Community-acquired methicillin-resistant Staphylococcus aureus in a rural American Indian community. JAMA 2001; 286(10): 1201-5.
20. Bukharie HA, Abdelhadi MS. The epidemiology of methicillin-resistant Staphylococcus aureus at Saudi university hospital. Microb Drug Resist 2001; 7(4): 413-6.
21. Fergie JE, Puracell K. Community-acquired methicillin-resistant Staphylococcus aureus infections in South Texas children. Pediatr Infect Dis J 2001; 20: 860-3.
22. Blanc DS, Pittet D, Ruef C, Widmer AF, Muhlemann K, Petignat C, et al. Epidemiology of methicillin-resistant Staphylococcus aureus: results of a nation-wide survey in Switzerland. Swiss Med Wkly 2002; 132: 223-9.
23. Dietrich DW, Auld DB, Mermel LA. Community-acquired methicillin-resistant Staphylococcus aureus in Southern New England children. Pediatrics 2004; 113(4): e347-52.
24. Fang YH, Hsueh PR, Hu JJ, Lee PI, Chen JM, Lee CY, et al. Community-acquired methicillin-resistant Staphylococcus aureus in children in northern Taiwán. J Microbiol Inmunol Infect 2004; 37(1): 29-34.
25. Lee MC, Ríos A, Aten M, Mejías A, Cavuoti D, McCracken G, et al. Management and outcome of children with skin and soft tissue abscesses caused by community-acquired methicillin-resistant Staphylococcus aureus. Pediatr Infect Dis J 2004; 23(2): 123-7.
26. Martinez-Aguilar G, Hammerman WA, Mason EO, Kaplan SL. Clindamycin treatment of invasive infections caused by community-acquired methicillin-resistant end methicillin-susceptible Staphylococcus aureus in children. Pediatr Infect Dis J 2003; 22: 593-8.
27. Marcinak JF, Frank AL. Treatment of community-acquired methicillin-resistant Staphylococcus aureus in children. Curr Opin Infect Dis 2003; 16(3): 265-9.
28. Barlett JG. Antibiotic selection for infections involving methicillin-resistant Staphylococcus aureus. www.medscape.com/viewprogram/3124_pnt. 13 screens. Visitado 17/06/04.
29. Panagea S, Perry JD, Gould FK. Should clindamicyn be used as treatment of patients with infections caused by erythromycin-resistant staphylococci? J Antimicrob Chemoter 1999; 44: 581-2.
30. Siberry GK, Tekle T, Carroll K, Dick J. Failure of clindamycin treatment of methicillin-resistant Staphylococcus aureus expressing inducible clindamycin resistance in vitro. Clin Infect Dis 2003; 37(9): 1257-60.
Correspondencia: Dr. Javier Prego.
Hermanos Ruiz 3427. Montevideo, Uruguay
E-mail: jotapre@adinet.com.uy