Services on Demand
Journal
Article
Related links
Share
Archivos de Pediatría del Uruguay
Print version ISSN 0004-0584On-line version ISSN 1688-1249
Arch. Pediatr. Urug. vol.75 no.3 Montevideo Sept. 2004
ARTÍCULO ORIGINAL
Arch Pediatr Urug 2004; 75(3): 212-219
Broncodilatación en niños preescolares: fenoterol comparado con la asociación de fenoterol y bromuro de ipratropium.
Efectos sobre la mecánica pulmonar
DRES. PAUL ESTOL HAYWARD 1, ANíBAL CAPANO 2, MARíA JULIA SARáCHAGA 3, SILVIA BREA 4
Resumen
En datos previos no controlados se observó mayor frecuencia de respuestas paradojales al administrar fenoterol (F) a niños menores de 6 años en comparación con bromuro de ipratropium combinado con fenoterol (BF).
Objetivos: comparar la respuesta espirométrica a F y BF en este grupo de edad.
Metodología: en niños de 0 a 5 años, enviados para estudio de función respiratoria por antecedentes de obstrucción bronquial, con una resistencia inspiratoria (Ri) de la vía aérea basal >p90 de la normalidad, determinado por espirometría dinámica, se administró F (fenoterol 400 µg), o BF (ipratropium 80 µg + fenoterol 200 µg) con inhalocámara provista de máscara, en forma randomizada. A los 10 minutos se realizó una segunda determinación de Ri. Se consideró como respuesta positiva la reducción de la Ri en forma significativa (prueba de T) en relación al estudio basal, y respuesta paradojal al incremento significativo de la Ri. En función de los datos previos, se calculó un n de 232 niños por grupo de tratamiento (alfa=00,5 y beta=0,20).
Resultados: se estudiaron finalmente 472 niños, 232 en el grupo BF y 240 en el F. No se observaron diferencias significativas de relevancia en la composición de los grupos. El grupo BF presentó una frecuencia de respuesta positiva de 65,9% y el F de 62,9% (ns). En el grupo BF se observó una frecuencia de respuesta paradojal del 9,9% y en el F del 11,74% (ns). La única diferencia significativa demostrada fue un incremento de la frecuencia cardiaca mayor en el grupo F (+21,8%) comparada al grupo BF (+13,7%) (t=5,83 p<0,0001).
Conclusión: no existieron diferencias espirométricas en la respuesta inmediata a la broncodilatación con F o con BF medida mediante espirometría dinámica en niños menores de 6 años.
Palabras clave: ASMA-quimioterapia
AGENTES BRONCODILATADORES
-uso terapéutico
TESTS DE FUNCION RESPIRATORIA
RESISTENCIA DE LAS VIAS
RESPIRATORIAS
1. Consultorio de Función Respiratoria.
2. Pediatra Hospital de Dolores, Soriano.
3. Profesor Agregado Clínica Pediátrica “C”.
4. Policlínica Neumológica del Centro Hospitalario Pereira Rossell.
Trabajo realizado en el Consultorio de Función Respiratoria, y la Policlínica Neumológica del Centro Hospitalario Pereira Rossell.
Fecha recibido: 7 de mayo de 2004
Fecha aceptado: 26 de agosto de 2004
Summary
In previous non controlled data, we observed an increased frequency of paradoxical responses when Fenoterol (F) was administered to children < 6 years age as compared to a combination of fenoterol and ipratropium B (BF).
Objectives: to compare the spirometric response to BF as compared to F in this age group.
Methods: children 0-5 years referred for respiratory function determination due to a preceding bronchial obstruction, which presented with inspiratory airway resistance (Ri)= > than p90 of normal range as determined by dynamic spirometry. In each case, F (fenoterol 400 µg), or BF (ipratropium 80 µg + fenoterol 200 µg was administered in a randomized fashion, with a spacer provided with a face mask. Ten minutes later, a second Ri determination was performed. A positive response was considered when Ri decreased as compared to basal study (Student test), paradoxical response was considered when a significant increase of the Ri was evidenced. In function of our previous data, an alpha value = 0,05 and a beta value = 0,20, n was estimated in 232 children for each treatment group.
Results: 472 patients were studied, 232 in BF group and 240 in F group. No relevant significant differences were observed in group composition. Group BF evidenced a positive response in 65,9% of the cases and group F in 62,9% (ns). Group B evidenced 9,9% of paradoxical response whereas group F 11,7% (ns). The only significant difference was a greater increase in heart rate in group F (+21,8%) as compared to group BF (+13,7%) (T=5,83 p<0,0001).
Conclusions: no differences were evidenced in immediate bronchodilator response to BF or F in children less than 6 years as assessed by dynamic spirometry.
Key words: ASTHMA-drug therapy
BRONCHODILATOR AGENTS
-therapeutic use
RESPIRATORY FUNCTION TESTS
AIRWAY RESISTANCE
Introducción
En pediatría el uso de broncodilatadores inhalados (beta 2) ha experimentado un sostenido incremento en el mundo desarrollado desde la década de los ochenta (1), y en menor medida en la población general en Uruguay (2). Este incremento se ha acompañado de una mayor familiarización con su acción, a la vez que sus efectos colaterales indeseables se han hecho mejor conocidos. Desde el año 1987 se ha descrito la llamada “respuesta paradojal” a los broncodilatadores en niños tanto por sus efectos funcionales (3), como por sus efectos sobre la oxigenación (4). Consiste en un empeoramiento clínico o funcional del paciente luego de la administración del fármaco broncodilatador. Ha sido descrita también por Hellinckx y colaboradores (5) en niños y adolescentes con fibrosis quística que reciben salbutamol inhalado, así como por Yuksel y Greenough en niños nacidos prematuros, tratados con bromuro de ipratropium (6) o con salbutamol (7). Estos autores describen una respuesta paradojal temprana (primeros 5 minutos) con la administración de salbutamol por nebulización, pero no cuando se administra por inhalador presurizado (8). En la experiencia de nuestro grupo hemos observado la ocurrencia de una respuesta paradojal en alrededor de 10% de los niños menores de 6 años (datos no publicados), manifiesta como un incremento significativo de la resistencia inspiratoria medida por espirometría dinámica a los 10 minutos de administrado un broncodilatador mediante inhalador presurizado. En un análisis retrospectivo (no controlado) de dichos pacientes, apreciamos que la respuesta paradojal fue más frecuente en los niños a quienes se suministró fenoterol (17%) que en los que se utilizó una combinación de fenoterol + bromuro de ipratropium (8%) (datos no publicados).
El objetivo del presente trabajo es demostrar en niños menores de 6 años con historia de broncoespasmo y evidencias de obstrucción por medida de resistencia inspiratoria, que la respuesta paradojal es más frecuente con la administración de fenoterol como droga única, que cuando el fenoterol es asociado con bromuro de ipratropium.
Material y métodos
Se diseñó un estudio prospectivo, controlado y randomizado (conociendo el técnico y el acompañante la droga utilizada), comparando la respuesta espirométrica al fenoterol (F), con la respuesta a la asociación de fenoterol + bromuro de ipratropium (BF), administrados mediante inhalador presurizado con inhalocámara.
El número de casos a incluir en cada grupo para demostrar la diferencia de frecuencia de respuesta paradojal observada en nuestro estudio previo (8 a 17%), con una potencia (alfa) de 0,05 y un error beta de 0,20, es de 232 casos en cada grupo.
Fueron incluidos en el estudio niños de 0 a 5 años inclusive, que siendo referidos a nuestro laboratorio para estudio, presentaran como antecedente crisis de obstrucción bronquial recidivante o neumonía, sin otras patologías. Durante el estudio realizado en condiciones basales presentaron una resistencia inspiratoria (Ri), igual o mayor al p90 de la normalidad según patrones publicados por nuestro grupo (9). Se tomó sólo la Ri como parámetro de referencia, pues los niños menores de un año presentan una resistencia espiratoria aumentada secundaria a un frenado glótico espiratorio fisiológico, como estrategia de conservación del volumen residual funcional (9). En el momento de comprobar la Ri >p90, se asignaba el tratamiento a F o BF mediante un sistema de tarjetas en sobre cerrado numerado, generado por una tabla de números aleatorios. El operador y el familiar del niño conocían la droga a administrar. Se estudiaron los niños con ligera sedación con midazolam nasal (0,25 mg/kg) realizada 10 minutos previos al estudio. En todos los casos los niños se hallaban despiertos, sentados en brazos de su madre o padre o en un sillón cómodo, con posa brazos, y generalmente jugando durante el estudio. Se colocó una sonda de alimentación (Rusch Nº 2) nasoesofágica (tercio inferior de esófago), lubricada con lidocaína viscosa, luego de administrar anestesia tópica en una fosa nasal con spray de lidocaína al 2%. Se comprobó la correcta posición del catéter mediante prueba de oclusión inspiratoria.
Mediante espirometría dinámica se determinó la Ri (media, desvío estándar y número de ciclos), según técnica previamente descrita (9-11) en condiciones basales y 10 minutos después de administrar el broncodilatador. Debido a la asociación de los valores de Ri con el peso corporal (9), donde los niños más pequeños poseen mayor Ri que los más grandes, se representó el valor de Ri como valor relativo (%) al valor del p90 de los niños normales para su peso (Ri% p90).
Ri%p90 = 100 * (Ri - Ri p90) / Ri p90
En todos los casos se monitorizó a los niños con un saturómetro Criticare 505, se determinó el valor de saturación de Hb (respirando al aire) y de frecuencia cardiaca en los dos minutos previos al estudio basal y 10 minutos posmedicación (broncodilatación).
Como drogas broncodilatadoras se administraron cuatro disparos de fenoterol (F) (400 µg) o cuatro disparos de una combinación de fenoterol (200 µg )+ bromuro de ipratropium (80 µg) (BF), utilizando una inhalocámara Babyhaler con un volumen de 300 ml, provista de máscara facial de látex, con intervalo de 30 segundos entre cada disparo y con el niño respirando tranquilo por la nariz.
Las respuestas se clasificaron de acuerdo al cambio de Ri al comparar el valor posbroncodilatador con el valor basal aplicando prueba de T para muestras independientes, de dos colas, con un valor de significación de 0,05. Se consideraron positivas cuando la Ri posbroncodilatador se redujo en forma significativa, paradojal el incremento significativo de Ri, y negativa la falta de cambios significativos.
Las variables discontinuas se compararon mediante la prueba de Chi cuadrado. Las variables continuas se compararon mediante prueba de T para variables independientes.
En todos los casos se le explicó al acompañante (padre o madre u otro) la técnica del procedimiento, así como las precauciones y cuidados a tomar. El procedimiento (la espirometría dinámica) es una técnica estandarizada utilizada de rutina en la exploración funcional respiratoria en los niños menores de 6 años en nuestro medio desde el año 1992, el que fuera solicitado por neumólogo tratante en todos los casos. Las medicaciones utilizadas (cualquiera de las dos) y las dosis son de uso rutinario y protocolizado en el estudio de la respuesta a broncodilatadores en los niños.
Resultados
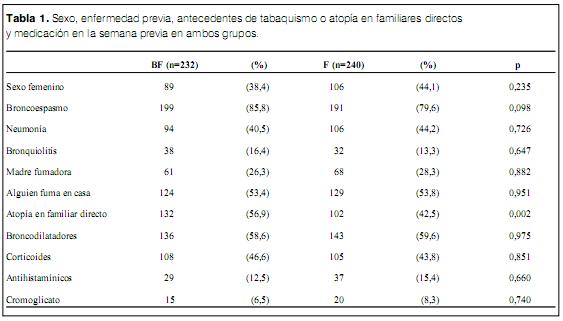
En total se estudiaron 472 niños en el período comprendido entre diciembre de 1996 y octubre de 1999. Fueron randomizados al grupo BF 232 niños y al F 240. No se observaron diferencias en la distribución de sexos, enfermedad respiratoria previa, madre fumadora o la presencia de algún fumador en el domicilio (tabla 1). Se observó una mayor frecuencia de enfermedad atópica en algún familiar directo (madre-padre o hermanos) en el grupo BF (56,9%) que en el F (42,5%) p<0,002 (tabla 1). No se observaron diferencias entre los grupos en el uso de medicación antiasmática en la semana previa al estudio (tabla 1).
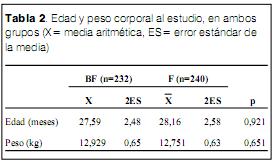
La edad al realizar el estudio estuvo comprendida entre los 2 y los 71 meses cumplidos, con una edad media de 27,6 2,4 (X 2ES) (media aritmética 2 errores estándar) en el grupo BF y 28,2 2,6 en el F, diferencias no significativas (tabla 2). El peso corporal al realizar el estudio estuvo comprendido entre los 2,5 y los 32,6 kg, con 12,9 0,65 (X 2ES) en el grupo BF y de 12,8 0,63 en el grupo F, diferencias no significativas (tabla 2).
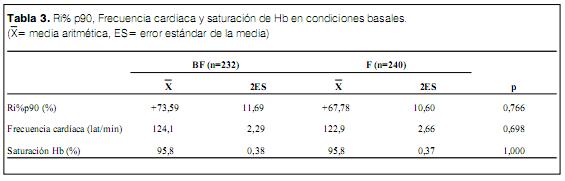
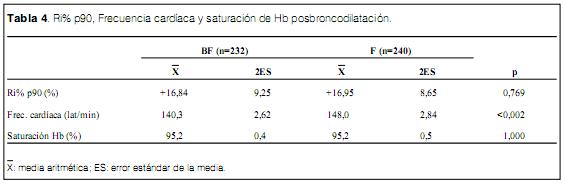
La Ri% p90 (Ri como valor relativo al valor del p90 de los niños normales) basal fue de +73,59 11,69% en el grupo BF y de +67,78 10,60% en el grupo F (ns). De la misma forma no se evidenciaron diferencias significativas en la frecuencia cardiaca y la saturación de Hb en condiciones basales previo al estudio (tabla 3).
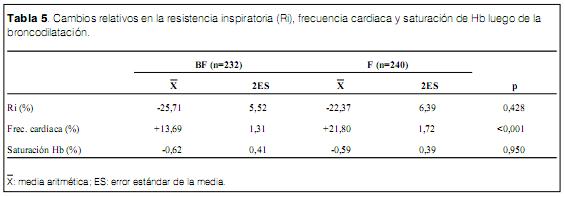
Luego de 10 minutos de administrar el broncodilatador, la Ri% p90 se redujo a +16,84 9,25 en el grupo BF y a +16,95 8,65 en el grupo F, no evidenciando diferencias (ns) entre los grupos (tabla 4). La saturación de Hb fue de 95,2 0,4% en el grupo BF y de 95,2 0,5% en el grupo F (ns). Se observó una diferencia significativa en la frecuencia cardiaca posbroncodilatación con 140,3 2,62 en el grupo BF y de 148,0 2,84 en el grupo F (t=3,09 p<0,002) (tabla 4) implicando un incremento de 13,7% en el grupo BF y de 21,8% en el grupo F, relativos al valor basal (tabla 5).
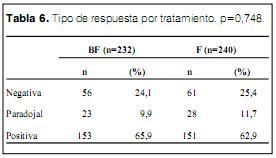
Se observó una respuesta positiva (reducción significativa de Ri relativo al valor basal) en 153 casos del grupo BF (65,9%) y en 151 casos del grupo F (62,9%) (ns). Se observó una respuesta paradojal (incremento significativo de la Ri) en 23 casos del grupo BF (9,9%) y en 28 casos del grupo F (11,7%), (ns) (tabla 6).
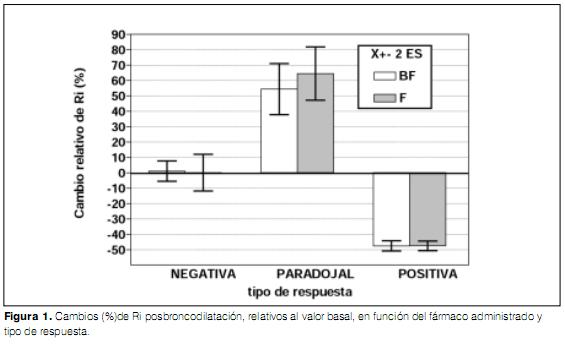
Los niños con respuesta positiva redujeron la Ri 47% en ambos grupos (figura 1), mientras que los que presentaron una respuesta paradojal incrementaron la Ri entre 54 y 59%. No se observaron diferencias significativas en la magnitud de los cambios en la Ri por tipo de respuesta y por tratamiento (figura 1).
Discusión
No fue posible demostrar una diferencia significativa en la frecuencia de respuesta paradojal entre los dos grupos de tratamiento a pesar de haber diseñado el estudio para detectar una diferencia del 9%, con una potencia de 0,80. Los grupos aparentan estar bien aleatorizados, dadas las mínimas diferencias en la constitución (sólo una mayor frecuencia de enfermedades atópicas en familiares directos de los niños del grupo BF). La diferencia de frecuencia en reacción paradojal observada entre el grupo BF y el F fue de 1,8%, lo cual desde el punto de vista clínico posiblemente no posea ninguna importancia, aun en el caso de no ser debida al azar. Los niños de este estudio poseían en el momento del estudio basal una obstrucción de la vía aérea demostrada en la espirometría basal (una Ri entre un 60 y 70% mayor al p90 del observado en niños sanos) (9).
La ocurrencia de una respuesta paradojal entre el 10 y el 12% de la población de niños menores de 6 años está, sin embargo, en concordancia con nuestras observaciones previas no publicadas. Yuksel (7) describe una respuesta paradojal en 4 casos de 15 niños nacidos prematuros (26%) con una edad postnatal de 6 a 24 meses. Administró salbutamol mediante nebulización y midió la resistencia de la vía aérea mediante pletismografía. Hellinckx describe la ocurrencia de reacción paradojal al salbutamol en 2 de 20 (10%) niños fibróticos quísticos en quienes determinó la resistencia de la vía aérea por pletismografía, pero en 6/20 (30%) de la misma población cuando midió la respuesta mediante la medida del Fev1s (volumen espirado forzado en 1 segundo) (5). Este autor y con esta misma población no logra evidenciar una respuesta paradojal cuando hace la determinación de resistencia de la vía aérea mediante una técnica oscilométrica. La respuesta paradojal en los primeros cinco minutos se refiere como más frecuente cuando se administra el salbutamol por nebulización que cuando se administra por inhalador presurizado (8). Asimismo se ha asociado la caída de saturación postadministración de salbutamol a la acidez de la preparación para nebulizar (12). Yuksel describe una respuesta paradojal mediante medida de resistencia en tres prematuros de 20 (15%) en quienes administró bromuro de ipratropium como broncodilatador a una edad de 6 a 16 meses (6). Prácticamente todos los autores que describen una respuesta paradojal miden la resistencia de la vía aérea por pletismografía, solamente Hellynckx describe respuestas paradojales con espiración forzada (5).
Este trabajo tiene la importancia de demostrar en este grupo de población de niños preescolares una respuesta positiva a la broncodilatación en más de 60% de los casos, en forma independiente de la droga utilizada, y que dicha respuesta implicó una reducción de la Ri mayor a un 40% del valor basal. Las reacciones paradojales con ambos tratamientos fueron de similar frecuencia, así como de similar magnitud (incremento de Ri del orden 54-59%).
La respuesta a los broncodilatadores en niños preescolares, y sobre todo en niños menores a un año, es motivo de discusión (13), habiendo autores que no logran demostrar una respuesta positiva (12,14), evidenciando incluso un incremento de la resistencia medida por oclusión en todo el grupo tratado (14). Otros autores describen un efecto beneficioso utilizando la medida de la resistencia en niños sibilantes menores de dos años (15) en menores de tres años, midiendo la resistencia inspiratoria por oclusión (16), o en niños con fibrosis quística mediante la determinación del VmaxFrc (flujo máximo espiratorio a capacidad residual) (17). El efecto beneficioso mejor descrito en los niños sibilantes pequeños es la protección contra la obstrucción inducida por las pruebas de provocación bronquial con agua destilada (18), metacolina (19) o histamina (20). Creemos que esta variabilidad en las respuestas está basada en tres aspectos de tipo metodológico: 1) existe una diferente capacidad diagnóstica de respuesta a los broncodilatadores con los diferentes métodos utilizados (21), describiéndose mayor capacidad con la medida de la resistencia de la vía aérea por pletismografía, comparada con la medida de resistencia por interrupción u oscilación; 2) al no existir una protocolización con estandarización de los métodos, es probable que los resultados no sean directamente comparables entre sí; 3) la mayoría de los autores reportan los resultados como medias de grupos, no clasificando las respuestas individuales en cada paciente, por lo que al agrupar niños con respuesta positiva junto con niños con respuesta paradojal, la media hallada puede ser una falta de respuesta.
Los resultados obtenidos en el presente estudio, sugieren que la determinación de la Ri por espirometría dinámica en la forma descrita, permite la evaluación de la respuesta a broncodilatadores en niños preescolares en forma confiable y sencilla de realizar. El procedimiento es bien tolerado por los pacientes, no requiriendo más que una ligera sedación. La exploración de respuesta espirométrica a los broncodilatadores se ha constituido en un paso importante en el estudio de todo niño en que se plantee un tratamiento a mediano o largo plazo con este tipo de medicación.
Es de destacar que en los niños a quienes se administró bromuro de ipratropium + fenoterol (BF) el incremento de frecuencia cardiaca (+13,6%) fue significativamente menor al observado con el uso de fenoterol aislado (+21,8%), lo cual podría constituir una ventaja a tomar en cuenta al decidir por una u otra forma de tratamiento. Yuksel (22) describe un incremento de la dispersión del intervalo QT al administrar una dosis estándar de albuterol neubulizado en comparación de una menor dosis de albuterol asociado con bromuro de ipratropium en 29 niños menores de dos años, a pesar de obtener similar respuesta clínica. Dicho autor sugiere que la combinación de anticolinérgicos con beta 2 agonistas podría ser una terapéutica más segura que la de utilizar altas dosis de beta 2 agonistas en lo que respecta al potencial arritmogénico en los niños sibilantes.
Rodrigo y Rodrigo (23), así como Plotnick y colaboradores (24) en recientes revisiones sobre el uso de anticolinérgicos asociados a beta 2 agonistas exponen las evidencias publicadas acerca de la superioridad de la combinación referida al ser comparada con los beta 2 agonistas aislados en el tratamiento de la crisis de obstrucción bronquial aguda en pediatría. Este efecto es más evidente cuando la administración se realiza en dosis múltiples. El beneficio demostrado consiste en un menor número de internaciones (sobre todo en la crisis severa), evitando la internación de 1 cada 12 niños tratados con la combinación de drogas, así como una modesta mejoría en los valores espirométricos. Ésta, sin embargo, no es una visión unánime existiendo estudios randomizados recientes que no logran demostrar un efecto beneficioso de la asociación de drogas (25,26) sobre el tratamiento con beta 2 agonistas aislados como fármacos broncodilatadores.
Es de destacar que en estas revisiones (23,24), así como de los trabajos previamente citados (25,26), que constituyen estudios predominantemente clínicos en donde las variables primarias a evaluar fueron variables clínicas, siendo las funcionales sólo variables secundarias y que no fueron consideradas en todos los estudios. A su vez agrupan pacientes de 1 a 18 años inclusive, por lo cual la heterogeneidad de la población estudiada es muy grande, pues sabemos las considerables diferencias en el comportamiento de la fisiología pulmonar al comparar un lactante pequeño con un niño preescolar y con un adolescente.
En conclusión, en niños preescolares con antecedentes de crisis broncoobstructivas recidivantes o neumonía y con Ri aumentada, la administración de bromuro de ipratropium asociado con fenoterol inhalado comparado con el fenoterol como fármaco único produce una similar respuesta espirométrica en los 10 minutos siguientes a su administración, con una similar frecuencia de respuesta paradojal y con el beneficio de un menor incremento de la frecuencia cardiaca postadministración del fármaco. Este menor efecto taquicardizante, asociado con la mejor respuesta clínica descrita en la literatura podría significar una ventaja sobre la administración de beta 2 agonistas en forma aislada.
Bibliografía
1. Goodman DC, Lozano P, Stukel T, Chang C, Hecht J. Has Asthma Medication Use in Children Become More Frequent, more Appropriate, or Both? Pediatrics 1999; 104: 187-94.
2. Baluga JC, Sueta A, Ceni M. Tendencia de la mortalidad por asma en Uruguay: 1984-2001. Relación con la venta de medicamentos antiasmáticos. Rev Med Uruguay 2003; 19: 117-25.
3. Prendiville A, Green S, Silverman M. Paradoxical response to nebulised salbutamol in wheezy infants, assessed by partial expiratory flow-volume curves. Thorax 1987; 42(2): 86-91.
4. Prendiville A, Rose A, Maxwell DL, Silverman M. Hypoxaemia in wheezy infants after bronchodilator treatment. Arch Dis Child 1987; 62(10): 997-1000.
5. Hellinckx J, De Boeck K, Demedts M. No paradoxical bronchodilator response with forced oscillation technique in children with cystic fibrosis. Chest 1998; 113(1): 55-9.
6. Yuksel B, Greenough A, Green S. Paradoxical response to nebulized ipratropium bromide in pre-term infants asymptomatic at follow-up. Respir Med 1991; 85(3): 189-94.
7. Yuksel B, Greenough A. Variable response to bronchodilator therapy in young children born prematurely. Respir Med 1993; 87(5):359-64.
8. Yuksel B, Greenough A. Comparison of the effects on lung function of two methods of bronchodilator administration. Respir Med 1994; 88(3): 229-33.
9. Estol P, Simini F, Piriz H. Espirometría dinámica en 200 niños menores de 6 años, sin patología: una aproximación a los patrones normales. Rev Med Uruguay 1997; 13: 191-200.
10. Basalo S, Estol P, Simini F. PULMOSYS: equipo para medida de los parámetros de la mecánica ventilatoria en condiciones dinámicas. Rev Mex Ing Biomed 1993; 14: 227-36.
11. Estol P, Piriz H, Pintos L, Nieto F, Simini F. Assessment of pulmonary dynamics in normal newborns: a pneumotachographic method. J Perinat Med 1988; 16(3): 183-92.
12. Seidenberg J, Mir Y, von der H. Hypoxaemia after nebulised salbutamol in wheezy infants: the importance of aerosol acidity. Arch Dis Child 1991; 66(6): 672-5.
13. Chavasse RJ, Seddon P, Bara A, McKean M. Short acting beta agonists for recurrent wheeze in children under two years of age (Cochrane Review). The Cochrane Library 2003; 4.
14. Chavasse RJ, Bastian-Lee Y, Richter H, Hilliard T, Seddon P. Inhaled salbutamol for wheezy infants: a randomised controlled trial. Arch Dis Child 2000; 82 (5): 370-5.
15. Jackson AC, Tennhoff W, Kraemer R, Frey U. Airway and tissue resistance in wheezy infants: effects of albuterol. Am J Respir Crit Care Med 1999; 160(2):557-63.
16. Phagoo SB, Wilson NM, Silverman M. Evaluation of a new interrupter device for measuring bronchial responsiveness and the response to bronchodilator in 3 year old children. Eur Respir J 1996; 9(7): 1374-80.
17. Hiatt P, Eigen H, Yu P, Tepper RS. Bronchodilator responsiveness in infants and young children with cystic fibrosis. Am Rev Respir Dis 1988; 137(1): 119-22.
18. O’Callaghan C, Milner AD, Swarbrick A. Nebulised salbutamol does have a protective effect on airways in children under 1 year old. Arch Dis Child 1988; 63(5): 479-83.
19. Clarke JR, Aston H, Silverman M. Delivery of salbutamol by metered dose inhaler and valved spacer to wheezy infants: effect on bronchial responsiveness. Arch Dis Child 1993; 69(1): 125-9.
20. Henderson AJ, Young S, Stick SM, Landau LI, LeSouef PN. Effect of salbutamol on histamine induced bronchoconstriction in healthy infants. Thorax 1993; 48(4): 317-23.
21. Nielsen KG, Bisgaard H. Discriminative capacity of bronchodilator response measured with three different lung function techniques in asthmatic and healthy children aged 2 to 5 years. Am J Respir Crit Care Med 2001; 164(4): 554-9.
22. Yuksel H, Coskun S, Polat M, Onag A. Lower arrythmogenic risk of low dose albuterol plus ipratropium. Indian J Pediatr 2001; 68 (10): 945-9.
23. Rodrigo G, Rodrigo C. The Role of Anticholinergics in Acute Asthma Treatment*: An Evidence-Based Evaluation. Chest 2002; 121: 1977-87.
24. Plotnick LH, Ducharme FM. Combined inhaled anticholinergics and beta2-agonists for initial treatment of acute asthma in children [Review]. Cochrane Database Syst Rev 2003; 3.
25. Craven D, Kercsmar CM, Myers TR, O’riordan MA, Golonka G, Moore S. Ipratropium bromide plus nebulized albuterol for the treatment of hospitalized children with acute asthma. J Pediatr 2001; 138(1): 51-8.
26. Goggin N, Macarthur C, Parkin PC. Randomized trial of the addition of ipratropium bromide to albuterol and corticosteroid therapy in children hospitalized because of an acute asthma exacerbation. Arch Pediatr Adolesc Med 2001; 155(12): 1329-34.
Correspondencia: Dr. Paul Estol Hayward
Martí 3114, Montevideo, Uruguay.
E-mail estolpaul@adinet.com.uy
CON INTENTO DE AGILITAR Y MEJORAR LOS TIEMPOS DE PUBLICACION
DE LOS ARTICULOS ORIGINALES Y CASOS CLINICOS
SE REALIZARAN HASTA DOS CORRECCIONES Y EL PLAZO TOTAL
DE CUATRO MESES ENTRE LA ENTREGA Y CADA CORRECCION