Services on Demand
Journal
Article
Related links
Share
Archivos de Pediatría del Uruguay
On-line version ISSN 1688-1249
Arch. Pediatr. Urug. vol.72 supl.1 Montevideo Nov. 2001
Endocarditis infecciosa aguda
Dres. Silvana Sanguinetti, Rosana Raina, Malbina Langenhin y colaboradores
Endocarditis infecciosa aguda por estreptococo beta hemolítico de grupo A
DRES. SILVANA SANGUINETTI 1, ROSANA RAINA 1, MALBINA LANGENHIN 1, JAVIER PREGO 2, OSVALDO BELLO 3
1. Residente de Pediatría.
2. Profesor Adjunto Clínica Pediátrica. Coordinador Departamento de Emergencia Pediátrica-Centro Hospitalario Pereira Rossell
3. Ex Profesor Adjunto Cuidado Intensivo. Supervisor del Departamento de Emergencia Pediátrica-Centro Hospitalario Pereira Rossell.
Centro Hospitalario Pereira Rossell. Departamento de Emergencia Pediátrica. Facultad de Medicina. Clínica Pediátrica "C"
Trabajo presentado en las IV Jornadas Integradas de Emergencia Pediátrica. Montevideo, 1998.
Fecha de recibido: 17/9/2001
Fecha aprobado: 1/10/01
Resumen
La incidencia de endocarditis infecciosa en la edad pediátrica ha aumentado en los últimos años. Se han producido cambios en los factores de riesgo, agentes patógenos y condiciones predisponentes de esta enfermedad.
La endocarditis infecciosa sobre válvula nativa sin cardiopatía subyacente es poco frecuente, de evolución aguda, acompañada de insuficiencia cardíaca y manifestaciones sistémicas.
La causada por estreptococo beta-hemolítico de grupo A es rara, aunque en los últimos años ha aumentado la frecuencia de enfermedades invasivas graves por este agente patógeno.
Se presenta el caso clínico de un varón de siete años, previamente sano, con una endocarditis aguda sobre válvula mitral por estreptococo beta-hemolítico de grupo A. La forma clínica fue aguda, severa, con insuficiencia cardíaca progresiva y sepsis, requiriendo cirugía en dos oportunidades.
Palabras clave: ENDOCARDITIS BACTERIANA-diagnóstico
ENDOCARDITIS BACTERIANA-cirugía
INFECCIONES ESTREPTOCÓCICAS-
diagnóstico
INFECCIONES ESTREPTOCÓCICAS-terapia
Resumo
A incidência de endocarditis infecciosa na idade pediátrica tem aumentado nos últimos anos. Produziram-se mudanças nos fatores de risco, patógenos e condições predisponentes desta doença.
A endocarditis infecciosa sobre válvula nativa sem cardiopatia prévia é pouco freqüênte, de evolução aguda, acompanhada de insuficiência cardíaca e manifestações sistemáticas.
A causa por estreptococo beta-hemolítico de grupo A é rara, embora nos últimos anos tenha aumentado a freqüência de doenças invasivas graves por este patógeno.
Apresenta-se um caso clínico de uma criança de sexo masculino de 7 anos, previamente sadio, com uma endocaditis aguda sobre válvula mitral por estreptococo beta-hemolítico de grupo A. A forma clínica foi aguda, severa com insuficiência cardíaca progressiva e sepse, requerendo cirurgia em duas oportunidades
Palabras chave: ENDOCARDITE BACTERIANA-diagnóstico
ENDOCARDITE BACTERIANA-cirugia
INFEÇCÕES ESTREPTOCÓCICAS-
diagnóstico
INFECÇÕES ESTREPTOCÓCICAS-terapia
Introducción
La endocarditis infecciosa (EI) es la colonización microbiana de la superficie endotelial del corazón que, clásicamente, se ha dividido en aguda y subaguda. La EI aguda se presenta con marcada toxicidad y progresividad en días o semanas, con gran destrucción valvular y alto índice de embolias sistémicas. La EI subaguda tiene, por el contrario, un curso más indolente con menor toxicidad, evoluciona en semanas o meses causando raramente infección metastásica (1).
Sin embargo en los últimos años, dados los grandes cambios que se han producido en esta enfermedad se prefieren clasificaciones que implican no sólo la toxicidad temporal sino el agente patógeno, el sitio anatómico de la infección y los factores de riesgo, si los hubiera, dado que éstos tienen mayores implicancias terapéuticas y pronósticas.
Ahora los grupos de riesgo incluyen niños con enfermedad cardíaca cianótica cada vez más compleja, debido a los avances de la terapéutica quirúrgica, muchas veces con cortocircuitos y válvulas protésicas, lactantes prematuros y niños mayores con enfermedad crítica ingresados en unidades de cuidado intensivo, frecuentemente con catéteres centrales, y adolescentes que consumen drogas intravenosas o presentan prolapso de válvula mitral (1-7).
Como consecuencia de la menor incidencia de fiebre reumática y cardiopatía subyacente, la EI sobre cardiopatía valvular reumática también ha disminuido, dando cuenta del 10% de los casos (1).
Los organismos causantes incluyen bacterias y hongos, no obstante Estreptococo viridans y Staphylococcus aureus son causa de la mayoría de los casos de endocarditis (1,2,8).
Los agentes causantes de EI en los pacientes pediátricos se revisan en la tabla 1.
Otros gérmenes más raros han sido descritos como causantes de EI: Pasteurella gallinarum y Bartonella (9-11).
La EI por estreptococo beta-hemolítico de grupo A (EBHGA) es muy poco frecuente en la edad pediátrica, existiendo poca referencia en la literatura internacional se cita una incidencia menor al 5% (12-14).
Debe considerarse que los diferentes agentes patógenos están en relación con los diferentes factores de riesgo y condiciones predisponentes, por lo que deben tenerse en cuenta para el diagnóstico y la terapéutica (1).
Se han ideado diferentes criterios diagnósticos debido a que el diagnóstico de EI no siempre es directo y requiere altos índices de sospecha. Los más utilizados son los criterios de Von Reyn y los de la Universidad de Duke, en éstos el diagnóstico de EI se basa en la combinación de la evaluación clínica, resultados histopatológicos, hemocultivos y datos de laboratorio. Se han publicado estudios comparativos de ambos criterios que demuestran superioridad de la aplicación de los criterios de Duke en el diagnóstico de EI en la población pediátrica. Los criterios de Duke incluyen también los signos ecocardiográficos, lo que constituye un avance importante en el diagnóstico; el ecocardiograma transtorácico bidimensional puede visualizar vegetaciones mayores a 2 mm2 así como puede evidenciar signos iniciales de EI como engrosamiento de las valvas e irregularidades (1,2,17).
La introducción de nuevas técnicas ecocardiográficas, como el ecocardiograma transesofágico, aumenta la sensibilidad y especificidad en el diagnóstico (2,4).
En los últimos años se ha observado un aumento en la incidencia de infecciones graves por EBHGA. La enfermedad invasiva por EBHGA se define como una infección asociada con el aislamiento de EBHGA a partir de un área corporal normalmente estéril e incluye tres síndromes clínicos que se superponen: el síndrome del shock tóxico, la fascitis necrotizante y un grupo de infecciones caracterizadas por el aislamiento de EBHGA a partir de un área normalmente estéril que no cumplen con los criterios de los dos grupos anteriores e incluye la bacteriemia sin un foco identificado e infecciones focales (15).
Todavía no se han definido por completo los mecanismos patogénicos de las infecciones invasivas por EBHGA, pero se ha sugerido una asociación con las exotoxinas pirogénicas estreptocócicas (EPE E, B y C) responsables del exantema de la escarlatina, y dos exotoxinas pirogénicas descubiertas recientemente: el factor mitógeno y el superantígeno estreptocócico. Dichas exotoxinas estimulan una intensa activación y proliferación de los linfocitos T y macrófagos que se traduce en la producción de grandes cantidades de citocinas, capaces de producir shock y lesión en los tejidos.

Los factores del huésped tales como la presencia o ausencia de anticuerpos antiestreptocócicos de tipo específico o antitoxina, el tipo de repuesta de las citocinas y la presencia de una enfermedad subyacente podrían influir en la susceptibilidad a las cepas virulentas específicas y en la gravedad de las manifestaciones clínicas (15,16).
Caso clínico
Escolar de 7 años, sexo masculino, buen crecimiento y desarrollo, inmunizaciones vigentes, sin antecedentes personales a destacar.
Nueve días antes del ingreso al Departamento de Emergencia, comienza con fiebre, decaimiento y anorexia, acompañado de rush cutáneo fugaz de tipo escarlatiniforme. Epístaxis en una oportunidad que cede espontáneamente sin otra sintomatología a destacar.
Presentó una herida supurada en piel una semana previa al inicio de los síntomas. Recibió antiinflamatorios no esteroideos en varias oportunidades.
Al ingreso se constata paciente lúcido, febril (temperatura axilar 39°C), parches congestivos en mejillas.
Piel y mucosas hipocoloreadas. Petequias que predominan en sector distal de miembros inferiores, petequias conjuntivales y en paladar. Adenopatías carotídeas pequeñas móviles.
Abdomen depresible, se palpa borde inferior hepático a un cm del reborde costal de consistencia normal doloroso, borde superior hepático en quinto espacio intercostal; bazo a un cm del reborde costal, doloroso. No presenta dificultad respiratoria, a la auscultación murmullo alvéolo-vesicular presente bilateralmente. A nivel cardiovascular ritmo regular de 100 cpm, ruidos bien golpeados, no soplos. Pulsos periféricos simétricos, presión arterial 110/60 mmHg. Examen psiconeuromuscular normal. Faringe roja.
Exámenes de laboratorio al ingreso:
Hemograma: glóbulos blancos 8.200 elementos/mm3, granulocitos 77,1%, linfocitos 18%; glóbulos rojos 3.200.000 elementos/mm3, hemoglobina 9,3 g/dl, hematocrito 26,5%, reticulocitosis 0,1%. Plaquetas 84.000 elementos/mm3. Doce horas después recuento plaquetario 59.000 elementos/mm3.
Mielograma: serie roja con hipoplasia moderada, 10% de la celularidad global sin alteraciones morfológicas ni madurativas. Serie granulocítica y mononuclear-fagocítico normal. Sector megacariocítico: aumento del número de megacariocitos en todas las etapas madurativas. Sector linfoplasmocitario: 2% de linfocitos maduros. No se observan blastos ni células de estirpe hematopoyética.
Proteína C reactiva: 108 mg/l. Examen de orina, funcional hepático y radiografía de tórax normales. Monoslide negativo.
Se realizan hemocultivos.
En sala a las 48 horas: paciente grave, epístaxis en curso, intensa palidez cutánea mucosa, extensión del síndrome purpúrico con lesiones hemorragíparas en palmas, plantas, petequias subconjuntivales y lesiones en astilla subungueales, hemorragia digestiva alta. Signos de insuficiencia cardíaca global y soplo sistólico de moderada intensidad.
Nuevo hemograma: glóbulos blancos 4.900 elementos/mm3, granulocitos 78,1%, glóbulos rojos 2.310.000 elementos/mm3, hemoglobina 6,3 g/dl, hematocrito 18,8%, plaquetas 22.000 elementos/mm3.
Tiempo de protrombina 25%, fibrinógeno indosificable, PDF positivos.
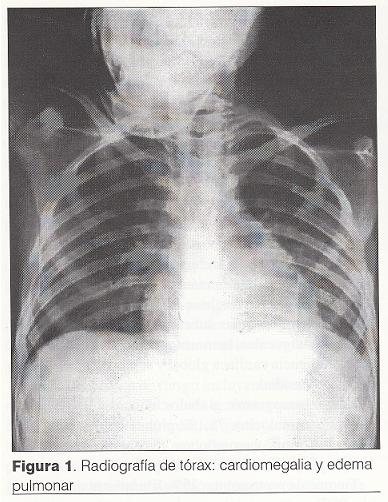
Radiografía de tórax: cardiomegalia y edema pulmonar (figura 1).
Examen de orina: microhematuria. Azoemia 0,36 g/l. Creatininemia 0,66 mg%. Ionograma normal.
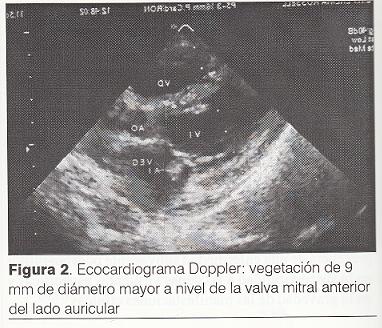
Ecocardiograma Doppler: vegetación de 9 mm de diámetro mayor a nivel de la valva mitral anterior del lado auricular. Insuficiencia mitral leve a moderada. Función contráctil de VI normal. Leve derrame pericárdico (figura 2).
Los cultivos en sangre separados por 24 horas desarrollaron estreptococo beta-hemolítico del grupo A.
Se inició tratamiento con inotrópicos, diuréticos, reposición hematológica (plasma, glóbulos rojos, concentrado de plaquetas y crioprecipitados), penicilina 300.000 UI/kg/día, gentamicina 5 mg/kg/día y vancomicina 60 mg/kg/día, suspendiéndose esta última al aislar el germen.
Presenta mejoría del síndrome séptico, instalando insuficiencia cardíaca progresiva por lo que se realiza cirugía, con resección de la vegetación con plastia valvular y reposición de cuerdas tendinosas. En la evolución persiste febril, con leucopenia e insuficiencia cardíaca, realizándose nueva cirugía con colocación de válvula protésica. Se inició nuevo plan de antibióticos, clindamicina, imipenem y fluconazol. Mejoría progresiva desde el punto de vista infeccioso y hemodinámico. Se otorgó el alta a los 3 meses del ingreso.
Discusión
El caso clínico descrito se presentó como una enfermedad aguda, severa, con cambios en el examen cardiovascular como la aparición de un soplo nuevo, insuficiencia cardíaca congestiva progresiva por destrucción valvular, falla multisistémica y coagulación intravascular diseminada, requiriendo cirugía cardíaca en dos oportunidades; típica evolución de la EI aguda (1).
Si bien en 90% de los casos de EI se encuentra una enfermedad subyacente, en 50 a 60% de las EI agudas se observan en pacientes con anatomía cardíaca normal. Se cree que la afección procede de un foco extracardíaco y se extiende afectando al corazón (1).
Las cardiopatías que con mayor frecuencia asocian EI son las que ocasionan flujos turbulentos de alta velocidad como: tetralogía de Fallot, defectos septales ventriculares y estenosis aórtica congénita entre otras (1-3).
No se identificó una cardiopatía subyacente en el caso clínico analizado.
El germen que causa con mayor frecuencia EI aguda es el Staphylococcus aureus, no obstante estreptococos beta-hemolíticos del grupo A, B, C y G pueden determinar una clínica similar (1,18).
Los hemocultivos obtenidos previos al inicio del tratamiento antibiótico desarrollaron colonias de EBHGA, siendo éste un criterio mayor para el diagnóstico de EI, así como la evidencia ecocardiográfica de una vegetación de 9 mm a nivel de la superficie auricular de la válvula mitral con lo que se establece el diagnóstico de EI aguda definitiva según los criterios de Duke (4).
La EI por EBHGA, poco frecuente en la niñez, clínicamente se presenta en forma similar a la endocarditis causada por otros estreptococos beta-hemolíticos, con un curso agudo y fulminante (12,18). En revisiones desde 1965, se han identificado 15 niños con endocarditis por EBHGA. Todos se presentaron clínicamente como una endocarditis aguda, las vegetaciones se hallaron con mayor frecuencia en las válvulas mitral y aórtica; como complicaciones más frecuentes se citan abscesos intracardíacos y fenómenos embólicos. Requirieron cirugía dos pacientes. La mayoría de estos niños no tenía una enfermedad cardíaca subyacente. Como antecedentes de la enfermedad se citan ampollas de piel, faringitis y varicela. Dos pacientes fallecieron (12).
En casi 25% de los casos de enfermedad invasiva grave por EBHGA se desconoce la puerta de entrada, rara vez aparecen después de un episodio de faringitis. La infección suele iniciarse en la piel o tejidos blandos, frecuentemente en la localización de un traumatismo mínimo o traumatismo local no aparente (15,16,19). Como antecedente en este caso clínico, se destaca que una semana previa presentó una herida supurada en piel, pudiendo corresponder ésta al foco de infección primaria.
La incidencia de infecciones invasivas graves por EBHGA parece ser más elevada entre niños pequeños y ancianos. Otros grupos han sido identificados como portadores de mayor riesgo: individuos con diabetes mellitus, enfermedad cardíaca o pulmonar crónica, infección por VIH o SIDA, consumo de drogas por vía intravenosa y niños con varicela. Las infecciones invasivas por EBHGA son una complicación bien conocida de la varicela, tanto en niños inmunológicamente sanos como en el huésped inmunocomprometido. El EBHGA es el agente que con mayor frecuencia determina sobreinfección bacteriana en las lesiones varicelosas, representa 59% de los patógenos aislados en los cultivos (12,15,19).
Actualmente se puede incluir a la EI por EBHGA y por S. aureus dentro de las complicaciones de la varicela (12, 21).
Diversas publicaciones han sugerido una correlación entre la utilización de antiinflamatorios no esteroideos (AINES) e infecciones invasivas graves por EBHGA (14, 22). Existen pruebas de que los AINES puedan deteriorar la función granulocítica y estimular la producción de citocinas; además pueden enmascarar los signos de la progresión de la enfermedad: dolor, fiebre e inflamación. Todo lo que contribuye a demorar el diagnóstico y determina una infección más grave al momento del mismo. De todas formas falta evidencia para limitar su uso (19).
El caso clínico presentado recibió ibuprofeno en varias oportunidades previo al diagnóstico de endocarditis. Este es el único factor de riesgo que se encontró para desarrollar una infección invasiva por EBHGA.
El tratamiento antibiótico empírico, previo a la obtención de los resultados de los hemocultivos estuvo dirigido hacia los gérmenes más frecuentemente involucrados en las EI agudas, por lo que se realizó penicilina, vancomicina y un aminoglucósido. Una vez obtenidos los cultivos se suspendió la vancomicina, cumpliendo en total 21 días de penicilina y 15 días de gentamicina.
La evolución en los primeros días fue mala, con progresión de la insuficiencia cardíaca congestiva, necesitando apoyo inotrópico permanente. Esto motivó la cirugía tempranamente, con resección de la vegetación y plastia de la válvula mitral, como lo recomienda la literatura. La evolución inmediata del punto de vista cardiovascular fue buena, no así desde el punto de vista infeccioso, persistiendo febril y con signos clínicos de toxicidad medular por lo que se decidió reintervenir a fin de remover el foco infeccioso, realizándose recambio valvular con colocación de válvula protésica mecánica. Se inició tratamiento con clindamicina, imipenem y fluconazol, con mejoría progresiva y alta a domicilio tres meses después de iniciada la enfermedad.
Conclusiones
Se presenta un caso clínico de endocarditis infecciosa aguda por estreptococo beta-hemolítico del grupo A, enfermedad muy poco frecuente en la edad pediátrica.
La evolución fue aguda y rápidamente progresiva, requiriendo un abordaje médico-quirúrgico.
Dado los cambios que se han producido en los factores de riesgo y patógenos causantes de EI, lo que ha llevado en los últimos años a un aumento de su incidencia, el médico clínico debe mantener un alto nivel de sospecha ante esta enfermedad.
No se halló en este paciente una cardiopatía subyacente. Como único factor de riesgo para desarrollar una enfermedad invasiva grave por EBHGA se identificó el tratamiento previo con AINES.
Es necesario, además, que los pediatras se familiaricen con el diagnóstico, tratamiento y prevención de estas enfermedades por el aumento en la incidencia de infecciones invasivas por EBHGA y la elevada morbimortalidad que las mismas conllevan.
Summary
The incidence of infectious endocarditis in pediatric ages has increased during the last years. It has been produced changes in danger, pathogen factors, and predispose conditions of this illness.
The infectious endocarditic on native valve without structural cardiac disease is not common, the acute evolution, joined of cardiac failure and systematic manifestations.
The etiology by beta hemolytic group A streptococcal (GAS) is rare although the frequency of invading serious illness by this pathogen has increased on the last years.
It is shown the clinical case of a 7 year old previously healthy, with an acute endocarditis on mitral valve by GAS. The clinical form was acute, severe with progressive cardiac failure and sepsis, needing surgery twice.
Key words: ENDOCARDITIS, BACTERIAL-diagnosis
ENDOCARDITIS, BACTERIAL-surgery
STREPTOCOCCAL INFECTIONS-diagnosis
STREPTOCOCCAL INFECTIONS-therapy
Bibliografía
1. Saiman L. Endocarditis. In: Kats S, Garshon A, Hotez P, Krugman. Enfermedades Infecciosas Pediátricas. 10° Ed Madrid: Harcourt, 1999: pp. 68-80.
2. Baltimore R. Infective endocarditis in children. Pediatr Infect Dis J 1992; 11: 907-12.
3. Jorge S, Caixeta A, Abizaid A, Arnoni A, Paulista P, Bento, Sousa L et al. Endocardite infecciosa na infancia e adolescencia. Arq Bras Cardiol 1994; 63(3): 173-7.
4. Del Pont J, De Cicco L, Vertalitis C, Ithurralde M, Gallo J, Vargas F, et al. Infective endocarditis in children: clinical analyses and evaluation of two diagnostic criteria. Pediatr Infect Dis J 1995; 14: 1079-86.
5. Daher A, Berkowitz F. Infective Endocarditis in Neonates. Clin Pediatr 1995; 34(4): 198-206.
6. Rastogi A, Luken JA, Pildes RS, Chrystof D, LaBranche F. Endocarditis in Neonatal Intensive Care Unit. Pediatr Cardiol 1993; 14: 183-6.
7. Hartyánszky IL, Pintér M, Kádár K, Oprea V, Krause I, Lozsádi K. Candida endocarditis in an infant. Pediatr Cardiol 1997; 18: 440-2.
8. Souto C, Cotter L, Assad J, Añorve A, Rosete G. Endocarditis Infecciosa en el Instituto Nacional de Cardiología " Ignacio Chávez". Experiencia de cinco años (1990-1994). Arch Inst Cardiol Mex 1997; 67: 46-50.
9. Bass J, Vincent J, Person D. The expanding spectrum of Bartonella infections: I. Bartonellosis and trench fever. Pediatr Infect Dis J 1997; 16: 2-10.
10. Swaminathan S, Ritter S. Enterococcus avium endocarditis in an infant with tetralogy of Fallot. Pediatr Cardiol 1999; 20: 227-8.
11. Al Fadel Saleh M, Al-Madan M, Erwa H, Defoenseka I, Sohel S, Kumar Sanyal S. Primer caso de infección humana debida a Pasteurella gallinarum causando una endocarditis infecciosa en un adolescente 10 años después de la corrección quirúrgica de un tronco arterioso. Pedatrics 1995; 39(6): 391-4.
12. Winterbotham A, Riley S, Kavanaugh-McHugh A, Dermody T. Endocarditis caused by Group A B-Hemolytic Streptococcus in an Infant: Case report and review. Clin Infec Dis 1999; 29: 196-8.
13. Aoun N, Fernandes L, Succi E, Albanesi F. Endocardite por estreptococo B-hemolítico em adolescente portador de cardiomiopatia hipertrófica. Arq Bras Cardiol 1994; 63(3): 211-3.
14. Mohan U, Walters S, Kroll S. Endocarditis due to group A beta-hemolytic Streptococcus in children with potencially lethal sequelae: 2 cases and review. Clin Infect Dis 2000; 30(3): 624-5.
15. Comitee on Infectious Diseases 1996-1997. Infecciones invasivas graves por estreptococo del grupo A: una revisión del tema. Pediatrics 1998; 45(1): 62-6.
16. Shulman S. Infección invasiva por estreptococos del grupo A y síndrome de shock tóxico estreptocócico. Pediatr Infect Dis J 1993; 12(6) supl: 14-5.
17. Zabaleta N, Ayala E, Romero A, Loredo M. Endocarditis Infecciosa mitral y/o aórtica. Correlación entre ecocardiografía transesofágica, cirugía y anatomía patológica. Arch Inst Cardiol Mex 1998; 68: 309-14.
18. Baddour L, Ballon-Landa G, Gordon S, Tomford J, Nettles R, Sexton D et al. Infective Endocarditis caused by beta-hemolitic streptococci. Clin Infect Dis 1998; 26(1): 66-71.
19. O Brien K, Levine O, Shwartz B. The changing epidemiology of group A Streptococcus Infections. Semin Pediatr Infect Dis 1997; 8(1): 10-6.
20. Doctor A, Harper M, Fleisher G. Bacteriemia por estreptococo betahemolítico del grupo A: panorama histórico, incidencia cambiante y reciente asociación con la varicela. Pediatrics 1995; 40(2): 157-62.
21. Gold L, Barbour S, Guerrero-Tiro L, Koopot R, Lewis K, Rudinsky M et al. Staphylococcus aureus endocarditis asociated with varicella infection in children. Pediatr Infect Dis 1996; 15(4): 377-9.
Correspondencia: Dr. Javier Prego.
Hermanos Ruiz 3427. Montevideo, Uruguay. CP 11704
E-mail: jotapre@adinet.com.uy