Introducción
La ablación con catéter de la fibrilación auricular (FA) mediante el aislamiento de las venas pulmonares (VP), es una estrategia ampliamente utilizada en la actualidad. Se realiza con mayor frecuencia para mantener el ritmo sinusal en pacientes con FA sintomática, paroxística o persistente resistente a los medicamentos o como una estrategia inicial de control del ritmo en lugar de la terapia con medicamentos antiarrítmicos en FA paroxística, obteniéndose tasas de éxito de un solo procedimiento del 60-80%. Sin embargo puede presentar recurrencias aproximadamente en el 30% de FA paroxística, incrementándose hasta un 50% en FA persistente1-3.
Si bien el estudio de las recurrencias de FA tras ablación en las últimas décadas ha permitido conocer mejor los mecanismos fisiopatológicos implicados, identificar factores asociados, crear scores predictores e implementar técnicas de optimización o estrategias adicionales para mejorar la durabilidad y eficacia del procedimiento, seguimos sin poder definir la estrategia óptima, especialmente tras varios procedimientos, existiendo una falta de consenso2,3.
A continuación, mediante la presentación de una serie de casos contemporáneos que reflejan la práctica clínica y del intervencionismo de ablación de un centro de electrofisiología, resumimos y discutimos elementos clave para la comprensión, prevención, predicción, detección y tratamiento de la FA recurrente sintomática después de un procedimiento inicial de ablación de VP.
Casos Clínicos
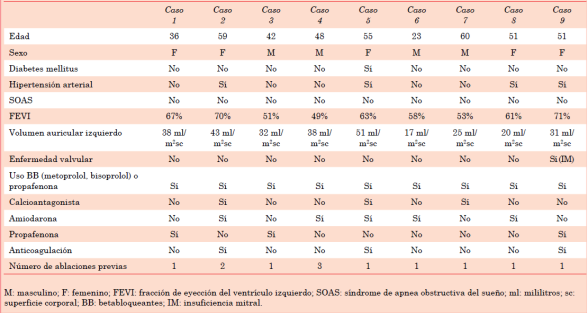
Se incluyeron nueve pacientes con FA recurrente sintomática después de un procedimiento inicial de ablación de venas pulmonares, que fueron sometidos a un nuevo procedimiento de ablación, atendidos en el servicio de electrofisiología del Hospital de Especialidades del Centro Médico Nacional de Occidente, IMSS Guadalajara, Jalisco, México, entre 2019 al 2021.
La media de edad de los pacientes fue de 47 años, 55% mujeres, 77% con fibrilación auricular paroxística, y una media de procedimientos previos de ablación de 1,3 (tabla 1).
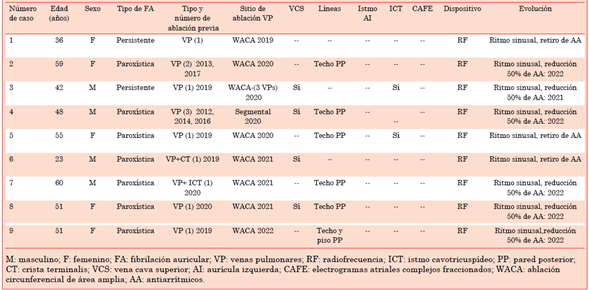
Mediante el estudio electrofisiológico y mapeo tridimensional se encontró reconexión de las VP en el 100% de los casos, siendo éste el objetivo de ablación inicial. La ablación de VP tipo WACA (ablación circunferencial de área amplia) se realizó en el 88%. La ablación adicional a las VP se consideró en el 100% de los casos, de los cuales la ablación lineal del techo de la pared posterior de la aurícula izquierda (AI) se realizó en el 66%. No se realizaron ablaciones lineales en el istmo auricular izquierdo (istmo mitral), en 5 (55%). Empíricamente se consideró ablación adicional de desencadenante extrapulmonar, correspondiendo a la vena cava superior su totalidad. El sistema de suministro de energía empleado en los 9 casos fue radiofrecuencia (RF) (tabla 2).
La ablación se consideró exitosa en el 89%, presentándose una recurrencia (11%), la cual al reiniciar antiarrítmicos tuvo adecuada evolución. La suspensión de antiarrítmicos se logró en 3 casos (33%), existiendo reducción del 50% o más de la dosis en el 77%.
Durante el tiempo de seguimiento ningún paciente presentó complicaciones tromboembólicas (figura 1).
Discusión
La FA es la arritmia cardiaca más frecuente, con una prevalencia estimada en la población adulta del 4%, considerándose una pandemia global, caracterizada por una activación rápida e irregular en las aurículas.
Su presencia determina un aumento de 5 veces en el riesgo de complicaciones tromboembólicas, y de 2 veces en el desarrollo de insuficiencia cardíaca, mayor morbilidad y un exceso de costos de atención médica; aspecto que la convierten en tema de gran interés4-7).
El tratamiento de la FA consta de tres componentes principales: anticoagulación como prevención de complicaciones tromboembólicas, control de la frecuencia cardiaca y control del ritmo. En este sentido estudios recientes como el ensayo EAST-AFNET4 demuestran la importancia del control temprano del ritmo, estrategia en la que existe una superioridad a corto y largo plazo de la ablación con catéter en comparación con la terapia farmacológica antiarrítmica convencional, como lo previamente demostrado en los estudios CABANA (Ablación con catéter versus terapia con medicamentos antiarrítmicos para la fibrilación auricular) y CASTLE-AF (Ablación con catéter versus tratamiento médico para la fibrilación auricular con insuficiencia cardíaca)5-10
La estrategia de ablación empleada con más frecuencia es el aislamiento eléctrico de las VP, debido a que en el 90% de los casos es el sitio desencadenante, situación que la ha convertido en un pilar del tratamiento de la FA con tasas de éxito de un solo procedimiento del 60-80%2,11,12
Sin embargo, la FA puede presentar recurrencia posterior a la ablación en el 30% de FA paroxística e incrementándose hasta un 50% en FA persistente1-3.
Debido esta alta tasa de recurrencia se han investigado diferentes estrategias adicionales a la ablación VP, como la ablación de desencadenantes extrapulmonares, la modificación del sustrato arritmogénico, la interrupción de vías cruciales de conducción, la reducción del volumen y la denervación auricular4,11.
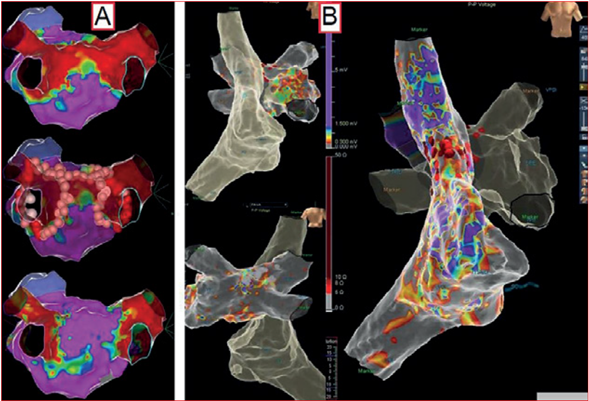
Figura 1 Ejemplos de casos clínicos, mapeo tridimensional EnSite y estrategia de ablación. A) Caso clínico 2. Mapa de voltaje que muestra tejido normal en el cuerpo, con reconexión en el techo de la VPSD y VPSI, EGM residuales fragmentados hacia pared anterior de la VPII y hacia el piso de la VPID. Posterior desconexión WACA en las 4 venas + línea de ablación en tercio superior de pared posterior de aurícula izquierda. B) Caso clínico 4. Mapa de voltaje que muestra tejido del cuerpo auricular con cicatriz prácticamente total, las 4 venas aisladas, solo actividad en VPSD a predominio posterior, adyacente a vena cava superior. Se realiza ablación por radiofrecuencia segmental de VPSD + línea del techo posterior + circunferencial de vena cava superior. VPSD: vena pulmonar superior derecha; VPSI: vena pulmonar superior izquierda; VPII: vena pulmonar inferior izquierda; VPID: vena pulmonar inferior derecha; EGM: electrogramas; WACA: ablación circunferencial de área amplia.
Base electrofisiológica de la ablación de FA
En general, se acepta que el inicio y el mantenimiento de la FA requiere la interacción compleja de un desencadenante, un sustrato auricular y la actividad del sistema nervioso autónomo. Debido a ello el efecto de la ablación puede atribuirse a varios mecanismos, incluidos la eliminación del desencadenante que en el 80 a 90% de los casos se encuentra localizado en las VP, la modificación del sustrato arritmogénico dirigida las fuentes específicas de la AI y la aurícula derecha (AD) (líneas extendidas a pared posterior de la AI, fragmentación endocárdica), la interrupción de vías cruciales de conducción (haz de Marshall), la reducción del volumen (hipótesis de la “masa crítica de la fibrilación”) o la denervación auricular (ablación de ganglios autonómicos) (figura 2) 4,11,13,14.
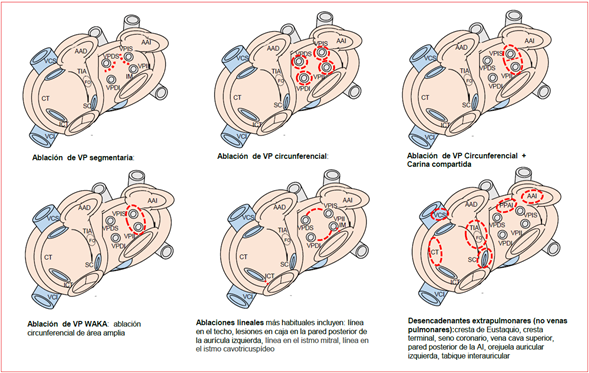
Figura 2 Principales estrategias de ablación en fibrilación auricular recurrente. CT: crista terminalis y cresta de Eustaquio; SC: seno coronario; VCS: vena cava superior; VCI: vena cava inferior; FO: fosa oval; IM: istmo mitral; ICT: istmo cavotricuspídeo; TIA: tabique interauricular; AAI: apéndice auricular izquierdo; AAD: apéndice auricular derecho; VPDS: vena pulmonar superior derecha; VPIS: vena pulmonar superior izquierda; VPDI: vena pulmonar inferior derecha; VPII: vena pulmonar inferior izquierda; PPAI: pared posterior de la aurícula izquierda.
Factores asociados a las recurrencias
Existen predictores de recurrencia posablación identificados en diversos estudios como la duración de la FA (FA persistente de larga duración), la edad, el sexo masculino, anatomía atípica de las venas pulmonares, menor fracción de eyección del ventrículo izquierdo (FEVI) y propiedades de la aurícula izquierda (diámetro de la AI >50-55 mm, fibrosis), enfermedad sistémica asociada (hipertensión, apnea obstructiva del sueño), enfermedad cardíaca concomitante (en particular, la enfermedad de la válvula mitral y la miocardiopatía hipertrófica)15,16
En busca de una mejor predicción de la recurrencia de la arritmia, diversos estudios han evaluado puntuaciones de riesgo predictivas. Entre las más importantes se encuentran el APPLE score (edad >65 años, FA persistente, tasa de filtración glomerular <60 ml/min/1,73 m2, diámetro de la AI ≥43 mm y FEVI <50%) y MB-LATER score (hombre, bloqueo de rama, aurícula izquierda ≥47 mm, tipo de FA)17,18,19).
Clasificación de las recurrencias de la FA posterior a ablación
Las recurrencias de la FA después de la ablación se clasifican en tres tipos: temprana, cuando se presenta cualquier episodio de FA, flutter o taquicardia auricular mayor a 30 segundos dentro de los primeros 3 meses, tardía entre los 3 y 12 meses o muy tardía, posterior a los doce meses posablación1,15.
Mecanismos fisiopatológicos de recurrencia de la FA posablación
Entre los mecanismos fisiopatológicos relacionados con la recurrencia temprana se destacan: reconexión de las VP por aislamiento incompleto, cambios inflamatorios agudos debidos a la energía de RF aplicada, recuperación de la conducción en una VP previamente aislada, cambios en el sustrato de la aurícula, efecto retardado de la ablación con RF debido a consolidación de la lesión, y modificación del sistema nervioso autónomo. En la recurrencia tardía y muy tardía diversos estudios destacan el rol que tienen los focos de tipo gatillo (triggers) distintos a las VP, la progresión del sustrato de la FA y las brechas en líneas previas de ablación2,3,20.
Técnicas para mejorar la durabilidad y eficacia del aislamiento de venas pulmonares
Dadas las altas tasas de recurrencia después de la ablación de las venas pulmonares, se han estudiado diferentes técnicas complementarias para mejorar la durabilidad y eficacia, teniendo actualmente una recomendación acorde a guías de clase IIb21.
Dentro de estas técnicas se encuentran: las pruebas de bloqueo de entrada y salida, la ablación con una vaina orientable controlada manualmente para la navegación del catéter, que al otorgar mayor estabilidad y mejorar el contacto con el tejido proporciona mayor eficacia y seguridad22, la ablación con catéteres de punta irrigada multiporo que generan un enfriamiento uniforme de la punta durante la ablación23, el uso de catéteres de detección de fuerza, que determinan cuantitativamente la fuerza de contacto y la estabilidad del catéter con punto de corte >10 gramos24, y la evaluación de inexcitabilidad a lo largo de la línea de ablación como marcador de lesiones completas (uniformes y transmurales)(25. La anestesia general se ha asociado a una mayor estabilidad y contacto del catéter al disminuir la respiración y el movimiento del paciente26. La administración de adenosina (dosis 1-30 mg) permite desenmascarar la conducción latente e identificar brechas en la línea de ablación27,28.
Dilemas posteriores a FA recurrente después de una ablación
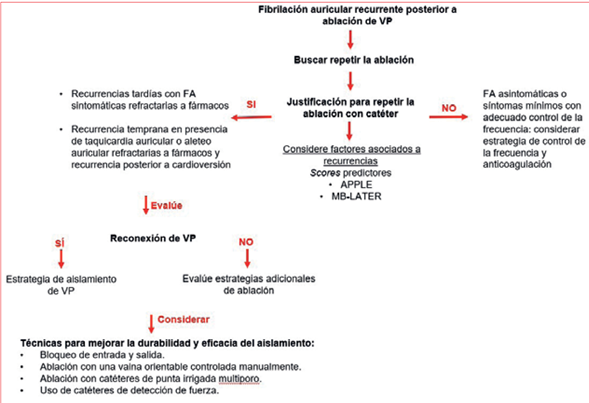
Los pacientes con FA recurrente después de la ablación con catéter presentan una serie de dilemas, como el determinar la indicación de repetir el procedimiento, el tiempo de ideal para repetir la ablación, el enfoque óptimo para la ablación y el beneficio de intervenciones adicionales3 (figura 3).
Justificación para repetir la ablación con catéter
La ablación repetida se considera principalmente para recurrencias tardías (>3 meses) que persistan con FA sintomáticas (a menudo refractarias a fármacos); en los pacientes con síntomas mínimos o sin síntomas que tienen un control de la frecuencia adecuado pueden ser apropiado optar por una estrategia de control de la frecuencia y anti coagulación en lugar de seguir buscando el ritmo sinusal. En recurrencia temprana a menudo se pospone la repetición del procedimiento en este período de tiempo debido a que pueden resolverse espontáneamente (periodo de “blanqueamiento”) o no reaparecer después de la cardioversión, considerando una segunda ablación particularmente en la taquicardia o el aleteo auricular, que es difícil de manejar médicamente y recurre a pesar de la cardioversión3.
Técnica de ablación de repetición: radiofrecuencia o crioablación
Existen datos limitados sobre el sistema de suministro de energía a emplearse luego de una recurrencia de FA. Diversos estudios sugieren que repetir RF frente a crioablación produce mejores resultados. Pokushalov y colaboradores en su estudio de 80 pacientes con FA paroxística recurrente después de un procedimiento inicial fallido de ablación con RF, demostraron que una segunda ablación con RF presenta menos recurrencia y mayor seguridad que la ablación con crioablación (58% vs 43%, p = 0,06) 3,29.
Recurrencia de FA en presencia de reconexión de las VP
Dado que la reconexión o ablación incompleta de las VP es el hallazgo electrofisiológico y mecanismo más frecuente de recurrencias, las guías sugieren que el primer paso y objetivo principal en un procedimiento repetido es verificar cada VP en busca de reconducción eléctrica, seguido de reaislamiento de las VP de ser necesario. La ablación adicional de desencadenantes diferentes a las PV durante la repetición de la ablación de la FA es controversial, no se recomienda de rutina y presenta bajo nivel de evidencia en las recomendaciones emitidas por diferentes sociedades, debido a que diferentes estudios han comprobado que no logra mejorar la supervivencia libre de arritmia en comparación con los enfoques con objetivo solo de las VP30,31.
Recurrencia de FA en presencia de VP aisladas
Las estrategias de ablación en presencia de PV aisladas están menos definidas en la actualidad3.
Sin embargo, acorde con algunos estudios, se sugiere que de existir poca o ninguna evidencia de reconducción de PV se deben buscar y eliminar (empíricamente o después de observar una ectopia significativa) focos desencadenantes extrapulmonares (cresta de Eustaquio, cresta terminal, seno coronario, vena cava superior, pared posterior de la AI, orejuela izquierda, tabique interauricular particularmente en la región de la fosa oval/limbus), los que según diferentes series tienen una concomitancia del 60% al 80% con la reconexión de las VP y una prevalencia del 20% en presencia de PV aisladas, hallazgos que indicarían la importancia de los focos arritmogénicos fuera de las venas pulmonares en recurrencias posablación32-34.
Evidencia actual de la ablación de focos diferentes a las venas pulmonares
La mayoría de los grandes ensayos clínicos que han comparado estrategias de ablación con el objetivo de venas pulmonares contra venas pulmonares y ablaciones adicionales (desencadenantes extrapulmonares o ablación de sustrato arritmogénico) han sido dirigidos a pacientes sometidos a procedimientos de ablación de primera vez. Por lo tanto, se disponen de datos limitados en cuanto a la estrategia óptima de ablación repetida por recurrencias36,37.
En cuanto a la estrategia de ablación por FA durante la primera intervención, el resultado de diversos ensayos clínicos ha evidenciado que el aislamiento solo de VP tiene tasas de recurrencias similares a ablaciones adicionales lineales o ablación con electrograma fraccionado complejo (CAFE). El ensayo clínico Approaches to Catheter Ablation for Persistent Atrial Fibrillation (STAR-AF II) con 589 pacientes publicado en 2015 estudió el impacto de diferentes estrategias de ablación primaria, evidenciando tasas de recurrencias tempranas y tardías similares entre ablación solo de VP contra VP más CAFE o VP más líneas (59% para VP solo, 48% para VP + CAFE y 44% para VP+ líneas, p=0,15)(35). Resultados similares mostró el estudio CHASE-AF publicado en 2015, el cual evidenció ausencia de beneficio en días libres de arritmia al adicionar el aislamiento de VP con desfragmentación completa (CAFE más líneas de ablación) pero sí un incremento en la duración del procedimiento y uso fluoroscópico, así como del tiempo de aplicación de la RF (75 vs 73%, p 0,90) 36.
Estrategia de ablación en recurrencias de FA
La mayor parte de la evidencia actual sobre la estrategia óptima de ablación en recurrencias parte de estudios retrospectivos, sugiriendo un beneficio de la ablación adicional a las VP. Mohanty y colaboradores en 2017 en su estudio de 305 pacientes con FA remitidos después de ≥2 aislamientos fallidos de VP encontraron que los desencadenantes extrapulmonares eran responsables del mantenimiento de la FA en la mayoría (VP 74% vs no VP 93%) y su ablación incrementó el éxito del procedimiento (ablación adicional a VP 81% vs ablación exclusiva de VP 8%, RR 8,97, p<0,0001)37.
En otro estudio retrospectivo, Hojo R y colaboradores en 2017 reportaron 216 pacientes con FA sometidos a un segundo estudio electrofisiológico después del aislamiento original de las VP. Evidenciaron que los desencadenantes extrapulmonares de novo incrementan la recurrencia de FA (24,1% frente a 7,4%, p= 0,0015); concluyendo que los focos no VP son un predictor de recurrencia de FA y por tanto su detección y ablación puede representar una opción terapéutica importante38. Peigh y colaboradores, en su cohorte retrospectiva publicada en 2020 de 84 pacientes con FA recurrente y reconexión de PV, evidenciaron que la adición de la técnica Focal Impulse and Rotor Modulation (FIRM) no aumenta la ausencia de fibrilación auricular posterior a la ablación (55,6% para reaislamiento exclusivo de VP vs 33,3% para reaislamiento de VP + FIRM; p=0,049)39.
Conclusiones
La ablación de las venas pulmonares se ha convertido en un tratamiento clave para la FA. Sin embargo, pueden ocurrir recurrencias.
Encontrar la estrategia ideal para la ablación después de una recurrencia de FA es un problema controvertido, complejo y desafiante, y se dispone de datos limitados. Debido a que la reconexión de VP es un hallazgo típico durante los procedimientos repetidos, debe ser considerada el objetivo principal para un nuevo procedimiento de ablación.
En las últimas décadas se ha obtenido una mejor comprensión de los mecanismos fisiopatológicos implicados en la recurrencia de FA posablación, permitiendo identificar factores asociados, crear scores predictores, implementar técnicas de optimización o estrategias adicionales para mejorar la durabilidad y eficacia del aislamiento de venas pulmonares.
Sin embargo, el uso de ablaciones adicionales más allá de la ablación de VP en casos de reconexión requiere de investigaciones más sólidas y ensayos clínicos que permitan determinar su eficacia y seguridad.