Introducción
La enfermedad valvular cardíaca (EVC) es una condición muy frecuente en la población general, con una incidencia aproximada de 64 casos por cada 100.000 personas/año y una prevalencia que alcanza el 50% para las afectaciones valvulares leves en ≥ 65 años de edad1. En los últimos años se ha evidenciado un cambio en la epidemiología de la EVC, con una reducción de la carga de cardiopatía reumática, y hoy en día las valvulopatías más frecuentemente diagnosticadas son la estenosis aórtica (EAo), insuficiencia mitral (IM) e insuficiencia aórtica (IAo) de etiología no-reumática1,2,3. Dado que la EVC acarrea un importante grado de morbimortalidad1,3, un adecuado manejo y tratamiento es menester.
En la actualidad, las prótesis valvulares biológicas (PVB) constituyen un poco más del 50% del total de válvulas implantadas, la mayoría de ellas se colocan en posición aórtica4,5,6,7. Su ventaja fundamental es que se logra evitar la anticoagulación (ACO) a largo plazo a expensas de un tiempo de vida útil menor, por lo cual se suelen recomendar en pacientes con esperanza de vida menor que la durabilidad presunta de la prótesis, imposibilidad de una ACO de calidad o contraindicaciones para esta, generalmente por riesgo hemorrágico elevado8,9. El abordaje para el implante de la prótesis biológica puede ser quirúrgico o transcatéter.
En cuanto al tratamiento antitrombótico, aún existe controversia respecto a cuál es la mejor estrategia en etapas tempranas posteriores a la sustitución valvular biológica quirúrgica (primeros 3 meses), dado que la evidencia clásica describe un riesgo de tromboembolias (TE) mayor en ese período posoperatorio temprano10,11. Con la finalidad de prevenir dichos eventos, diversos fármacos han sido estudiados, existe actualmente una disputa en términos de evidencia entre el uso de ácido acetilsalicílico (AAS), warfarina e incluso los anticoagulantes directos (ACOD). Al mismo tiempo, nos encontramos con un escenario particular que modifica el abordaje terapéutico: pacientes portadores de PVB con otras indicaciones de ACO (fibrilación auricular -FA- o flutter auricular, TE reciente, etc.). En esos casos, el dilema central que resta por definir es cuál es el tipo de ACO más adecuada en términos de seguridad y efectividad (warfarina versus ACOD).
Por tanto, en dicho contexto, la finalidad de esta revisión es detallar los aspectos principales de las prótesis biológicas y su tratamiento antitrombótico coadyuvante, así como también mencionar aquellas condiciones con riesgo protrombótico adicional, vistas con frecuencia en este tipo de pacientes, para finalmente plantear un esquema de abordaje terapéutico para estas situaciones clínicas. Nos centraremos en las PVB implantadas de forma quirúrgica.
¿Cuándo utilizar prótesis biológicas?
Como mencionamos, las PVB constituyen un poco más del 50% del total de válvulas implantadas, la mayoría de ellas se colocan en posición aórtica4-7. Debido a las características de las prótesis biológicas, su vida útil y el tratamiento coadyuvante necesario, su utilización tiene ciertas indicaciones particulares. Basándonos en las guías de valvulopatías de la European Society of Cardiology (ESC), vemos que se recomiendan en pacientes con esperanza de vida menor que la durabilidad presunta de la prótesis, imposibilidad de una ACO de calidad o contraindicaciones para esta, generalmente por riesgo hemorrágico elevado, así como también en casos de reintervención por trombosis de válvula mecánica, a pesar de una ACO de calidad (indicaciones IC)8. Las guías de la American Heart Association (AHA) comparten lineamientos similares respecto a las indicaciones de las prótesis biológicas9.
Basándonos en un estudio publicado en el año 2015 por Isaacs y cols.7 vemos cómo el uso de las prótesis biológicas ha aumentado > 70% en los últimos años y, a su vez, se destaca cómo influye en la toma de decisiones el flujo de pacientes a nivel del hospital intervencionista, los centros con bajo volumen de pacientes implantan un menor número de prótesis biológicas en comparación con aquellos de volumen moderado y alto. En el mismo estudio se describe una tasa menor de mortalidad intrahospitalaria con este tipo de válvulas en comparación con las mecánicas.
De esta manera, al momento de decidir el tipo de prótesis valvular a implantar, es necesario tomar en cuenta la opinión del paciente y del resto del equipo clínico-quirúrgico, sopesando los riesgos y beneficios de la ACO coadyuvante, así como el riesgo quirúrgico y la potencial necesidad y riesgo de reintervenciones valvulares futuras, valorando también la experiencia local respecto a la cirugía cardíaca valvular y el implante valvular aórtico transcatéter (TAVI).
Riesgo trombótico. Condiciones clínicas coadyuvantes
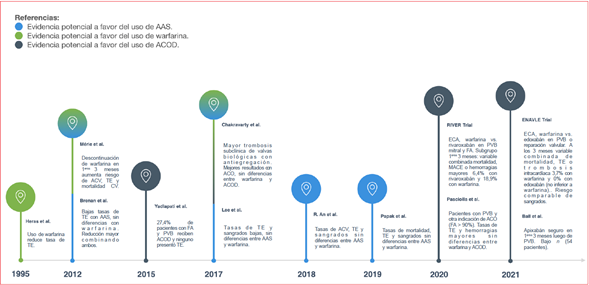
Históricamente se describe un riesgo mayor de TE en el período posoperatorio temprano10, con una incidencia que hoy en día se encuentra entre 0,9% y 1,2% a los 3 meses para las PVB12,13. De forma basal, el riesgo de TE es mayor con las prótesis mecánicas que con las biológicas, así como también en aquellas prótesis implantadas en posición mitral en comparación con la aórtica. La tasa anual global de TE con las válvulas biológicas es cercana al 0,4-0,7%9,14. En un estudio publicado en el año 2017 por Chakravarty y cols.15 se describe una incidencia considerable de trombosis subclínica de las valvas protésicas biológicas en posición aórtica cercana al 12% de los pacientes incluidos en la serie, es más común en aquellas implantadas de forma percutánea que de forma quirúrgica. Del mismo estudio se desprende que la edad avanzada, las válvulas implantadas transcatéter, la fracción de eyección del ventrículo izquierdo (FEVI) reducida y la ausencia de ACO eran factores predictores de la trombosis subclínica de las valvas, la cual se asocia con tasas mayores de accidentes isquémicos transitorios (AIT).
Sin embargo, la presencia de una prótesis valvular no suele ser la única condición protrombótica presente en la mayoría de los pacientes en la práctica clínica habitual. Otras entidades patológicas con potencial trombótico frecuentes de ver en estos pacientes incluyen la enfermedad renal crónica (ERC), desórdenes de la coagulación, TE previas, insuficiencia cardíaca (IC) congestiva, FEVI reducida < 35% y taquiarritmias auriculares, particularmente la FA y flutter auricular1,4,15,16.
De todas las situaciones clínicas mencionadas, la FA es verdaderamente frecuente tanto en la población general como en los pacientes portadores de PVB4,16-18 y, a su vez, suele acarrear dificultades en el momento de su manejo. En lo que respecta a la FA y la EVC, tradicionalmente existía una división en los conceptos de FA valvular y no valvular, pero dado que existe una heterogeneidad marcada respecto a esas definiciones, en la actualidad se plantea el uso de una terminología diversa basada en el tipo de ACO utilizada17-19. De esta manera, se propone la categorización funcional EHRA (Evaluated Heartvalves, Rheumatic or Artificial) en 2 grupos: tipo 1, pacientes con EVC que requiere ACO con antagonistas de la vitamina K (AVK) (incluyen estenosis mitral -EM- moderada-severa o de etiología reumática y prótesis valvulares mecánicas) y tipo 2, pacientes con EVC que requieren ACO con AVK o ACOD (incluyen IM, reparación valvular mitral, EAo, insuficiencia tricuspídea, estenosis tricuspídea, insuficiencia pulmonar, estenosis pulmonar y PVB).
En un estudio descriptivo publicado en el año 2020 por Melgaard y cols.20 observamos que el riesgo anual de TE en pacientes con FA y EVC EHRA tipo 2 es de 1,2 a 1,5%, valores que sobrepasan el nivel a partir del cual la ACO se considera beneficiosa17,21. A punto de partida de otro estudio se desprende que los pacientes que presentan PVB y FA tienen una tasa anual de accidente cerebrovascular (ACV) o TE cercana a 1,95% y una tasa anual de hemorragias aproximada a 1,86%4. La FA se asocia de forma independiente a la estasis sanguínea y formación de trombos, pero la presencia de prótesis valvulares agrega otros factores a la ecuación que predisponen a un ambiente protrombótico, principalmente alteraciones hemodinámicas, daño tisular y exposición de elementos artificiales, con activación de las vías extrínseca e intrínseca de la cascada de la coagulación, respectivamente14,18.
Tratamiento antitrombótico coadyuvante
Los elementos que deben tomarse en cuenta para definir el tratamiento antitrombótico coadyuvante al implante de una prótesis valvular son el tipo de prótesis, el riesgo de TE y el riesgo hemorrágico y, en casos de prótesis biológicas, el tiempo desde su implante14. La evidencia en la actualidad persiste en controversia respecto a cuál es el mejor tratamiento antitrombótico en términos de efectividad y seguridad, fueron estudiados los antiagregantes, la warfarina y más recientemente los ACOD. A pesar de esto, las últimas guías de práctica clínica mantienen niveles de evidencia conflictivos (clase IIa o IIb) en lo que respecta al manejo antitrombótico luego de la sustitución valvular biológica y la reparación valvular sin otras indicaciones adicionales de ACO8,9. Se mantiene un nivel de evidencia fuerte sobre el uso de AAS en los pacientes sometidos a TAVI que no presentan otras indicaciones de ACO8.
Tratamiento antiagregante
La evidencia a favor de la no-inferioridad del tratamiento antiagregante en las PVB sin indicaciones adicionales de ACO existe desde hace varios años.
En un estudio de cohortes con pacientes ≥ 65 años publicado en el 2012 por Brennan y cols.12 se evidenciaban bajas tasas de eventos a los 3 meses con el uso de AAS, describen una mortalidad de 3%, una tasa de TE de 1% y de hemorragias de 1%, sin diferencias estadísticamente significativas con el grupo sometido a ACO con warfarina. Sin embargo, los autores describen una reducción del riesgo de muerte y TE con la combinación de AAS y warfarina, todo a expensas de un aumento del riesgo hemorrágico (riesgo relativo de 2,80 con un IC de 2,18 a 3,0). El agregado de AAS a bajas dosis a la ACO se encuentra incluido en las últimas guías de práctica clínica en el contexto de los pacientes portadores de prótesis valvulares mecánicas y elevado riesgo de TE o en aquellos que presentaron TE a pesar de una ACO adecuada (nivel de evidencia intermedio)8,9,18.
En el año 2017 Lee y cols.13) publican los resultados de un estudio retrospectivo en el que valoran la terapia antitrombótica temprana en pacientes > 60 años sometidos a sustitución valvular aórtica biológica. En este se evidencia que las tasas de TE y hemorragias a los 90 días de la cirugía son bajas, cercanas al 1,2% y 2%, respectivamente, no existen diferencias significativas entre el grupo tratado con AAS y los pacientes bajo warfarina. Por tanto, los autores recomiendan el uso de AAS en este grupo de pacientes, con excepción de aquellos que tienen otra indicación de ACO.
Una revisión sistemática y metaanálisis publicado en el 2018 por An y cols.22 incluyó 2 ensayos clínicos controlados y 5 estudios observacionales que evaluaban el tratamiento antiagregante versus la ACO con warfarina en el período posoperatorio temprano luego de la sustitución valvular aórtica biológica. En dicho estudio se evidenció que las tasas de ACV, TE y mortalidad no mostraban diferencias significativas entre los grupos terapéuticos, con una menor incidencia de sangrados en los pacientes tratados con antiagregantes (nivel de evidencia bajo-moderado).
En el año 2019 Papak y cols.23 publican una revisión sistemática sobre las diferentes estrategias antitrombóticas luego de la sustitución valvular biológica aórtica. Concluyeron que el tratamiento con AAS o con warfarina acarrea resultados similares luego de la intervención quirúrgica en términos de mortalidad, TE y hemorragias. Los hallazgos encontrados en el subgrupo de pacientes sometidos a TAVI concuerdan con las guías de práctica clínica actuales, recomiendan el uso del tratamiento antiagregante simple8.
En contraposición con lo anteriormente mencionado, el estudio observacional publicado por Chakravarty y cols. en 201715 mostró que en los pacientes con PVB aórticas los grupos bajo tratamiento antiplaquetario simple o dual presentaban una prevalencia mayor de trombosis subclínica de las valvas (15% y 16%, respectivamente) en comparación con los individuos tratados con ACO (4%). La presencia de trombosis se asoció con mayores tasas de la variable combinada de ACV o AIT, pero a expensas de un mayor número de AITs, sin diferencias significativas entre las tasas de ACV en los distintos grupos. A su vez, no se evidenciaron diferencias entre los individuos tratados con ACOD y aquellos pacientes que recibieron warfarina, y ambos regímenes de ACO fueron efectivos en el tratamiento de la trombosis subclínica de las valvas. No obstante, debemos destacar que la gran mayoría de pacientes incluidos en el estudio fueron sometidos a TAVI y el número de pacientes portadores de PVB aórtica implantada de forma quirúrgica que presentó trombosis subclínica de la válvula fue muy bajo (5 pacientes), situación que dificulta el análisis estadístico de los resultados obtenidos.
Otra situación clínica en la cual aún existe controversia respecto al rol de la antiagregación es la reparación valvular, estrategia quirúrgica que generalmente se implementa en la valvulopatía mitral, ya que es el gold standard para el tratamiento de la insuficiencia primaria de dicha válvula, es la afectación observada con más frecuencia1-3,8,9. Se ha reportado una incidencia de TE en los primeros 3 meses luego de la reparación valvular mitral cercana a 1,6-2,6%, y la evidencia sugiere tasas similares de eventos en los pacientes tratados con AAS y aquellos bajo warfarina24.
Por tanto, como podemos observar, a pesar de que la evidencia persiste y es discutible, existe una tendencia hacia resultados similares en términos de tasas de TE al comparar el AAS y la warfarina en el período posoperatorio temprano de la sustitución valvular biológica y la reparación valvular, con datos orientadores hacia menores tasas de sangrados con la antiagregación.
Tratamiento anticoagulante
Dentro de las estrategias de ACO, los AVK y, particularmente, la warfarina han sido convencionalmente los más estudiados y recomendados. Sin embargo, en los últimos años ha surgido un interés creciente en la comunidad científica en cuanto al rol de los ACOD en pacientes portadores de PVB, tanto con como sin FA/flutter auricular asociada. Para analizar de forma más ordenada la evidencia, para lograr un abordaje sencillo de aplicar en la práctica clínica, planteamos una división en 2 períodos de tiempo luego de la intervención valvular biológica: una etapa temprana (primeros 3 meses) y una tardía (luego de los primeros 3 meses).
Período posoperatorio temprano
De forma clásica en este período de tiempo se ha recomendado el uso de AVK hasta que se logre una correcta endotelización de la válvula protésica, esta etapa es la que presenta mayor riesgo de TE8,14. En 1995 Heras y cols.10) demuestran que el riesgo de TE era particularmente elevado en los primeros 90 días luego de la intervención quirúrgica y se encontraron tasas mayores de eventos en pacientes sin ACO, válvulas en posición mitral, TE previas y edad avanzada. A su vez, evidenciaron que la demora en lograr niveles terapéuticos adecuados de ACO podía resultar en la formación temprana y rápida de trombos a nivel valvular y auricular. La tasa anual de sangrados fue 2,3%, la mayoría de los pacientes eran tratados con warfarina. Sin embargo, diversas características metodológicas del estudio interfieren con la interpretación de sus resultados. Por un lado, estamos frente a un estudio realizado entre los años 1975 y 1982, por lo cual las características de la cirugía cardíaca de dicha época difieren con la actualidad, hecho que se ve reflejado en las tasas más elevadas de TE (13% sufrieron al menos 1 episodio) y mortalidad (47% fallecieron en el seguimiento) en comparación con series de casos publicadas hoy en día. Por otra parte, vemos cómo los pacientes con prótesis mitral y aórtica tratados con ACO tenían una prevalencia similar de FA, TE previa y dimensiones de la aurícula izquierda que aquellos sin ACO, y, a su vez, los pacientes portadores únicamente de prótesis mitral mostraban una incidencia mayor de FA. Por tanto, podemos ver que existe un sesgo en el análisis estadístico, ya que probablemente los resultados obtenidos con el uso de ACO se debieran a su beneficio en pacientes con FA como ha demostrado la evidencia en los últimos años.
Como mencionamos anteriormente, en el 2012 Brennan y cols.12 evidencian bajas tasas de eventos TE y hemorrágicos a los 3 meses de la intervención, sin diferencias significativas entre el uso de warfarina y AAS. Sin embargo, postulan un beneficio en términos de reducción del riesgo de muerte y TE con la combinación de ambos fármacos, a expensas de un aumento considerable en el riesgo de sangrados.
En el mismo año, Mérie y cols.25 publican un estudio retrospectivo que analizó la asociación entre la duración del tratamiento con warfarina luego del reemplazo valvular aórtico biológico y el riesgo de mortalidad, TE y sangrados. La conclusión principal a la que llegan los autores es que la suspensión del tratamiento con warfarina en los primeros 3 meses posoperatorio se asocia a un incremento significativo en el riesgo de ACV, TE y mortalidad cardiovascular. En el estudio se describe una incidencia de ACV del 2,7%, TE 5%, hemorragias 1,8% y mortalidad 6,0% a los 30 días del seguimiento luego de la cirugía. Sin embargo, cabe destacar que, dentro de los pacientes incluidos, la monoterapia con AAS fue utilizada infrecuentemente, por lo que el análisis estadístico se realizó entre tratamiento con warfarina versus tratamiento sin warfarina, sin realizar una comparación directa con el uso de AAS. A su vez, desde la perspectiva metodológica fue un estudio no aleatorizado en el cual se tomaron los datos sobre la medicación de un registro farmacéutico asumiendo varias características del tratamiento, como ser dosis inicial de la warfarina, dosis de mantenimiento e incluso el momento de la suspensión del fármaco, sin aclarar los motivos para la interrupción de la ACO.
Dado que la evidencia en la literatura respecto al uso de la ACO con fármacos no-AVK en este contexto era escasa, con el pasar de los años comenzó a tomar mayor interés el uso de los ACOD en pacientes con FA y EVC, así como también en aquellos individuos portadores de PVB. Es así que en el año 2015 Yadlapati y cols.26 publican los resultados de un estudio retrospectivo que evaluó la eficacia y la seguridad de los ACOD en pacientes con FA y prótesis biológicas. Analizaron a 73 pacientes y los autores concluyeron que el uso de ACOD acarreaba tasas de TE bajas a expensas de un leve aumento en los sangrados. Del total de pacientes, un 27,4% (20 individuos) comenzaron a recibir ACOD en los primeros 3 meses del posoperatorio y ninguno de ellos presentó TE en el seguimiento.
A fines del año 2019, se lleva a cabo un análisis derivado del estudio PARTNERII A11 cuyo objetivo principal fue evaluar el impacto de la ACO luego del implante de PVB (quirúrgicas o TAVI) en la hemodinamia de la válvula (gradientes y área valvular efectiva) y en variables clínicas (mortalidad, TE, rehospitalización, ACV, sangrados). Los autores concluyeron que a corto plazo la ACO temprana luego del reemplazo aórtico biológico quirúrgico no afectaba los resultados clínicos (TE y hemorragias), así como tampoco tuvo efectos significativos en los parámetros hemodinámicos de la válvula. Los pacientes sometidos a TAVI que fueron dados de alta bajo ACO presentaron aumento en la incidencia de mortalidad, rehospitalización y sangrados, sin diferencias significativas en la incidencia de ACV. Lamentablemente, solo 5% de los pacientes incluidos fueron tratados con ACOD y, a su vez, del total de pacientes bajo ACO, la gran mayoría recibieron antiagregación de forma concomitante.
En el año 2020 Pasciolla y cols.27 publican un estudio retrospectivo de cohortes en el cual evaluaron la ACO en los primeros 6 meses luego de la sustitución valvular biológica aórtica o mitral de 197 pacientes, valoraron tasa de TE y hemorragias. El tiempo promedio hasta iniciada la ACO fue de 4 días luego de la cirugía y casi la totalidad de los pacientes recibieron AAS de forma concomitante. En estas condiciones se evidenciaron únicamente 3 eventos TE y 11 episodios de sangrados mayores, sin diferencias estadísticamente significativas entre el grupo tratado con ACOD y aquellos que recibieron warfarina. La indicación de ACO fue FA en > 90% de los pacientes.
Siguiendo la misma línea del estudio de los ACOD, en el mismo año se publican los resultados del estudio RIVER28, un ensayo clínico aleatorizado que comparó el uso de rivaroxabán versus warfarina en pacientes con FA y PVB mitral, analizaron la mortalidad, eventos cardiovasculares mayores (MACE) y sangrados mayores a 12 meses de seguimiento. Un 18,8% de los pacientes incluidos en el estudio (189 individuos) fueron aleatorizados y, por ende, comenzaron la ACO durante los primeros 3 meses luego de la cirugía. En este subgrupo la incidencia de la variable principal combinada de mortalidad, MACE o hemorragias mayores ocurrió en un 6,4% en el grupo rivaroxabán versus un 18,9% en el grupo warfarina (hazard ratio 0,31 con un IC de 0,12 a 0,79), con una media de tiempo hasta el evento primario mayor en los pacientes tratados con rivaroxabán (348,6 versus 313,5 días). Con base en estos hallazgos, hoy en día encontramos en la guía de abordaje a las valvulopatías de la ESC 2021, con un nivel de evidencia IIb, el uso de ACOD sobre AVK en los primeros 3 meses posteriores al implante de una válvula biológica en posición mitral en pacientes con FA8. El resultado final del estudio evidenció que el uso de rivaroxabán es no inferior a la warfarina respecto al tiempo promedio hasta la variable principal combinada, no existen diferencias entre la incidencia de las variables muerte cardiovascular o TE, mortalidad y hemorragias, con una tendencia a menores episodios de ACV con el grupo bajo ACOD (0,6% versus 2,4% con warfarina).
A mediados del 2021, Young Shim y cols. publican los resultados del estudio ENAVLE29, un ensayo clínico aleatorizado que comparó la eficacia y la seguridad del edoxabán versus warfarina luego del implante quirúrgico de una PVB o reparación valvular. La aleatorización se realizó durante la internación en los primeros 5 a 9 días posoperatorio. Un total de 218 pacientes fueron analizados, de los cuales 107 se sometieron a reemplazo aórtico, 45 a sustitución mitral y 86 a reparación mitral. A 3 meses del seguimiento, la variable principal combinada de mortalidad, TE clínica o trombosis intracardíaca asintomática ocurrió en un 3,7% de los pacientes tratados con warfarina versus un 0% de aquellos individuos bajo edoxabán; se describieron tasas de sangrados mayores de 0,9% en el primer grupo y 2,8% en el segundo. Por tanto, se concluyó que el tratamiento con edoxabán es no inferior al uso de warfarina en términos de eficacia para prevenir TE en los primeros 3 meses luego de la reparación valvular o sustitución valvular biológica quirúrgica, con una tendencia a presentar un riesgo comparable de sangrados mayores. Se destaca que, durante el estudio, dentro de los pacientes bajo ACO con warfarina, el International Normalized Ratio (INR) se encontró en rango terapéutico el 53,4% del tiempo.
Por último, otro estudio de tipo retrospectivo de cohortes fue publicado en el mismo año por Ball y cols.30). Este concluyó que el uso de apixabán es seguro en los primeros 3 meses posteriores al implante de la PVB, pero lamentablemente contó con pocos pacientes incluidos en el análisis (54 individuos).
Podemos observar cómo, a pesar de que la literatura clásica sugiere el uso de AVK en el período posoperatorio temprano luego del implante de una PVB o reparación valvular, la evidencia a favor de su uso en ausencia de otras indicaciones de ACO es escasa, se tiende a lograr resultados similares con el uso de antiagregación simple. Por otra parte, en aquellos pacientes con indicaciones adicionales de ACO (generalmente FA), ha ganado terreno la evidencia a favor del uso de los ACOD debido a las ventajas que estos ofrecen como fármacos más prácticos de utilizar y a los datos recabados en los distintos estudios que orientan a un grado de eficacia y seguridad al menos equiparable con el uso de warfarina. Por tanto, concluimos que:
1) las tasas de TE y sangrados en los primeros 3 meses luego de la sustitución valvular biológica o reparación valvular descritas en la actualidad son relativamente menores que las vistas en series de casos más antiguas;
2) existe evidencia a favor de la seguridad y efectividad del uso de los ACOD en el período posoperatorio temprano luego de la sustitución valvular biológica o reparación valvular en pacientes con indicaciones adicionales de ACO, particularmente con rivaroxabán y edoxabán. Podemos observar la evidencia de forma gráfica más clara en la figura 1.
Período posoperatorio tardío
La evidencia en los últimos años respecto al uso de ACOD en patologías que requieren ACO como FA17,31-33, embolia pulmonar34 e incluso en el contexto de cardiopatía isquémica35,36 no se centra específicamente en su utilidad en individuos con PVB o reparación valvular previa, pero ha funcionado como disparador para distintos análisis y estudios posteriores en este subgrupo tan particular de pacientes. Los estudios generalmente se centraron en pacientes con FA no valvular (según la terminología clásica), por lo que muchas veces por diferencias en las definiciones, no se incluían individuos portadores de PVB. Sin embargo, se han logrado recabar ciertos datos de utilidad de los estudios más icónicos sobre ACOD en FA para poderlos aplicar en esta etapa del posoperatorio tardío en pacientes con prótesis biológicas.
En el año 2011 se publican los resultados del estudio ARISTOTLE31, donde Granger y cols. demuestran que el uso de apixabán en pacientes con FA es superior a la warfarina en términos de prevención de ACV o TE, menores hemorragias y menor mortalidad. Fueron excluidos del estudio los pacientes con EM significativa o prótesis valvulares mecánicas, pero un subgrupo de individuos eran portadores de FA y EVC (26,4% de los pacientes). De todos ellos, 104 pacientes tenían como antecedente un reemplazo valvular biológico o una reparación valvular más allá de 3 meses previos a la inclusión al estudio. En estos grupos, varios autores llevaron a cabo revisiones de datos, encontraron que las tasas de eventos eran bajas, sin diferencias entre el uso de apixabán y de warfarina, resultados acordes a las conclusiones generales del estudio ARISTOTLE37,38.
Continuando en la misma línea, en el año 2013 Giugliano y cols. publican los resultados del estudio ENGAGE AF-TIMI 4833, donde se demuestra la no inferioridad del edoxabán frente a la warfarina respecto a la prevención de ACV o TE en pacientes con FA, encontraron tasas más bajas de hemorragias y mortalidad por causas cardiovasculares con su uso. Del total de pacientes incluidos, aquellos con sustitución valvular biológica previa (191 individuos) presentaron tasas similares de ACV o TE y sangrados mayores con edoxabán comparado con el uso de warfarina39.
Posteriormente, Durães y cols. intentan llevar a cabo un estudio aleatorizado para valorar el uso de dabigatrán en pacientes con PVB y FA, pero lamentablemente fue finalizado de forma prematura debido al bajo reclutamiento de pacientes40. De todas formas, existía una tendencia hacia resultados similares entre el uso de warfarina y dabigatrán en prevenir la formación de trombos intracardíacos.
A modo de profundizar en la situación, en el año 2017 Pan y cols.41 llevan a cabo una revisión sistemática y metaanálisis a modo de valorar los perfiles de riesgo-beneficio del uso de ACOD versus warfarina en pacientes con FA y EVC. Los estudios analizados no incluían individuos portadores de prótesis mecánicas ni EM moderada-severa, pero sí pacientes con PVB. A pesar de no haberse realizado un análisis específico de esta subpoblación, los resultados generales fueron positivos a favor del uso de ACOD en términos de prevención de TE y menores tasas de sangrados.
Siguiendo con el estudio de la ACO en este contexto, en el mismo año se publica otra revisión sistemática y metaanálisis en el European Heart Journal por Caldeira y cols.42 que apuntó a analizar la eficacia y la seguridad de los ACOD en pacientes con FA y EVC comparados con la warfarina. Los hallazgos principales fueron los siguientes:
1) el uso de ACOD reduce el riesgo de ACV y TE en estos pacientes;
2) el riesgo de hemorragia intracraneana se redujo significativamente con el uso de ACOD de forma similar en pacientes tanto con como sin EVC asociada; y
3) las tasas de TE y sangrados mayores fueron similares entre ambos grupos terapéuticos en aquellos pacientes con PVB.
Una revisión publicada en el 2018 por Andrade y cols.43 muestra cómo la evidencia hasta ese momento, pese a que los datos eran limitados, orienta hacia resultados similares con el uso de ACOD o warfarina en pacientes con FA y PVB. En el mismo año, Russo y cols.44 publican los resultados de un estudio observacional que incluyó 122 pacientes con reparación valvular previa o PVB con FA tratados con ACOD. En este, se evidenció una incidencia anual baja de TE (0,8%) y hemorragias mayores (1,3%), por lo que los autores concluyeron que el uso de ACOD es una estrategia efectiva y segura en este subgrupo de pacientes. Utilizando la misma base de datos, al año siguiente los mismos autores publican nuevos resultados, marcan que el uso de ACOD parecería estar asociado a un beneficio clínico neto mayor versus el uso de warfarina en pacientes con FA y PVB, a expensas de menores tasas de sangrados mayores y TE6.
En el año 2019, se publica una revisión por Anderson y cols.45 centrada en valorar la eficacia y la seguridad del uso de ACOD para el tratamiento de pacientes con FA y EVC. El resultado principal del estudio reafirma la evidencia conocida hasta el momento, plantea que los ACOD se deben evitar en pacientes que presentan EM moderada-severa o válvulas protésicas mecánicas, es razonable su uso en presencia de otras EVC, incluyendo las prótesis biológicas. A su vez, Malik y cols.46 en su artículo de revisión agregan datos a favor del uso de ACOD en pacientes con EVC y en aquellos con PVB.
Hampton y cols.47 en el año 2020 realizan un estudio retrospectivo de cohortes que incluyó 200 pacientes con EVC y FA tratada bajo ACOD, en vistas a valorar la efectividad y la seguridad del tratamiento. La mayoría de los pacientes recibieron apixabán (66,5%), seguido de rivaroxabán (25%) y dabigatrán (8,5%). La tasa global de ACV o TE fue de 3,5%, sin diferencias significativas entre las distintas afectaciones valvulares. Por último, la tasa global de hemorragias mayores fue 5,5%, sin diferencias significativas entre las distintas válvulas y ACOD utilizado.
En el año siguiente, Izumi y cols.4 publican los resultados de un estudio prospectivo observacional con pacientes portadores de FA y PVB. En este se encontraron tasas anuales relativamente bajas de eventos, con un 1,95% para ACV o TE y 1,86% para sangrados mayores. Del total de pacientes incluidos en el estudio, un 30% fueron tratados con ACOD y no se evidenciaron diferencias significativas con el grupo bajo warfarina respecto al riesgo de TE y sangrados. Un 28% de los individuos de cada grupo terapéutico recibió concomitantemente antiagregación.
Posteriormente, en el año 2021 se publican los resultados de otro estudio retrospectivo sobre la comparación del uso de warfarina y ACOD en pacientes con FA y PVB48. En este no se evidenciaron diferencias significativas en la incidencia de TE, pero existió un menor riesgo de la variable de seguridad combinada de hemorragia intracraneal, sangrado digestivo y otros sangrados. Por tanto, concluyeron que el uso de ACOD en estos pacientes es igual de efectivo que la warfarina, es una alternativa adecuada a considerar en pacientes con FA y PVB.
En el mismo año, en Italia, Mannacio y cols.49 llevan a cabo un estudio retrospectivo que evaluó la eficacia y la seguridad de los ACOD utilizados 4 meses después del reemplazo valvular aórtico biológico en pacientes con FA. Los autores concluyeron que el uso de ACOD en esas condiciones era más efectivo que la warfarina en términos de incidencia anual de TE (13,1% versus 21,8%, respectivamente) y sangrados mayores (2,4% versus 4,2%, respectivamente).
Finalmente, en el 2021 se publican los resultados de un estudio retrospectivo a gran escala llevado a cabo por Dawwas y cols.50 que analizó el uso de ACOD versus warfarina en pacientes con FA y EVC, encontraron mejores resultados clínicos a favor del grupo tratado con ACOD. La mayor parte de los individuos presentaba enfermedad valvular mitral o aórtica, pero lamentablemente ser portador de una PVB fue considerado un criterio de exclusión para el estudio.
En contraposición con lo anteriormente mencionado, un estudio observacional retrospectivo realizado en Finlandia, cuyos resultados fueron publicados en el 2021 por Myllykangas y cols.51, mostró una asociación entre el uso de ACO y un riesgo aumentado de ACV, con reducción del riesgo de mortalidad, para una media de seguimiento cercana a 3 años luego de la cirugía. Sin embargo, no existió una diferencia estadísticamente significativa entre los pacientes tratados con warfarina y ACOD en términos de ACV (17,3% versus 19,7%, respectivamente) y complicaciones hemorrágicas (6,8% versus 7,2%, respectivamente). Cabe destacar que, del total de pacientes incluidos en el estudio, aproximadamente un 21% presentaban FA previa, de los cuales la mayoría fueron incluidos en el grupo de ACO.
Como podemos ver, a diferencia del período posoperatorio temprano, existe amplia evidencia a favor del uso de ACOD en pacientes con PVB y FA (la principal indicación de ACO) pasados los primeros 3 meses luego de la intervención valvular. Por tanto, parece adecuado utilizarlos, ya que han demostrado ser al menos igual de efectivos y seguros que la warfarina, e incluso con una tendencia hacia la superioridad en lo que refiere a prevención de TE y sangrados.
Esquema de abordaje clínico
Ahora bien, con la evidencia sobre la mesa, resta interpretarla, procesarla y plasmarla de forma adecuada en la práctica clínica. Por tanto, parece apropiado tener en cuenta algunos puntos clave para el encare del tratamiento antitrombótico en los pacientes portadores de PVB (figura 2).
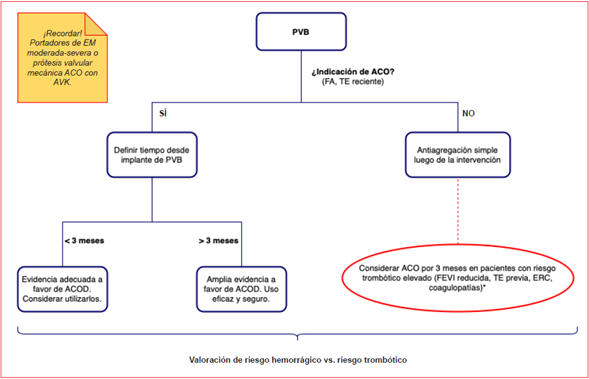
Figura 2: Esquema de abordaje clínico. PVB: prótesis valvular biológica; ACO: anticoagulación; FA: fibrilación auricular; TE: trom boembolia; ACOD: anticoagulantes directos; AVK: antagonistas de la vitamina K; FEVI: fracción de eyección del ventrículo izquier do; ERC: enfermedad renal crónica.
A.¿Qué riesgo hemorrágico y trombótico presenta el paciente?
En este punto es muy común en la práctica clínica apoyarnos en scores de valoración de riesgo, los más conocidos son el CHA2DS2-VASc y HAS-BLED, el primero de ellos está avalado para el uso en pacientes portadores de FA17, pero ambos son muy utilizados en distintas situaciones clínicas que impliquen el análisis del riesgo trombótico y hemorrágico. Esta valoración de riesgo debe llevarse a cabo como primer escalón del abordaje clínico y mantenerse durante los otros pasos del encare terapéutico. En primer lugar, se deben de tener en cuenta las condiciones clínicas y paraclínicas de riesgo a favor y en contra de la ACO y, posteriormente, se deben valorar factores específicos del uso de ACOD y de la warfarina.
Es sabido que los AVK presentan gran variabilidad en términos de dosis necesaria y respuesta individual de cada paciente, en donde la edad, el sexo y el uso de fármacos concomitantes explican alrededor del 15% de esas alteraciones52. Sus principales desventajas incluyen las marcadas interacciones farmacológicas y dietéticas, y el requisito de una monitorización de la coagulación seriada mediante el estudio del INR. Es así que se ha descrito en distintas series de casos un porcentaje cercano a 40-60% de pacientes que presentan una ACO subóptima con warfarina, definida como un tiempo en rango terapéutico < 65%53,54. El score SAMe-TT2R2 incluye como variables el sexo, la edad, los antecedentes patológicos, los fármacos concomitantes, el tabaquismo y la raza, y ha demostrado ser un buen predictor de una ACO subóptima con el uso de warfarina52,54, con valores > 3 puntos es preferible utilizar ACOD19.
Los ACOD presentan muchos puntos a favor en términos de seguridad, efectividad y conveniencia, pero no se encuentran libres de desventajas. Las principales de ellas incluyen falta de evidencia sólida en el contexto de PVB, disponibilidad de los fármacos y sus antídotos, costo económico e interacciones farmacológicas19. A pesar de esto, su uso en la práctica clínica ha aumentado en los últimos años de forma marcada gracias a la evidencia creciente a su favor, incluyendo pacientes portadores de PVB.
B.¿Tiene el paciente otras indicaciones de ACO?
Si el paciente no presenta otras indicaciones de ACO (como FA o TE reciente), existe evidencia considerable a favor del uso de antiagregación simple en los primeros 3 meses posteriores a la intervención valvular, dado que el AAS ha demostrado resultados similares a la warfarina respecto a la reducción de TE en este período de tiempo, con una tendencia a reducir las tasas de sangrados. Podría considerarse el uso de ACO en la etapa posoperatoria precoz en aquellos casos de pacientes con elevado riesgo trombótico (FEVI reducida, TE previa, ERC, coagulopatías), teniendo en cuenta siempre el riesgo hemorrágico individual.
C.En el paciente que requiere ACO, ¿cuánto tiempo pasó desde el implante de la PVB?
En general, la indicación más frecuente de ACO plasmada en las distintas series de casos es la FA. En este punto dividimos a los pacientes según nos encontremos en el período posoperatorio temprano o tardío. En individuos portadores de PVB cuya intervención valvular se realizó hace más de 3 meses, es efectivo y seguro utilizar los ACOD para el tratamiento de la entidad que requiere ACO, con vasta evidencia que sugiere no inferioridad respecto a la warfarina, e incluso con una tendencia a la superioridad de estos. En aquellos pacientes que aún se encuentran en los primeros 3 meses del implante de la PVB, parece adecuado el uso de ACOD, ya que, aunque la evidencia persiste siendo controversial, gran parte de los estudios y análisis han plasmado que no existen diferencias significativas entre su utilización y el tratamiento con warfarina, y demuestran tasas de TE y sangrados relativamente bajas y similares entre ambos grupos.
D.¿EM moderada-severa o de etiología reumática o prótesis valvular mecánica?
A pesar de que existen estudios en marcha para evaluar el uso de ACOD en estos pacientes55-57, hoy en día el manejo de la ACO debe realizarse bajo un régimen de AVK, ya que la evidencia actual contraindica los ACOD en estas condiciones8,9.
De esta manera, intentamos simplificar de la mejor forma una situación clínica tan compleja como lo es el uso de antitrombóticos en pacientes portadores de PVB. Para lograr un abordaje clínico completo y de la manera más adecuada posible, es necesario tener en cuenta la evidencia actual, los puntos clave mencionados, la disponibilidad y la experiencia de cada centro hospitalario, y también condiciones inherentes a cada paciente que muchas veces son omitidas en los ensayos clínicos y estudios analíticos, como el medio socioeconómico y las preferencias del paciente.
Conclusiones
Hemos realizado un análisis en profundidad respecto al riesgo trombótico que acarrea el hecho de ser portador de una PVB, sumado muchas veces a condiciones adicionales con riesgo sobreagregado. Esto conlleva una situación clínica de difícil manejo al momento de decidir el tratamiento antitrombótico coadyuvante, la evidencia hoy en día persiste en controversia. A pesar de esto, la tendencia actual al uso más frecuente de ACOD también se está dirigiendo a la inclusión de los pacientes con PVB. Esta población incluye un número importante de pacientes, y más aún son aquellos que presentan FA concomitantemente, la afectación más frecuente que agrega riesgo trombótico al panorama clínico del individuo.
Para enfrentar estas situaciones, diversos fármacos han sido estudiados, principalmente el AAS, la warfarina y más recientemente los ACOD. Como hemos visto en la revisión, el abordaje clínico y, por ende, el tratamiento antitrombótico que se utilizará dependerá de si nos encontramos en el período posoperatorio temprano o tardío, así como también de la presencia de condiciones sobreagregadas que requieran ACO. Es así que las principales conclusiones tomadas de esta revisión son:
1) las tasas de TE y hemorragias en los primeros 3 meses posteriores al implante de una PVB o reparación valvular son relativamente bajas;
2) en pacientes sin indicaciones adicionales de ACO es adecuado utilizar AAS dada su efectividad comparable con la warfarina y las menores tasas de sangrado que acarrea su uso;
3) en pacientes con indicaciones adicionales de ACO es adecuado utilizar ACOD luego de los primeros 3 meses posteriores al implante de la PVB o reparación valvular, dado que su efectividad y seguridad es comparable a la warfarina, con una tendencia a la superioridad en prevención de TE y menores sangrados; y
4) existe evidencia a favor de la seguridad y la efectividad del uso de los ACOD en el período posoperatorio temprano luego del implante de la PVB o reparación valvular en pacientes con indicaciones adicionales de ACO, particularmente con rivaroxabán y edoxabán.