Introducción
El cuidado del paciente crítico en sus diferentes escenarios ha evolucionado en el último siglo, in tegrando y desarrollando diferentes estrategias diagnósticas y terapéuticas que han incremen tado su sobrevida y reducido eventos adversos. Una de estas principales evaluaciones es la mo nitorización hemodinámica, la cual mediante un conjunto de técnicas y parámetros evalúa el es tado y el comportamiento del sistema cardiovas cular, previene o diagnostica perfusión tisular u oxigenación inadecuada y orienta la estrategia terapéutica requerida. Se trata de una evaluación con constantes avances, que ha pasado desde técnicas básicas de monitorización hasta sofisticados dispositivos, situación que hace necesaria su fre cuente revisión y análisis1,2.
En este artículo, proporcionaremos una des cripción general e integrada de las diferentes téc nicas de monitorización clínicas, gasométricas y ecocardiográficas, así como aspectos fisiológicos relevantes para su entendimiento y empleo tera péutico3.
Discusión
La hemodinamia se refiere al flujo sanguíneo en relación con los parámetros del sistema arterial, por lo tanto, su conocimiento permite determinar el estado del sistema cardiovascular, condición hemodinámica del paciente y estrategia terapéu tica requerida1,3,4.
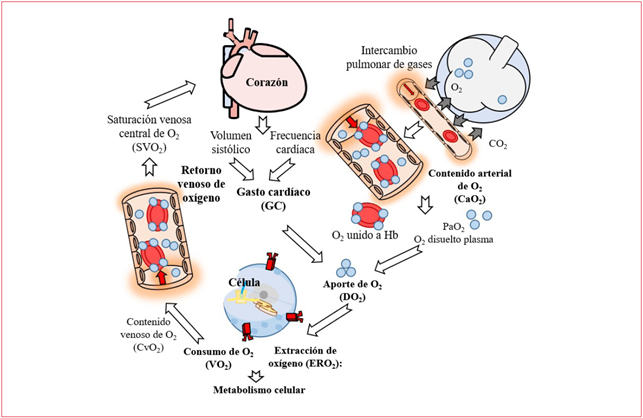
El objetivo del sistema cardiopulmonar es llevar el oxígeno presente en la atmósfera hasta las mitocondrias de cada célula del organismo, en cantidades adecuadas para satisfacer las de mandas metabólicas del cuerpo. Una vez realiza do el intercambio pulmonar de gases en el apa rato respiratorio, se debe garantizar el aporte de sustratos y O2 a los tejidos, lo cual dependerá de la perfusión del tejido y un adecuado transporte de O25,6.
Al llegar el O2 a la circulación capilar, se pro duce el fenómeno de aporte de O2 (DO2), este atra viesa el endotelio y su membrana basal, el líquido intersticial, la membrana celular, el citoplasma y finalmente las paredes de la mitocondria, don de según el metabolismo celular será el consumo de O2 por los tejidos (VO2), la cantidad de oxíge no que se libera en cada tejido es proporcional a sus demandas metabólicas y a su capacidad de extracción; esto determina una presión venosa de O2 (PvO2) particular para cada tejido1,7 (figura 1).
Cualquier aporte insuficiente de nutrientes y O2 necesarios para la actividad celular normal da como resultado un estado de hipoperfusión tisu lar, cuyas causas pueden obedecer a alteraciones en el volumen circulante efectivo (hipovolemia), la función cardíaca, tono vascular (choque vasopléji co) y/o alteraciones respiratorias8.
Indicaciones de monitorización hemodinámica
Todos los pacientes graves deben tener una míni ma monitorización que comprende presión arte rial, electrocardiograma, pulsioximetría, control de diuresis, presión venosa central, saturación ve nosa central de O2. Sin embargo, algunos pacien tes requieren una monitorización hemodinámica exhaustiva, sus indicaciones son: choque refrac tario, pacientes posquirúrgicos con alto riesgo de inestabilidad hemodinámica, pacientes con fallo cardíaco o choque cardiogénico9,10.
Utilidad de la monitorización hemodinámica
El objetivo de la monitorización hemodinámica es la evaluación y optimización del sistema cardiovascu lar que permita combatir el desequilibrio sistémico entre el suministro y la demanda de O2 de los teji dos, que van desde la hipoxia tisular global hasta el choque manifiesto y la falla de múltiples órganos5.
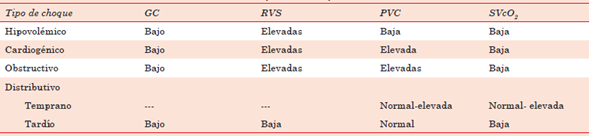
La medición de parámetros hemodinámicos identifica la estrategia terapéutica requerida des de reanimación con líquidos, vasopresores o ino trópicos3. A la vez, según su perfil hemodinámico, es una herramienta diagnóstica para determinar el tipo de choque (hipovolémico, cardiogénico, obs tructivo o distributivo)8 (tabla 1).
Parámetros hemodinámicos a monitorizar
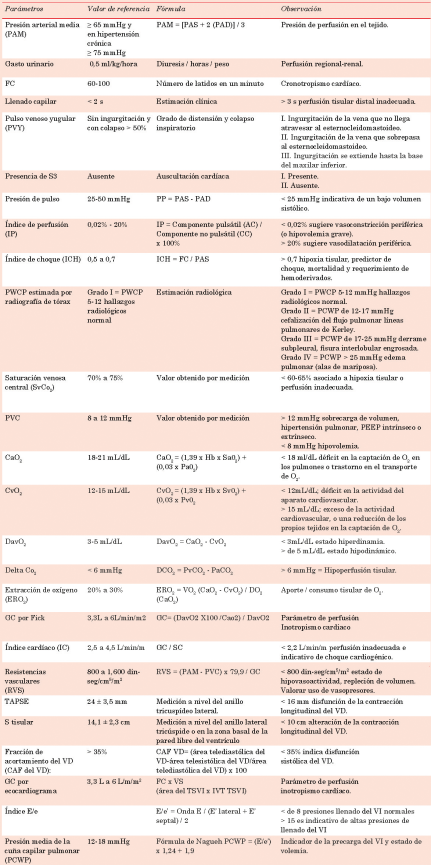
Los parámetros que se deberán monitorizar son aquellos que nos indican el estado del sistema cardiovascular e indirectamente evalúan la perfu sión y la oxigenación tisular. Se pueden generali zar en tres modalidades: clínicos, gasométricos y ecocardiográficos1,11) (tabla 2).
Parámetros hemodinámicos clínicos
El monitoreo hemodinámico por clínica permite evaluar la perfusión tisular general y regional, es una herramienta útil, altamente reproducible con buena correlación con otros marcadores de perfu sión tisular12.
Presión arterial media (PAM): valora una adecuada presión de perfusión en el tejido, su variabilidad depende del valor del gasto car díaco y la resistencia vascular periférica4. Los resultados del estudio SEPSISPAM (Sepsis y Presión Arterial Media) sugieren un obje tivo de PAM de 65 a 75 mmHg en pacientes con choque, pero una PAM mayor (de 75 a 85 mmHg) es recomendable en pacientes con hi pertensión arterial crónica. Una PAM de 65 a 90 mmHg y una presión arterial sistólica de 90 a 130 mmHg son objetivos razonables; PAM = (PAS + 2 (PAD))/ 38,13.
Gasto urinario: la valoración de la diuresis por horario constituye un marcador de perfusión regional, se considera un indicador de flujo sanguíneo renal e indirectamente de un estado de llenado intravascular adecuado. Son valores aceptables mayores a 0,5 ml/kg/ hora14,15.
Presión de pulso: evalúa la elastancia ventri cular y la elastancia arterial, su valor se obtiene de la resta presión arterial sistólica - presión arterial diastólica (PP = PAS - PAD). Se conoce como presión de pulso amplia si es mayor 50 mmHg (con valor de riesgo para eventos cardio vasculares) y presión de pulso estrecha menor de 25 mmHg, lo que indica un bajo volumen sistólico (hipovolemia, choque cardiogénico o choque obstructivo, ICC) y es un marcador de capacidad de respuesta de fluidos16,17.
Llenado capilar: variable dependiente de la perfusión tisular distal controlada por el endo telio y la resistencia vascular periférica, deno ta de forma indirecta alteración hemodinámica del estado microcirculatorio. Son anormales valores mayores a 3 segundos14,18.
Presión venosa central (PVC): marcador indirecto del estado de volumen intravascular que estima la precarga del ventrículo derecho (VD); resulta de la interacción del retorno ve noso hacia la aurícula derecha y la presión de llenado del VD19. Los valores normales osci lan entre 8 a 12 mmHg; una PVC baja puede representar hipovolemia; una PVC alta deno ta sobrecarga de volumen, hipertensión pul monar, PEEP intrínseco o extrínseco, procesos restrictivos pulmonares20.
Pulso venoso yugular (PVY): parámetro de volemia que estima la presión de la aurícula derecha y grado de retorno venoso. Su ins pección y estimación de grado de distensión identifica congestión sistémica y elevación de la presión de llenado del lado izquierdo, se considera un signo de congestión intravascu lar acorde a su grado de distensión y colapso inspiratorio21.
Presencia de S3: ruido cardíaco resultado de un llenado ventricular rápido, es indicativo de sobrecarga de volumen cardíaco y disfunción sistólica. Se considera un signo de congestión intravascular (congestión intracardíaca)22.
Presión media de la cuña capilar pulmo nar estimada por radiografía de tórax: medida no invasiva del estado del volumen intravascular que valora el grado de conges tión pulmonar, estimando la presión de en clavamiento capilar pulmonar con base en los hallazgos radiológicos. Grado I = PWCP 5-12 mmHg, hallazgos radiológicos normal; grado II = PCWP 12-17 mmHg, cefalización del flujo pulmonar líneas pulmonares de Kerley; grado III = PCWP 17-25 mmHg, derrame subpleu ral, fisura interlobular engrosada; grado IV = PCWP > 25 mmHg, edema pulmonar (alas de mariposa). Debido a su sensibilidad y especificidad moderadas, solo debe considerarse cuando no están disponibles métodos hemodi námicos23,24,25.
Índice de perfusión (IP): marcador indirec to no invasivo continuo de perfusión periférica que evalúa la relación entre el funcionamiento cardíaco y la resistencia vascular periférica, refleja el tono vasomotor periférico, mediante el cálculo de la fuerza pulsátil en un sitio es pecífico de control (relación de las ondas pulsá tiles y no pulsátiles), medidas a través de un oxímetro de pulso. IP = componente pulsátil (AC) / componente no pulsátil (CC) x 100%. Su valor promedio es de 0,02%-20%. Un bajo IP sugiere vasoconstricción periférica (o hipovole mia grave) e IP alto sugiere vasodilatación26.
Índice de choque (ICH): parámetro clínico de perfusión tisular y desenlaces clínicos que informa de la respuesta integrada de los sis temas cardiovascular y nervioso, identificando estados compensatorios previo al colapso car diovascular (predictor temprano de deterioro hemodinámico). Su fórmula es FC / PAS, con un valor normal 0,5 a 0,7; valores elevados (> 0,7) indican alteración de la función ventricu lar izquierda secundaria al choque, lo que pre dice requerimiento de transfusión. Se deben contemplar factores externos que modifican su valor como el uso de fármacos betabloqueado res, antihipertensivos, la presencia de dolor o ansiedad27-29.
Parámetros hemodinámicos gasométricos
La monitorización hemodinámica por gasometría está basada principalmente en parámetros de transporte, aporte, perfusión y extracción, deriva dos de la hemodinámica global.
Saturación venosa central de oxígeno (ScvO2): medida de transporte de oxígeno que evalúa la idoneidad del suministro de oxígeno. Se considera un indicador de la oxi genación tisular global al integrar el estado cardiopulmonar y hemodinámico, informa del equilibrio entre el transporte de oxígeno (DO2) y el consumo (VO2), reflejando la cantidad de O2 no extraído por los tejidos. Una vez que las necesidades metabólicas han sido cubiertas, oscila entre 70 y 75%; los valores < 60% son indicativos de hipoxia tisular o perfusión inadecuada6,8,30,31.
Resistencias vasculares periféricas (RVP): resistencia ofrecida por el lecho vascular sistémico al flujo sanguíneo eyectado por el ven trículo izquierdo. Ofrece una estimación de la poscarga cardíaca. Se calcula a partir de los valores de diferencia de presión entre dos pun tos determinados y la cantidad de flujo, su fór mula es RVP = (PAM - PVC) x 79,9 / GC; los valores normales van de 800 a 1,600 din-seg/ cm5/m29,32,33.
Contenido arterial de oxígeno (CaO2): co rresponde a la suma del O2 unido a la hemoglobina con el oxígeno disuelto en el plasma; CaO2 = (Hgb x 1,39 x SaO2) + (0,003 x PaO2); su valor es de 18-21 mL/dL7. Un CaO2 normal habla de una correcta capacidad de captación y transporte de O2 a los tejidos. Un CaO2 bajo corresponde a un déficit en la captación de O2 en los pulmones (neumonía) o un trastorno en el transporte de O2 (anemia severa)12,15.
Contenido venoso de oxígeno (CvO2): re fleja la cantidad de O2 que retorna al corazón. Su fórmula es CvO2 = (Hgb x 1,39 x SvO2) + (0,003 x PvO2); su valor es 12-15 mL/dL7. Un CvO2 bajo puede significar un déficit en la actividad del aparato cardiovascular (como en el shock), lo que conlleva a que la sangre perdure más tiempo del pautado en los teji dos; un aumento del CvO2 puede significar un exceso de la actividad cardiovascular, que supera la velocidad de captación de los tejidos, o una reducción de los propios tejidos en la captación de O212,15.
Diferencia arterio-venosa de oxígeno (DavO2) o consumo de oxígeno tisular: in dicador de la cantidad de O2 que es consumida por los tejidos calculado de la diferencia entre el contenido de O2 de la sangre arterial y la sangre venosa (DavO2 = CaO2 - CvO2). Cuanto mayor sea la diferencia, mayor es la demanda de O2 por los tejidos. En reposo, la DavO2 es de 3-5 mL/dL de sangre; estado de hiperdinamia (DavO2 < 3 mL/dL), DavO2 > 5 mL/dL reflejan un estado hipodinámico, lo que puede significar que el aparato cardiovascular no está supliendo de forma adecuada las necesidades metabólicas de los tejidos7.
Diferencia arteriovenosa de CO2 o Delta pCO2 (DCO2): marcador de hipoperfusión, valora la capacidad del sistema cardiovascu lar para eliminar el CO2 producido en los tejidos periféricos8,11 obtenido de la diferencia entre el CO2 venoso y arterial (DCO2 = PvCO2 - PaCO2), se toma como valor de corte 6 mmHg por lo que un gradiente > 6 mmHg sugiere una perfusión tisular inadecuada, en especial cuando la ScvO2 es > 70%34. Se correlaciona inversamente con el índice cardíaco (IC), un incremento en el DCO2 se correlaciona con una disminución del gasto cardíaco y presencia de hipoxia isquémica12,35.
Aporte de O2 (DO2): volumen de O2 que reci ben los tejidos por minuto. Es el producto del gasto cardíaco y del contenido de O2 de la san gre arterial (DO2 = GC x CaO2 x 10); valores normales = 900-1000 ml/mn13.
Consumo de oxígeno (VO2): es la cantidad total de O2 utilizado por los tejidos, determi na si el DO2 es adecuado para satisfacer las necesidades tisulares. Este consumo de O2 es calculado por la ecuación de Fick como el pro ducto del GC y de la diferencia en el contenido de O2 arterial y venoso: VO2 = gasto cardíaco (GC) x diferencia arterio-venosa de O2 (CaO2 - CvO2) x 10. En condiciones basales, el VO2 iguala a la demanda, es decir VO2 (consumido) = VO2 (demandado), los valores normales son de 200 a 250 mlO2/min13.
Extracción de oxígeno (ERO2): evalúa el aporte y el consumo de O2 de los tejidos. ERO2 = VO2 (CaO2 - CvO2) / DO2 (CaO2). Los valores de referencia oscilan entre el 20-30%36.
Gasto cardíaco (GC) por Fick: el gasto car díaco es la variable principal y determinante del flujo del suministro de O2 sistémico, defi nida como cantidad de sangre que expulsa el ventrículo izquierdo en un minuto7,30. Gaso métricamente se obtiene aplicando el principio de Fick que establece que el flujo sanguíneo a un órgano se puede calcular usando un indica dor y midiendo la cantidad del indicador que es absorbido por el órgano y sus respectivas concentraciones en sangre arterial y venosa, por lo que el GC se calcula a partir de la rela ción entre la captación de O2 alveolar y la dife rencia de contenido de O2 arteriovenoso, GC = (DavO2 x 100 / CaO2) / DavO2. Se considera GC normal 3,3 L/min a 6 L/min 11,32.
Lactato: marcador clave de la hipoperfusión ti sular y pronóstico del paciente crítico. Informa del equilibrio entre el transporte de O2 y la de manda de O2; se recomienda observar los nive les de lactato y su cinética. Desde una perspecti va metabólica, elevaciones en su concentración sanguínea pueden deberse a incremento de la producción, disminución del aclaramiento o una combinación de ambas: su valor de corte es 2 mmol/L, pero niveles > 1,5 mmol/L se asocian con un aumento de la mortalidad12,15.
Parámetros hemodinámicos ecocardiográficos
La monitorización hemodinámica por ecocardio grafía permite una mejor caracterización de los trastornos hemodinámicos, selección de las me jores opciones terapéuticas (fluidos intravenosos, inotrópicos y ultrafiltración) o evaluación de la respuesta de los trastornos hemodinámicos a la terapia. Se realiza por medio del análisis de medi das volumétricas, presiones de llenado y resisten cias vasculares37,38.
Diámetro de la vena cava inferior e índi ce de colapso inspiratorio: parámetro de precarga que estima la presión de la aurícula derecha, de manera indirecta y no invasiva, se establece como diámetro normal de 16 ± 2 mm. La medición del índice de colapso inspiratorio se realiza en decúbito dorsal, desde la ventana subcostal a 2 cm de la aurícula derecha (AD), en teleespiración en diástole y a continuación tras la inspiración profunda (índice de colap sabilidad = diámetro máximo de VCI - diáme tro mínimo de VCI / diámetro máximo de VCI), un diámetro ≤ 21 mm con colapso > 50% esti ma presión normal de 0-5 mmHg, si es < 50% en 10 mmHg, si no se comprueba colapso en 15 mmHg y si se dilata en 20 mmHg39.
El TAPSE (tricuspid annular plane systolic excursion): estima la función ventricular sis tólica longitudinal derecha. Representa la distancia que se mueve el anillo tricúspideo desde el final de la diástole hasta el final de la sístole. Se obtiene en la ventana apical de cuatro cámaras situando el cursor del modo M en el borde libre del anillo tricúspide. Valor normal > 16 mm40.
S tisular (velocidad sistólica máxima del anillo tricúspide en su porción lateral): evalúa la con tracción longitudinal del VD a través del análi sis de la onda S del Doppler tisular. Se obtiene en la ventana apical 4C, situando el cursor del Doppler a nivel del anillo lateral tricúspide o en la zona basal de la pared libre del ventrículo. Los valores < 10 cm/s se consideran anormales38.
Fracción de acortamiento del VD (CAF del VD): estima la función sistólica VD definida como (Área telediastólica del VD-área telesis tólica del VD/área telediastólica del VD) x 100, obtenida de una ventana apical donde se traza el borde endocárdico tanto en diástole como en sístole. Es normal > 35%41.
Fracción de eyección del ventrículo iz quierdo (FEVI): medida central de la función sistólica del VI, corresponde a la fracción del volumen telediastólico del ventrículo eyectado en sístole (volumen telesistólico) a los grandes vasos. El método recomendado es el biplano de discos (regla de Simpson modificada) que uti liza vistas apicales 4 y 2 cámaras diastólica y sistólica final para la estimación del volumen del VI y el cálculo de la fracción de eyección. Su fórmula es FEVI = (VTD - VTS) / VTD42.
Gasto cardíaco por ecocardiograma: la ecografía proporciona una estimación del vo lumen sistólico sistémico (VS) y, por tanto, del GC al multiplicarlo por la FC. Su valor normal es 3,3 L/min a 6 L/min: el VS se obtiene del cál culo de la integral de velocidad-tiempo (IVT) del flujo sanguíneo subaórtico por el área del conducto atravesado por este flujo (TSVI). El área del TSVI se basa en la teoría de que el TSVI es una estructura circular en la que al medir su diámetro a nivel subvalvular aórtico generalmente en un enfoque paraesternal de eje largo se puede estimar el área de ese seg mento mediante la fórmula para el cálculo de área de un círculo (pR2). El IVT representa el espectro de la velocidad del flujo durante un latido a nivel del TSVI mediante la técnica de Doppler pulsado en un eje de apical de cinco cámaras. Se suele observar como una imagen triangular, de diámetro promedio 18-23 cm; un valor inferior a 12 cm puede indicar bajo GC y mala función ventricular. En paciente bajo fibrilación auricular se recomienda obte ner un promedio de 5 IVT37,38.
Índice cardíaco: resulta de ajustar el GC al área de superficie corporal (SC). Se calcula dividiendo el volumen minuto entre la SC del paciente, se considera normal 2,5 y 4,5 L/min/ m2; su cálculo se obtiene haciendo GC / SC38.
Relación E/e’: estima las presiones de llenado del VI relacionándose con la presión capilar pul monar, a través del cociente obtenido del aná lisis del flujo transmitral con ecocardiografía Doppler pulsado (E) y la velocidad del flujo en el tejido durante la diástole con Doppler tisular del anillo mitral (e’). La onda E mitral se obtiene colocando Doppler pulsado a nivel de los bordes libres de los velos mitrales mediante la ventana apical de 4 cámaras, en ritmo sinusal, se obtiene un registro de 2 ondas: onda E, de llenado rápi do protodiastólico y una onda A. La onda e’ se obtiene colocando la muestra de Doppler tisular, generalmente en la porción septal y lateral del anillo en una ventana apical de 4 cámaras. El re gistro presenta una onda sistólica anterógrada (S), seguida de una imagen en espejo del llenado mitral compuesta por 2 ondas retrógradas: una onda e’ (e prima) y una onda a’ (a prima). Para nuestro cálculo usaremos la velocidad de la onda e’, la misma que se promedia entre la septal y lateral o, de no ser posible, usar la lateral que es la más validada. E/e’ = onda E / (E’ lateral + E’ septal) / 2 una relación E/E’ < de 8 refleja presio nes normales y relación E/E’ > 15 es indicativo de altas presiones de llenado del VI37,38.
Presión media de la cuña capilar pulmo nar (PCWP): indicador de la precarga del VI, refleja la presión de la aurícula izquier da. Puede calcularse por fórmula de Nagueh PCWP = (E/ e’) x 1,24 + 1,9. Se consideran va lores normales de 12-18 mmHg, es poco fiable en entidades clínicas como estenosis mitral o prótesis valvulares mitrales38,43.
Resistencia vascular sistémica por eco cardiografía (RVS): esta fórmula ecocardio gráfica sustituye para el cálculo de las RVS el valor de la PVC por la presión AD (PAD) esti mada según el diámetro de la VCI y su índice de colapso inspiratorio. Diámetro de la VCI ≤ 21 mm con colapso > 50% estima una presión de AD en 5 mmHg, < 50% en 10 mmHg, ausencia de colapso 15 mmHg y si se dilata en 20 mmHg. RVS = ((PAM - PAD) / GC)x 79,944-46.
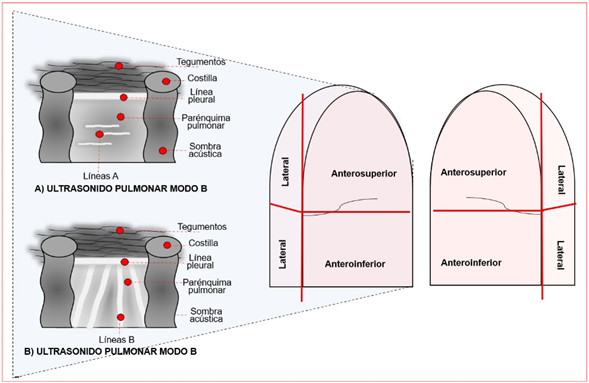
Ultrasonido pulmonar: se utiliza para valorar el estado de congestión pulmonar. Su visualiza ción será resultado de la presencia de artefacto, puesto que el pulmón, al ser un órgano aireado, es invisible en la ecografía; en cambio, si el pa rénquima pulmonar es reemplazado por tejido, líquido o consolidaciones, podrá visualizarse. Los principales artefactos visualizados en modo B son: las líneas A, correspondientes a líneas hiperecogénicas horizontales estáticas generadas por el eco de ambas pleuras (pleura parietal y visceral) que indican la presencia de aire; y las líneas B, líneas hiperecogénicas verticales (co las de cometa) que bajan desde la línea pleural hasta la parte inferior moviéndose de manera sincronizada con el deslizamiento pulmonar. Se considera congestión pulmonar si existe 3 o más líneas B. Hay protocolos extensos (28 sitios) y protocolos abreviados (3, 4 y 8 sitios); de acuerdo con lo recomendado por Lichtenstein, se requiere la exploración de 6 puntos torácicos, 4 puntos con una localización ventral (2 en cada hemitórax) y los 2 puntos restantes estarán en los costados del paciente (1 en cada costado)47-49 (figura 2).
Conclusiones
La monitorización hemodinámica es un pilar fun damental de la evaluación y tratamiento del pa ciente crítico, capaz de incrementar su sobrevida y reducir eventos adversos; su implementación permite evaluar el estado y el comportamiento del sistema cardiovascular, previniendo o diagnosti cando perfusión tisular u oxigenación inadecuada y orientando la estrategia terapéutica requerida. En las últimas décadas ha presentado grandes avances tecnológicos, pasando desde técnicas bá sicas de monitorización hasta sofisticados dispositivos.
Su interpretación debe partir de la integración y la correlación de diversos parámetros hemodi námicos y no de parámetros independientes, y debe ir acompañado de un tratamiento enfocado (figura 3).
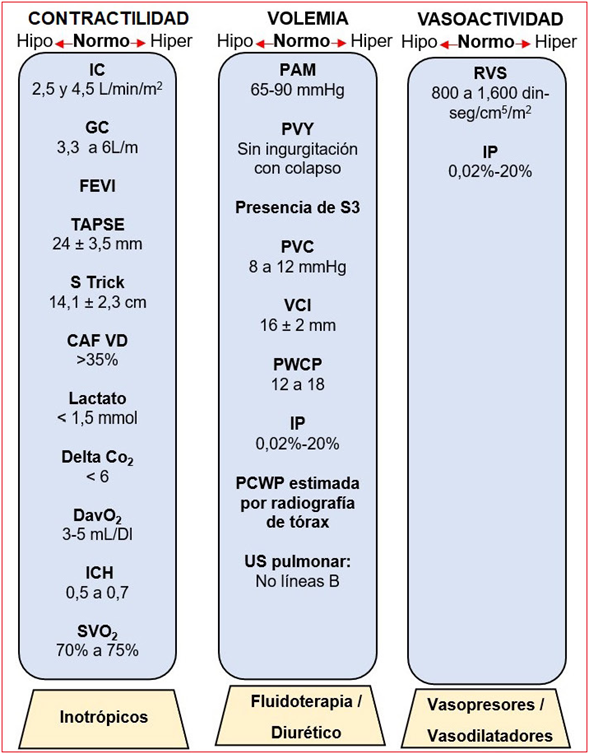
Figura 3: Patrones hemodinámicos y estrategias terapéuticas. Integra ción y correlación de diversos parámetros hemodinámicos acompañado de un tratamiento enfocado. IP: índice de perfusión; ICH: índice de choque; HVC: hipertensión venocapilar; RVS: resistencias vasculares; CAF del VD: fracción de acortamiento del VD; TAPSE: tricuspid annu lar plane systolic excursión; PCWP: presión media de la cuña capilar pulmonar; PVY: pulso venoso yugular.