¿Qué aporta este estudio al conocimiento actual?
El electrocardiograma ha sido una prueba diagnóstica utilizada de forma clásica en el diagnóstico de la amiloidosis cardíaca. Sin embargo, y pese a que las pruebas diagnósticas de esta enfermedad han avanzado de forma significativa durante los últimos años, es escasa la literatura que resuma los diferentes hallazgos electrocardiográficos encontrados. Por ello, este trabajo pretende arrojar luz en este campo, resumiendo de forma ordenada las diferentes alteraciones que se pueden encontrar y facilitar la sospecha diagnóstica.
Introducción
La amiloidosis es una enfermedad caracterizada por el depósito extracelular de proteínas fibrilares en diferentes órganos del cuerpo humano1. Esta enfermedad provoca, por tanto, sintomatología diversa, incluyendo manifestaciones neurológicas, musculares, etc., y puede causar también afectación cardíaca por infiltración del miocardio y del sistema de conducción2-4. Se han descrito más de 30 proteínas que se pueden agregar en forma de amiloide, de las que únicamente 9 se acumulan en el miocardio y, en consecuencia, pueden provocar la enfermedad conocida como amiloidosis cardíaca (AC)5. Sin embargo, más del 98% de la AC es provocada por el depósito de dos proteínas: cadenas ligeras de inmunoglobulina producidas por células plasmáticas clonales en la médula ósea (AC-AL) y transtiretina (AC-TTR), también conocida como prealbúmina, que se produce mayoritariamente a nivel hepático, cuyo origen puede ser hereditario (AC-TTRv) o esporádica o wild type (AC-TTRwt)4. Clásicamente se ha considerado la forma AL la más frecuente en los países desarrollados; sin embargo, el envejecimiento de la población y el uso creciente de técnicas diagnósticas no invasivas ha conducido a que el tipo ATTR sea el diagnosticado con más frecuencia en nuestro medio en la actualidad6.
El tratamiento de la AC ha evolucionado de forma importante durante los últimos años y se dirige de forma específica en función del tipo de proteína depositada.
La AC-AL puede manifestarse como un cuadro de insuficiencia cardíaca (IC) con fracción de eyección preservada o deprimida, de instauración progresiva o, menos frecuentemente, de forma aguda con una presentación similar a una miocarditis, pudiendo derivar incluso en un shock cardiogénico7. El tratamiento de esta entidad va dirigido a la eliminación de las células plasmáticas monoclonales, y se basa en un esquema de quimioterapia combinado y, en ciertos pacientes, un trasplante autólogo de células madre, con el objetivo de disminuir la carga de cadenas ligeras libres8. La AC-TTR se presenta clásicamente como un cuadro de IC con fracción de eyección preservada. El tratamiento específico modificador de la enfermedad se centra en silenciar y estabilizar la producción de transtiretina, así como eliminar el amiloide de los tejidos en los que se ha depositado3. En ambos casos, el diagnóstico precoz de la enfermedad es clave para poder instaurar el tratamiento en un estadio temprano y, de esta manera, poder mejorar el pronóstico de estos pacientes, ya que cuando el diagnóstico se retrasa, el pronóstico es infausto6.
Cuando se sospecha esta enfermedad, se solicitan pruebas diagnósticas, como el SPECT y los test hematológicos (resultado el primero positivo en pacientes con AC-ATTR y el segundo alterado en pacientes con AC-AL). Posteriormente, y en función de los resultados de estas pruebas, se necesitará un diagnóstico de confirmación con biopsia o, en el caso de la AC-ATTR, se puede llegar al diagnóstico con las pruebas no invasivas4. Sin embargo, es importante destacar que las pruebas diagnósticas solamente se llevarán a cabo ante la sospecha de la enfermedad; el retraso en esta sospecha es la asignatura pendiente en estos pacientes9. Es por ello que el documento de consenso para el diagnóstico de la AC de la European Society of Cardiology ha incluido unas banderas rojas (red flags) que nos deben hacer sospechar de la presencia de AC y, por ende, realizar las pruebas diagnósticas específicas para esta enfermedad. Dentro de estas red flags se incluyen datos clínicos (como la polineuropatía o síndrome del túnel carpiano bilateral), analíticos (como elevación desproporcionada del NT-proBNP para el grado de IC), de imagen (hipertrofia con patrón moteado del miocardio en la ecocardiografía), así como electrocardiográficos4. El signo electrocardiográfico clásico es la presencia de bajos voltajes, pese a hipertrofia ventricular marcada en las pruebas de imagen, fue descrito por primera vez por Carroll et al. en 198210.
El electrocardiograma (ECG) es una prueba de bajo costo, fácil acceso y disponible en todo el mundo, que se realiza a pie de cama a la gran mayoría de los pacientes que consultan por signos y síntomas de IC. El ECG resulta normal en menos del 5% de los pacientes con AC2. Debido a que la bibliografía centrada en los hallazgos electrocardiográficos de esta enfermedad es escasa, el objetivo del presente trabajo fue realizar una revisión bibliográfica minuciosa para recoger las principales alteraciones del ECG en estos pacientes, con el fin de aumentar el grado de sospecha diagnóstica de esta enfermedad y, de esta manera, mejorar el pronóstico de los pacientes.
Revisión del tema
Las alteraciones electrocardiográficas en la AC se producen como consecuencia de la infiltración miocárdica y del tejido de conducción por material amiloide11. En estudios clásicos de anatomía patológica en pacientes con AC se han descrito depósitos de amiloide en el intersticio miocárdico y pared de pequeños vasos de la pared auricular y ventricular, así como fibrosis del tejido de conducción cardíaco11,12. Debido a la afectación extensa de esta enfermedad, que puede provocar alteraciones de la conducción eléctrica en todas las cámaras cardíacas, se describirán de forma ordenada las principales alteraciones electrocardiográficas que se han descrito con el objetivo de facilitar la comprensión del artículo de revisión.
Alteraciones del QRS
La presencia de voltajes del QRS desproporcionadamente bajos para el grado de hipertrofia ventricular ha sido el hallazgo clásicamente descrito como típico de la AC. En el primer trabajo que se describió este hallazgo se utilizó un índice entre el voltaje del QRS y la masa ventricular izquierda objetivada mediante ecocardiografía10. Sin embargo, debido a que la obtención de este índice podría dificultar la detección de estos pacientes en la práctica clínica habitual, los trabajos más recientes han utilizado criterios exclusivamente electrocardiográficos que facilitarían la detección de forma rápida de esta alteración y, por tanto, sospechar de forma temprana la enfermedad.
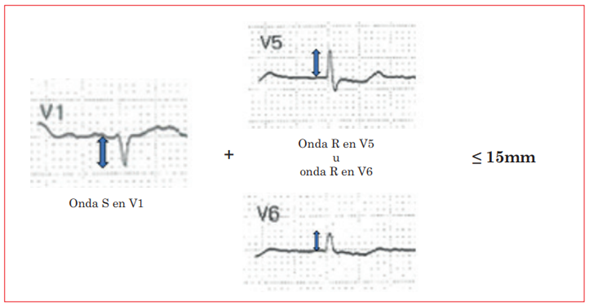
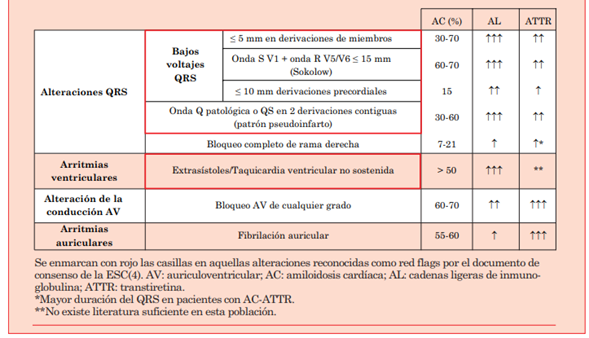
Existen varios criterios utilizados en los diferentes trabajos publicados recientemente. El que se utiliza de forma más amplia consiste en detectar un voltaje ≤ 0,5 mV (≤ 5 mm en un ECG realizado a velocidad normal (25 mm/s) y con una amplificación normal (10 mm/mV)) en todas las derivaciones de los miembros (figura 1)2,13-19. La prevalencia de bajos voltajes teniendo en cuenta este criterio varía entre los diferentes estudios entre el 30 y el 70% de los pacientes con AC2,13-19. La variación tan amplia entre los diferentes estudios, tanto para este criterio como para el resto que se comentarán a continuación, surge en el porcentaje de pacientes incluidos con AC-AL y AC-ATTR. Se ha visto de forma consistente que la prevalencia de bajos voltajes es superior en los pacientes con el subtipo AL que en aquellos con el subtipo ATTR. Se hipotetiza que esta diferencia puede ser provocada por la mayor prevalencia de edema miocárdico, secundario a inflamación, en los pacientes con AC-AL, que se ha demostrado en estudios realizados con resonancia magnética cardiovascular (RMC)20. Este edema justificaría, además, la asociación entre los bajos voltajes y otros hallazgos que sugieren una enfermedad más avanzada, como: la edad más joven, una peor clase funcional de la NYHA, valores de péptidos natriuréticos más elevados, un grosor mayor del ventrículo izquierdo (VI) y una disfunción ventricular derecha más marcada13. Otros criterios utilizados hacen referencia al voltaje del QRS en las derivaciones precordiales. Dentro de estos, destacan el uso de criterios de Sokolow para bajo voltaje, definido como la suma de la onda S en V1 más la onda R en V5 o V6 ≤ 15 mm (figura 2); así como la presencia de voltajes ≤ 1 mV (≤ 10 mm en un ECG realizado a velocidad y amplificación estándar) en la totalidad de las derivaciones precordiales. Estos criterios también han sido ampliamente utilizados en la literatura2,14-16,19. Aquellos estudios en los que se reporta la prevalencia de bajos voltajes del QRS en pacientes con AC de acuerdo con los diferentes criterios, se ha visto que el criterio de Sokolow es más sensible que el criterio de las derivaciones de miembros, objetivando una prevalencia de este hallazgo entre el 60 y el 70% de los pacientes con AC14,15. Es de gran importancia destacar que estos hallazgos no solamente nos pueden ayudar a un diagnóstico temprano de la enfermedad, sino que se han asociado con eventos adversos cardiovasculares15, así como con mortalidad cardiovascular13 y global14.
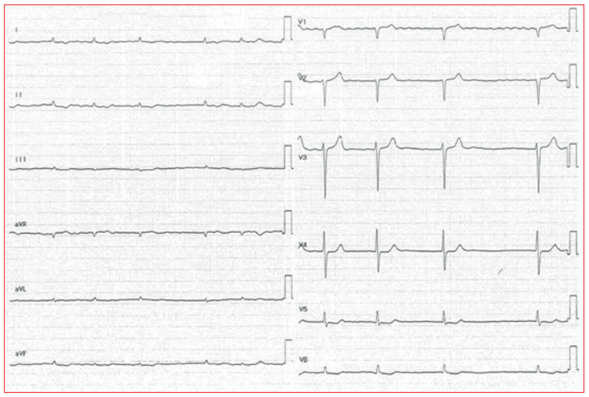
Figura 1 Electrocardiograma (ECG) de un paciente con amiloidosis cardíaca (AC) obtenido a velocidad y amplificación estándar (25 mm/s y 10 mm/mV).
Se objetivan dos hallazgos típicos de AC: bajos voltajes definidos por una amplitud del QRS ≤ 0,5 mV (≤ 5 mm en un ECG a velocidad y amplificación estándar) en todas las derivaciones de miembros (I, II, III, aVR, aVL y aVF) y fibrilación auricular.
Se define como una suma de la onda S en V1 más la onda R en V5 o V6 menor de 15 mm en un electrocardiograma realizado a velocidad y amplificación normales (25 mm/s y 10 mm/mV).
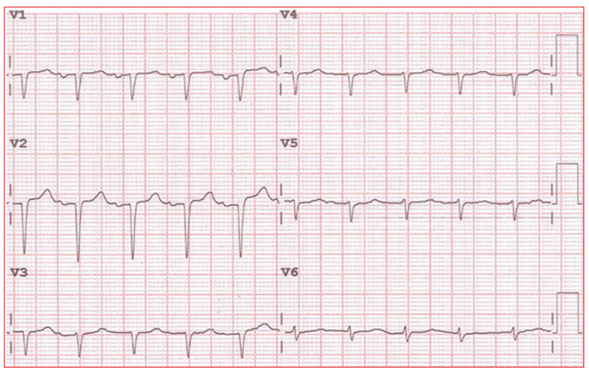
Otra alteración del QRS en los pacientes con AC ampliamente descrita en la literatura e incluida en las red flags del documento de consenso de la ESC es el denominado patrón de pseudoinfarto4. Este patrón se define como una onda Q patológica (1/4 de la amplitud de la onda R) o morfología QS en 2 derivaciones contiguas en ausencia de cardiopatía isquémica, bloqueo de rama izquierda del haz de His (BRIHH) y alteraciones de la contractilidad segmentaria del VI (figura 3 y4)2,15-19,21. Este hallazgo podría llevar inicialmente a una sospecha errónea de enfermedad coronaria en estos pacientes3. En la mayoría de los estudios, la prevalencia de este hallazgo varía entre el 30 y el 60% de los pacientes con AC, es más frecuente en las derivaciones de la cara anterior2,15-19,21. Además, este hallazgo se ha asociado con la presencia de bajos voltajes y de igual manera es más frecuente en AC-AL, probablemente también como consecuencia de la presencia de edema miocárdico15,16,21. Aunque no se ha estudiado en tantos trabajos su valor pronóstico, se ha descrito una disminución de la supervivencia en pacientes con AC-AL y patrón de pseudoinfarto con respecto a una cohorte de pacientes con la misma enfermedad, pero sin este hallazgo electrocardiográfico22.
Este patrón se define como una onda Q patológica (1/4 de la amplitud de la onda R) o patrón QS en al menos 2 derivaciones contiguas en la ausencia de bloqueo de rama izquierda, cardiopatía isquémica o alteraciones de la contractilidad segmentaria en pruebas de imagen. En esta imagen se aprecia una morfología QS en las derivaciones V1, V2 y V3.
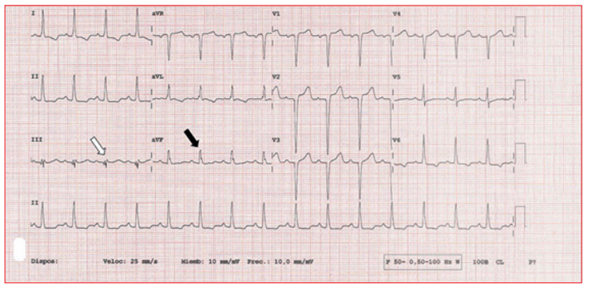
Este hallazgo electrocardiográfico se define como la presencia de un patrón RSR’, incluyendo la presencia de una onda R adicional, notch de la onda R, notch de la pendiente descendente o ascendente de la onda S o la presencia de >1 R’; en dos derivaciones contiguas correspondientes al territorio de una arteria coronaria. En este caso se objetiva un patrón rSR’ precedido de una onda Q en la derivación III (flecha blanca) y un notch en la pendiente descendente de la onda R en la derivación aVF (flecha negra), con lo que se cumpliría el criterio de fragmentación del QRS. Además, como otro hallazgo típico de AC se objetiva el patrón de pseudoinfarto con una morfología QS en V1-V3.
Es razonable pensar que la fibrosis del sistema de conducción puede llevar al desarrollo de bloqueos de rama en los pacientes con AC. Sin embargo, este hallazgo no se encuentra con tanta frecuencia en esta población. El bloqueo de rama derecha del haz de His (BRDHH) aparece entre un 7 y un 21% de los pacientes con AC, es ligeramente más frecuente que en la población sin esta enfermedad18,19,21,23,24. No obstante, el BRIHH aparece con menos frecuencia en pacientes con AC (< 5% en la mayoría de los estudios), sin diferencias significativas en la prevalencia entre estos pacientes y controles sin la enfermedad18,19. La presencia de estos hallazgos no varía de manera significativa entre los dos subtipos más frecuentes de AC, pero se ha descrito una mayor duración del QRS en pacientes con AC-ATTR, lo que refleja una mayor enfermedad del tejido de conducción infrahisiano en estos pacientes21,25. La presencia de QRS ancho en pacientes con AC se ha asociado con la incidencia de bloqueo auriculoventricular (BAV) avanzado durante el seguimiento24. Cabe resaltar que la prevalencia de bajos voltajes en aquellos pacientes con QRS ancho es menor y, de hecho, el criterio de Sokolow no ha demostrado ser útil en este subtipo de pacientes, por lo que en estos casos se recomienda realizar el índice entre el QRS y el grosor de la pared del VI para la correcta valoración de la presencia de bajos voltajes26.
Otra alteración del QRS que ha sido menos descrita en la literatura, pero que se ha asociado con mortalidad en pacientes con AC-AL, es la presencia de un QRS fragmentado, que también se ha relacionado fisiopatológicamente con la fibrosis miocárdica que produce esta enfermedad27. En este estudio, el QRS fragmentado se definió como la presencia de patrón RSR’ con o sin ondas Q, incluyendo la presencia de una onda R adicional, notch de la onda R, notch de la pendiente ascendente o descendente de la onda S o la presencia de > 1 R’, en dos derivaciones contiguas correspondientes al territorio de una arteria coronaria (figura 4)27. En la población de 264 pacientes con AC-AL, de este estudio, este hallazgo ECG se encontró en un 28% de estos. Teniendo en cuenta la prevalencia y su asociación con mortalidad, es importante tener en cuenta este hallazgo al valorar el ECG de los pacientes con AC.
El ángulo QRS-T es el obtenido entre las direcciones de despolarización y repolarización eléctrica ventricular, y se obtiene como la diferencia entre el vector del QRS y de la máxima T en el plano frontal28. El aumento de este ángulo representa una alteración estructural cardíaca, así como heterogeneidades eléctricas que dan lugar a cambios de la dirección de repolarización28. Se considera normal hasta 100º, y su aumento ha demostrado ser un marcador de inestabilidad eléctrica en la población general, por lo que es un predictor de muerte súbita de causa arrítmica29. Se cree que la infiltración del miocardio por amiloide debería provocar un cambio en la dirección de la repolarización, con lo que se aumentaría este ángulo QRS-T. Se ha demostrado en un trabajo que es un hallazgo frecuente en pacientes con AC-AL (más de la mitad de los pacientes de este estudio tenían un ángulo > 100º) y, además, se ha asociado con mortalidad en el análisis multivariable, por lo que es un parámetro electrocardiográfico interesante a tener en cuenta en estos pacientes30.
Arritmias ventriculares
Aunque la información es escasa y no se incluyen dentro de las red flags del documento de consenso de la ESC, las arritmias ventriculares son relativamente frecuentes en la AC y tienen implicación pronóstica31. La mayoría de literatura a este respecto ha sido realizada en pacientes con AC-AL, en los que la presencia de arritmias ventriculares como las extrasístoles ventriculares y la taquicardia ventricular no sostenida aparecían en alrededor de un 70% de los pacientes monitorizados mediante telemetría32-34. En dos trabajos en los que se le realizó estudio electrofisiológico a pacientes con AC, se logró inducir taquicardia ventricular monomórfica en 2 (11%) y 4 (16%) pacientes, respectivamente35,36. Sin embargo, el implante de desfibrilador en estos pacientes es controvertido, debido a que ningún estudio ha demostrado que aporte un beneficio en la mortalidad en pacientes con AC, que el ritmo de parada cardiorrespiratoria más frecuentemente encontrado es la disociación electromecánica y al mal pronóstico de la enfermedad31.
Alteración de la conducción auriculoventricular
Las alteraciones de la conducción auriculoventricular (AV), en forma de enlentecimiento de esta e incluso bloqueos avanzados, son un hallazgo clásico en la AC, también incluido en las red flags electrocardiográficas para sospechar el diagnóstico de esta enfermedad en el documento de consenso de la ESC4. De hecho, los trabajos que han realizado estudios electrofisiológicos en pacientes con AC han demostrado la prolongación del intervalo HV > 55 ms (un parámetro que refleja la conducción infrahisiana) en prácticamente todos los pacientes con esta enfermedad35,36. Se ha demostrado en diversos registros que la incidencia de estas alteraciones es superior en pacientes con AC-ATTR que en aquellos con AL16,17,21,31. Una explicación plausible para que las alteraciones de la conducción ocurran más frecuentemente en pacientes con AC-ATTR es la propia evolución de esta enfermedad, lenta y progresiva hacia una cardiopatía terminal, facilitando la fibrosis progresiva del sistema de conducción y, por tanto, mayores alteraciones a este nivel; al contrario que la AC-AL, que por la toxicidad de las cadenas ligeras puede provocar un cuadro similar a una miocarditis, sin que dé tiempo al desarrollo de alteraciones de la conducción AV16,37. En esta misma línea también se ha demostrado que la necesidad de implante de marcapasos es muy superior en pacientes con AC-ATTR21.
Debido a la asincronía en la contracción miocárdica propia de esta enfermedad en relación con las alteraciones de la conducción previamente comentadas, se ha estudiado el uso de resincronización en estos pacientes en comparación con marcapasos convencional. Se objetivó una mejoría en diversos parámetros clínicos y de imagen en una cohorte de pacientes con AC-ATTR38.
Cabe reseñar que en un estudio de dispositivo Holter implantable llevado a cabo en 20 pacientes con AC-AL, el hallazgo objetivado en la gran mayoría de los pacientes en el momento de su muerte era una marcada bradicardia, normalmente causada por bloqueo AV completo, que podría haber llevado a una descompensación cardíaca y que esto provocase la muerte de estos pacientes39.
Alteración de la conducción auricular y disfunción sinusal
Mientras que las alteraciones en la conducción AV son muy frecuentes en pacientes con AC, la incidencia de disfunción sinusal en estos pacientes es mucho menor, no se conoce de manera adecuada la correlación fisiopatológica que justifica este hallazgo31. De hecho, en un trabajo en el que se realizó un EEF a 25 pacientes con AC-AL, se objetivó un tiempo de recuperación del nodo sinusal normal en un total de 22 pacientes (88%), lo que apoya la teoría de que la función sinusal suele verse respetada en esta enfermedad36. Sin embargo, la presencia de bloqueo interauricular, que se reconoce en el ECG como una duración de la onda P ≥ 120 ms con un patrón bifásico en cara inferior en el caso de bloqueos avanzados (figura 5), se ha objetivado hasta en un 27% de pacientes con AC-ATTR en un trabajo recientemente publicado40. Este hallazgo ECG parece ser secundario a un bloqueo completo del haz de Bachmann y se ha relacionado con la presencia de arritmias supraventriculares como la fibrilación auricular (FA), aparece con mayor frecuencia en pacientes con ictus embólico41. El elevado riesgo cardioembólico de los pacientes con AC es bien conocido. Son necesarios más estudios para conocer el valor de este hallazgo como marcador precoz de riesgo cardioembólico en estos pacientes.
Como curiosidad, cabe resaltar en este apartado el clásicamente denominado atrial standstill o parada auricular. Este fenómeno se corresponde con una ausencia de actividad eléctrica auricular (ausencia de ondas p, f o F en ECG de superficie y ausencia de electrograma auricular medido de forma invasiva), así como de la contracción de dicha cámara, que ha sido descrito en casos de AC como consecuencia del propio infiltrado de amiloide, que comporta una pérdida muscular en la pared auricular42.
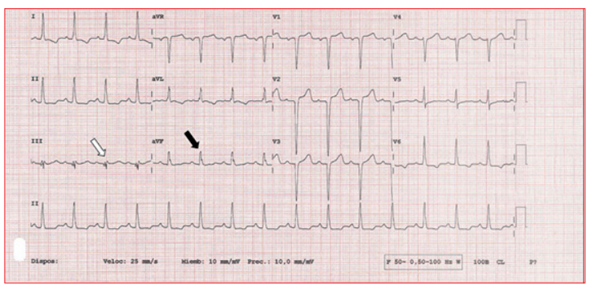
Figura 5 Bloqueo interauricular avanzado. Este ECG muestra un bloqueo interauricular avanzado, que se reconoce como una duración de la onda P ≥ 120 ms con morfología bifásica en cara inferior (flechas blancas). Este hallazgo se cree que es secundario a un bloqueo completo del haz de Bachmann y se encuentra más frecuentemente en pacientes con amiloidosis cardíaca
Arritmias auriculares
Se cree que los mecanismos que generan arritmias auriculares en estos pacientes son de origen multifactorial. La infiltración del miocardio causa engrosamiento de la pared auricular y ventricular, lo que genera una alteración de la relajación y, como consecuencia, un llenado restrictivo durante la diástole43. De tal manera, tanto la propia infiltración de amiloide en la pared auricular como la elevación en las presiones de llenado ventricular predisponen a estos pacientes a sufrir FA (figura 1) y otras arritmias auriculares31,43. La prevalencia de FA es mayor en el subtipo ATTR, llega a una prevalencia entre el 55 y el 60% de los pacientes con este subtipo de la enfermedad, mientras que en los pacientes con AC-AL la prevalencia es menor del 30%2,44. Se ha asumido que la mayor prevalencia de FA en los pacientes con AC-ATTR es debida a que este subtipo suele aparecer en pacientes más mayores (sobre todo la wild type, que a su vez es en la que existe mayor prevalencia de esta arritmia) y se desarrolla como una cardiopatía infiltrativa crónica, con la consiguiente elevación de las presiones de llenado ventricular y dilatación de cavidades auriculares que facilitan esta arritmia31. Se ha observado que los predictores independientes de desarrollo de FA en los pacientes con AC son la edad, el tamaño auricular izquierdo y la presencia de enfermedad renal secundaria a la enfermedad45.
Conclusiones
La AC es una enfermedad de mal pronóstico, cuya principal asignatura pendiente es la sospecha y el diagnóstico precoz, que permita la instauración del tratamiento adecuado según el subtipo al que nos enfrentemos. Debido a que la presentación es similar a otras cardiopatías que causan IC con fracción de eyección preservada, es importante detectar red flags que nos permitan sospechar esta enfermedad de manera temprana. En este terreno entra el ECG, como arma diagnóstica de bajo costo y amplia disponibilidad que nos puede hacer sospechar esta enfermedad (tabla 1). El hallazgo electrocardiográfico clásico son los bajos voltajes en relación con la gran hipertrofia que se objetiva en el ecocardiograma, así como el denominado patrón de pseudoinfarto; ambos son más frecuentes en el subtipo AL. Con el uso cada vez más extendido de pruebas diagnósticas no invasivas, el subtipo ATTR ha pasado a ser el más frecuentemente diagnosticado en nuestro medio. En este, hallazgos como los bloqueos de la conducción AV o las arritmias auriculares, fundamentalmente FA, son más frecuentes que en la AC-AL. Por ello, nos encontramos ante un cambio de paradigma en el que estos últimos hallazgos también nos deben hacer sospechar AC, incluso en la ausencia de hallazgos que suponíamos clásicos.