Definición de amiloidosis
La amiloidosis cardíaca (AC) es una miocardiopatía restrictiva infiltrativa caracterizada por el depósito extracelular de amiloide a nivel de las estructuras cardíacas. Puede tratarse de una forma localizada (afectación de un solo órgano) o formar parte de una afección sistémica (amiloidosis sistémica).
El amiloide se crea por el acúmulo extracelular de fibrillas insolubles compuestas por unidades de diferente peso molecular. Las proteínas que conforman el amiloide son solubles en el plasma, pero se convierten en agregados insolubles luego de ensamblarse anormalmente (plegado Beta)1.
Si bien existen aproximadamente 20 tipos de amiloide capaces de producir afección cardíaca, 2 subtipos son los que se observan con frecuencia en la práctica clínica, a cadenas livianas (CL) de inmunoglobulinas y a transtiretina (TTR). A su vez, existen dos tipos de amiloidosis a TTR (ATTR): la forma mutante o genéticamente determinada (ATTRm) y la senil (ATTRs)2.
El compromiso cardiovascular depende del tipo de amiloidosis, es muy frecuente en la ATTRs mientras que es muy variable en la amiloidosis cardíaca (AC) a cadenas livianas (ACCL)3. El acúmulo de amiloide a nivel de los diferentes tejidos determina la disfunción de los órganos afectados.
El depósito de amiloide a nivel cardíaco puede determinar aumento del espesor de las paredes ventriculares, infiltración de la pared auricular, del sistema de conducción, valvular y a nivel perivascular3,4. Las consecuencias clínicas y morfológicas pueden ser la presencia de hipertrofia ventricular (con frecuente compromiso ventricular derecho), disfunción auricular y predisposición a fibrilación auricular (FA), trastornos de conducción auriculoventricular e intraventricular (bloqueo auriculoventricular, bloqueo de rama, alteraciones electrocardiográficas, etc.).
La forma de presentación clínica habitual es como insuficiencia cardíaca (IC) congestiva pudiendo asociar trastornos del ritmo como bloqueo auriculoventricular y frecuentemente fibrilación auricular (FA). En general, se presenta IC con fracción de eyección de VI (FEVI) conservada, aunque en estadios avanzados de la enfermedad asocia deterioro la función sistólica. Las manifestaciones de insuficiencia cardíaca derechas son muy frecuentes y generalmente dominan el cuadro clínico5.
El gold standard para el diagnóstico de AC es la biopsia endomiocárdica, una técnica invasiva que requiere experiencia para su realización. Su uso es limitado por el rendimiento (puede haber posibles errores en la toma de muestra, ya que la distribución de amiloide no es uniforme en todo el miocardio) y por el riesgo de complicaciones6.
La resonancia magnética cardíaca (RCM) juega un rol protagónico en el diagnóstico no invasivo de AC, así como para estratificar pronóstico y seguimiento. Permite evaluar con mayor precisión características morfológicas, obtener medidas precisas del espesor miocárdico, la masa miocárdica, el tamaño auricular, el aumento del espesor del ventrículo derecho, objetivar la presencia de derrame pericárdico y/o pleural en forma precisa, así como valorar la función sistólica de ambos ventrículos. A su vez, permite la caracterización tisular del miocardio ya sea con las nuevas técnicas de mapeo o con la administración de medios de contraste de gadolinio7. Es la técnica de elección para el diagnóstico no invasivo de AC, pero su uso está limitado por la escasa disponibilidad, alto costo y por aspectos técnicos como es la presencia de arritmias, insuficiencia renal y la presencia de dispositivos de estimulación cardíaca no compatibles con cardiorresonancia.
Rol del ecocardiograma transtorácico (ETT)
La técnica de imagen ideal para esta patología debería poder confirmar el diagnóstico de AC, diferenciar el subtipo y brindar información pronóstica. Lamentablemente, no existe una técnica que por sí sola brinde toda esta información. El ecocardiograma juega un rol central en la evaluación diagnóstica, pronóstica y ayuda a guiar el tratamiento en los pacientes con AC. Permite una evaluación estructural y funcional única, dado que es una técnica de amplio uso, bajo costo, fácil realización y sin complicaciones potenciales. La evaluación ecocardiográfica se basa en identificar los cambios morfológicos y funcionales determinados por la infiltración por amiloide.
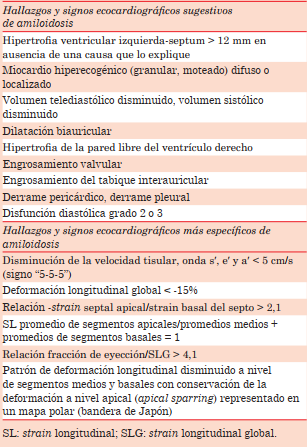
El principal cambio morfológico objetivable es el aumento del espesor parietal de VI mayor a 12 mm en ausencia de causas que lo expliquen8. Se considera criterio diagnóstico de compromiso cardíaco en los casos donde contamos con el diagnóstico confirmado de amiloidosis sistémica8 (figuras 1A y 1B). La presencia de hipertrofia ventricular asociada a hallazgos electrocardiográficos compatibles como microvoltaje, trastorno de conducción intraventricular y pseudoonda q aumentan la sospecha clínica de AC, pero el diagnóstico diferencial con otras causas de hipertrofia no se puede descartar9.
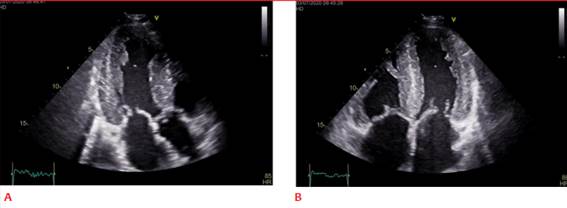
Figura 1: A. Vista apical de 3 cámaras. Hipertrofia con severo aumento de espesor parietal y patrón especulado del miocardio. B. Vista apical de 4 cámaras. Se aprecia aumento del espesor del septum interauricular y de los velos mitral y tricúspideos e hipertrofia de VD.
La presencia de un aspecto granular o espiculado del miocardio ventricular ha sido descrita como elemento sugestivo de compromiso amiloidótico (figuras 1A y 1B). Esta puede ser difusa o localizada en segmentos específicos y se debe a que las proteínas que conforman el amiloide son más ecogénicas que el miocardio10. Los segmentos más frecuentemente involucrados son el septum y la pared posterior, respetando el ápex. Esta distribución refleja el patrón de depósito de amiloide a nivel de miocardio11. Si bien es un signo orientador, no es un signo característico, puesto que puede observarse en otros tipos de cardiopatías que cursan con hipertrofia, así como en la enfermedad renal crónica avanzada7. Cabe aclarar que es un signo ecocardiográfico descrito para la evaluación con imagen fundamental, ya que la imagen armónica puede generar un aspecto espiculado, elemento que baja aún más la especificidad de este signo.
Otras características morfológicas sugestivas de compromiso infiltrativo es la presencia de volúmenes ventriculares pequeños con FEVI conservada y bajo volumen latido, auriculomegalia bilateral con disfunción auricular, estasis y eventualmente trombo auricular o en orejuela auricular aún en ritmo sinusal, hipertrofia de ventrículo derecho (VD), engrosamiento valvar (figura 1B), hipertrofia del septum interauricular (SIA) (figura 1B), derrame pleural y pericárdico6,7.
El compromiso de la función diastólica es una de las características principales de AC. En etapas precoces de la enfermedad es característico que presenten cavidad ventricular pequeña con FEVI preservada y disfunción diastólica marcada. Habitualmente el patrón de llenado restrictivo se observa en estadios avanzados de la enfermedad (figuras 2A y 2B).
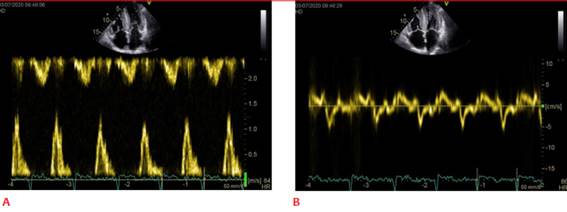
Figura 2: A. Llenado de VI restrictivo. B. Doppler tisular con velocidades tisulares disminuidas, onda s′, a′ y e′ muestran velocidades tisulares < 5 cm/seg (signo de “5-5-5”).
Si bien los hallazgos morfológicos y funcionales previamente descritos son sugestivos de compromiso infiltrativo y se consideran signos de alerta o banderas rojas para el diagnóstico de AC, estos son inespecíficos y no confirmatorios, dado que se pueden observar en cardiopatías que se expresen fenotípicamente como hipertróficas.
Evaluación de la mecánica ventricular. El rol del strain
Si bien los parámetros ecocardiográficos morfológicos y funcionales mencionados son elementos fuertemente orientadores, la evaluación de la mecánica miocárdica mediante Doppler tisular y deformación miocárdica refinan el reconocimiento de AC.
Es típico de AC un patrón de deformación o strain longitudinal global (SLG) de VI reducida a predominio de los segmentos basales y medio con preservación apical. Este patrón asociado a FEVI conservada ayuda a diferenciar de otras formas de hipertrofia7) (tabla 1).
La afectación de la función sistólica longitudinal del VI se observa en estadios precoces de la enfermedad, por lo que la evaluación de la función longitudinal se plantea que sea un marcador precoz de compromiso amiloidótico(12).
¿Qué parámetros medir?
Doppler tisular (DT)
La evaluación mediante DT nos va a permitir medir la velocidad de desplazamiento miocárdico (velocidad de onda s′, e′ y a′), la deformación miocárdica y la velocidad de deformación miocárdica (strain y strain rate, respectivamente).
Es típico de la AC la presencia de velocidades tisulares disminuidas tanto de la velocidad de desplazamiento sistólico como de las diastólicas. Un signo típico, pero tardío, es el “5-5-5” que implica que las velocidades tisulares de onda s′, e′ y a′ son menores a 5 cm/seg7 (figura 2B).
La evaluación de strain (deformación) y strain rate (velocidad de deformación) miocárdico por DT es posible, pero tiene múltiples limitaciones, como ser dependiente de factores técnicos, consumir demasiado tiempo en el procesamiento y mayor variabilidad intra e interobservador que la técnica de speckle tracking (ST). Por esto, su uso está restringido en la práctica clínica y queda limitado a casos con fines de investigación13.
Speckle tracking (ST) 2D
El ST a diferencia del DT nos permite evaluar los diferentes patrones de deformación (strain) miocárdico, longitudinal, circunferencial y radial. La AC afecta en diferente grado los tres tipos de strain6.
El patrón de compromiso de la deformación miocárdica refleja la forma en que el amiloide infiltra al miocardio en la AC, se observan depósitos de amiloide predominantemente en los sectores basales y medio del VI con relativa preservación de los segmentos apicales14.
La gran virtud del ST 2D es que ayuda a diferenciar con mayor precisión el diagnóstico de AC versus otras formas de HVI. Se han descrito diversos patrones de la deformación miocárdica con diferente rendimiento diagnóstico.
El compromiso de strain longitudinal global (SLG) de VI es mayor que en otras formas de HVI y esto depende en parte del estadio de la enfermedad15,16. Diferentes patologías que se presenten con HVI pueden tener grados similares de compromiso del SLG, pero estar en estadios diferentes de la enfermedad y, por tanto, el valor absoluto de SLG es poco específico para diferenciar entre ellas.
Existen reportes que muestran que el strain radial es menor en los segmentos donde existe depósito de amiloide, así como el strain circunferencial apical es menor que otras formas de hipertrofia17.
El tiempo al pico de deformación miocárdica presenta mayor dispersión entre segmentos, sugestivo de una contracción asincrónica parcheada. Esto se observó en pacientes con miocardiopatía hipertrófica (MCH) y AC ATTR16.
Existe evidencia que muestra diferencias regionales en el patrón strain longitudinal en la AC con un compromiso predominante de los segmentos basales y medio con relativa “preservación apical” (figura 3). Este patrón típico de strain se objetiva con los diferentes índices de deformación miocárdica que describimos a continuación. Su presencia apoya fuertemente el diagnóstico de AC y se correlaciona en forma inversa con la carga de amiloide objetivado tanto en la histopatología, así como en el realce tardío evidenciado por cardioresonancia4.
Figura 3: A. Curvas de strain longitudinal de los diferentes segmentos miocárdicos y mapa polar; se observa disminución del SLG a predominio de los segmentos basales y medios. B. Mapa polar de mismo paciente. Se observa el signo de la bandera de Japón.
La presencia de un gradiente de strain longitudinal (SL) a nivel septal desde base a ápex es un signo con buena capacidad para discriminar entre AC y otras formas de HVI. Dan Liu y colaboradores demostraron que una relación entre el strain apical/basal septal mayor a 2,1 asociado a un tiempo de desaceleración (TD) menor a 200 ms tiene una sensibilidad de 88%, especificidad de 85%, VPP de 67% y VPN de 96% para discriminar entre AC y otras formas de HVI18.
Phelan y colaboradores encontraron que el patrón de preservación apical tiene una alta sensibilidad y especificidad para discriminar AC de otras formas de HVI. Una relación entre el promedio de strain de los segmentos apicales sobre la sumatoria del promedio de los segmentos basales y medio (RRSR: relative regional strain ratio) igual a 1 tienen una S de 93% y E de 82% con un área bajo la curva de 0,94. En este estudio se comparó AC con MCH y estenosis aórtica (EA)19. Este hallazgo fue independiente del tipo de AC identificado.
Otra forma de expresar el patrón de preservación apical es mediante un mapa paramétrico en el cual, a través de una codificación de colores se expresa la deformación de los diferentes segmentos miocárdicos en un “ojo de buey” (bull eye). Se le codifica con diferentes tonos de colores a los diferentes valores de strain; así, se expresa en forma visual e intuitiva la deformación miocárdica de los diferentes segmentos. En la AC, el patrón de preservación apical remeda la bandera de Japón en la que el centro rojo representa a los segmentos apicales de mayor valor de strain y en la periferia blanca representa a los segmentos basales y medios con menores valores de strain (figura 3B). Esta forma de expresión ayuda a la interpretación de AC y a diferenciar de otras formas de HVI20.
Otro índice que ayuda a diferenciar entre AC con otras formas de hipertrofia es la relación entre la FEVI y el SLG (EF/SLG). Pagourelias y colaboradores encontraron que una relación mayor a 4,1 presenta una alta sensibilidad (89,7%) y especificidad (91,7%) para AC21,22.
Como conclusión, estos índices de deformación han mostrado buena capacidad para discriminar entre AC con otras formas de hipertrofia. Sin embargo, el patrón de preservación apical tiene limitaciones, dado que puede observarse en otras formas de hipertrofia como MCH, EA y cardiopatía hipertensiva23.
Este patrón (preservación apical) fue descrito para AC en estadios avanzados, con hipertrofia promedio mayor a 14 mm, pero recientemente se describió para pacientes con menor grado de hipertrofia24,6.
Pronóstico
El compromiso cardíaco es frecuente en ambos tipos de amiloidosis (ATTR y AL) y tiene impacto pronóstico adverso tanto para calidad de vida como mortalidad3,7. La ecocardiografía, al igual que los biomarcadores, juegan un rol crucial en la estratificación pronóstica. Las imágenes de strain pueden agregar información sobre progresión de la enfermedad, así como pronóstica en la AC.
Existe evidencia de que los biomarcadores, el SLG 2D y el patrón de preservación apical son predictores independientes de sobrevida.
En pacientes portadores de AC AL, el SLG fue predictor independiente de sobrevida y agrega valor incremental sobre otros marcadores pronóstico25. Al igual que para la AC AL, en la AC ATTR el strain aporta información pronóstica adicional26.
Si bien existen múltiples variables ecocardiográficas que tienen valor como marcadores pronósticos en la AC, actualmente no existe un sistema de estratificación validado que incorpore las variables ecocardiográficas a este.
Conclusiones
La ecocardiografía transtorácica juega un rol fundamental en la evaluación diagnóstica de los pacientes con AC. La presencia de ciertos hallazgos morfológicos y funcionales previamente descritos nos permite orientar el diagnóstico con un alto índice de sospecha. La evaluación de la deformación miocárdica mediante ST nos permite refinar el diagnóstico con mayor rendimiento diagnóstico. La presencia de un valor de strain longitudinal global disminuido con preservación apical es muy sugestivo de AC.