Introducción
Dada la epidemiología y el crecimiento exponencial en el conocimiento de técnicas diagnósticas y nuevos tratamientos de la amiloidosis cardíaca, ha crecido el interés por parte de la comunidad cardiológica en adquirir herramientas de conocimiento, tanto desde el abordaje diagnóstico como terapéutico de esta enfermedad sistémica, pero con alta mortalidad de causa cardiovascular.
En tal sentido, la resonancia cardíaca (CR) se ha transformado en una herramienta diagnóstica y pronóstica fundamental en la práctica clínica diaria. En el contexto de amiloidosis cardíaca, provee un valor diagnóstico y pronóstico incremental en relación con la ecocardiografía. Esto es debido a la capacidad de la CR como método diagnóstico no invasivo de realizar una caracterización tisular, funcional y morfológica de alta resolución, todo en un mismo estudio.
Técnica y protocolo
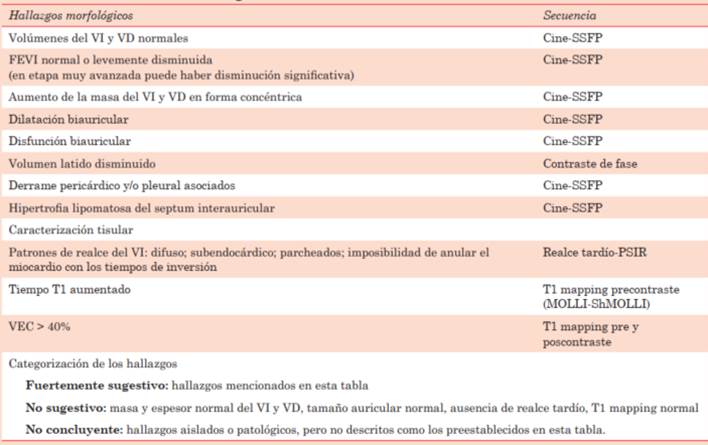
Para comprender la utilidad de la técnica en esta enfermedad, es fundamental conocer el protocolo general1 y las secuencias que deberían ser aplicadas frente a un paciente con sospecha de amiloidosis cardíaca. Por ello, comenzaremos explicando brevemente cada una de las secuencias que utilizamos habitualmente y simplificaremos su utilización en la amiloidosis en la (tabla 1).

Tabla 1: Recomendaciones para la adquisición estandarizada en la resonancia magnética cardíaca en la amiloidosis cardíaca.
Protocolo en la sospecha clínica de amiloidosis cardíaca:
a. Módulo anatómico.
b. Módulo función del ventrículo izquierdo (VI) y ventrículo derecho (VD).
c. Módulo edema.
d. Módulo realce precoz y realce tardío.
e. Módulo mapeo T1 y volumen extracelular si hay disponibilidad.
a. Módulo anatómico
Como en todos los estudios, se comienza la adquisición con imágenes en sangre negra o sangre blanca, axiales desde el arco aórtico hasta el diafragma, con apnea respiratoria y espesores de corte de 8-10 mm, preferentemente en diástole para disminuir los artefactos por movimiento.
b. Módulo de función del VI y VD
La resonancia cardíaca es el patrón de referencia para la cuantificación de los volúmenes, masa y función de ambos ventrículos, dado que se obtienen imágenes con excelente definición de los bordes endocárdicos y epicárdicos. Esto permite tener una menor variabilidad inter e intraobservador en relación con la ecocardiografía, además de que no depende de la ventana acústica ni se asumen presunciones geométricas2.
La secuencia que se utiliza hoy en día es la secuencia de precesión libre en estado estacionario (SSFP, por su sigla en inglés), que permite una adquisición rápida de múltiples imágenes consecutivas que cuando se muestran en modo cine permiten valorar el movimiento cardíaco3.
Se adquieren proyecciones perpendiculares en eje largo (2, 3 y 4 cámaras cardíacas) y una pila de cortes en eje corto, desde base a ápex, siguiendo el eje largo del VI e incluyendo la totalidad de ambos ventrículos. Es en esta pila de cortes en eje corto que se delimitan los bordes endocárdicos tanto en sístole como en diástole, permitiendo obtener los volúmenes sistólicos y diastólicos de ambos ventrículos y, por lo tanto, calcular la fracción de eyección del VI y del VD. La masa del VI se calcula a partir de la diferencia entre el volumen total epicárdico menos el volumen total endocárdico, para posteriormente multiplicarlo por la densidad del miocardio.
A partir de estas mismas imágenes es posible valorar el tamaño de las aurículas, el espesor del septum interauricular, el espesor de los segmentos del VI, la contractilidad sectorial, los diámetros de las cavidades. También es posible evaluar la presencia de derrame pericárdico y su extensión, así como la de derrame pleural.
c. Módulo edema
Para la valoración de la presencia de edema miocárdico se utilizan secuencias potenciadas en T2. La ventaja de las secuencias potenciadas en T2 es su gran sensibilidad a los líquidos, por lo que las hace excelentes para demostrar el edema del miocardio, en especial cuando es focal. Se anula la intensidad de la señal de la sangre, por lo que esta aparece negra y en las zonas de edema miocárdico se observa un aumento de la intensidad de la señal, y se observan zonas de color blanco. Se adquieren imágenes en eje corto basal, medio y apical y puede adquirirse también cortes en eje largo.
d. Módulo realce precoz y realce tardío
Los agentes de contraste basados en gadolinio aceleran la relajación de las moléculas de agua presentes en los tejidos y dan lugar a un aumento de la intensidad de la señal en imágenes potenciadas en T1. El gadolinio es un contraste extracelular que no puede atravesar la membrana celular intacta de los miocitos. En el miocardio normal, los miocitos están densamente dispuestos, por lo que el espacio extracelular es la menor parte del volumen miocárdico (menor al 15%). En la amiloidosis cardíaca, el espacio extracelular aumenta debido al depósito extracelular de la sustancia amiloide. Esto determina un aumento de la concentración de gadolinio en el miocardio y, por lo tanto, un aumento de la intensidad de la señal en las zonas donde el gadolinio se deposita. Este fenómeno puede observarse característicamente entre los 10 a 20 minutos después de la administración del gadolinio, en las secuencias de realce tardío. Para ello, se utilizan secuencia de ecogradiente con adquisición de imágenes con inversión-recuperación potenciadas en T1 y con diferentes tiempos de inversión. El miocardio normal se “anula”, esto quiere decir que se ve negro, en un tiempo de inversión determinado que provoca que se suprima la señal del miocardio. Los patrones de depósito de gadolinio sirven para diferenciar de manera fiable las miocardiopatías no isquémicas y las isquémicas4. Pero, inclusive, la topografía del depósito de gadolinio permite diferenciar diferentes causas etiológicas dentro de las miocardiopatías no isquémicas.
Además de la secuencia de realce tardío, obtenida a los 10-20 minutos luego de la administración del contraste, podemos realizar lo que se denomina la secuencia de realce precoz. Esta es la misma secuencia de ecogradiente con inversión-recuperación, pero adquirida más precozmente luego de la administración del contraste, en los primeros 4 minutos. Se ha descrito que una diferencia de tiempo T1 entre el subendocardio y la sangre de 191 ms tiene una alta sensibilidad y especificidad para el diagnóstico de amiloidosis cardíaca5.
La secuencia T1 scout se utiliza habitualmente para identificar el tiempo de inversión del miocardio normal. Se adquieren varias imágenes de un mismo corte del corazón, habitualmente en eje corto medio ventricular, que muestran los cambios de la intensidad de la señal según el tiempo, pudiendo elegir, entonces, el tiempo de inversión más adecuado para anular el miocardio sano.
En la amiloidosis cardíaca puede ser dificultoso encontrar el tiempo de inversión capaz de anular el miocardio o, inclusive, puede suceder que el miocardio se torne negro antes que la cavidad en la secuencia T1 scout. Este hallazgo es altamente sugestivo de la presencia de amiloidosis cardíaca con una muy alta sensibilidad, cercana al 100%6,7.
Luego de adquirir la secuencia T1 scout, se adquiere la secuencia de realce tardío. Si existe la sospecha clínica de amiloidosis cardíaca, se recomienda que se elija la secuencia PSIR (por su sigla en inglés, phase sensitive inversion recovery sequence), que elimina la necesidad de optimizar el tiempo de inversión del miocardio. Se deben adquirir imágenes en eje largo (2 cámaras, 3 cámaras y 4 cámaras) y una pila de eje corto de base a ápex, preferentemente con la misma orientación que en las secuencias de cine. Para minimizar los artefactos de movimiento se recomienda adquirir las imágenes en diástole y en apnea.
Una limitación en el uso de gadolinio es la presencia de insuficiencia renal severa (filtrado glomerular menor a 30 ml/min o pacientes en diálisis) por el riesgo de desarrollar fibrosis nefrogénica sistémica, que presenta elevada mortalidad y se debe al depósito de gadolinio con fibrosis de piel y tejidos conectivos8. En los últimos años se han desarrollado secuencias de mapeo en donde no es necesario utilizar contraste y que pueden ser utilizadas en pacientes con insuficiencia renal severa o hemodiálisis.
e. Módulo mapeo T1 nativo y evaluación del espacio extracelular
El mapeo T1 es una técnica relativamente nueva donde se realiza la medición directa del tiempo T1 a nivel del miocardio tanto precontraste, obteniendo en tiempo T1 nativo, como poscontraste en el caso de que se haya administrado, permitiendo calcular el espacio extracelular9.
Un mapa de T1 es una imagen en la que la intensidad de señal de cada vóxel es directamente proporcional al tiempo T1 del tejido en que se encuentra. Así, la tasa de recuperación de T1 del miocardio o valor de T1 se relaciona directamente con las propiedades intrínsecas del tejido miocárdico, que se afecta en presencia de tejido patológico y da lugar a diferentes valores de T1. Los cambios en el valor de T1 nativo pueden reflejar la afectación miocárdica, y se ve influido por la presencia de edema, colágeno u otras proteínas como el amiloide, hierro y lípidos.
Los valores de T1 tanto previos como posteriores al contraste permiten el cálculo de la fracción de volumen extracelular, que refleja variaciones en el espacio extracelular miocárdico con base en las variaciones de T1 debidas a la presencia de contraste extracelular. Esta información se obtiene calculando las diferencias en T1, tanto de la sangre como del músculo cardíaco, antes y después de la inyección del gadolinio con la siguiente fórmula:
λ = (Δ R1 miocardio)/ (Δ R1 sangre) previo y posterior a la administración de contraste, donde R1 = 1/T1; fracción de VEC: (1-hematocrito) * λ.
Para el uso clínico de las técnicas de mapeo T1 se recomienda que se establezcan los rangos locales de normalidad y los puntos de corte en cada centro, siempre bajo la misma secuencia y manera de procesar los datos, definiendo los valores de normalidad como la media ± 2 desviaciones estándar de los valores de sujetos sanos.
Implicancias clínicas
Como ya vimos, dado el enorme potencial de precisión en la valoración anátomofuncional y de caracterización tisular de la CR, y reconociendo a la amiloidosis como la principal causa de miocardiopatía restrictiva e integrando el complejo panel de causas diferenciales de miocardiopatías con fenocopias que hipertrofian, la CR juega un rol central en el diagnóstico y sus diferenciales, en su valor pronóstico y como apoyo a la terapéutica en su monitorización. Siguiendo estas premisas describiremos a continuación brevemente cada uno de estos ítems, su integración a criterios estandarizados de informe y cómo se insertan en el complejo análisis de evaluación diagnóstica de amiloidosis cardíaca según las recomendaciones internacionales10.
En cuanto a su evaluación diagnóstica, por las propiedades mencionadas, juega un rol primordial en el algoritmo, siendo además su fortaleza la evaluación de sus diferenciales que en muchos pacientes son la punta angular de tratamiento10-13,15. Con este concepto la resonancia presenta características propias que marcan alta sensibilidad y especificidad diagnóstica, que nos permite según sus hallazgos marcar su probabilidad, y en las cuales las últimas recomendaciones las dividen en: fuertemente sugestiva, no sugestiva o no concluyente10.
Estas características son morfológicas y de caracterización tisular. Esta última es un punto de inflexión en la evaluación diagnóstica y diferenciales, que marca la real dimensión del problema y en la cual se fundamenta su indicación10,11. En cuanto a sus características morfológicas destacamos la elevada precisión que tiene la CR frente a otros métodos, como la ecocardiografía, lo que nos permiten valorar con mayor exactitud la presencia de diversos hallazgos como: volúmenes del VI y VD normales con aumento de la masa del VI (se puede evidenciar aumento del espesor del VD) y espesor parietal relativo del VI > 0,42; volumen latido < 35 ml/m2 con o sin disfunción del VI y/o VD (habitualmente la FEVI es normal o levemente disminuida); aumento de los volúmenes de la AI y AD10,16) (> 163 ml en hombres y > 131 ml en mujeres; AD > 85 ml/m2) y disfunción de AI y AD por método de Simpson (> 29% en hombres y 35% en mujeres); derrame pericárdico y/o pleural asociados.
En cuanto a la caracterización tisular, son una serie de secuencias que centran el flujograma diagnóstico y sus diferenciales, y que describiremos brevemente.
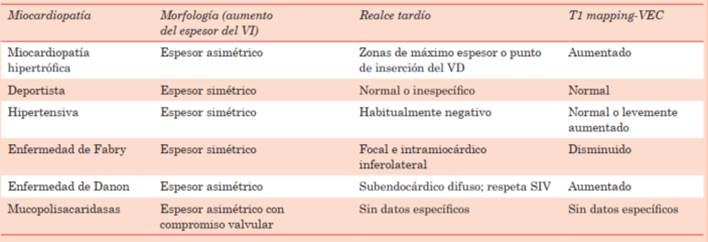
Respecto a la secuencia de realce tardío, desde que Alicia Maceira et al describieron el patrón típico subendocárdico difuso en 20055, la evidencia y la tecnología avanzó y hoy se sugiere la utilización de nueva secuencia de realce tardío (PSIR) y nuevos patrones e interacción con otras técnicas de caracterización que aumentan la sensibilidad y especificidad de los flujogramas diagnósticos10,16. Aunque se han descrito múltiples patrones de distribución del realce tardío, la amiloidosis cardíaca típicamente presenta la imposibilidad de anulación del miocardio con diferentes tiempos de inversión, siendo los patrones de referencia la presencia de realce tardío subendocárdico difuso o transmurales que no respeta territorio vascular coronario específico, predominando el patrón subendocárdico en la forma AL y transmural en la de tipo ATTr, asociándose también la transmuralidad y el compromiso biventricular a un peor pronóstico10,11,16-18. La sensibilidad diagnóstica de estos criterios, comparado con biopsia miocárdica, son del 85% con una especificidad del 92%10,19.
Para aumentar la sensibilidad y especificidad, las actuales recomendaciones sugieren asociar al algoritmo de caracterización las secuencias T1 mapping nativo pre y poscontraste, con el cálculo del volumen extracelular (VEC) comparando el T1 pre y a los 15 minutos poscontraste. Estas secuencias no solo le agregan poder diagnóstico, sino también capacidad de mejorar la especificidad en el algoritmo de sus diferenciales, y con perspectiva futura se postula como secuencia de valor pronóstico. Como ya vimos, esta secuencia T1 mapping es una nueva técnica que permite medir la señal cuantitativa directa del miocardio, tanto pre y poscontraste, por lo que evidencia en forma directa la fibrosis intersticial difusa, tanto con aumento del tiempo T1 (precontraste) como el cálculo de volumen extracelular sumando el T1 poscontraste, que ciertamente deberá ser mayor a lo normal (mayor al 25%)9,10. Este concepto-valoración de la fibrosis intersticial difusa y la cuantificación del VEC en forma directa permite aumentar la sensibilidad diagnóstica (mayor al 90%), con el agregado a su importancia que en etapas precoces de la enfermedad puede tener valores de T1 mapping aumentados, con aumento del VEC, con secuencia de realce tardío que no evidencia fibrosis focal, marcando un poderoso potencial diagnóstico en estadios más precoces14,15. Es un hecho no menor en este grupo de pacientes que para la adquisición de la secuencia T1 mapping no se requiere contraste, y así un grupo selecto de pacientes en el cual hay contraindicaciones para el contraste con gadolinio puede ser la clave de evaluación diagnóstica10,11,16,18.
Existen otros parámetros morfológicos y de caracterización tisular que nos permiten apoyar el diagnóstico, como lo son el realce tardío biauricular (no fácil de interpretar en ocasiones), el aumento del espesor del septum interauricular, y la complementariedad de secuencias de mapeo que nos permiten ver edema miocárdico con alta sensibilidad (secuencia T2 mapping), siendo de valor tanto en la amiloidosis como en la puesta a punto de sus diferenciales10,11,16,17.
Para culminar la evaluación diagnóstica por este método, mencionamos que con base en parámetros morfológicos y de caracterización tisular podemos orientarnos al tipo de amiloidosis cardíaca (ATTr vs. AL), pero dada la limitada sensibilidad de estos parámetros, considerando que en estadios más avanzados puedan presentar criterios mixtos y porque fundamentalmente existen métodos séricos e imagenológicos de alta sensibilidad y especificidad, esta información podrá ser solamente un complemento a la evaluación diagnóstica, pero no un dogma a seguir, debiéndose complementar por otras técnicas de imagen y/o análisis séricos en tipo de amiloidosis10,18-24. Expondremos en las (tabla 2), (tabla 3) y (tabla 4) un esquema de evaluación diagnóstica y diferenciales por resonancia.
En cuanto a su evaluación pronóstica, existen múltiples parámetros morfológicos y de caracterización tisular que nos hablan de sobrevida libre de eventos cardiovasculares y/o muerte. Dentro de los morfológicos, los de mayor impacto en mortalidad son el aumento de la masa del VI y/o VD, como expresión de progresión de enfermedad infiltrativa; y dentro de la caracterización tisular el aumento en la extensión del realce tardío en segmentos y profundidad (de subendocárdico a transmural), así como valor T1 nativo muy elevado y un VEC > 40%10,11,25-28.
Respecto al valor de la CR como apoyo a la monitorización terapéutica, existe evidencia que la regresión de la masa del VI en un predictor de respuesta al tratamiento quimioterápico en la amiloidosis AL, pero son las secuencias de caracterización tisular como la regresión del realce tardío o del valor de T1 mapping y/o la reducción del VEC las que se postulan como fuertes predictoras de respuesta al tratamiento con el consiguiente valor pronóstico que esto conlleva10,26-28. Por la heterogeneidad de la evidencia, formas y tipo de amiloidosis, todavía no contamos con una pauta específica de recomendación de seguimiento terapéutico con resonancia y/o período temporal de cada cuánto tiempo se debe realizar posterior al diagnóstico.
Conclusiones
Como corolario de lo expuesto, y siguiendo las últimas recomendaciones, estandarizaremos los puntos claves que deben considerarse en la adquisición e informe10,11,26.
1. Cuando hay sospecha o los hallazgos ecocardiográficos son indeterminados se aconseja la evaluación integral por CR utilizando sus herramientas basadas en las secuencias de análisis estructural-funcional (CINE-SSFP) y apoyadas en la de caracterización tisular (T1 mapping; realce tardío -PSIR-, T2 mapping, T2 mapping con el cálculo del VEC), con la finalidad de carácter diagnóstico y alejar diferenciales, pronóstico y de apoyo a la respuesta al tratamiento.
2. En ausencia de amiloidosis sistémica documentada los hallazgos de la CR deben combinarse con la clínica
3. Con base en los ítems preestablecidos, ya pautados en este número especial, hay una recomendación explícita de finalizar el informe de la CR con una probabilidad diagnóstica: a) fuertemente sugestiva; b) no sugestiva c) no concluyente.
4. Los hallazgos fuertemente sugestivos no pueden distinguir AL o ATTr con precisión, requieren de otras técnicas séricas y/o imagen.
5. La biopsia endomiocárdica es innecesaria en pacientes con CR que informa “fuertemente sugestivos” y amiloidosis sistémica histológicamente documentada o presenta imágenes diagnósticas 99mTc-PYP.
Para sistematizar los conceptos mencionados finalizaremos con un caso clínico paradigmático que se expondrá en la (figura 1).
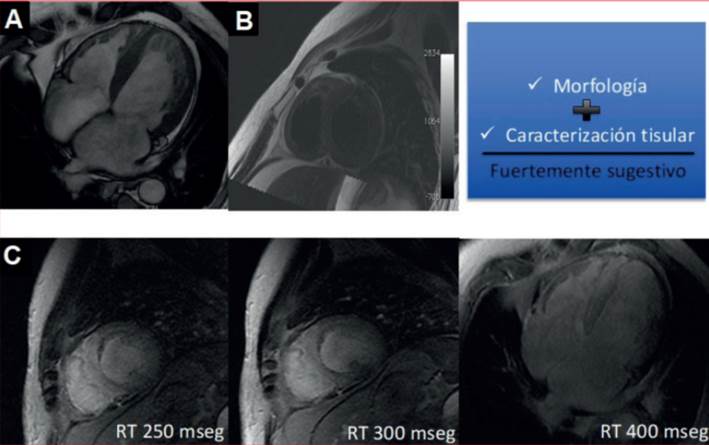
Figura 1: Caso clínico: 68 años. Sin AP. Debut de IC. ECG microvoltaje. ETT con aumento del espesor y strain sugestivo de amiloidosis cardíaca. Se solicita CR para evaluar etiología. a. Secuencia cine-SSFP que evidencia aumento del espesor difuso con dilatación biauricular. b. Secuencia T2 sin edema. c. RT difuso con imposibilidad de supresión con diferentes tiempos.