Las nuevas tecnologías digitales tienen el potencial de transformar la práctica asistencial en las próximas décadas, a través del diagnóstico más rápido y confiable de las enfermedades infecciosas, el empoderamiento de los pacientes para monitorizar y manejar sus patologías crónicas, la promoción de salud y el bienestar a través de aplicaciones personalizadas y los cuidados médicos fuera de los ambientes tradicionales a través del monitoreo remoto.
The Topol Review. Preparing the healthcare work force to deliver the digital future. NHS (National Health Service). Reino Unido. Febrero, 2019.
Introducción
La tecnología digital móvil y portable es utilizada habitualmente con diversos objetivos en nuestra vida cotidiana. En Medicina y en particular en Cardiología este recurso, aún subutilizado, tiene el potencial de transformarse en un auxiliar imprescindible en la valoración clínica y en el adecuado seguimiento de muchos pacientes con patologías crónicas de importancia pronóstica.
La llamada mSalud o salud móvil ha sido definida por la Organización Mundial de la Salud (OMS) como “la práctica médica y de salud pública apoyada en dispositivos móviles como teléfonos celulares, dispositivos de monitorización de pacientes, asistentes digitales personales y otros dispositivos inalámbricos”1. El uso de los teléfonos celulares es lo que se ve con más facilidad. Los médicos utilizamos en forma cotidiana diversas aplicaciones (apps) como fuente de consultas o asesoramiento; asimismo, el uso de estos dispositivos y diversas apps se ha desarrollado de manera explosiva entre los usuarios que intentan mejorar sus cuidados de salud. Debemos tener conciencia que inevitablemente estamos en medio de una revolución digital en la práctica médica, que es crucial asumir la responsabilidad de su aplicación y desarrollo y que estos objetivos son compartidos por médicos, pacientes e industria2. Las principales sociedades científicas del mundo han publicado en los últimos años recomendaciones para el uso y el desarrollo de las tecnologías digitales en la asistencia médica, en general y en particular para patología cardiovascular3-9.
¿Cuál es la aceptación de la sociedad en cuanto al uso y preferencias de esta tecnología disponible en salud? Más allá de la información existente sobre las características de nuestro país y las opiniones de los pacientes y operadores que resumimos en anterior publicación10, internacionalmente y según datos de la Encuesta de consumidores realizada por el Centro Stanford en Salud Digital11, globalmente el uso de medios digitales en salud creció más de 10% entre 2019 y 2020. Este porcentaje incluye la videoconsulta, la utilización de dispositivos portátiles usables o ponibles (wearables) y el seguimiento de parámetros a distancia. Particularmente y comparando en este caso entre los años 2015 y 2020, el uso de la videoconsulta pasó de 7% a 43%, el uso de dispositivos de 13% a 43% y el uso de aplicaciones para control de parámetros (pasos, actividad, etc.) de 18% a 54%. No menos importante es la comprobación que 2/3 de los pacientes buscan información en internet sobre su patología, síntomas o tratamientos (figura 1). En el mismo período se detecta, además del aumento significativo de la videoconsulta, una disminución de las consultas telefónicas y del contacto a través de mensajes de texto o correo electrónico. El 70% de los consultados manifestaron el deseo de poder compartir los datos colectados en sus aplicaciones (de actividad física, control del peso, control de diabetes, por ejemplo) con sus médicos.
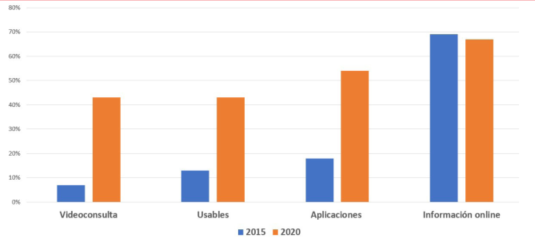
Figura 1: Adopción de herramientas digitales en salud. Modificado de referencia 11. Encuesta a consumidores sobre el uso de tecnologías en Salud Digital 2020. Stanford Center for Digital Health.
Otra encuesta realizada en marzo de 2020, en este caso entre médicos de la Asociación Americana del Ritmo Cardíaco (HRS por su sigla en inglés) y sus similares de Latinoamérica y Asia Pacífico (LA-HRS y AP-HRS) fue contestada online por 1.601 colegas de 77 países12. El análisis de las respuestas permitió concluir que la mayoría de los médicos (62%) recomendaban el uso de dispositivos de salud digitales para la detección de fibrilación auricular (FA), mayoritariamente el dispositivo KardiaMobile® y el Apple Watch®. Reclamaban, sin embargo, una mayor facilidad para integrar estos datos a la historia clínica digital y un mayor involucramiento de las sociedades científicas para establecer normas para optimizar este recurso. Con similar metodología online, una encuesta europea de 2019 tuvo la participación de 417 médicos. Como ventajas del sistema de monitoreo fueron destacadas la facilidad de su utilización, que logra rápidamente el involucramiento del paciente, la rapidez y la eficacia en lograr un diagnóstico, su disponibilidad y la posibilidad del control a largo plazo. Se anotaron algunos inconvenientes; el principal fue la sobrecarga de datos para el análisis de los profesionales13.
¿Por qué hacer screening de FA?
La FA es no solo una arritmia muy frecuente, cuya prevalencia aumenta con la edad, sino que genera una importante morbimortalidad. Multiplica por 5 el riesgo de accidente cerebrovascular (ACV), su consecuencia más dramática. El mecanismo fisiopatológico es embólico y habitualmente se trata de trombos grandes que generan infartos cerebrales de gran tamaño. Por tanto, tienen mayor mortalidad y secuelas más importantes. Su importancia se jerarquiza aún más si consideramos que pueden ser recurrentes. Sin embargo, está ampliamente demostrado que son prevenibles: depende de un diagnóstico y estratificación de riesgo oportunos y del uso de anticoagulantes en quienes esté indicado. Más allá de si la FA es la causa o un marcador de riesgo de ACV, quizás la indicación de anticoagulación sea la más trascendente que podremos hacer a un paciente en quien se detecta esta arritmia. En forma alarmante se ha reportado que en Latinoamérica el 70% de los pacientes con un ACV y FA conocida no reciben tratamiento anticoagulante. Además, el 80% de los portadores de FA desconocen que la padecen14. De acuerdo con el estudio clásico de Friberg y col., la FA tiene una prevalencia de 33% en pacientes con ACV isquémico, y 10% de estos ocurren en casos con FA no diagnosticada15. No obstante, no es esta su única consecuencia: la FA compromete la calidad de vida, la función cardíaca, aumenta la mortalidad y recientemente se ha vinculado también a deterioro cognitivo y demencia16.
En un número significativo de casos la FA es intermitente y además puede ser asintomática o presentarse con síntomas inespecíficos que no orientan a una causa arrítmica. La FA asintomática ha sido asociada en forma independiente a un mayor riesgo de ACV y mortalidad comparada con la sintomática6. Por otra parte, estudios observacionales mostraron que la respuesta al tratamiento anticoagulante es similar a cuando la FA es detectada clínicamente. En consecuencia, su diagnóstico no es sencillo con las herramientas clínicas clásicas, examen físico y ECG, y puede pasar desapercibida6. Considerando su trascendencia clínica y estas dificultades diagnósticas, es necesario y recomendable utilizar estrategias adicionales para su detección17.
Recientemente fue presentado en el congreso anual de la Asociación Europea del Ritmo Cardíaco (EHRA 2021) y luego publicado en The Lancet el estudio STROKESTOP con el reporte del seguimiento a más de 6 años de una población en la cual se utilizó una estrategia de screening18,19. El objetivo no solo fue detectar FA, sino además investigar si la estrategia de monitoreo se traducía en beneficio clínico, reduciendo morbilidad y mortalidad. Se trata de un estudio comunitario donde se invitó a participar en un protocolo de detección de FA a todas las personas de 75 y 76 años residentes en dos regiones de Suecia, sin criterios de exclusión, y fueron randomizados 1:1. Poco más de la mitad (51,3%, 7.165/13.979) de la población aceptó. Las características clínicas de ambos grupos eran similares y 55% fueron mujeres. En aquellos que no tenían FA conocida se realizó, mediante un dispositivo, un registro de ECG de una derivación durante 30″ dos veces al día durante dos semanas. De detectarse FA se indicaba anticoagulación. El punto final primario combinado considerado fue ACV isquémico, embolia sistémica, sangrado grave y muerte de cualquier causa. El score CHA2DS2VASc fue 3,5 de promedio. El seguimiento mostró que el grupo asignado a screening tuvo un número levemente menor, estadísticamente significativo de eventos respecto al grupo control (HR 0,96; 95% CI 0,92-1,0; p = 0,045). Si se analizan los resultados referidos al grupo de los realmente “tratados”, se evidencia que la diferencia se basó fundamentalmente en la menor incidencia de ACV en relación con los controles (HR 0,76; 95% CI 0,680,87)18,19.
Teniendo en cuenta este contexto, sumado a las cifras epidemiológicas que permiten estimar que la prevalencia de esta arritmia se duplicará en 30 años y considerando los aspectos aún no resueltos: a quién, cómo y cuándo hacer screening, la Unión Europea ha financiado un proyecto denominado AFFECT-EU Project con el objetivo de desarrollar una estrategia de detección utilizando aplicaciones digitales de monitorización del ritmo que permitan disminuir la carga de ACV y otras comorbilidades relacionadas a la FA20. Los principales objetivos de este ambicioso proyecto incluyen: determinar la magnitud del problema sanitario y la relevancia de la detección de FA, la precisión de los métodos digitales, comparar las estrategias en cuanto a su rendimiento y eficacia, su viabilidad y aceptación, las implicancias económicas, etcétera.
¿Cuándo hacer tamizaje de fibrilación auricular?
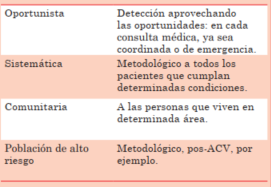
El objetivo principal de la detección de FA es poder identificar la población con mayor riesgo de ACV para establecer una terapia preventiva efectiva y segura, que en la mayoría de los casos implica el uso de anticoagulantes orales. Las nuevas tecnologías han simplificado la monitorización, pero el rendimiento de la estrategia a utilizar debe adaptarse a cada situación particular. En la (tabla 1) se resume la definición de las principales estrategias utilizadas extractadas de los documentos de consenso de las principales sociedades científicas del mundo9.
¿Cómo hacer el tamizaje de fibrilación auricular?
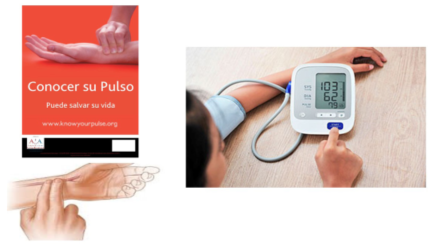
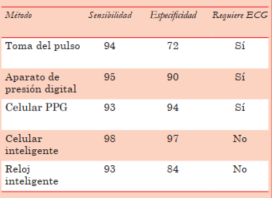
En la pesquisa de cualquier patología, lo más importante en la selección del método a usar es su sensibilidad. Los métodos disponibles para detección de FA son múltiples, ya sea clínicos o usando tecnología y la mayoría tiene sensibilidad y especificidad muy buenas. El más sencillo es la toma del pulso buscando una irregularidad continua, aunque es el de menor especificidad. Se utiliza para detección oportunística en caso de una consulta médica o al servicio de salud, o para autocontrol enseñando la maniobra al paciente o a sus familiares; requiere siempre la realización de un ECG para confirmación de la arritmia. También pueden utilizarse para el autocontrol seriado los aparatos de control de la presión arterial digitales, que al medir la presión detectan el ritmo y alertan de su irregularidad; también requieren de confirmación con ECG (figura 2).
El desarrollo tecnológico ha puesto a disposición una gran variedad de dispositivos que facilitan la detección de FA21. Se ha reportado la existencia de más de cien mil apps y de más de cuatrocientos dispositivos portátiles para la monitorización de parámetros cardiovasculares6. Los sistemas más sencillos son apps para celulares inteligentes, muchas gratuitas, disponibles para todos los sistemas operativos. Usan fotopletismografía (PPG), tecnología similar a la usada por los oxímetros, a través de un haz de luz y la cámara del teléfono, registran la onda de pulso pudiendo así definir su irregularidad. Son de uso muy amigable, sencillas y no hacen necesario ningún entrenamiento especial. Estos sistemas requieren, al igual que los métodos clínicos antes mencionados, la confirmación con un ECG. Aunque su sensibilidad y especificidad son buenas, sin duda los dispositivos que permiten registrar una derivación del ECG son superiores y, además, no requieren de la confirmación con un ECG completo. En las últimas guías clínicas de la Sociedad Europea de Cardiología (ESC) se establece (recomendación clase I) que el diagnóstico de FA puede hacerse en base al registro de un ECG de 12 derivaciones o un registro de 30″ de una derivación del ECG6. En la (tabla 2) se resumen la sensibilidad y la especificidad de estas diferentes metodologías.
Tabla 2: Sensibilidad-especificidad de las principales estrategias clínicas y tecnológicas para detección de FA. Modificado de referencia 21
Existen diferentes dispositivos (parches, relojes, lentes, cinturones) que registran una derivación del ECG, vinculados en general al celular por bluetooth®, que han permitido avanzar en la precisión diagnóstica y en la frecuencia del diagnóstico de FA. Son también sencillos de usar, tienen excelente sensibilidad y especificidad y son ideales para detección en poblaciones asintomáticas. Por ejemplo, el sistema Kardia de Alivecor®, de los más populares, es un dispositivo pequeño y fácilmente portable, vinculado al celular al cual puede adherirse, conectándose en forma inalámbrica a este a través de una app. Abriendo la aplicación y apoyando dos dedos sobre el dispositivo ubicado cercano o sobre el celular se registra una derivación del ECG durante 30″. De manera automática, el algoritmo de la app genera un reporte que tiene tres opciones: ritmo sinusal, FA o sin clasificar. El trazado obtenido se dispone en formato pdf y puede ser archivado, compartido, etc. (figura 3).
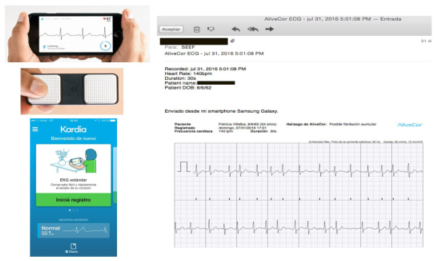
Figura 3: Sistema KardiaMobile de Alivecor®. A izquierda y de arriba abajo, celular, dispositivo y pantalla inicial de la app. A derecha, archivo pdf originado.
Este sistema, por ejemplo, fue usado en el estudio REHEARSEAF22, en el cual se aleatorizaron 1.001 personas mayores de 65 años con un score de CHADSVASc > 2 y sin historia de FA, a registrar un ECG de 30″ dos veces por semana durante un año versus los controles habituales. Se registraron 19 FA nuevas en el grupo Kardia versus 5 en grupo control (HR 3,9; 95% IC 1,410,4; p = 0,007).
El KardiaMobile de AliveCor® diseñado para uso individual fue utilizado en el estudio piloto realizado por la Comisión Honoraria para la Salud Cardiovascular con el objetivo de valorar su confiabilidad en el tamizaje de FA en una población de riesgo23. Se comparó un registro de 30″ del dispositivo con un ECG de 12 derivaciones tomado en la misma instancia. En este caso se aplicó en una población del Plan Ibirapitá, incluyéndose 114 personas (78 mujeres) con una edad media de 72 años. La sensibilidad para la detección de FA fue de 100% y la especificidad 96,6%. No hubo falsos negativos, aunque se destaca un 18,4% de registros con diagnóstico automático de “sin clasificar” por la aplicación.
Este estudio piloto se basó en un único registro de 30″. Cada cuánto debería reiterarse este control en la población objetivo para optimizar su rendimiento sigue siendo una pregunta sin respuesta definitiva. En un ensayo llevado a cabo en China, usando también el dispositivo AliveCor® Heart Monitor, se incluyeron pacientes de varios centros comunitarios residentes en la provincia de Shanghái, considerando como únicos criterios de inclusión ser mayores de 65 años y no tener historia de FA. Fueron randomizados a un solo control anual o controles trimestrales (n 4.120 en cada grupo). El control trimestral se asoció a un aumento significativo en la detección de FA (HR 1,71; 95% IC 1,062,76; p = 0,029)24.
Existe un gran desarrollo y competencia en diversos fabricantes de relojes inteligentes. Algunos permiten no solo el registro del ECG, una o más derivaciones durante 30″, sino también de la presión arterial y de la saturación de O2. Varias empresas conocidas los han desarrollado: Samsung, Garmin, Huawei, Fitbit, Galaxy y otras (figura 4). El más conocido y estudiado es el Apple Watch® que usando tecnología PPG registra un tacograma y mide los intervalos pico a pico que interpreta como RRs. Aplicando un algoritmo propio puede determinar su regularidad. Sin embargo, la precisión de este algoritmo para definir FA puede estar comprometida por la presencia de extrasístoles o por el movimiento. Pero, además, incorporando la tecnología del sistema KardiaMobile de AliveCor®, es posible registrar una derivación del ECG a través de un circuito establecido entre un detector ubicado en la parte inferior en contacto con la piel y un dedo apoyado en la perilla. Una vez registrados los 30″ del ECG genera automáticamente un reporte y es almacenado en el celular vinculado desde donde puede disponerse. Es conveniente hacer el registro en reposo para una mejor definición (figura 5).

Figura 5: Arriba, app del celular usando PPG, registrando la onda de pulso. Abajo, registro con el App
El Apple Heart Study valoró el algoritmo diagnóstico de FA utilizando PPG25. En este estudio participaron 419.297 personas mayores de 18 años, en los cuales se registraba un tacograma de 1 minuto cada 2 horas. Aquellos en los que se identificaba un ritmo irregular recibían por correo un parche para registrar el ECG en forma permanente durante 7 días, que se devolvería de la misma forma. El ECG obtenido por el parche era luego analizado por dos médicos. De los participantes, solo 0,52% recibieron una notificación inicial de ritmo irregular y considerando aquellos que devolvieron el parche el valor predictivo de FA de la notificación fue de 84%. Si consideramos a las personas de más de 65 años, 3,2% recibieron notificaciones. De manera similar en el Huawei Heart Study26, realizado en China, se usaron dos dispositivos de esa empresa, una pulsera y un reloj, que registraban el ritmo y su regularidad usando también un algoritmo basado en PPG. Se incluyeron 187.912 mayores de 18 años que se monitorizaron durante 14 días. De ellos, 424 (0,23%) recibieron la notificación de posible FA. Entre los que se avanzó en la confirmación diagnóstica, el 87% tenían FA. También en este estudio tanto el reporte de posible FA como su confirmación fue más frecuente en mayores de 65 años.
Intentando proyectarnos hacia el futuro cercano en el desarrollo de estas herramientas y considerando su avasallante avance, debemos mencionar que ya existen sistemas de monitorización del ritmo cardíaco sin contacto con la piel. Analizan las señales de PPG obtenidas de la imagen de la cara de una persona a través de la cámara del celular, detectando los cambios de coloración de la piel vinculados al ciclo cardíaco27. Otra línea de desarrollo tecnológico aplica un sistema de sonar similar al usado en los radares, que basado en el parlante del celular emite señales continuas en frecuencia modulada. La señal de cada latido cardíaco es recibida por el micrófono y luego de un complejo procesamiento y el uso de varios algoritmos, concluye en una señal que permite computar los intervalos RR, su variabilidad y definir la probabilidad de la existencia de FA28. En estudios clínicos preliminares realizados para validar la idea, se comprobó una excelente correlación entre los RR medidos de esta forma y el ECG.
Los registros reiterados multiplican por 3 la posibilidad de detectar una FA, ya sea en relación con el registro único o con estudios de Holter de 24-48 horas. De cualquier manera, son siempre controles intermitentes. Cuando se desea un monitoreo continuo la tecnología pone también a disposición otras plataformas. Por ejemplo, existe un sistema de parches descartables de 14 días de duración a prueba de agua que permiten un monitoreo permanente durante ese período. Concluido este, el parche se retira y son leídos los registros cuyo reporte es enviado al médico referente. Es de uso más confortable para el paciente que un sistema de Holter prolongado21.
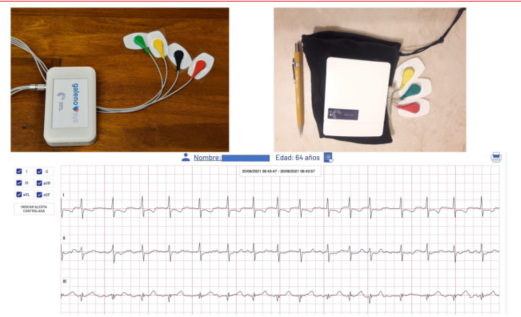
En nuestro país también existen iniciativas en desarrollo con sistemas de monitoreo/telemetría permanente en línea en pleno desarrollo. Se trata de un dispositivo del tamaño de una caja de cigarrillos conectado al paciente con 4 electrodos torácicos, que permite registrar en forma continua y por el período de tiempo que sea necesario, hasta 6 derivaciones del ritmo cardíaco. La información es enviada en forma continua a un servidor en la nube, lo que permite analizar desde cualquier dispositivo, celular o computadora el ECG en tiempo real o el análisis histórico del registro del paciente con jerarquización de alarmas mediante la aplicación de un algoritmo. Es muy práctico para monitorización ambulatoria de largo plazo, para telemetría intrahospitalaria o en internación domiciliaria (figura 6).
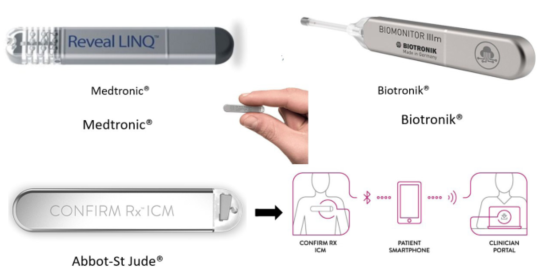
Varias empresas han desarrollado registradores de eventos en asa (loop recorders) implantables en el tejido celular subcutáneo. De forma similar a los registradores de eventos externos, los implantados registran el ECG cuando son activados por el paciente, en este caso aplicando un magneto sobre el dispositivo, o cuando se activa de manera automática su algoritmo de detección. Al inicio fueron indicados para la evaluación de pacientes con síntomas esporádicos probablemente vinculados a arritmias como palpitaciones o síncope de causa no explicada. Los nuevos dispositivos tienen algoritmos específicos para la detección de FA; su batería dura varios años (figura 7). Se han utilizado básicamente para tratar de detectar FA en pacientes que han tenido un ACV. La información disponible es limitada y la incidencia reportada de nueva FA es muy variable debido a diferencias en las poblaciones estudiadas, a la tecnología de los mismos dispositivos y al tiempo de seguimiento. En la actualidad, su indicación para el diagnóstico de FA es limitada, aunque aún no conocemos reportes con los dispositivos más recientes6,8.
¿En quiénes pesquisar fibrilación auricular?
La eficacia y el rendimiento del screening dependen de la población objetivo, del método utilizado en cuanto a su certeza diagnóstica y de los costos de su aplicación. Los factores de riesgo que deben considerarse para seleccionar la población a valorar son básicamente los incluidos en el score CHA2DS2VASc de estimación del riesgo de ACV.
Las diferentes estrategias para detección de FA, ya sea oportunista o sistemática, han sido evaluadas en numerosos estudios involucrando diferentes poblaciones. Algunos estudios referidos a poblaciones de riesgo, otros en la comunidad o con pacientes internados o en oportunidad de concurrir a centros asistenciales. Globalmente la tasa de detección fue de 0,9% (95% IC, 0,7-1,1), lo cual determina que el número de personas a controlar sería de 111 por cada diagnóstico de FA8. Sin embargo, teniendo en cuenta la relación demostrada entre la presencia de FA y la edad, ajustando para los mayores de 65 años como lo hace un metaanálisis que involucra a más de 140.000 personas, la tasa de detección con un solo control del ritmo fue de 1,4% (95% IC, 1,13-1,82). En este caso, el número necesario de individuos a incluir sería de 69 por cada FA detectada29.
Estos resultados fueron independientes de la geografía y del método de detección utilizado, aunque se trató siempre de un registro único. El ensayo SAFE (Screening for AF in the Elderly) realizado en el Reino Unido, randomizó pacientes de 65 o más años a chequeo oportunístico versus sistemático, que se compararon con un grupo control de seguimiento habitual (5.000 incluidos por grupo aproximadamente). El período de estudio fue de un año, y en ambos grupos de intervención se identificaron más casos nuevos de FA comparativamente con la conducta habitual (OR 1,6; 95% IC 1,1-2,3)30. Como fue también demostrado, el tiempo de monitorización aumenta de manera significativa la detección de FA18,22. De forma concordante con el aumento de la prevalencia de FA y de ACV, el rendimiento de las estrategias de screening aumenta con la edad, no se indica en pacientes asintomáticos menores de 65 años si no hay factores de riesgo que lo justifiquen, por ejemplo, antecedentes de hipertensión arterial o de apnea obstructiva del sueño. Recientemente el grupo de trabajo de la ESC en Cardiología Digital (e-Cardiology)4 estableció recomendaciones referidas a las estrategias para el tamizaje de FA, que resumimos en la (tabla 3).
A nivel global, más del 80% de los ACV son isquémicos y de ellos en un 15%-40% no se puede definir una causa y de manera genérica se denominan criptogénicos. El grupo de pacientes que presenta un ACV embólico en los que no se detecta una causa clara ni se registra FA por los métodos tradicionales (ESUS: Embolic Stroke of Undetermined Source), tiene un elevado riesgo de recurrencias y de lesiones isquémicas clínicamente silenciosas. La mejor estrategia para la prevención secundaria en este grupo significativo de pacientes genera siempre un problema clínico: ¿antiagregación o anticoagulación? Dos estudios de reciente publicación valoraron en esta población: uno de ellos, el uso de rivaroxaban 15 mg versus aspirina 100 mg31; y el otro, dabigatrán 150/110 mg x2 versus aspirina 100 mg32. En ninguno de los dos estudios los anticoagulantes directos usados empíricamente mostraron superioridad sobre el uso de aspirina y sí una mayor incidencia de sangrados en el caso del rivaroxaban. Estos resultados jerarquizan aún más la importancia de profundizar la metodología para detección de FA. El monitoreo prolongado permitirá definir con mayor certeza la necesidad del uso de anticoagulantes y evitar su empleo en forma empírica9.
El ensayo EMBRACE (Event Monitor Belt for Recording Atrial fibrillation after a Cerebral Isquemic Event) incluyó 572 pacientes y comparó el monitoreo durante 30 días con un registrador de eventos versus Holter de 24 horas realizado dentro de los 90 días del episodio isquémico cerebral. Se detectó 16% de FA en el primer grupo versus 3,2% en el grupo Holter (p < 0,001); el número de pacientes a monitorizar por cada FA detectada fue de 833. Por otra parte, el estudio CRYSTAL-AF (Cryptogenic Stroke and Underlying Atrial Fibrillation) en una población pos-ACV isquémico sin FA documentada en ECG o Holter de 24 horas, comparó el uso de un dispositivo implantable (n: 221) versus los controles habituales (n: 220). El grupo implantado mostró una frecuencia de detección de FA 6 veces mayor a los 6 meses, que alcanzó al 30% del grupo a los 3 años34. El monitoreo prolongado se traduce en una reducción del 51% en el riesgo de recurrencia de ACV de acuerdo con un reciente metaanálisis. Este análisis que incluyó 28 estudios con un total de 4.531 pacientes mostró que la detección de FA luego de un evento isquémico cerebral se asoció solo con dos factores: la edad y la duración de la monitorización35.
En pacientes portadores de marcapasos o cardiodesfibriladores que permiten el registro de la actividad auricular (catéter atrial o electrodos proximales para sensado en electrodo ventricular) se pueden detectar episodios de frecuencia rápida auricular, Atrial High Rate Episodes (AHRE, por su sigla en inglés). Integran el espectro de la llamada FA subclínica, aunque a veces se utilizan estos términos como sinónimos. Si bien no existe un límite específico de frecuencia, habitualmente los dispositivos lo definen por defecto como una frecuencia > 175 pm. Debido a su intermitencia y a veces corta duración, es casi imposible detectarlos por métodos de registro externos. Constituye una recomendación clase I en las guías de FA de la ESC 20206 que al controlar periódicamente marcapasos y cardiodesfibriladores se revisen los electrogramas auriculares almacenados y se confirme si se trata de AHRE, valorando su incidencia general, duración, aspectos que además ayudan a determinar la “carga” de FA (figura 8).
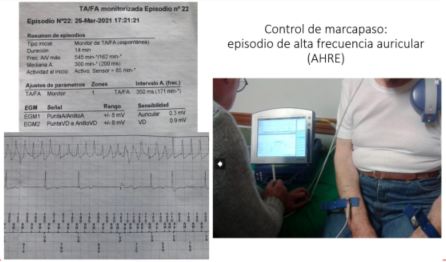
Figura 8: Registros tomados del programador durante el control rutinario de un marcapaso bicameral en policlínica. Arriba: detalles del episodio, fecha, hora, duración. Debajo: registro intracavitario sensado a través de los electrodos auricular y ventricular; de arriba abajo, registro de actividad auricular, registro de actividad ventricular, canal con medida de los intervalos auriculares y ventriculares. AR: registro auricular durante el período refractario; AS: sensado de actividad auricular; VS: sensado de actividad ventricular; VP: actividad ventricular estimulada.
Es habitual que la población portadora de marcapasos sea añosa, por tanto, el registro de AHRE en pacientes con dispositivos es frecuente, estimándose entre un 30%-70%36. Los episodios breves, de segundos de duración, son irrelevantes desde el punto de vista clínico. Sin embargo, cuando son prolongados se asocian a mayor riesgo de FA, ACV isquémico y eventos cardiovasculares mayores. Se ha reportado además que 1 de cada 5-6 pacientes con AHRE desarrollarán FA en un período de 2,5 años37. Sin embargo, todavía no está claro el riesgo de ACV de esta población en comparación con una población con FA detectada clínicamente. La indicación de tratamiento anticoagulante es, entonces, todavía motivo de debate, debiendo considerarse siempre el riesgo global del paciente. La evidencia actual sugiere considerar su uso cuando los episodios duran más de 24 horas y es obligatorio cuando el score CHA2DS2VASc es > 2. Puede estar justificado también cuando, si bien la duración es menor, el riesgo es elevado. En cualquier caso, estos pacientes requieren de un control más estricto, monitorización regular y reevaluación periódica del score de riesgo. Existe en curso una serie de ensayos clínicos que aportarán más información sobre ese punto.
Más allá del diagnóstico de fibrilación auricular: el rol de la tecnología en el manejo y la prevención
Las herramientas digitales disponibles también facilitan al clínico el manejo y el seguimiento de los pacientes con FA ya conocida. Agregado a su aporte en el diagnóstico inicial, su utilidad es fácilmente comprensible en la valoración del mantenimiento del ritmo sinusal luego de una cardioversión o de una ablación, por ejemplo. Además, permiten valorar y controlar otros aspectos que, como en la mayoría de las enfermedades crónicas no trasmisibles, son muy difíciles de seguir en forma continua y objetiva en la práctica asistencial tradicional. Entre ellos la adherencia al tratamiento, los cambios de estilo de vida, el autocontrol, pudiendo aportar también aspectos educativos fundamentales. Está demostrado que el mayor empoderamiento de los pacientes respecto a su patología y su control mejora los resultados clínicos.
El ensayo mAF-App Trial reporta la experiencia con el uso de una aplicación sencilla que incorpora datos clínicos y antecedentes del paciente, los scores de riesgo de ACV y sangrado, además de material educativo, diferentes estrategias para involucrar al paciente y protocolos de autocuidado y seguimiento38. En el piloto se randomizaron 113 pacientes para el uso de la app y 96 para el control habitual. El uso de la app se tradujo en una mejoría en el conocimiento de la patología, en la adherencia al tratamiento, sobre todo la aceptación del tratamiento anticoagulante y en la calidad de vida. El mismo grupo de investigadores (mAF-App II Trial Investigators) publicó recientemente un ensayo39 a mayor escala realizado en 40 ciudades de China, con el objetivo de demostrar si el uso de la tecnología móvil como parte de una estrategia de manejo del paciente con FA (1.646 pacientes) reducía los eventos adversos en relación con el control habitual (1.678 pacientes). Con el apoyo tecnológico, el punto final combinado de ACV + tromboembolismo, rehospitalizaciones y muerte fue significativamente menor (1,9% versus 6,0%, HR 0,39; 95% IC 0,22-0,67; p < 0,001).
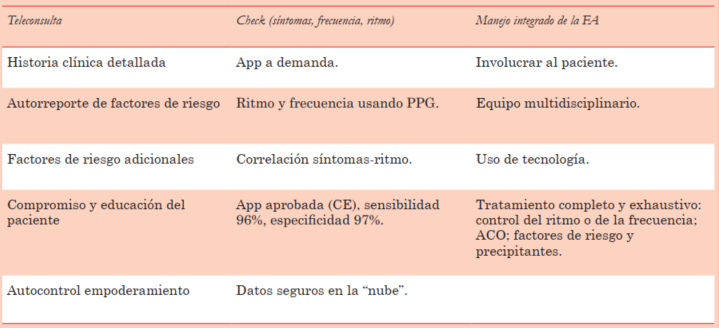
Al inicio de la pandemia por coronavirus la clínica de FA del Centro Médico de la Universidad de Maastricht canceló las consultas presenciales de los pacientes con FA que pasaron a realizarse en formato de teleconsulta. En apoyo a esta modalidad de relación con el paciente se instrumentaron recursos de mSalud para monitorización del ritmo y la frecuencia cardíaca usando apps, proyecto denominado TeleCheck-AF, que se fundamentó en tres pilares: la teleconsulta, el control del ritmo y frecuencia y el enfoque multidisciplinario40(tabla 4).
El protocolo TeleCheck-AF es aplicado en numerosos centros europeos. Recientemente los investigadores presentaron en el Congreso de la EHRA 2021 los resultados de dos encuestas realizadas a los centros participantes, una sobre las características del centro (25 sitios) y otra sobre la experiencia en sí misma (23 sitios). Se reclutaron 1.930 pacientes en 28 semanas. La mayoría de los centros eran académicos y tenían clínicas de FA especializadas (64%). La experiencia reportada fue ampliamente satisfactoria: uso sencillo y accesible tanto para el médico como para los pacientes, aceptación y confiabilidad de los datos. En otro reporte se resume una encuesta de satisfacción realizada a los pacientes (completada por 826 pacientes). La aceptación fue ampliamente mayoritaria, con la mayor adherencia lograda en la población de más de 80 años y el deseo de mantener esta alternativa luego de la pandemia41,42.
La Inteligencia Artificial (IA) se utiliza en electrofisiología desde hace décadas y es aplicada para el análisis de los registros obtenidos mediante el uso de PPG en teléfonos celulares y relojes inteligentes. En la actualidad, sumado al desarrollo tecnológico en sensores, al mayor poder de las computadoras y a la existencia de plataformas basadas en la web, sus usos se han potenciado. El avance en las telecomunicaciones, el wifi, los celulares inteligentes, junto a conceptos nuevos como el de internet de las cosas, que refiere a la interconexión digital de objetos cotidianos con internet, han permitido, como vimos, el monitoreo de grandes poblaciones para la detección de FA, un hecho que hasta hace no muchos años era inimaginable. Este desarrollo seguramente contribuirá en un futuro cercano, además del diagnóstico y el seguimiento de la FA, a su prevención. Un modelo de IA fue aplicado para el análisis del ECG basal en ritmo sinusal, utilizando una muestra de 10″ de las 12 derivaciones de registros de la base de datos de la Clínica Mayo de Estados Unidos43. Se analizaron 649.931 ECG correspondientes a 180.922 pacientes. Se logró identificar a los pacientes que tendrían FA por el ECG en ritmo sinusal con una sensibilidad y especificidad del 79%. Si se consideraban los ECG registrados en el mes previo a la primera FA, la sensibilidad fue del 82,3% y la especificidad de 83,4% (área bajo la curva: 0,90).
Lo que falta
Más allá de la información resumida, vinculada específicamente a la FA, quedan aún muchas interrogantes que sin duda tendrán respuesta en los próximos años. A modo de ejemplos: ¿cuál es el número de personas a controlar para prevenir un ACV?, ¿cuánto tiempo debería monitorizarse una persona de riesgo?, ¿cuáles son las estrategias de detección de mayor rendimiento?, o ¿cuánto debe durar el screening luego de un ACV? Además, las nuevas tecnologías tendrán que ser validadas en ensayos clínicos, deberán incorporarse a la historia clínica electrónica y también permitir el diagnóstico de otras arritmias (figura 9).
Por último, pero muy importante, la indicación y los resultados deben ser analizados en el contexto global e individual de cada paciente.
A pesar de estas limitaciones, el uso y la aceptación de los recursos tecnológicos en los cuidados de salud está cada vez más difundido entre los pacientes/consumidores. Sumado a la investigación y al desarrollo de diferentes tipos de dispositivos para monitorizar los parámetros biológicos por empresas tecnológicas, inevitablemente estos procesos impulsarán su aplicación en la rutina asistencial44,45(figura 10).
Conclusiones
El concepto de salud digital comprende el uso de tecnologías de la comunicación que permiten colectar y analizar información digital para mejorar la salud del paciente, su educación y asegurarle una correcta asistencia. Involucra a la telesalud, registros electrónicos, dispositivos de monitorización implantables o sensores portátiles, IA, ciencias del comportamiento y a la llamada medicina personalizada. La mSalud es parte de este concepto. Quizás los especialistas más adaptados a su uso sean los electrofisiólogos, pero el desarrollo de los sensores hará que esta modalidad asistencial se expanda a todas las especialidades, principalmente a aquellas que manejan patologías crónicas no trasmisibles.
La mSalud se encuentra en diferentes etapas de desarrollo en el mundo. Solo algunas de las tecnologías resumidas en este artículo están aprobadas a escala global o son financiadas en todos los países. La OMS ha planteado que el aumento de la capacidad de implementar y desarrollar a gran escala estrategias innovadoras y rentables en salud digital jugará un papel fundamental para conseguir el objetivo de una cobertura sanitaria universal, al mismo tiempo que aseguraría servicios de calidad3. Para cumplir este objetivo deben superarse algunas barreras, sin embargo, la pandemia por coronavirus permitió visualizar que la base tecnológica existe y que muchos obstáculos pueden resolverse con facilidad. La mSalud revolucionará la forma de interacción entre las poblaciones y los servicios de salud en el mundo.
Finalmente, en referencia concreta al screening de FA y más allá de la enorme ayuda que el desarrollo y uso de la tecnología aportan en la práctica, su indicación y sus resultados deben ser siempre analizados en el contexto global e individual de cada paciente y de acuerdo con la evidencia científica.
El uso de la tecnología digital en salud, que incluye la genómica, la medicina digital, la inteligencia artificial y la robótica, no debe ser visto simplemente como un aumento en los costos. Se trata de una nueva manera de abordar los enormes desafíos en los cuidados de la salud del siglo XXI.
The Topol Review. Preparing the healthcare work force to deliver the digital future. NHS (National Health Service). Reino Unido. Febrero, 2019.