Principales aportes
La degeneración valvular protésica es un problema para los cardiólogos y cirujanos. Hasta el momento, las técnicas convencionales permitían realizar su diagnóstico en las últimas etapas de este proceso. El PET con 18Ffluoruro de sodio identifica de forma precoz la degeneración protésica subclínica. Estudiamos una cohorte de pacientes con PET con 18Ffluoruro, al año de ser sometidos a sustitución valvular biológica. No se detectaron alteraciones en el PET ni en los gradientes valvulares ecocardiográficos.
Introducción
El implante de prótesis biológicas aórticas es cada vez más frecuente debido, entre otros factores, al envejecimiento poblacional, las preferencias del paciente y el advenimiento de las prótesis valvulares aórticas transcatéter1. A pesar de los avances en el diseño de las bioprótesis, la degeneración de estas es uno de los principales problemas a largo plazo, y genera aumento de la morbimortalidad, lo que se estima será un problema aún mayor en las próximas décadas2.
Si bien el conocimiento de la patogenia de esta entidad ha ido en aumento, existen aspectos que aún quedan por dilucidar y las técnicas de imagen usadas habitualmente nos permiten hacer diagnóstico de degeneración valvular, pero no son capaces de detectar etapas precoces de este proceso. El documento de consenso de la Valve Academic Research Consortium-3 (VARC-3)3 define la disfunción protésica aórtica de acuerdo con ciertos parámetros ecocardiográficos. Recientemente se describió que la tomografía por emisión de positrones (PET) con 18Ffluoruro puede identificar de manera precoz, antes que el ecocardiograma, aquellas bioprótesis con degeneración subclínica4. Esto se debe a que este trazador se une preferencialmente a zonas con microcalcificaciones o microtrombosis, indicativas de degeneración protésica. El nivel de captación del 18Ffluoruro en la prótesis valvular, corregido por el nivel de captación del pool sanguíneo, es el índice que se utilizó para detectar la degeneración valvular. Esta herramienta podría ser útil en predecir la disfunción protésica a futuro, seleccionando a aquellos pacientes con mayor riesgo de degeneración a los que justificaría realizar un seguimiento más estrecho o incluso intervenciones terapéuticas tempranas5. Sin embargo, es escasa la evidencia respecto a la relación entre parámetros precoces de deterioro estructural obtenidos con PET y los parámetros hemodinámicos obtenidos por ecocardiografía en prótesis biológicas implantadas quirúrgicamente en posición aórtica.
El objetivo de nuestro trabajo es correlacionar los parámetros de deterioro estructural protésico por PET con los parámetros hemodinámicos ecocardiográficos al año de la sustitución valvular aórtica (SVA) por bioprótesis porcina.
Materiales y métodos
Tipo de estudio
Se trata de un estudio prospectivo ad hoc de un ensayo clínico. Entre el 01/01/2019 y el 13/02/2020 se realizó un ensayo clínico randomizado que incluyó a todos los pacientes sometidos a SVA por bioprótesis porcina en dos centros nacionales de cirugía cardíaca. Fueron incluidos 140 pacientes. Se realizaron controles clínicos al alta, a los tres meses y al año de la SVA.
Evaluación ecocardiográfica
Se realizaron controles con ecocardiograma transtorácico (ETT) en el posoperatorio antes del alta, a los 3 meses y al año luego del procedimiento. Los siguientes parámetros ecocardiográficos fueron analizados: fracción de eyección del ventrículo izquierdo, diámetro diastólico del ventrículo izquierdo, diámetro de la aurícula izquierda, área efectiva valvular aórtica (AVA) absoluta e indexada, coeficiente de obstrucción (CO), gradiente medio, gradiente máximo, insuficiencia protésica (ninguna, mínima, leve, moderada, severa). Los ETT fueron realizados de acuerdo a la guía de la Sociedad Americana de Ecocardiografía6, los gradientes de presión derivados de la fórmula de Bernoulli modificada y la AVA calculada por ecuación de continuidad.
Evaluación por tomografía con emisión de positrones fusionada con angiotomografía
De esta población, se seleccionaron de forma aleatoria 19 pacientes a los que se les realizó PET con 18Ffluoruro de sodio fusionado con angiotomografía (angioTC) luego del año de la SVA.
Para cuantificar la captación de 18Ffluoruro, se trazó a partir de las imágenes PETTC una región de interés (ROI) circular (área de 1 cm2) alrededor del área de captación máxima que se origina en las cúspides de la válvula, empleando un enfoque del “segmento más enfermo”. En los casos en los que no se visualizaba captación en las cúspides, se trazó una ROI circular de 1 cm2 en el centro de la válvula. Los valores medios y máximos de captación estandarizada (SUV) de la válvula (SUVavV) se extrajeron de estas ROI y se corrigieron para la actividad del pool sanguíneo, medido en la aurícula derecha (SUVavA) (ROI de 2 cm2, cortes axiales, al nivel del ostium coronario derecho) para calcular el cociente target to background (índice SUVavV/SUVavA). Cuanto mayor sea la captación de 18Ffluoruro en la válvula respecto a la aurícula derecha, mayor será el índice y, por tanto, sugiere mayor degeneración valvular (no existe en la actualidad un valor umbral aceptado universalmente).
En la angioTC se valoró la presencia de trombo, pannus, engrosamiento de las valvas ≥ de 2 mm con 30200 UH, calcificación valvular (> 500 UH). Asimismo, se tomaron medidas del anillo, área valvular, diámetro del tracto de salida del ventrículo izquierdo, altura de los ostium de las arterias coronarias y de la aorta.
Análisis estadístico
Debido al tamaño de la muestra, las variables cualitativas se expresan en valor absoluto y frecuencia relativa (FR), las cuantitativas en mediana e intervalo intercuartílico. Se comparó el índice SUVavV/SUVavA con los gradientes medio y máximo medidos por ecocardiograma transtorácico al año de la SVA realizando un análisis de correlación de Spearman.
Resultados
Se analizaron 19 pacientes, con una mediana de tiempo de realización del PET de 16,3 meses (15,9-16,9) luego de la SVA. Las características basales de la población se muestran en la (tabla 1). La mediana de edad de la población fue de 72 (66-79) años, 8 (frecuencia relativa (FR) 0,42) eran de sexo masculino y se destaca la presencia de una importante prevalencia de factores de riesgo cardiovasculares: 19 hipertensos (FR 1), 6 diabéticos (FR 0,31), 14 dislipémicos (FR 0,73) y 8 tabaquistas (FR 0,42).
Todas las prótesis implantadas fueron de origen porcino (Medtronic Hancock II Ultra n=9, Mosaic n=2 y St Jude Epic n=8).
La mediana de captación fue un índice SUVavV/SUVavA = 1,17 (1,11-1,27). En cuanto a los datos ecocardiográficos al año, la mediana del área valvular aórtica fue de 1,24 cm2 (1,12-1,48), las medianas de los gradientes fueron medio 19 mmHg (14-26,5) y máximo 31 mmHg (25-44,5), y la mediana del CO fue 0,42 (0,37-0,51). Solo un paciente presentó regurgitación protésica mayor que leve (moderada).
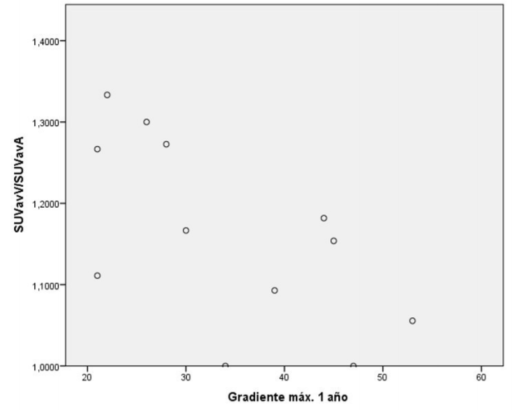
Respecto al análisis de correlación de Spearman, se encontró una correlación negativa moderada (Rho de Spearman, coeficiente de correlación -0,516) estadísticamente significativa entre la captación de 18Ffluoruro en el PET y el gradiente medio al año (p = 0,028), así como entre la captación y el gradiente máximo al año (Rho de Spearman, coeficiente de -0,589, p = 0,010) (figura 1) y (figura 2).
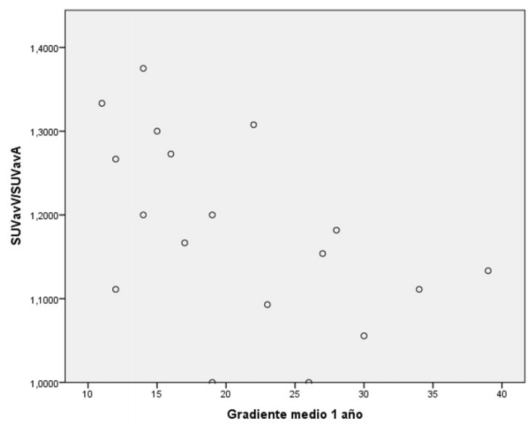
Figura 1: Correlación gradiente medio al año vs. SUVavV/SUVavA. Rho de Spearman, coeficiente de correlación -0,516, valor p = 0,028.
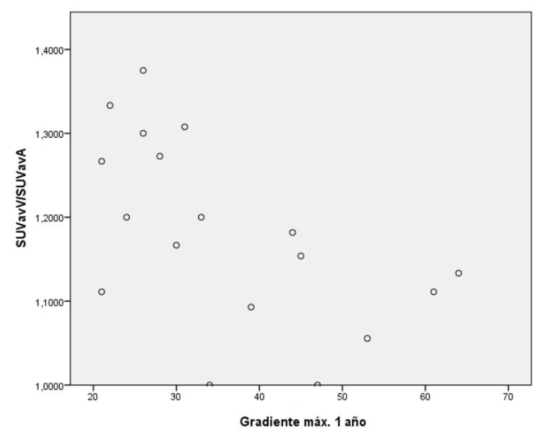
Figura 2: Correlación gradiente máximo al año vs. SUVavV/SUVavA. Rho de Spearman, coeficiente de correlación -0,589, valor p = 0,010
En la angioTC se encontraron macrocalcificaciones valvulares en 5 pacientes (FR 0,26) y trombo en la válvula de un paciente (FR 0,05). No se detectó pannus en ningún caso.
A la luz de estos resultados, se realizó un análisis excluyendo a los pacientes con macrocalcificaciones y/o trombo, del cual se destaca que la mediana de captación fue un índice SUVavV/SUVavA = 1,16 (1,08-1,27). En cuanto a los datos ecocardiográficos al año, la mediana del área valvular aórtica fue de 1,20 cm2 (1,10-1,41) y las medianas de los gradientes fueron medio 17 mmHg (12-26) y máximo 30 mmHg (22-44). La mediana del CO fue de 0,42 (0,37-0,51) y no hubo regurgitaciones protésicas.
En este análisis se encontró también una correlación negativa moderada estadísticamente significativa (Rho de Spearman, coeficiente de correlación -0,589) entre la captación de 18Ffluoruro en el PET y el gradiente medio al año (p = 0,044), así como entre la captación y el gradiente máximo al año (Rho de Spearman, coeficiente de -0,611, p = 0,035) (figura 3) y (figura 4).
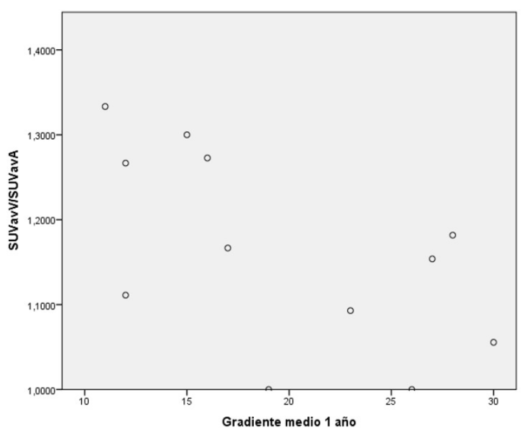
Figura 3: Correlación gradiente medio al año vs. SUVavV/SUVavA, excluyendo pacientes con macrocalcificaciones y trombo. Rho de Spearman, coeficiente de correlación -0,589, valor p = 0,044.
Discusión
Se presentan los resultados de un estudio ad hoc sobre correlación de parámetros de degeneración valvular y parámetros hemodinámicos ecocardiográficos al año del implante quirúrgico de prótesis biológicas en posición aórtica, encontrando una correlación negativa moderada, estadísticamente significativa. Nuestro estudio representa el primer estudio a nivel nacional que evalúa esta correlación en bioprótesis implantadas quirúrgicamente.
El trazador 18Ffluoruro emergió en los últimos años como un marcador de actividad de microcalcificación en el sistema cardiovascular7-9. Dweck y col. demostraron que, en pacientes con válvulas aórticas nativas, la captación de este trazador era mayor en pacientes con estenosis aórtica que en pacientes control y, a su vez, que el nivel de captación se correlacionaba con la severidad de la enfermedad10. Así como en la fisiopatología de la estenosis aórtica, la calcificación también estaría involucrada en la degeneración valvular protésica11. Existe un único trabajo realizado con PET 18Ffluoruro en bioprótesis aórticas. En este, realizado por Cartlidge y col.4, se realizó un PET 18Ffluoruro de 2 a 10 años luego de la SVA y después se siguió a los pacientes con ecocardiogramas anuales. Los autores de este trabajo sugieren usar un valor umbral de captación de 1,3 para catalogar un estudio PET como anormal; este valor surge de estudios previos de PET con 18Ffluoruro para placas ateroscleróticas12, que luego se reafirma debido a que es el umbral que define el tercil superior de captación de sus resultados. En el trabajo de Cartlidge, se encontró que los pacientes con mayor captación en el PET (índice de captación más alto) fueron los que tuvieron un deterioro más rápido en la función protésica y todos aquellos pacientes que desarrollaron disfunción protésica clínicamente evidente en la evolución, habían tenido altos niveles de captación en el PET basal. Los autores concluyen que el PET 18Ffluoruro identifica de forma precoz la degeneración protésica subclínica.
En nuestro trabajo encontramos valores de captación en el PET globalmente bajos en comparación con este valor umbral sugerido, con una mediana del índice de captación de 1,17. Es decir que, globalmente, se encontró en las bioprótesis implantadas una captación solo 17% mayor que la del pool sanguíneo, hallazgo que puede explicarse por la precocidad del estudio respecto al implante de la bioprótesis (un año). Asimismo, encontramos una asociación inversa moderada (según el coeficiente de correlación) entre los hallazgos de captación del PET 18Ffluoruro y los gradientes medidos en el ecocardiograma al año de la SVA. Creemos que la diferencia entre nuestros hallazgos y los de Cartlidge radica en el tiempo de evolución desde la cirugía hasta la realización de los estudios imagenológicos; nuestra población no tuvo la ventana de tiempo necesaria para evidenciar microcalcificación protésica. Esto nos hace plantear que no sería aconsejable la realización del PET previo a los 2-5 años cuando este se realice con fines pronósticos a la degeneración futura.
En la presentación preliminar de un trabajo de seguimiento de 73 pacientes con implante de válvulas aórticas transcatéter con ecocardiograma y PETTC, Sorysz y col.13 encontraron la misma correlación inversa significativa entre la captación de 18Ffluoruro a los 6 meses y el gradiente máximo por ecocardiograma a los 6 meses. Los autores discuten que este hallazgo pueda deberse a una casualidad, lo que también puede ser una explicación a nuestros hallazgos; aunque también podría explicarse por la precocidad de la realización del estudio.
En cuanto a los parámetros ecocardiográficos, el documento de consenso de la VARC33) define el deterioro protésico hemodinámico (moderado) como un aumento en el gradiente medio ≥ 10 mmHg que resulte en un gradiente medio ≥ 20 mmHg con un descenso concomitante del área efectiva valvular aórtica (AVA) ≥ 0,3 cm2 o ≥ 25%¸ y/o una disminución del coeficiente de obstrucción ≥ 0,1 o ≥ 20%, comparado con el ecocardiograma realizado de 1 a 3 meses de posoperatorio; y/o insuficiencia protésica moderada o severa. En nuestra población, solo un paciente cumplió estos criterios de deterioro protésico en el ecocardiograma; a su vez, presentó un valor de captación en el PET de 1,11 y macrocalcificaciones en la angioTC.
Es decir que, en nuestros pacientes, tanto los parámetros ecocardiográficos como los parámetros del PET se encuentran en el espectro prácticamente normal. A pesar de esto, cuando analizamos los hallazgos de la angioTC, vemos una frecuencia relativamente alta (FR 0,38) de pacientes con macrocalcificaciones valvulares al año de la SVA. Si comparamos con los reportes previos de la literatura, vemos que no existen datos de hallazgos tomográficos a tan corto plazo, aunque se ha reportado calcificación en la mitad de las prótesis porcinas a los 5 años de la sustitución y en 75% a los 8 años14,15. Si bien puede parecer llamativo que más de un tercio de los pacientes presentaran macrocalcificaciones en la TC a pesar de tener índices de captación en el PET bajos, la captación del 18Ffluoruro suele ser menor en las áreas de macrocalcificación (200-500 µm) que en las de microcalcificación (< 50 µm) para una misma masa de calcio7. En el estudio de Dweck y col.10, la actividad del 18Ffluoruro en el PET presentó una distribución diferente a la de la macrocalcificación en la TC, y fue predictora de nuevas áreas de calcio en la TC realizada dos años después. Es decir que el 18Ffluoruro detecta microcalcificaciones y áreas de actividad de calcificación, mientras que la TC detecta depósitos de calcio establecidos13. Estos dos tipos de calcificación tienen una distribución diferente, sin embargo, potencialmente ambos podrían tener una repercusión hemodinámica a futuro en las válvulas protésicas. Debido a que la mayor utilidad del PET se considera para la etapa subclínica de la degeneración valvular, antes de que ocurran manifestaciones en la tomografía y el ecocardiograma, se reanalizó la correlación excluyendo a aquellos pacientes con calcificaciones y trombo. En este nuevo análisis, la correlación fue asimismo inversa y con un coeficiente de correlación moderado.
Por lo tanto, en nuestro estudio, realizando PET a corto plazo luego de la SVA, no encontramos que la captación de 18Ffluoruro en el PET pueda correlacionarse de forma directamente proporcional con los parámetros de deterioro estructural ecocardiográfico.
A pesar de la importancia de poder realizar un diagnóstico precoz del deterioro estructural protésico, aún no existen tratamientos para detener su progresión. El tratamiento clásico para la degeneración valvular protésica establecida es la reintervención11. No obstante, es importante considerar la posibilidad de trombosis valvular como una causa potencial de gradientes transvalvulares aumentados, dado que esta entidad sí tiene un tratamiento médico potencialmente curativo16.
Como perspectiva de nuestros hallazgos, la imagen convencional con ecocardiograma puede identificar las manifestaciones hemodinámicas de la degeneración protésica, pero falla en proveer información acerca del proceso molecular subyacente y en la detección precoz; en todo esto el PET tiene un rol emergente. Sin embargo, en el corto plazo luego de la SVA, nuestro estudio no encontró que la captación con el PET pueda correlacionarse con el deterioro estructural ecocardiográfico.
Limitaciones
La mayor limitación de diseño de nuestro estudio es que no se trata de un seguimiento longitudinal de las prótesis en el tiempo, sino de un análisis de dos estudios con poca diferencia en el tiempo transcurrido desde la sustitución valvular aórtica. Por ello, continuaremos nuestro trabajo de investigación, siguiendo a esta cohorte de pacientes con ecocardiogramas a lo largo del tiempo y, asimismo, incorporaremos a otro grupo de pacientes que llevan más de dos años del implante de la bioprótesis a quienes realizaremos PET 18Ffluoruro TC. A su vez, otra limitación es el n pequeño, compuesto de 19 sujetos.
Conclusiones
En este primer trabajo que estudia la correlación entre los hallazgos del PET 18Ffluoruro con los parámetros ecocardiográficos a corto plazo luego de la SVA por bioprótesis porcina, se encontraron valores bajos de captación con el PET, gradientes ecocardiográficos en el rango normal y no se encontró correlación positiva entre estos dos parámetros.