Introducción
La fibrilación auricular (FA), una de las complicaciones más frecuentes del posoperatorio de cirugía cardíaca (POCC) y la arritmia más común en ese contexto, merece ser considerada como una entidad particular. Interpretada inicialmente como un suceso casi anodino, se la ha vinculado en las últimas dos décadas a variadas y serias complicaciones con impacto pronóstico en el mediano y largo plazo. Incide negativamente en la utilización de recursos materiales y humanos y en el tiempo de internación, elevando el costo sanitario.
No obstante, si esa relación responde a un efecto propio de la arritmia o ésta constituye simplemente un marcador de mayor deterioro miocárdico y peores condiciones comórbidas con consecuencias alejadas, ha sido motivo de persistente discusión.
Esta asociación desfavorable ha propiciado un creciente interés en precisar sus factores de riesgo y mecanismos de producción a fin de desarrollar medidas costo-efectivas de profilaxis, aunque su multicausalidad y complejidad fisiopatológica han conducido a una gran variedad de propuestas preventivas con éxito relativamente escaso. A ello han contribuido el aumento progresivo de la edad y la prevalencia creciente de comorbilidades en los pacientes sometidos a procedimientos cardioquirúrgicos.
La presente revisión provee una mirada global del tema, con consideraciones sobre epidemiología, mecanismos de inicio y persistencia, repercusión clínica, medidas de profilaxis y manejo inmediato de esta complicación, proponiendo además una perspectiva de lo que a la luz del conocimiento actual debería representar para el clínico, más allá del episodio agudo.
Definición e incidencia
La FA posoperatoria (FAPO) es la que aparece de novo en este contexto, sin previa presentación en ninguna de sus formas. Su incidencia es mayor luego de cirugía cardíaca (CC) que en el posoperatorio de cirugía torácica no cardíaca, y francamente menor luego de cirugía no torácica1. En el POCC la frecuencia reportada por un servicio depende de varios aspectos: el criterio diagnóstico, referido al umbral de duración o reiteración requeridos para su consideración, el método de registro, que determina la sensibilidad en su detección, las características de la población intervenida y el horizonte temporal definido para su notificación. Sólo con respecto a la duración se han utilizado criterios tan disímiles como un episodio de cualquier duración, un registro completo en papel, 30 segundos, 5 minutos, 30 minutos y FA de cualquier duración que requirió tratamiento2. Dada esta marcada variabilidad, las cifras más citadas de incidencia se sitúan entre 20% y 40% de las intervenciones, aunque con extremos entre 15% y 60% en poblaciones seleccionadas.
Pese a la implementación de diferentes estrategias de prevención, la FAPO no muestra una tendencia decreciente en el curso de las décadas3,4, probablemente porque se relaciona fuertemente con la edad y con condiciones que afectan las propiedades estructurales o la carga hemodinámica del miocardio auricular, como insuficiencia cardíaca (IC), diabetes, obesidad, enfermedad pulmonar obstructiva crónica (EPOC), etc., que propician apoptosis, necrosis, fibrosis miocárdica y dilatación cavitaria4,5. Tanto la edad como estas comorbilidades han experimentado un incremento casi constante en las poblaciones sometidas a CC.
El tipo y la complejidad del procedimiento quirúrgico son también relevantes, registrándose una incidencia relativamente menor en revascularización miocárdica aislada, y cifras crecientes para sustitución de válvula aórtica, sustitución mitral y asociación de revascularización con sustitución valvular, en ese orden6. Notablemente, la menor incidencia ocurre luego del trasplante cardíaco ortotópico, dado que las aurículas trasplantadas quedan desconectadas eléctricamente de las venas pulmonares y, producto de la denervación, sin la influencia del sistema neurovegetativo7, aunque se ha comprobado que el rechazo del órgano se vincula significativamente con taquiarritmias auriculares tardías8.
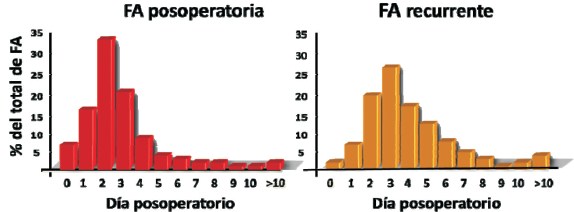
La mayoría de los episodios se acumulan dentro de la primera semana del posoperatorio9. Al cuarto día de la cirugía se presentan el 74% de los episodios, y al sexto el 94%. La incidencia pico del primero se sitúa típicamente en el segundo día y la primera recurrencia en el tercer día10(figura 1), lo que proporciona una ventana de tiempo considerable para implementar medidas de profilaxis.
Factores de riesgo
La lista de condiciones predisponentes a la FAPO reportada en la literatura es muy extensa, y su reproducibilidad entre diferentes publicaciones ha resultado pobre, lo que ha dificultado identificar un blanco concreto y con validez generalizada para su profilaxis.
Para sistematizar su estudio, agruparemos conceptualmente a los factores asociados a FAPO en dos tipos de sustrato ubicados en diferente contexto temporal.
Existe un sustrato basal o vulnerable, representado por el grado de remodelación auricular previo a la cirugía, relacionado con la edad y diversas condiciones patológicas11. Esta afectación auricular, catalogada como miopatía atrial12,13, determina qué tan cerca se sitúa el paciente de lo que podríamos considerar como umbral de FA.
El segundo es el sustrato facilitador, referido a las modificaciones fisiopatológicas originadas por el acto operatorio y sus técnicas de soporte (procedimiento quirúrgico, anestesia, circulación extracorpórea (CEC), fármacos, etc.), incidiendo sobre la actividad eléctrica auricular a través varias vías, cuya acción sumatoria definirá si se alcanza o no dicho umbral2. Entre ellas se destacan la inflamación local y general, la hiperactividad simpaticoadrenal, la injuria por isquemia/reperfusión-estrés oxidativo y las alteraciones del medio interno, especialmente en la composición hidroelectrolítica (figura 2). Estos fenómenos son propios del ambiente específico posquirúrgico y en consecuencia autolimitados en el tiempo, lo que explica la habitual transitoriedad de los episodios arrítmicos y la buena respuesta a la cardioversión en caso de ser requerida. Sin embargo, se ha observado que la ocurrencia de FAPO se asocia con una posibilidad ocho veces mayor de presentar FA en el futuro alejado14, señalando la importancia de la miopatía atrial.
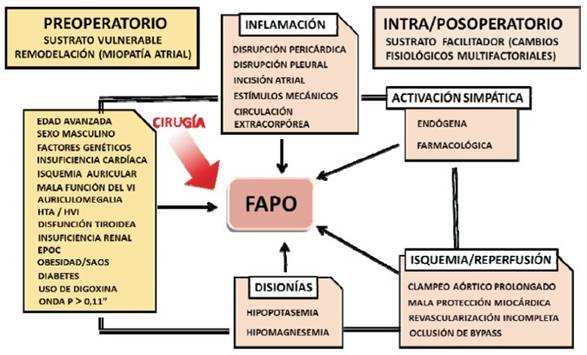
Figura 2: Factores de riesgo de fibrilación auricular posoperatoria (FAPO). HTA: hipertensión arterial; HVI: hipertrofia ventricular izquierda;EPOC: enfermedad pulmonar obstructiva crónica;SAOS: síndrome de apnea obstructiva del sueño.
Además del tipo de procedimiento, se identificaron factores intraoperatorios que mediante la activación de los referidos mecanismos fisiopatológicos incrementan la incidencia de FAPO: tiempo de clampeo y de CEC, mala protección miocárdica, incisiones atriales, canulación venosa bicava y colocación de un vent (aspirador) en el ventrículo izquierdo a través de venas pulmonares. La cirugía sin CEC parece tener un papel protector, pero algunas experiencias no apoyan este concepto.
En la (figura 3) se esquematiza la compleja interrelación que existe entre la alteración de diversas constantes fisiológicas en el intra y el posoperatorio y las grandes vías patogénicas que desencadenan la arritmia.
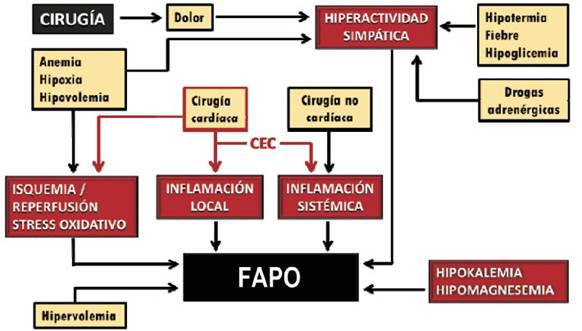
Figura 3: Fisiopatología de la fibrilación auricular posoperatoria. La alteración de diversas constantes fisiológicas por la cirugía y el posoperatorio activa cuatro vías principales con acción directa sobre las propiedades físicas y eléctricas del miocardio auricular. Estas desviaciones fisiológicas son a la vez adecuados blancos terapéuticos a atacar con medidas farmacológicas y no farmacológicas en una estrategia integral de profilaxis. CEC: circulación extracorpórea. (Adaptado de Chelazzi y colaboradores16).
Se ha intentado cuantificar el riesgo de FAPO mediante la elaboración de sistemas de puntuación o scores. Su objetivo es identificar preoperatoriamente a los pacientes de riesgo más elevado y aplicar medidas profilácticas dirigidas y presuntamente más eficaces. Sin embargo, un análisis post-hoc de validación utilizando tres scores derivados de algunos de los estudios de mayor extensión obtuvo un bajo valor predictivo cuando se aplicó en una cohorte prospectiva de validación15.
Mecanismos básicos de inicio y persistencia
La patogénesis de la FAPO no difiere de la que subyace fuera del contexto quirúrgico, que actualmente se apoya en una hipótesis dual. Una condición básica es la heterogeneidad de las propiedades electrofisiológicas del miocardio auricular, con disminución de la velocidad de conducción o del período refractario efectivo en algunas áreas, generando un bloqueo funcional que se acentúa ante sucesos relacionados con la cirugía y el posoperatorio (isquemia, inflamación, incisión atrial, canulación venosa, elongación de los miocitos, disionías, etc.).
Independientemente del origen de este sustrato, se requiere un segundo factor, el evento gatillo, representado por uno o varios estímulos prematuros en sucesión, que dan inicio a múltiples circuitos de reentrada simultáneos que colisionan en el miocardio atrial, manteniendo una conducción aleatoria17, con pasaje irregular a través del nódulo auriculoventricular (figura 4).
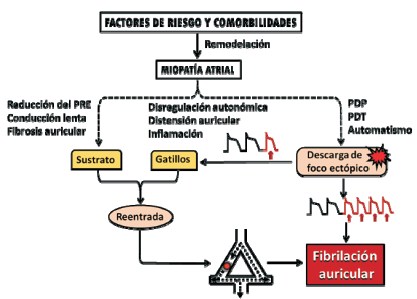
Figura 4: Mecanismos electrofisiológicos de la fibrilación auricular posoperatoria. La edad avanzada y múltiples condiciones patológicas, tanto cardiovasculares como extracardíacas, inducen una miopatía atrial por remodelación funcional y estructural. Ésta constituye el sustrato electrofisiológico vulnerable a la FA posoperatoria, y se sustenta en fibrosis, reducción del período refractario efectivo (PRE) y de la velocidad de conducción. Los eventos gatillo (firing) consisten en descargas ectópicas focales rápidas originadas en posdespolarizaciones precoces (PDP) o tardías (PDT), frecuentemente provenientes de la desembocadura de las venas pulmonares, que desencadenan bloqueo unidireccional y reentrada. Ambos sustratos son favorecidos por las alteraciones fisiológicas del posoperatorio. La hiperactividad sostenida del foco ectópico puede ser un factor de persistencia de la arritmia, y la remodelación atrial adicional que ésta genera obra en el mismo sentido. (Modificado de Nattel y colaboradores(19)).
Haisaguerre y colaboradores, en 1998, localizaron un frecuente origen de estas descargas ectópicas en fibras miocárdicas auriculares que penetran algunos centímetros en las paredes de las venas pulmonares y manifiestan un automatismo exacerbado ante desequilibrios del tono neurovegetativo o la distensión auricular propios del ambiente perioperatorio, con lo cual su aislamiento se tornó en el blanco más importante en la estrategia terapéutica de la FA crónica o paroxística recurrente, tanto quirúrgica como transcatéter18.
Menos frecuentemente, el foco hiperautomático puede situarse en la base del apéndice auricular izquierdo, en la desembocadura de la vena cava superior o en el ligamento de Marshall. A su vez, la remodelación atrial electroiónica y estructural tiempo-dependiente generada por la propia FA, con reducción adicional del período refractario efectivo y dilatación auricular, tiende a favorecer la persistencia de la arritmia.
Su continuidad o recurrencia dependerán del grado de remodelación electromecánica atrial, la evolución del contexto arritmogénico posoperatorio y la eficacia del tratamiento adoptado.
Impacto clínico
Durante mucho tiempo la FAPO fue contemplada como una complicación autolimitada, bien tolerada y benigna, quizá debido a que los primeros estudios se limitaron al período perioperatorio. Sin embargo, hoy se dispone de creciente evidencia de que se asocia a morbilidad y mortalidad, incluso en un horizonte temporal más amplio.
Los correlatos clínicos de esta arritmia deben considerarse en el corto y en el largo plazo. Habitualmente se presenta en episodios breves, paroxísticos, con tendencia a la remisión espontánea y habituales recurrencias dentro de la primera semana. Estos episodios son a menudo asintomáticos, lo que dificulta su detección si no se realiza monitorización continua. Los efectos clínicos inmediatos dependen de la condición cardiorrespiratoria previa del paciente, la persistencia o recurrencia de los episodios arrítmicos y particularmente la frecuencia cardíaca alcanzada. A menudo el paciente experimenta una sensación inespecífica de inquietud, desasosiego o disconfort torácico difuso que en ocasiones se acompaña de palpitaciones rápidas e irregulares o sensación de latidos cervicales.
En presencia de mala función o severa hipertrofia del ventrículo izquierdo, en condiciones de sobrecarga de volumen, o en la infrecuente situación de isquemia residual significativa, pueden presentarse ángor, hipotensión arterial, disnea de variable entidad o incluso edema pulmonar franco o shock. Estas diferentes formas de expresión clínica del episodio condicionan la oportunidad, el objetivo y la naturaleza de la respuesta terapéutica, como se tratará más adelante.
Tanto en el corto como en largo plazo, la FAPO ha sido crecientemente asociada con severas complicaciones en diferentes sistemas fisiológicos, reingreso a unidad de cuidados intensivos (UCI), reintubación, internación posoperatoria prolongada, infecciones, reintervención por sangrado, peor calidad de vida y mortalidad precoz y tardía20,21. Sin embargo, los estudios no son unánimes al respecto, probablemente por diferencias en su diseño, número y características poblacionales de los pacientes incluidos, procedimiento quirúrgico realizado, definición y sensibilidad en la detección de la arritmia, plazo de seguimiento, estrategia del tratamiento anticoagulante, etc. Además, estas asociaciones no implican necesariamente una relación de causalidad, lo que ha sido uno de los motivos por los cuales la profilaxis exitosa de la arritmia no siempre se ha visto acompañada de una reducción de dichas complicaciones ni del tiempo de internación. Más aún, la ocurrencia de muchas de ellas puede favorecer desarrollo de FAPO a través de uno o más de los grandes mecanismos previamente señalados, por lo cual ésta podría representar una consecuencia y no la causa.
Recurrencias de fibrilación auricular y ataque cerebrovascular
Por su potencial tromboembólico ampliamente reconocido fuera del contexto quirúrgico, una de las más temidas complicaciones asociadas con la FA en el POCC es el ataque cerebrovascular (ACV) isquémico o su variante menor, el ataque isquémico transitorio (AIT).
Ambos fueron señalados como complicaciones precoces en estudios iniciales20,22,23, y dada la existencia de un mecanismo plausible y directo de producción se ha aceptado como una relación causa/efecto.
El ACV constituye un suceso con frecuencia devastador, es un determinante mayor de mortalidad posoperatoria y genera un impacto económico considerable24,25.
Su abatimiento se presenta como uno de los objetivos centrales en las estrategias de profilaxis de la FAPO y del tratamiento anticoagulante. Sin embargo, la literatura no ha proporcionado información uniforme. Algunos estudios no observan una asociación independiente entre FAPO y ACV o una relación temporal adecuada10,26-29, y obviando eventos neurológicos de casi segura génesis intraoperatoria, plantean mecanismos alternativos de producción. No obstante, en la mayoría de ellos el empleo de una definición restrictiva de FAPO o de anticoagulación prolongada son elementos que los propios autores reconocen con probable impacto en ese resultado.
Determinar el potencial embolígeno precoz de la FAPO y su evolución a mediano y largo plazo es crucial para definir la estrategia de tratamiento anticoagulante y su alcance temporal. La cirugía de sustitución valvular presenta una dificultad adicional, ya que la frecuente indicación de anticoagulación prolongada puede ocultar el riesgo embólico futuro de la FAPO, y, por otra parte, ante la ocurrencia de un ACV resulta difícil asegurar el papel causal de la arritmia contra una eventual embolia de origen protésico. Por este motivo, los estudios se han enfocado particularmente en la cirugía de revascularización miocárdica (CRM).
Loubani y colaboradores30, en una serie de 375 pacientes revascularizados, mostraron que la ocurrencia de FAPO no constituye un evento fugaz limitado al posoperatorio inmediato. Del 25% de sus pacientes que presentaron FAPO, la mitad persistía con la arritmia al momento del alta sanatorial y 39% a los seis meses. La incidencia de ACV posoperatorio, sin embargo, no resultó diferente entre pacientes con y sin FAPO.
En una serie de 185 pacientes, Cioffi y colaboradores documentaron una tasa de recidiva de FA a los 30 días de 32%, que no se modificó con dosis modestas de amiodarona al alta; en cambio, el uso de betabloqueantes (BB), tanto en forma aislada como en asociación a este antiarrítmico, logró descenderla a 10% (p=0,002). No obstante, estos autores registraron una muy baja frecuencia de FA a los diez meses independientemente del modo de tratamiento31).
Otros estudios demostraron que la irrupción de uno o más episodios de FAPO en pacientes con ritmo sinusal (RS) recuperado al momento del alta, no sólo es predictor independiente de FA a largo plazo, sino también de ACV alejado.
Gialdini y colaboradores32, en un estudio retrospectivo encontraron, con un seguimiento medio de 2,1 años, que la incidencia de FA luego de CC fue 4,8 veces mayor entre los pacientes que presentaron FAPO, y que a un año se asoció en forma independiente a ACV (HR 1,3; IC 95% 1,1-1,6). Esta asociación resultó aún más potente al considerar específicamente el ACV embólico (HR 2,1; IC 95% 1,4-3,1), y la incidencia de ACV guardó una relación directa con el score CHA2DS2-VASc. A pesar de una incidencia global francamente menor, la FAPO resultó un marcador aún más fuerte de ACV embólico en cirugía no cardíaca.
Melduini y colaboradores33, con un seguimiento medio de 8,3 años luego de CC, también identificaron a la FAPO como predictor independiente de FA subsiguiente (HR 3,52; IC 95% 2,42-5,13). El riesgo de FA recurrente fue mayor dentro del primer año (18%). Al término del seguimiento, se presentó FA en 49,3% y en 13,6% de los pacientes con y sin FAPO respectivamente (p<0,001). Los autores no informan la incidencia de ACV, por lo que no se dispone de datos sobre su relación con la FAPO.
En un metaanálisis que incluye ocho estudios y 1.157 pacientes monitorizados hasta dos años del posoperatorio con diferentes métodos, la recurrencia de FA fue de 28,3% a las cuatro semanas. En dos de los estudios, que utilizaron monitorización continua con dispositivos implantados, la FA se presentó en 61% y en 100% a los dos años. Asimismo, 40% y 93% de los episodios arrítmicos, respectivamente, fueron asintomáticos34.
Otro metaanálisis con 35 estudios y más de 2.450.000 pacientes -la gran mayoría luego de CC- muestra que la FAPO incrementa en 62% el riesgo de ACV precoz y en 37% a largo plazo, tras un seguimiento entre 1 y 17,8 años, la mayor parte de ellos entre 3 y 8 años35.
Megens y colaboradores36, en su metaanálisis de 16 estudios con 108.711 pacientes revascularizados seguidos durante dos años, utilizando un prolijo y minucioso análisis estadístico, observaron que la FAPO se asoció, en los estudios ajustados, con un aumento significativo del riesgo de ACV (ES (Effect Size) 1,25; IC 95% 1,09-1,42).
Finalmente, en otro metaanálisis recientemente publicado que incluye 19 estudios con 129.628 pacientes sometidos a CRM, se encontró una incidencia ajustada de ACV significativamente mayor en el grupo con FAPO (OR 1,88; IC 95% 1,02-3,46), con la mayoría de los estudios reportando el evento a más de un año37.
Estos datos revelan la elevada incidencia de FA recurrente luego de FAPO y el riesgo oculto de fenómenos embólicos en el largo plazo, y apoyan la eventual necesidad de un tratamiento anticoagulante prolongado o al menos un seguimiento minucioso del ritmo cardíaco por tiempo indefinido, en especial en el paciente añoso. El concepto de miopatía atrial, retomado y profundizado recientemente por Shen y colaboradores13, puede representar un abordaje apropiado para valorar el riesgo de ACV con independencia del perfil evolutivo de la FA y refinar el criterio para iniciar y mantener la anticoagulación.
Deterioro neurocognitivo
Stanley y colaboradores reportaron, utilizando cuatro scores independientes para distintas áreas de la función cognitiva y ajustando para varios factores de confusión, que aun en ausencia de daño neurológico estructural, los pacientes con episodios de FAPO muestran deterioro significativo a las seis semanas del posoperatorio38. Asimismo, Mathew y colaboradores10, en su estudio prospectivo multicéntrico (70 centros de 17 países) con 4.657 pacientes, detectaron una caída mayor a 3 puntos en el Mini-Mental test con respecto al preoperatorio, aunque sólo en caso de FAPO recurrente. Considerando el perfil etario actual del paciente candidato a CC, en quien no son raros antecedentes de enfermedad cerebrovascular o de afectación cognitiva preoperatoria, estos datos suman un argumento para redoblar esfuerzos en la prevención de esta complicación.
Mortalidad
Un punto del mayor interés clínico es definir si la FAPO está asociada a mortalidad hospitalaria o alejada, y si así fuera, si es un efecto independiente de la arritmia o ésta es un marcador de menor sobrevida por causas coexistentes.
Si bien la literatura al respecto no escasea, existen dificultades mayores a causa del diseño retrospectivo de gran parte de los estudios, la posibilidad de una incompleta consideración de factores de confusión en el análisis multivariado, e inconvenientes para lograr cohortes realmente equilibradas en los estudios con muestras pareadas28. Se ha señalado, además, que inconsistencias en la definición de la FAPO, como la de la Society of Thoracic Surgeons, que solo considera la FA que requiere tratamiento, pueden conducir a una subestimación de su prevalencia y la mortalidad asociada39.
El estudio original de Almassi y colaboradores en 3.855 pacientes con CRM o valvular, fue de los primeros en mostrar la FAPO como un evento con serio impacto pronóstico a corto y mediano plazo, incluyendo datos de mortalidad23. Además de una incidencia significativamente mayor de varios eventos adversos (readmisión a UCI, reintubación, infarto agudo de miocardio (IAM), insuficiencia cardíaca congestiva (ICC) y ACV), la FAPO se asoció a una mortalidad hospitalaria de 5,95% vs 2,95% y a seis meses de 9,36% vs 4,17% (p<0,001)). Sin embargo, el mismo autor en un estudio reciente con seguimiento a cinco años de pacientes revascularizados29 solo reportó una tendencia no significativa a mayor mortalidad, aunque utilizando un intervalo de confianza más exigente (OR 1,5; IC 99% 0,88-2,60).
En el ya referido estudio de Loubani30, no se demostró asociación de la FAPO con eventos adversos, pero la población estudiada era pequeña y el seguimiento limitado. En la serie de 6.475 pacientes revascularizados de Villareal y colaboradores40 la mortalidad hospitalaria y alejada a cuatro o cinco años fueron significativamente mayores en pacientes con FAPO, tanto en el análisis de regresión logística de la cohorte retrospectiva (OR 1,5; p<0,001) como en el subgrupo de casos pareados (OR 3,4; p<0,0018). Tulla y colaboradores propusieron un criterio de comparación diferente28. Siguieron durante una media de 8,5 años dos cohortes de 139 pacientes emparejadas mediante propensity score matching según una serie de variables; una con FAPO persistente al momento del alta y otra sin FAPO (grupo RS). Al término del seguimiento, 28,3% del grupo FAPO estaba en FA crónica y sufrió una mortalidad global de 33,3% y cardíaca de 15,2%, mientras que las cifras para el grupo RS fueron 5,1%, 18,8% y 4,3% respectivamente (p<0,002 para todas las comparaciones). La incidencia de ACV no resultó diferente, pero todos los pacientes con FA fueron anticoagulados con heparina y luego warfarina a largo plazo. El estudio de El-Chami y colaboradores, con 16.169 pacientes revascularizados y un prolijo análisis multivariado que incluyó múltiples covariables de confusión tanto pre como posoperatorias, mostró en el seguimiento a seis años una mortalidad significativamente mayor en pacientes con FAPO, incluso luego de excluir la mortalidad hospitalaria (HR 1,21; IC 95% 1,11-1,32). Notablemente, los pacientes que recibieron el alta bajo tratamiento con warfarina presentaron menor mortalidad en el seguimiento, planteándose un probable mecanismo embólico del deceso41.
Varios metaanálisis apoyan la influencia adversa de la FAPO en la mortalidad precoz y alejada luego de CC: el de Kaw y colaboradores, que incluye 40.112 pacientes, con efecto hasta cuatro años42, el ya referido de Meng-Hsin Lin35) con 2.458.010 pacientes (ambos en cirugía coronaria y combinada), y el también mencionado de Kerwin37 con 129.620 individuos sometidos a CRM aislada. Estas asociaciones, aunque estadísticamente significativas, no permiten asegurar una relación causal por las razones previamente mencionadas. Un argumento más convincente surge de estudios que analizan la mortalidad causa-específica, con un mecanismo que establece un nexo entre la posible causa y el evento, y la comprobación de que el tratamiento de ese mecanismo es capaz de reducir dicho evento, como sugiere el referido trabajo de El-Chami. El estudio prospectivo de Mariscalco y colaboradores en CRM (n=1.832) con seguimiento medio de 5,1 años, mostró una mayor mortalidad tanto hospitalaria (HR 3,3 vs 0,5%, p<0,001) como a largo plazo: (HR 2,13; p<0,001)43. Lo destacable es que la única causa de muerte que resultó significativa fue la embólica (HR 4,33; IC 95% 1,78-10,52). Ahlsson y colaboradores14, en su seguimiento a seis años de 571 pacientes revascularizados, observaron que la FAPO resultó el más potente predictor independiente de FA futura, y documentaron una mortalidad de 29,7% vs 14,8% en pacientes con y sin FAPO respectivamente (p<0,001). La muerte de causa cerebral isquémica fue mucho más común entre los primeros (4,2% vs 0,2%; p<0,001). Otro estudio con 6.821 pacientes revascularizados seguidos durante 9,8 años reveló también interacción independiente de la FAPO con mortalidad alejada, y que la mayor causa de muerte ajustada estuvo relacionada con arritmia (HR 1,8; IC 95% 1,6-2,0), a la que se suma la enfermedad cerebrovascular (HR 1,4; IC 95% 1,2-1,6)44. Estos datos, acordes a la idea bien consolidada de que la FA constituye un desorden progresivo45,46, sugieren que la FAPO luego de CRM o la miopatía auricular subyacente comportan una causa propia de ACV y mortalidad alejados, básicamente por ser precursores de una etapa más estable, frecuentemente silenciosa y de mayor potencial embolígeno de la arritmia (figura 5), y no representan simples subrogantes de un grado más evolucionado de enfermedad cardíaca, aunque este mayor deterioro sea también comprobable y genere su propia cuota de mortalidad.
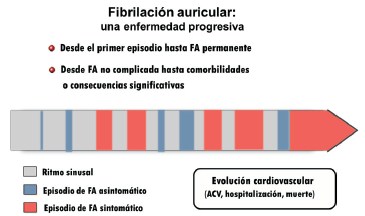
Figura 5: Progresión de la fibrilación auricular. La remodelación eléctrica, mecánica y estructural de la fibrilación auricular es un proceso dinámico y autopromovido que se traduce en manifestaciones clínicas y complicaciones progresivas. ACV: ataque cerebrovascular.
La mortalidad asociada a la FAPO luego de cirugía valvular no ha sido tan exhaustivamente analizada. Un estudio de Mariscalco y colaboradores reportó que si bien la FAPO compromete la sobrevida de los pacientes revascularizados al término de 7,9 años, no tiene efecto significativo en los sometidos a cirugía valvular o combinada47. Proponen como posible explicación que los pacientes intervenidos para bypass coronario reciben subsiguientemente menos controles ecocardiográficos y del ritmo cardíaco, y además un subgrupo importante de los pacientes valvulares son crónicamente anticoagulados.
El análisis retrospectivo de Swinkels y colaboradores en su serie de 569 pacientes con reemplazo de válvula aórtica con o sin bypass coronario asociado tampoco mostró un efecto independiente de la FAPO sobre la sobrevida a 15 años, pero el diagnóstico de FAPO requería que la arritmia persistiera durante varias horas, siempre se perseguía la reversión a RS y se instauraba anticoagulación por un mínimo de tres meses48.
Efecto sobre el flujo de los injertos coronarios
La FA puede comprometer considerablemente el gasto cardíaco y la perfusión de diversos órganos, incluido el corazón. En el caso del miocardio se suma al deterioro de la perfusión el incremento del consumo de O2 debido al aumento de la frecuencia cardíaca, agravando el disbalance oferta/demanda. Varios estudios han señalado una incidencia significativamente mayor de IAM posoperatorio en pacientes que experimentan FAPO23,27. Si bien se reconoce al IAM como una causa probable de esta arritmia, también puede ocurrir que la FA favorezca la complicación isquémica en un paciente recientemente revascularizado. En este sentido, resulta interesante el estudio de Shin y colaboradores que demuestra que durante un episodio provocado de FA al momento de la revisión de los puentes, además de un deterioro hemodinámico apreciable, se produce un descenso significativo de su flujo, más acusado en el caso de la arteria mamaria interna por su mayor dependencia del período diastólico49.
Implante de marcapasos definitivo
Algunos informes dan cuenta de un incremento significativo del requerimiento de marcapasos definitivo en pacientes con FAPO, en el posoperatorio inmediato20 o en el seguimiento alejado28. Esto puede deberse parcialmente al uso de fármacos con efecto crono y dromotrópico negativo, pero también participa un deterioro funcional de los nódulos sinusal y auriculoventricular como expresión de la remodelación auricular propia de la arritmia50,51.
Calidad de vida
En el estudio de Bramer y colaboradores, cuatro de diez scores de calidad de vida puntuaron peor luego de CRM en pacientes con FAPO. Además, ésta fue un predictor negativo independiente de recuperación de la calidad de vida a los seis meses del posoperatorio, tanto en los componentes físicos como mentales52.
Duración de la internación y costos
Casi invariablemente se ha vinculado a la FAPO con mayor tiempo de internación en UCI y hospitalario total, con incrementos en torno a 36-48 horas y tres o cuatro días respectivamente14,20-23,27,40,53.
En esto pueden participar dificultades en el control de la arritmia y en la obtención de una anticoagulación efectiva, pero la causa principal son las serias complicaciones cardiovasculares, respiratorias, renales, neurológicas e infecciosas con las que se asocia.
Paralelamente, la FAPO representa un sustancial exceso de costos evaluados en diferentes tipos de procedimiento54,55. Este costo excedente parece mantenerse a un año56, aunque no entre los dos y cinco años29.
Profilaxis
Pese al reconocimiento de los efectos deletéreos de la FAPO y la disponibilidad de varias guías de práctica clínica con propuestas de profilaxis probadamente efectivas, existe una limitada adherencia a recomendaciones de clase I y IIa y una gran variabilidad en el abordaje del tema57,58. Esta brecha de implementación es probablemente debida a una percepción desfavorable de la relación riesgo/beneficio del uso de los fármacos disponibles.
La prevención efectiva de la FA no supone necesariamente que los eventos adversos asociados disminuyan correlativamente, por tres posibles razones: 1) que el suceso estudiado no sea causado por la arritmia, sino simplemente una covariable asociada o incluso que ésta sea consecuencia de aquél, por ejemplo, infección, ICC, IAM; 2) que el evento tenga una baja incidencia y un mecanismo alternativo de producción, como ocurre con el ACV intra/posoperatorio, y 3) que los efectos colaterales de los fármacos utilizados en su profilaxis favorezcan el evento y anulen un posible beneficio: bradicardia severa, ICC, implante de marcapasos definitivo, reingreso a UCI.
Por otra parte, la multicausalidad de la génesis de esta arritmia y la interacción entre sus mecanismos patogénicos, representados en la figura 3, ofrecen la oportunidad de actuar con medidas no farmacológicas sobre distintos aspectos del proceso asistencial.
Es válido también el principio general que establece que el rendimiento de las medidas profilácticas será tanto mayor cuanto más probable sea el evento a prevenir, por lo que se impone una racionalización de las acciones acorde a la valoración del riesgo.
Betabloqueantes
Constituyen los fármacos más estudiados y los que reciben mayor acuerdo respecto al beneficio en la profilaxis de la FAPO. Su uso es una recomendación clase I A o I B, según las diferentes guías, en pacientes con riesgo normal o alto de FAPO y en ausencia de contraindicaciones59-64. Sin embargo, entre 30% y 50% de los médicos encuestados en Europa y en Estados Unidos no los utiliza rutinariamente en pacientes de alto riesgo10,64,65. Varios estudios y metaanálisis demostraron que determinan una significativa reducción de la FAPO en torno a 70%66. Considerando solo los estudios cuyo protocolo no requiere la suspensión de los BB por parte de los controles, su efecto se reduce a 31%, aún significativo67. Son efectivos iniciándolos desde el preoperatorio o en el posoperatorio inmediato, y su beneficio se relaciona con la atenuación del estado de hipertonía simpática habitual de este contexto, con efecto tanto sobre el foco gatillo como en la reentrada. Sin embargo, no han demostrado un efecto significativo sobre la duración de la internación, el ACV o la mortalidad68. Se han utilizado distintos fármacos, incluyendo propranolol, atenolol, nadolol, metoprolol y carvedilol.
El sotalol, que suma propiedades antiarrítmicas de clase III, mostró un mayor efecto comparativo, pero también mayor incidencia de ritmos lentos, hipotensión, proarritmia y necesidad de suspensión, por lo cual se le asigna una indicación llb61.
La suspensión de los BB previo a la cirugía es contraproducente, ya que se asocia a un incremento de la incidencia de la FA por sobrerregulación de receptores ß.
Amiodarona
Es un antiarrítmico de clase III, pero también tiene efecto bloqueador de los canales de sodio (I), de los receptores beta-adrenérgicos (II) y antagonista del calcio (IV). Su toxicidad pulmonar, hepática, tiroidea, cutánea y corneal es rara en el corto plazo, pero su uso intrahospitalario por vía intravenosa (i/v) puede generar bradicardia e hipotensión, y está contraindicada en caso de existencia de vías accesorias. Tiene menor potencial proarrítmico que los demás fármacos de clase III, incluido el sotalol.
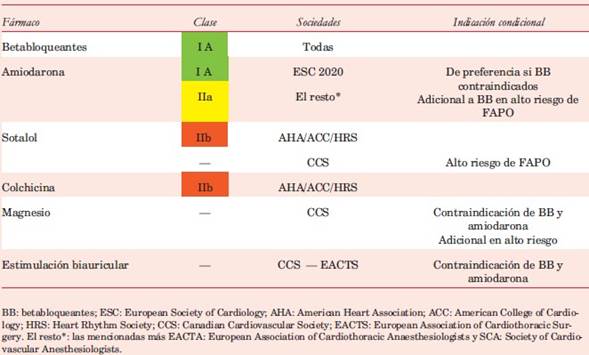
En el estudio randomizado PAPABEAR69, un protocolo de amiodarona por vía oral seis días antes y seis días después de cirugía de coordinación (coronaria, valvular o combinada) mostró una reducción global de la incidencia de taquiarritmias auriculares (HR 0,52; IC 95% 0,34-0,69; p<0,001) y en distintos subgrupos, con o sin asociación con BB. No modificó la mortalidad ni los reingresos. Un metaanálisis demostró que las dosis totales medias (3 a 5 g) son tan efectivas como las altas (>5 g) y que el inicio del fármaco en el preoperatorio no es necesario, ya que tiene similar efectividad si se comienza inmediatamente después por vía i/v70. En el metaanálisis de Cochrane, de 33 estudios, redujo la incidencia de FAPO (OR 0,43; IC 95% 0,34-0,54), y a diferencia de los BB también descendió la duración de la internación, aunque no la mortalidad66. En nuestro medio, un estudio no randomizado mostró una menor incidencia acumulada de FA en el grupo con profilaxis completa según protocolo, pero el grupo control tenía mayor riesgo basal de presentar la arritmia71. Ha sido aplicado con éxito un hidrogel de amiodarona epicárdico sobre las aurículas para evitar los efectos sistémicos de la droga72. La amiodarona recibe una recomendación de clase I A en equivalencia a los BB en la guía de la European Society of Cardiology (ESC) 202062, mientras que su versión previa (2016) y en las restantes es clase IIa (tabla 1). En pacientes de riesgo medio o moderado, puede utilizarse en sustitución de los BB cuando están contraindicados. Su asociación con estos fármacos logra una mayor reducción de la FAPO que los BB aislados73. Esta opción es atractiva en pacientes con riesgo elevado de la arritmia, aunque requiere una indicación personalizada y una estricta vigilancia por la posible potenciación de sus efectos indeseables.
Estatinas
ARMYDA-3 fue el primer estudio randomizado que mostró una reducción significativa de FAPO en CC de coordinación utilizando una estatina desde los siete días preoperatorios (OR 0,39; IC 95% 0,18-0,85). Este efecto se relacionó con un descenso de la proteína C reactiva. La duración de la internación fue levemente menor, pero los eventos mayores no se diferenciaron74. Estudios posteriores en CRM o cirugía valvular mostraron resultados conflictivos.
Varios metaanálisis abordaron el tema; la mayoría confirmó un efecto protector contra la arritmia. Kuhn y colaboradores, en su extenso metaanálisis de 54 estudios con más de 90.000 pacientes, reportaron que el uso preoperatorio de estatinas no solo redujo la incidencia de FAPO, sino también de ACV, mortalidad total y tiempo de internación75.
Otros metaanálisis también comprobaron reducción de la FAPO, particularmente luego de CRM76, menor tiempo de internación77, y protección con atorvastatina (RR 0,53; IC 95% 0,41-0,69, p=0,000), pero no con rosuvastatina (RR 0,76; IC 95% 0,38-1,50, p=0,425)78. La rosuvastatina tampoco redujo la incidencia de FAPO en el estudio controlado randomizado STICS79, además de asociarse a una tasa aumentada de injuria renal posoperatoria, por lo que pueden existir diferencias específicas entre los integrantes del grupo. En otro metaanálisis, en este caso con diversas estatinas, tampoco se obtuvo protección contra la FAPO y se produjo una mayor incidencia de injuria renal aguda80.
Por lo tanto, luego de una visión inicial favorable, se ha generado un manto de duda en cuanto a la protección que las estatinas pudieran ofrecer sobre distintos eventos posoperatorios adversos, incluida la FAPO. Sin embargo, un amplio grupo de pacientes llegan a cirugía bajo tratamiento con estatinas por otras indicaciones y raramente se presenta una razón para suspenderlas.
Magnesio
La baja concentración plasmática de este catión es predictor independiente de FAPO. No obstante, la suplementación i/v profiláctica de magnesio ha mostrado resultados contradictorios. Un metaanálisis de Cochrane, con 22 estudios de tamaño pequeño o mediano muy heterogéneos, mostró eficacia contra placebo (OR 0,55; IC 95% 0,41-0,73)66. Sin embargo, en un posterior metaanálisis se observó que los estudios pequeños originaban un sesgo hacia mejores resultados, mientras que analizando solo los estudios de mejor calidad no se mantenía el beneficio (OR 0,94; IC 95% 0,61-1,44)81. Además, se encontró que el efecto del magnesio solo se observa sin el uso concomitante de BB, y en su presencia no agregan protección (OR 0,93; IC 95% 0,60-1,16)67. Por lo tanto, el magnesio i/v podría ser una opción en caso de contraindicación de BB y amiodarona.
Colchicina
Es un potente antiinflamatorio que actúa mediante la despolimerización de los microtúbulos. El primer estudio randomizado sobre el papel de la colchicina en la profilaxis de la FAPO fue un subestudio del COPPS82, donde se inició el fármaco al tercer día del posoperatorio y se mantuvo durante un mes. La incidencia de FAPO a 30 días fue de 12% (colchicina) vs 22% (controles), p=0,021, con -1 día de estadía hospitalaria (p=0,040). En el COPPS-2 la colchicina fue iniciada 48 a 72 horas antes de la cirugía. Si bien se redujo el síndrome pospericardiotomía, no ocurrió lo mismo con la FAPO, a causa de la frecuente suspensión de la colchicina por efectos gastrointestinales. Sin embargo, en el análisis por tratamiento preespecificado la reducción fue significativa83. Varios metaanálisis apoyan la eficacia de la colchicina en la profilaxis de la FAPO, de los cuales dos son destacables por referirse específicamente al POCC: el de Salih y colaboradores84) con seis estudios y 1.257 pacientes (OR 0,52; IC 95% 0,40-0,68), aunque con un aumento significativo de los efectos colaterales, y el de Lemmerz y colaboradores85 con cinco estudios y 1.412 pacientes (RR 0,69; IC 95% 0,57-0,84; p=0,0002), y una reducción de 1,2 días de estadía hospitalaria (IC 95% -1,89 a -0,44; p=0,002). La evidencia a favor de la eficacia de la colchicina parece robusta, aunque restan esfuerzos por hacer para minimizar sus efectos gastrointestinales.
Glucocorticoides
Su papel en la profilaxis de la FAPO es al menos dudoso. Aunque algunos metaanálisis les asignan beneficio a varios corticoides86,87, adolecen de importante heterogeneidad en cuanto a fármacos, dosis, vía y oportunidad. Dos estudios grandes randomizados y doble ciego, el DECS88 con 4.494 pacientes (RR 0,94; IC 95% 0,87-1,02) y el SIRS89 con 7.507 pacientes (RR 0,97; IC 95% 0,89-1,06), no demostraron beneficio significativo sobre la FAPO. Por lo tanto, los estudios de mayor calidad no dan apoyo claro a su uso, lo que se suma a sus posibles efectos metabólicos y los riesgos de infección y compromiso de la cicatrización.
Suplementos de potasio
La hipokalemia es frecuente en pacientes que van a CC, y se ha identificado como un factor favorecedor de FAPO, de modo que su suplemento es utilizado en muchos centros. Si bien es adecuada su reposición cuando su nivel plasmático es bajo, no está avalado su aporte sistemático, y la mejor evidencia muestra que un objetivo de potasemia de 4,5 mEq/l no disminuye la incidencia de FAPO comparada con un objetivo de 4,0 mEq/l (estudio GRIP-COMPASS)90). Está en curso el estudio Tight-K91, que compara un objetivo de potasemia >3,6 vs >4,5 mEq/l.
Antioxidantes: N-acetilcisteína y vitamina C
Ambos depuradores de radicales libres han sido evaluados individualmente y en combinación.
Son una opción teóricamente atractiva, considerando su bajo costo y que atacan uno de los mecanismos principales de génesis de la FAPO. La N-acetilcisteína por vía i/v u oral mostró un papel protector significativo en varios metaanálisis y un estudio randomizado. Dado su favorable perfil de seguridad aparece como un recurso promisorio, aunque aún no ha sido incorporada en las guías. Para la vitamina C, la evidencia no es totalmente concordante. Recibe apoyo de un metaanálisis, pero un estudio randomizado pequeño más reciente no demostró diferencias con placebo92,93.
Otros fármacos evaluados incluyen los antiinflamatorios no esteroideos, los calcioantagonistas, los ácidos grasos poliinsaturados y la digoxina. Estos grupos de fármacos no han mostrado utilidad consistente en la profilaxis de la FAPO y no son considerados en las guías68,92,93.
En la tabla 1 se resumen las recomendaciones de las sociedades científicas sobre la elección de fármacos para la profilaxis de la FAPO.
Estrategias no farmacológicas
La profilaxis de la FAPO debe concebirse como una estrategia integral que incluye intervenciones farmacológicas orientadas a sus mecanismos directos de producción (antiarrítmicos, antiinflamatorios, antioxidantes, etc.) y acciones en todo el proceso de atención del paciente apoyadas en fundamentos fisiopatológicos, lo cual no significa que para ello no pueda requerirse el uso de medicación. Estas medidas complementarias de profilaxis están dirigidas a controlar y mantener ciertas constantes homeostáticas en diversos sistemas fisiológicos con fuerte impacto sobre el tono simpático, el estado inflamatorio y el daño auricular directo (figura 6).
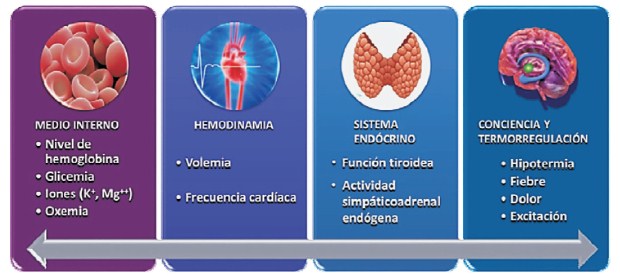
Figura 6: Profilaxis no farmacológica de la fibrilación auricular posoperatoria. Alteraciones en distintos sistemas fisiológicos participan en los mecanismos de inicio y mantenimiento de la arritmia. La corrección de estas variables constituye un coadyuvante válido y necesario tanto en su profilaxis como en su tratamiento.
La sobreestimulación auricular es una modalidad no farmacológica de profilaxis capaz de reducir la incidencia de FA corrigiendo la bradicardia y la carga de latidos ectópicos. En un metaanálisis de Cochrane de 22 estudios con importante heterogeneidad, redujo la FAPO significativamente (OR 0,47; IC 95% 0,36-0,61)66. La estimulación biatrial parece ser más efectiva que la de una sola aurícula y se ha asociado a disminución de la internación67. Otros estudios, sin embargo, no mostraron ventajas comparativas con respecto a metoprolol o amiodarona. Como limitaciones, no siempre se posicionan electrodos auriculares transitorios en la cirugía y no son raros los defectos de sensado o captura, además de los posibles riesgos de su remoción.
Otras estrategias no farmacológicas practicables durante la cirugía han mostrado beneficio, como el uso de circuitos heparinizados de CEC94, que reduce el componente inflamatorio sistémico, y la hipotermia sistémica leve95. La pericardiotomía posterior96,97 y el uso de un sistema de drenaje flexible y más efectivo98 minimizan la retención de fluido pericárdico, disminuyendo el componente inflamatorio local y reduciendo la incidencia de derrame clínicamente relevante y de FAPO.
Se ha planteado la cirugía coronaria sin CEC como una alternativa para reducir la tasa de FAPO debido a la supresión de un activador de la respuesta inflamatoria sistémica, pero los estudios y metaanálisis no ofrecen resultados concluyentes, en especial en aquellos de mejor calidad y en los que el riesgo de influencia de la industria es bajo99-101.
Tratamiento
La FAPO a menudo es transitoria o incluso fugaz, y puede no necesitar tratamiento alguno. No obstante, requiere intervención cuando genera efectos hemodinámicos adversos o cuando la continuidad o reiteración de la arritmia hacen prever un riesgo tromboembólico significativo. No debería obviarse además que traduce un grado variable de miopatía auricular con posibles consecuencias sobre el ritmo cardíaco futuro y complicaciones alejadas.
Una vez iniciada, el tratamiento de la FA requiere contemplar cinco aspectos básicos con un orden de prioridad temporal en correspondencia con los posibles efectos de la arritmia (figura 7).
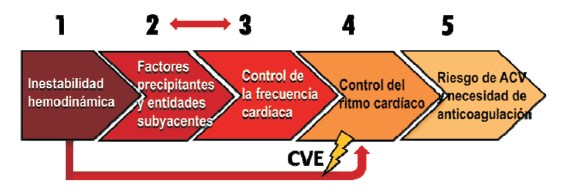
Figura 7: Orden de prioridades en el manejo de la fibrilación auricular posoperatoria. La inestabilidad hemodinámica requiere CVE inmediata. En la fibrilación auricular bien tolerada, la estrategia primaria recomendada por la ESC es el control de la frecuencia cardíaca(104), aunque el control del ritmo es igualmente válido para la CCS(60). Los factores precipitantes deben corregirse concomitantemente cualquiera sea la conducta elegida. CVE: cardioversión eléctrica; ESC: European Society of Cardiology; CCS: Canadian Cardiovascular Society.
La primera actitud será una rápida evaluación del estado hemodinámico y sintomático del paciente. Si la FA determina signos de isquemia, hipotensión arterial o ICC se procede a la cardioversión eléctrica (CVE) sincronizada inmediata con corriente bifásica, que resulta altamente efectiva.
El inicio simultáneo de medicación antiarrítmica i/v está indicado (clase IIa ESC) como facilitador y estabilizador de la conversión a RS, y ocasionalmente puede lograr la reversión mientras se prepara la CVE, o al menos un descenso de la frecuencia cardíaca (FC). La identificación clara del inicio reciente de la arritmia torna innecesarios la anticoagulación previa y el ecocardiograma transesofágico (ETE). Si los efectos son menos severos, pero se presentan síntomas, puede intentarse cardioversión farmacológica (CVF) o proceder a la CVE si aquélla fracasa. La FA de las primeras horas del PO con el paciente ventilado también se beneficia de la CVE, capitalizando la sedación en curso.
La refractariedad o la rápida recurrencia de la arritmia pueden deberse a factores precipitantes o condiciones asociadas frecuentes en el POCC que siempre hay que identificar y corregir. Estas condiciones pueden tener un impacto propio en la evolución del paciente y un tratamiento específico, como ocurre con el derrame pericárdico (frecuentemente asociado), infección, anemia, hipoxemia, alteraciones de la volemia, isquemia, disfunción tiroidea, etc.
Si la FA es asintomática, las dos estrategias posibles son el control del ritmo cardíaco (CRC), o el control de la FC. Al respecto, un estudio randomizado pequeño con bajo poder estadístico no encontró diferencias significativas en recuperación de RS a los dos meses, pero el grupo de CRC tuvo una internación hospitalaria menor102. En un estudio randomizado posterior más extenso tampoco se observó diferencias en obtención de RS a los 60 días ni en la incidencia de ACV u otros eventos mayores, aunque hubo un cruzamiento considerable entre los grupos103.
La guía canadiense60 y la de la AHA/ACC/HRS61 consideran razonables las dos estrategias, mientras que la ESC (2016) asigna preferencia (lla) al control de la FC104.
En el paciente con disfunción o hipertrofia ventricular severa la recuperación de la actividad auricular, aun transitoriamente, puede proveer un mejor estado hemodinámico y funcional en el período más crítico de recuperación. También es atendible la intención de limitar la carga precoz de FA y de remodelación atrial para evitar formas más estables de la arritmia y anticoagulación prolongada, en especial en el paciente con riesgo alto de sangrado. Además, la dificultad en lograr una FC adecuada obliga a reorientar la estrategia hacia el control farmacológico del ritmo. De hecho, en un estudio multicéntrico se observó una estrategia de control del ritmo en el 81% de los casos y un escaso uso de warfarina, sin diferencias regionales sustanciales65. El tratamiento de los factores precipitantes debe ser concomitante con cualquiera de estas estrategias.
Control de la frecuencia cardíaca
Varios agentes que reducen la conducción auriculoventricular son de uso habitual. El objetivo es una FC en reposo <90 cpm o <110 cpm, según la respuesta hemodinámica del paciente. Los BB son de primera elección, dado el elevado tono catecolaminérgico del posoperatorio, y deberían estar incluidos anticipadamente por su papel preventivo. Los calcioantagonistas no dihidropiridínicos son de segunda elección; solo tienen prioridad si los BB están contraindicados, y también pueden ser combinados con ellos. Los digitálicos están relegados a una tercera opción, ya que son menos efectivos en situación de hipersimpaticotonía. Sin embargo, combinados con alguno de los anteriores pueden permitir reducir su dosis y sus efectos colaterales. Están contraindicados en presencia de una vía accesoria. La cardiopatía de fondo también puede incidir fuertemente en la elección (figura 8). El control de la FC requiere asociar anticoagulación inmediata y seguimiento del ritmo cardíaco para decidir el momento de su interrupción.
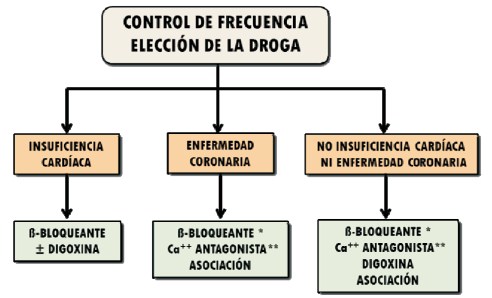
Figura 8: Elección del fármaco para el control de frecuencia cardíaca según la cardiopatía de fondo (Canadian Cardiovascular Society(60)).* Los betabloqueantes son preferibles en la enfermedad coronaria.** Calcioantagonistas no dihidropiridínicos (diltiazem, verapamil).± Podría considerarse digoxina en monoterapia sólo en individuos muy sedentarios.
Control del ritmo cardíaco en el paciente estable
Si en el primer episodio la estrategia elegida es CRC, la administración del antiarrítmico seguirá de inmediato al diagnóstico, intentando evitar la remodelación y la necesidad de anticoagulación. Las recomendaciones se basan en la información obtenida en la FA fuera del ámbito quirúrgico, dada la escasez de estudios específicos. Varias drogas pueden ser efectivas, pero la presencia de cardiopatía estructural (coronariopatía, disfunción o hipertrofia ventricular) limita o contraindica el uso de drogas de los grupos Ia o Ic en el POCC. En estas condiciones, la amiodarona i/v es efectiva en la conversión y el mantenimiento del RS, tiene menor potencial proarrítmico que otros fármacos del grupo III y su toxicidad mayor se presenta en el mediano y largo plazo, por lo cual es la droga de elección en nuestro medio (tabla 2). Puede iniciarse con 5 mg/kg en 15 a 20’ i/v seguida de una perfusión continua hasta completar una carga de 900 a 1.200 mg/24 h. Luego de la reversión a RS se continúa por vía oral (v/o) como prevención secundaria, manteniendo los BB de no surgir contraindicación.
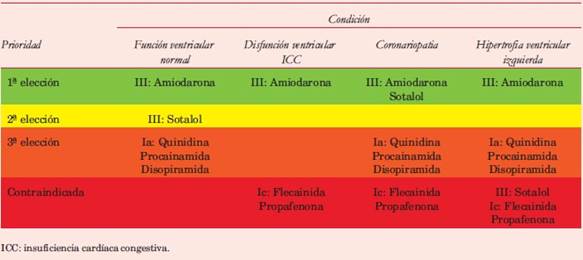
Tabla 2: Elección de la droga para control del ritmo cardíaco de acuerdo a condiciones clínicas y estructurales de la cardiopatía de base (guías CCS(60) y ESC(62)).
Si la arritmia persiste >48 horas sin anticoagulación, es recurrente o tiene inicio incierto (circunstancia inhabitual en el POCC) se requiere un ETE para descartar trombosis cavitaria previo a la cardioversión, o diferirla tres semanas bajo anticoagulación efectiva con INR entre 2,0 y 3,0, suspendiendo los antiarrítmicos.
Luego de cardioversión exitosa se continuará con anticoagulación durante un plazo no menor a cuatro semanas y vigilancia estrecha del ritmo cardíaco.
Las guías AATS 2014105, aunque referidas a cirugía torácica no cardíaca, recomiendan mantener el antiarrítmico durante cuatro a seis semanas luego del último episodio de FA (clase IIa).
En un pequeño estudio no randomizado se observó que el tratamiento con BB solos o asociados a amiodarona fue más eficaz que amiodarona sola para evitar la recidiva de FA a los 30 días31.
Anticoagulación
El siguiente pero no menos importante aspecto es la valoración del riesgo tromboembólico, determinado por la persistencia o reiteración de la arritmia y predictores integrados en el score CHA2DS2-VASc, aunque no validado en este contexto93. No hay un límite temporal seguro, pero la mayoría de las guías recomiendan indicar anticoagulación a las 24 o 48 horas de iniciada la FA. Por otra parte, el POCC se asocia a riesgo de sangrado por alteraciones de la hemostasis/fibrinolisis y presencia de suturas vasculares, por lo que la decisión y oportunidad de anticoagular debe condicionarse a un preciso balance, utilizando también el score HAS-BLED106.
Con FA >24 horas o dos o más episodios, CHA2DS2-VASc >2 en el hombre y >3 en la mujer y bajo o moderado riesgo de sangrado, debe iniciarse anticoagulación con heparina de bajo peso molecular (HBPM) simultáneamente con warfarina, con objetivo de INR entre 2,0 y 3,0.
Una alternativa atractiva en la FAPO no valvular (ausencia de prótesis mecánica y de estenosis mitral moderada o severa) son los anticoagulantes directos, que no requieren puente de HBPM ni monitorización y compiten favorablemente en eficacia y seguridad con la warfarina107.
Un estudio prospectivo randomizado recientemente diseñado (NEW-FA trial)108 probablemente aportará información de calidad sobre estos aspectos, además de consideraciones económicas sobre su utilización en este escenario.
El fundamento de la anticoagulación precoz (<24 horas) es permitir una cardioversión con bajo riesgo de complicaciones embólicas, aunque en la práctica muchos profesionales no se sienten cómodos sin un ETE previo que descarte trombosis cavitaria.
La duración de la profilaxis tromboembólica luego de restablecido el RS es tema de discusión; depende del estado de remodelación atrial preexistente y la carga de FA, que condicionan la posibilidad de recurrencia y el grado de disfunción mecánica posconversión.
Hasta ahora las guías recomiendan continuar al menos un mes, pero en caso de FA reiterada o evidencia de remodelación auricular significativa, parece prudente prolongar el tratamiento y reevaluar el ritmo cardíaco frecuentemente antes de su suspensión.
Una interesante comprobación es que el CHA2DS2-VASc -integrado por varias condiciones asociadas a remodelación auricular- es predictor de ACV en forma independiente de la FA109, lo cual enfatiza la importancia de la miopatía atrial en esta complicación. En consecuencia, este score debería ser especialmente considerado en la decisión de suspender los anticoagulantes, más allá de la recuperación y aparente estabilidad del RS. De hecho, la actualización 2019 focalizada de la Guía AHA/ACC/ HRS 2014 emite una recomendación lla B-NR para la anticoagulación prolongada luego de la CV de FA/flutter <48 horas con CHA2DS2-VASc >2 en el hombre o >3 en la mujer, aunque no específicamente en el contexto quirúrgico110. La nueva Guía ESC 2020 propone como recomendación llb la anticoagulación a largo plazo, “considerando el beneficio neto anticipado y las preferencias del paciente”(62). En la (figura 9) se sintetizan las medidas recomendadas por esta guía en la profilaxis y en el tratamiento de la FAPO.
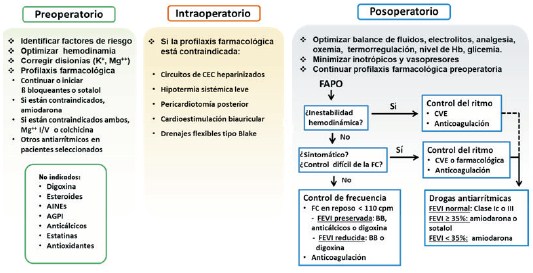
Figura 9: Principios básicos de la profilaxis y el manejo de la fibrilación auricular posoperatoria (FAPO). AINEs: antiinflamatorios no esteroideos; AGPI: ácidos grasos poliinsaturados; CEC: circulación extracorpórea; Hb: hemoglobina; CVE: cardioversión eléctrica; FC: frecuencia cardíaca; BB: betabloqueantes; FEVI: fracción de eyección del ventrículo izquierdo. (Guías ESC 2020 sobre FA62).
Conclusiones
La FAPO continúa siendo una complicación muy frecuente de la CC a pesar de numerosas medidas profilácticas propuestas, y es probable que esa realidad se mantenga en el futuro. Si bien la literatura sobre el tema es profusa, su estudio sistemático se ha dificultado debido a grandes inconsistencias en cuanto a definición, métodos de registro, población objetivo, diseño metodológico y manejo. No obstante, esta arritmia está siendo progresivamente contemplada no como un epifenómeno transitorio e inocuo, sino como un evento asociado a graves complicaciones que incluyen ACV y mortalidad tanto en el perioperatorio como en el largo plazo, generando mayor uso de recursos y exceso de costos. Por otra parte, los datos sólidos provenientes de estudios controlados randomizados son demasiado escasos como para asegurar que la reducción de su incidencia se traducirá efectivamente en un descenso de eventos adversos, por lo que buena parte de las recomendaciones de las guías para su manejo provienen de información obtenida de la FA ajena al contexto del perioperatorio. Este hecho y el temor a los efectos colaterales de los fármacos considerados de primera línea en su prevención explican la adherencia llamativamente baja en su aplicación.
Aun así, la información disponible sugiere fuertemente que la arritmia tiene una responsabilidad propia y directa en las complicaciones tromboembólicas y la mortalidad a largo plazo, y que su irrupción en el contexto quirúrgico representa la manifestación inicial de profundas modificaciones eléctricas y estructurales subclínicas del miocardio auricular, es decir, de una verdadera miocardiopatía atrial de carácter progresivo.
Con esto en mente, la aparición de la FAPO en el paciente intervenido debería generar una alerta en el clínico responsable de su seguimiento, que tendrá a su cargo la vigilancia del ritmo cardíaco, establecer un plan de prevención secundaria higiénico/farmacológico de la FA y sus comorbilidades relacionadas, y asumir decisiones tan importantes como definir el alcance temporal de la anticoagulación y la eventual necesidad y oportunidad de un tratamiento invasivo de la arritmia.
Estudios futuros bien diseñados podrían ayudar a definir mejor el valor de medidas preventivas concretas en la reducción de eventos mayores y obtener un modelo de estratificación de riesgo válido con el que racionalizar su aplicación, minimizando tanto los riesgos de la arritmia como los derivados del uso indiscriminado de tales medidas. En el largo plazo, la interrogante a responder es si la implementación posalta de estrategias ya consolidadas en la FA primaria, como el seguimiento diligente del ritmo, la prevención secundaria o la anticoagulación ajustada al riesgo tromboembólico serán capaces de mejorar el pronóstico de estos pacientes.