Introducción
Las alteraciones en el sistema de conducción son frecuentes en el posoperatorio de cirugía cardíaca (POCC), presentándose hasta en la mitad de los pacientes. Comprenden diferentes grados de bloqueo auriculoventricular (BAV), bloqueos fasciculares y enfermedad del nodo sinusal (ENS). La mayoría de estos trastornos son transitorios y reversibles. En ocasiones, es necesaria la estimulación temporal mediante electrodos epicárdicos para mantener un adecuado gasto cardíaco.
La necesidad de implante posoperatorio de marcapasos definitivo (MPD) es baja, 1,4%-3,0%, variando según el tipo de procedimiento quirúrgico realizado1-4. La indicación principal para la estimulación permanente es el BAV de alto grado.
Estos trastornos aumentan la morbilidad y prolongan la estadía hospitalaria, pero no se ha demostrado que determinen un aumento de la mortalidad operatoria. Durante la valoración preoperatoria es muy importante conocer la frecuencia de estas complicaciones, según el tipo de cirugía y los factores predisponentes, para el correcto manejo posoperatorio.
Epidemiología
Los trastornos de la conducción son frecuentes en la cirugía de revascularización miocárdica (CRM), siendo el bloqueo de rama derecha el más común5. El BAV completo se evidencia en alrededor del 16% de las cirugías6-8, pero solo 0,23%-1,1% de los pacientes requieren MPD, según las diferentes series2-4,8,9. En la cirugía valvular la incidencia es mayor, entre 3,0% y 6,0%2,4,9,10. Para la cirugía combinada se reporta una incidencia de 6,1%4.
En el caso de la cirugía de sustitución valvular aórtica (SVA), 2,5%-6,6%3,4,9,11-13 de los pacientes requiere MPD, y esta cifra aumenta a más del doble si se utilizan válvulas sin sutura15,16.
El 23% de los pacientes sometidos a reparación o reemplazo de válvula mitral presentan BAV de primer, segundo o tercer grado, requiriendo MPD 2,0%-4,4% de ellos9,17-19.
Debido a la baja frecuencia de la cirugía aislada sobre la válvula tricúspide en adultos, la incidencia en esta intervención por sí sola es difícil de establecer. En un estudio de sustitución valvular tricúspide, por prótesis biológica o mecánica, se informó que la necesidad de implante de MPD fue de 22%20. Wiggins y colaboradores4, por su parte, reportaron una incidencia de 25% y 12% para la sustitución y reparación valvular tricúspide, respectivamente.
El riesgo de bloqueo e implante de MPD aumenta con el número de válvulas sustituidas. Según un estudio publicado por Leyva y colaboradores9, que incluyó 135.356 pacientes, la incidencia de MPD fue de 4,22% para la SVA, 4,38% para la mitral, 5,59% para la cirugía combinada aórtica y mitral y 7,89% para la mitral y tricúspide. Por su parte, la reintervención valvular determina un aumento significativo en el riesgo de requerir MPD, pudiendo llegar hasta 10,5%21-23.
Anatomía del sistema de conducción
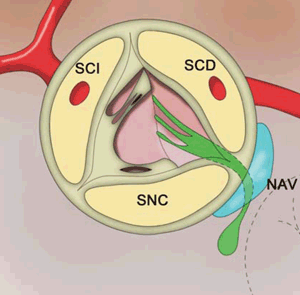
Para comprender los mecanismos implicados en estos trastornos es importante conocer la anatomía del sistema de conducción, especialmente su irrigación y la proximidad con las válvulas cardíacas. El sistema de conducción comprende el nodo sinusal (NS) encargado de la generación, propagación y distribución del impulso eléctrico cardíaco, el nodo auriculoventricular (NAV) que optimiza la transmisión del impulso eléctrico de aurículas a ventrículos, y el sistema His-Purkinje que distribuye el impulso para la contracción ventricular izquierda y derecha. El NS tiene una ubicación subepicárdica a lo largo de la pared ántero-lateral de la aurícula derecha, próximo a la desembocadura de la cava superior. El NAV es una estructura subendocárdica auricular derecha, ubicada en el tabique interauricular, anterior al orificio del seno coronario y encima de la inserción de la lámina septal de la válvula tricúspide, región conocida como triángulo de Koch (figura 1). La unión AV se divide en tres zonas: la región de células transicionales, el nodo AV compacto y el haz penetrante de His. La estructura histológica del NAV es compleja, encontrándose gran variabilidad interindividual, según la edad, la presencia de tejido graso y fibrosis. El haz penetrante de His es la única estructura del sistema de conducción que penetra el cuerpo fibroso central, formado por la unión del tejido conectivo de los velos valvulares aórtico y mitral, y por el velo septal de la válvula tricúspide. Luego atraviesa el septum membranoso interventricular y se divide en sus ramas derecha e izquierda (figura 2). La rama derecha pasa a través de la musculatura del tabique interventricular a la base del músculo papilar medial del ventrículo derecho. La rama izquierda, desde su origen, situado debajo de la comisura entre los velos derecho y no coronario de la válvula aórtica, desciende por el subendocardio del tabique interventricular y se divide en rama anterior y posterior24,25. La irrigación del NS depende de la arteria coronaria derecha en 73% de los casos, en 3% de la coronaria izquierda, y en el 23% restante de ambas, formando un anillo. La arteria del nodo AV es responsable de la irrigación de dicho nodo y es rama de la coronaria derecha en 80% de los casos, de la arteria circunfleja en 10% y de ambas en el 10% restante. El haz de His es irrigado, en 75% de los casos, por las ramas perforantes de la arteria coronaria izquierda, por la coronaria derecha en 5%-10%, y por ambas arterias en 15%-20%. Su sector proximal se abastece a través de la arteria coronaria derecha, pero a medida que se extiende periféricamente, el porcentaje de irrigación desde la arteria coronaria izquierda aumenta gradualmente, siendo los haces derecho e izquierdo, en todos los casos, irrigados por perforantes de la arteria coronaria izquierda26.
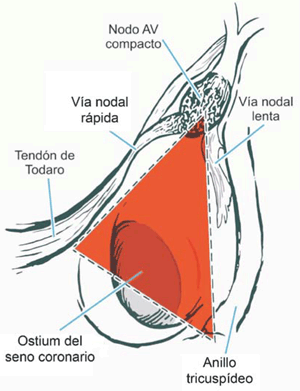
Figura 1: Anatomía del triángulo de Koch. Extraído de Texto de Cardiología, Sociedad Interamericana de Cardiología25.
Fisiopatología
Los mecanismos fisiopatológicos principales que explican las alteraciones de la conducción observadas en el POCC son el traumatismo mecánico directo, la isquemia miocárdica y la inadecuada protección cardíaca.
El trauma mecánico se relaciona principalmente con la cirugía valvular, y es conocido desde hace muchos años que la proximidad del sistema de conducción a las válvulas cardíacas es el factor determinante. En 1935, Yater y colaboradores27 ya describían el BAV en asociación con calcificación del anillo aórtico, y en 1963, Sellers y colaboradores28 demostraron por primera vez una lesión en el sistema de conducción durante el implante de una válvula mecánica aórtica. En estudios histopatológicos realizados a pacientes con cirugía valvular aórtica, Fukuda y colaboradores29 identificaron tres tipos de lesiones morfológicas del sistema de conducción: lesiones compatibles con degeneración crónica y fibrosis (identificadas como factores predisponentes), lesiones no traumáticas, como hemorragia y edema (reversibles en pocos días), y lesiones traumáticas persistentes (relacionadas con la decalcificación anular y lesiones por suturas). Como se describió anteriormente, el área debajo de la unión de las valvas aórticas derecha y no coronariana corresponde a la extremidad anterior del haz de His previo a subdividirse en sus ramas, por lo que cualquier trauma directo o tensión mecánica en esta región podría explicar la aparición de trastornos de la conducción. La lesión puede producirse durante el desbridamiento del calcio valvular o durante la sutura de la válvula, sobre todo en la técnica de sutura continua30. Por otro lado, cuando la insuficiencia aórtica es la patología predominante, la ectasia anular puede imponer un estiramiento mecánico crónico y progresivo entre el NAV y el haz de His, lo que aumenta el riesgo de daño irreversible en la cirugía10. El hecho de que la mayoría de los trastornos de la conducción, en particular el BAV competo, ocurran durante o dentro de las primeras horas de la cirugía, respalda el planteo de la lesión o tensión mecánica como principal mecanismo.
La válvula mitral también está anatómicamente próxima al sistema de conducción, especialmente su comisura medial posterior; sin embargo, no hay estudios que evidencien alteraciones morfológicas sobre el sistema de conducción en la cirugía mitral. Berdajs y colaboradores18 no encontraron predictores de BAV en pacientes con cirugías de sustitución o anuloplastia mitral y plantearon la hipótesis de que el daño de la arteria del NAV podría desempeñar un papel en su desarrollo. Los autores describieron que en 23% de los pacientes esta arteria está anatómicamente muy próxima al anillo mitral.
Como vimos, el NAV está íntimamente relacionado con la valva septal de la válvula tricúspide, lo que lo hace particularmente susceptible durante cualquier intervención sobre ésta. Se han desarrollado diferentes técnicas quirúrgicas de reparación valvular, incluyendo la utilización de anillos tricúspides incompletos para disminuir su lesión.
Durante la endocarditis valvular, el BAV puede ocurrir de manera secundaria a la extensión del proceso infeccioso. El bloqueo cardíaco se presenta más frecuentemente en la endocarditis de la válvula aórtica y se asocia con mayor riesgo de muerte súbita cardíaca y destrucción anatómica más severa de los tejidos cardíacos31.
La isquemia miocárdica y la pobre protección cardíaca son los mecanismos más frecuentemente involucrados en la génesis de trastornos de la conducción durante la CRM, aunque también participan en la cirugía valvular. En una revisión de Kumbhani y colaboradores5, la isquemia ha sido implicada como el factor más importante por la mayoría de los autores, existiendo una correlación entre el número y grado de estenosis de los vasos coronarios, y el desarrollo y severidad de los trastornos de la conducción. Caspi y colaboradores7 encontraron que la combinación de enfermedad obstructiva proximal de la arteria coronaria izquierda y oclusión de la arteria coronaria derecha dominante fue más frecuente en pacientes que presentaban BAV que en aquellos que no lo presentaron (32% vs. 12%, p<0,05). Plantearon que esta diferencia se debía a una insuficiente protección miocárdica por distribución no uniforme de la solución de cardioplejia y a la menor revascularización de la arteria coronaria derecha (y por ende de la arteria del NAV). El infarto de miocardio aumenta la incidencia de BAV por daño isquémico agudo del sistema de conducción7,8. El tejido de conducción difiere de los miocitos cardíacos por ser menos tolerante a los efectos de la isquemia, hiperpotasemia e hipotermia (estos dos últimos, sistémicos o inducidos por una solución cardiopléjica fría y rica en potasio)5. Se ha planteado que la protección miocárdica sería mayor con cardioplejia normotérmica y con una distribución más uniforme a través de perfusión anterógrada y retrógrada.
El deterioro en la irrigación coronaria aumenta con la edad, al igual que la frecuencia de enfermedades degenerativas del sistema de conducción, lo que aumenta la probabilidad de BAV.
La ENS tiene una incidencia menor que los BAV y fasciculares luego de cirugía cardíaca. Puede expresarse como bradicardia sinusal persistente o ritmos de la unión que requieren estimulación. En su mayoría, se deben a sufrimiento isquémico, aunque también pueden ser secundarios a un trauma producido durante la auriculotomía lateral derecha, u otros abordajes transeptales superiores que pueden ser utilizados en la cirugía mitral o durante la ablación de fibrilación auricular. La presencia, en algunos pacientes, de un anillo vascular sino-auricular formado por colaterales de ambas arterias coronarias, podría explicar la recuperación del NS al daño isquémico causado por infarto local, incisión quirúrgica o pobre protección miocárdica26.
En el posoperatorio inmediato es frecuente observar ritmos de la unión acelerados transitorios. Su etiología es multifactorial y generalmente no implican un trastorno de la conducción en sí mismos. Se caracterizan por comandar transitoriamente el ritmo cardíaco, dado que su alta frecuencia inhibe al NS por sobreestimulación.
Predictores de implante de marcapasos definitivo
Durante la valoración preoperatoria la posibilidad de identificar a los pacientes que necesitarán un MPD luego de la cirugía cardíaca, es baja. Conocer los predictores asociados más importantes nos será útil al momento de informar a nuestro paciente.
Diferentes estudios han definido factores de riesgo relacionados al desarrollo de trastornos de la conducción permanentes en el posoperatorio. En 1984, Goldman y colaboradores2 ya establecían como predictores de riesgo las alteraciones de la conducción previas, edad avanzada, anillo valvular aórtico calcificado, cirugía valvular (especialmente de la válvula tricúspide) y pobre protección miocárdica. En más de 10.000 pacientes sometidos a cirugía cardíaca, Gordon y colaboradores1 encontraron cinco factores de riesgo independientes relacionados con el trauma físico del sistema de conducción (cirugía valvular, reintervención, cirugía de ablación de arritmias, reconstrucción del anillo mitral y endocarditis activa), y otros relacionados con un aumento de la carga isquémica (edad >75 años, insuficiencia renal y pobre protección miocárdica durante la cirugía). Usando la fórmula de probabilidad propuesta por los autores, se puede calcular el riesgo de MPD para diferentes escenarios, por ejemplo, el riesgo en una CRM sin complicaciones es de 0,9%, mientras que para una cirugía de reintervención valvular aórtica por endocarditis es de 29,4%.
Otro estudio encontró que los trastornos de la conducción previos, especialmente el bloqueo completo de rama izquierda (BCRI), o diferentes grados de BAV y la cirugía de SVA, son predictores independientes de MPD en el POCC3. En 1.200 cirugías cardíacas, Socie y colaboradores15 establecieron como predictores de MPD, la edad, sexo femenino, endocarditis infecciosa y cirugía de SVA.
Una revisión publicada en el 201032, que incluyó 2.557 pacientes con SVA, estableció la enfermedad previa del sistema de conducción como el predictor más potente de BAV posoperatorio. Otros predictores descriptos fueron la insuficiencia aórtica (como patología valvular primaria), válvula aórtica bicúspide, calcificación del anillo aórtico, disfunción ventricular severa, hipertensión arterial, tiempo prolongado de circulación extracorpórea, y la técnica quirúrgica de sutura continua de la válvula. Estudios posteriores3,14,33,34 también encontraron a los trastornos de la conducción preoperatorios como predictores independientes, cuadruplicando el riesgo en algunos trabajos14.
En 1978, Friedman y colaboradores35 demostraron, mediante estudio electrofisiológico, que el 30% de los pacientes con estenosis aórtica calcificada presentaban alteraciones en la conducción intra o infra His (intervalo HV prolongado), mientras que los pacientes con insuficiencia aórtica crónica mostraban más frecuentemente un intervalo PR y AH prolongados. La prolongación del HV en la enfermedad valvular aórtica calcificada puede no tener expresión en el electrocardiograma (ECG) de superficie o solo manifestarse con un discreto aumento del intervalo PR.
Koplan y colaboradores36 elaboraron un score simple y útil para predecir el riesgo de MPD luego de la cirugía valvular. Este establece como predictores independientes más fuertes el bloqueo completo de rama derecha (BCRD) (OR: 3,6) y la cirugía multivalvular, que incluye la válvula tricúspide (OR: 3,7), a los cuales le adjudica 2 puntos; la cirugía multiválvula sin válvula tricúspide (OR: 2,1), BCRI preoperatorio (OR: 2,0), BAV de primer grado (OR: 1,9), cirugía valvular previa (OR: 1,8) y la edad >70 años (OR: 1,4) con 1 punto cada uno. Un puntaje de riesgo de 0-6 identificó pacientes en el grupo de validación con incidencias de MPD de 1,9%, 5,2%, 8,7%, 11,5%, 21%, 36% y 50%, respectivamente.
Resumiendo, los predictores más importantes para evaluar el riesgo de implante de MPD en el posoperatorio son: 1) la presencia de trastornos de la conducción previos, especialmente bloqueos de rama; 2) la mayor edad del paciente, asociada a mayores alteraciones degenerativas en el sistema de conducción; 3) la cirugía valvular, destacando la cirugía valvular aórtica con extensa calcificación anular, la cirugía por endocarditis valvular complicada con abscesos y la cirugía de múltiples válvulas que incluye a la válvula tricúspide; 4) la cirugía de reintervención valvular; 5) la pobre protección miocárdica, secundaria a enfermedad coronaria severa o a tiempos de circulación extracorpórea prolongados, o ambos; y 6) el BAV completo en el POCC inmediato que persiste en las primeras 48 horas, sobre todo si presenta un escape infranodal.
Indicación de marcapasos
Las indicaciones de implante de MPD durante el posoperatorio son las mismas que para el paciente no sometido a cirugía. Lo controvertido y menos estudiado, dada la posible reversibilidad de estos trastornos, es el momento más adecuado para el implante. Según Socie y colaboradores15, aproximadamente el 42% de los BAV de alto grado mejoran en un período medio de tres días. Los autores sostienen que el 90% de los pacientes que recuperan la conducción lo hacen antes del séptimo día del POCC. Según Kim y colaboradores37, el desarrollo de BAVC en las primeras 24 horas del POCC valvular que se mantiene durante las 48 horas siguientes, tiene una elevada probabilidad de permanecer, por lo que aconsejan el implante de MPD antes de la primera semana. Merin y colaboradores3 recomiendan el implante de MPD al quinto día del POCC en pacientes que mantienen el bloqueo y fueron sometidos a SVA, o presentaban BCRI en el preoperatorio.
El implante de un MPD permite la pronta movilización, reduciendo así la morbilidad asociada con estancia prolongada en cama. La indicación del implante está dada por BAV en más del 80%3,12,14,22) de los casos, siendo el resto por ENS (bradicardia severa sintomática y fibrilación auricular con respuesta ventricular lenta).
La Sociedad Europea de Cardiología38, en su guía de estimulación cardíaca publicada en el año 2013, recomienda un período de espera de cinco a siete días después de la cirugía para el implante de MPD en pacientes con BAV avanzado o completo y disfunción sinusal sintomática. Sin embargo, establecen que la presencia de un ritmo de escape bajo en el BAV completo, puede acortar este tiempo, dado que es poco probable que se resuelva espontáneamente (indicación I, evidencia C).
De acuerdo con la guía publicada en 2018 por American College of Cardiology y American Heart Association39, está indicado el implante de MPD en el posoperatorio de CRM o sustitución valvular antes del alta, cuando la ENS o el BAV se asocian con síntomas o inestabilidad hemodinámica que no se resuelven (indicación I, B). En cuanto al tiempo de espera, no hay estudios específicos, pero plantean como razonable un plazo de tres a cinco días en la SVA y cirugía tricúspide, y algo mayor, de cinco a siete días, en la sustitución valvular mitral y CRM. En todos los pacientes sometidos a cirugía cardíaca, recomiendan el implante de marcapasos epicárdico temporal (indicación I, evidencia C, para cirugía aórtica y tricúspide y IIa para cirugía valvular mitral y CRM). También establecen que se debe considerar, en pacientes sometidos a reemplazo o reparación de válvula tricúspide con alto riesgo de BAV completo posoperatorio, el implante de electrodos de estimulación epicárdica permanente en el momento de la cirugía (indicación IIa, evidencia C).
No existen recomendaciones en las guías, con respecto al BAV que se presenta luego de la cirugía valvular por endocarditis. Las guías de endocarditis31 se refieren al marcapasos como dispositivo vinculado a la infección, y a su extracción y oportunidad de reimplante para evitar nuevas infecciones. Establecen la necesidad de hemocultivos negativos al menos 72 horas previo al procedimiento, y si hay evidencia de infección valvular remanente, el implante debe retrasarse al menos 14 días. Además, plantean que la estimulación temporal en la endocarditis es un factor de riesgo para la infección de un dispositivo cardíaco posterior, y si es posible, debe evitarse. El uso temporal de cables de fijación activa conectados a dispositivos externos se describe como una terapia “puente” en pacientes dependientes, permitiendo la movilización precoz con un bajo riesgo de pérdida de captura.
En la endocarditis de múltiples válvulas o abscesos, complicados con BAV, la conducta más adecuada es el implante de electrodos epicárdicos bipolares durante la cirugía y, si tiene indicación, bicamerales, para lo cual es fundamental trabajar en conjunto con los cirujanos cardíacos. La estimulación epicárdica definitiva, a través de electrodos bipolares, ha demostrado mantener bajos umbrales de estimulación y excelente detección en el seguimiento en comparación con los electrodos unipolares, con mayor longevidad de la batería40. Esta conducta terapéutica disminuye la estimulación temporal prolongada, la estadía hospitalaria y, principalmente el riesgo de nuevas infecciones endocavitarias.
Morbilidad y mortalidad
Los pacientes con trastornos de la conducción presentan una estadía hospitalaria más larga y mayor morbilidad1,8,14. Según Mehaffey y colaboradores11, el grupo con MPD duplicó la estancia en cuidados intensivos y tuvo una internación más prolongada; también fue mayor el reingreso hospitalario en los primeros 30 días del POCC. Todo esto se reflejó en un aumento significativo del costo sanitario.
El pronóstico para el BCRD es favorable y la mayoría son transitorios. Con respecto a los trastornos de la conducción de los fascículos izquierdos, su carácter es más permanente, y se los ha correlacionado con un mayor daño miocárdico y mortalidad operatoria cuando se asocian a infartos extensos6,41. Algunos estudios reportaron mayor mortalidad operatoria en pacientes revascularizados que presentaron BAV completo7,8; sin embargo, también tuvieron una mayor incidencia de bajo gasto cardíaco e infarto de miocardio posoperatorio, por lo que el BAV no fue el único factor implicado en el aumento de la mortalidad. Una revisión publicada en 2006 sobre los trastornos de la conducción en pacientes con CRM, no encontró asociación significativa entre dichas alteraciones y la mortalidad posoperatoria, aunque como limitación, los autores reportaron que el BCRD fue el trastorno más frecuente dentro de los incluidos5. Bagur y colaboradores14 reportaron una tasa de mortalidad similar a 30 días entre los pacientes con y sin marcapasos.
Se reconoce que la estimulación desde el ápex del ventrículo derecho (VD) provoca una disincronía mecánica, que en algunos pacientes puede desencadenar remodelación ventricular con reducción de la fracción de eyección e insuficiencia cardíaca42. Parece razonable esperar que el implante de MPD después de la cirugía cardíaca se asocie a mayor mortalidad en el seguimiento; sin embargo, Bagur y colaboradores14 y Raza y colaboradores43 no encontraron dicha asociación. Por otro lado, Wiggins y colaboradores4 informaron una probable disminución en la supervivencia en aquellos pacientes con estimulación apical.
Estudios recientemente publicados por Greason y colaboradores12 y Mehaffey y colaboradores11, que incluyeron pacientes con SVA aislada o combinada, y una mediana de seguimiento de 11 años, encontraron que el implante de MPD es un factor independiente asociado con mayores tasas de mortalidad. Su efecto sobre la mortalidad a largo plazo fue mayor que otras complicaciones importantes del posoperatorio, incluidas la fibrilación auricular y la mediastinitis11. En el trabajo de Greason y colaboradores12 se informó que 98% de los electrodos fueron implantados en el ápex del VD. Actualmente, el lugar recomendado es el septum medio del VD44, por asociarse a menor incidencia de disincronía. Creemos que se requerirán nuevos estudios de seguimiento longitudinal para revalorar estos hallazgos sobre la mortalidad.
La evidencia actual sobre el uso del MPD luego de la cirugía cardíaca y la dependencia a este a largo plazo es limitada debido a la falta de un diseño estandarizado en los estudios. Durante el seguimiento se ha encontrado una mayor dependencia si la indicación del implante fue un BAV3,45. Según Kiehl y colaboradores46, la recuperación tardía de la conducción AV ocurre aproximadamente en 12% de los pacientes dentro de los seis meses siguientes. Entre los predictores de recuperación de la conducción, reportaron el sexo femenino y el antecedente de conducción AV transitoria en el POCC, y como predictor de dependencia el antecedente preoperatorio de trastornos de la conducción.
Conclusiones
Los trastornos del sistema de conducción son frecuentes en el POCC. Se presentan generalmente como bloqueos fasciculares y diferentes grados de BAV, siendo en su mayoría reversibles. De 1%-6% de las CRM y valvulares requieren implante de MPD.
Los mecanismos fisiopatológicos implicados durante la cirugía son el trauma mecánico, el daño isquémico y la pobre protección miocárdica. La mayor incidencia de trastornos en la cirugía valvular se debe al trauma mecánico directo del sistema de conducción, secundario a la proximidad anatómica que presenta con los anillos valvulares, aórtico y tricúspide. Las indicaciones de implante de MPD no difieren de las establecidas para los pacientes sin cirugía, sin embargo, dada la posible reversibilidad de los trastornos durante el POCC, las guías realizan solo recomendaciones sobre los plazos de espera para el implante. Los predictores más frecuentemente vinculados con la persistencia de estos trastornos de la conducción son la mayor edad del paciente, las alteraciones previas de la conducción (sobre todo BCRI o BCRD), la cirugía valvular (más frecuentemente aórtica), y la evidencia de BAV completo precoz que se mantiene en las primeras 48 horas (en particular si presenta escape infranodal). Destacamos la importancia de reconocer estos predictores para identificar qué pacientes se benefician de un implante precoz de MPD durante el POCC.