Introducción
Las arritmias ventriculares son una causa frecuente de morbilidad y mortalidad en el posoperatorio de cirugía cardíaca (POCC). Es escasa la evidencia que describa y desarrolle el tema de forma profunda y nos permita definir conductas claras para cada situación. La mayoría de los estudios de arritmias en el POCC se centran en la fibrilación auricular (FA) por su alta incidencia, reportada en el 15% a 45% de los pacientes1.
La importancia clínica de las arritmias ventriculares depende de su duración, de la respuesta ventricular, de la función ventricular subyacente y de la presencia de comorbilidades. De hecho, las arritmias son una causa mayor de morbi-mortalidad en el POCC de cardiopatías congénitas2. El manejo de las arritmias incluye la corrección de factores precipitantes o predisponentes así como factores específicos para el tratamiento de la arritmia. La urgencia y el tipo de tratamiento dependerá de la presentación clínica. Frecuentemente son autolimitadas y no requieren una terapia específica. Otras veces generarán repercusión por sí mismas o dentro de un contexto patológico de estrés crítico del POCC, como puede ser el sangrado, la sepsis, la insuficiencia respiratoria, las alteraciones del medio interno o el derrame pericárdico, entre las más frecuentes. En estos casos será necesario un tratamiento adecuado y precoz para lograr la estabilidad del paciente3,4.
Definición
Se denomina ritmo ventricular a todo aquel originado por debajo del haz de His. Las arritmias ventriculares tienen múltiples formas de presentación: extrasistolía ventricular (EV), taquicardia ventricular monomórfica no sostenida (TVMNS) (duración mayor o igual a tres latidos y menor a 30 segundos), taquicardia ventricular monomórfica sostenida (TVMS) (duración mayor a 30 segundos o que produzca repercusión hemodinámica), taquicardia ventricular polimórfica (la morfología del QRS cambia latido a latido en un mismo episodio y en ocasiones está asociada a QT prolongado), y la fibrilación ventricular (FV)5.
Patogenia
Muchos factores están implicados en la aparición de arritmias en el POCC. Estos se pueden dividir en factores dependientes del paciente y dependientes de la cirugía, aunque en muchos de ellos su valor relativo no está determinado.
1. Dependiente del paciente
a. Edad
A mayor edad existe mayor riesgo de desarrollo de arritmias. Existen cambios estructurales a nivel miocárdico con el aumento de la edad que bajan el umbral de producción de taquiarritmias6.
b. Enfermedad estructural
Los pacientes con cardiomegalia, tanto con dilatación auricular como ventricular, tienen más riesgo de desarrollar arritmias. A mayor diámetro ventricular, más predisposición a arritmias ventriculares, así como la historia previa de FA, infarto de miocardio, estenosis significativa de la arteria coronaria derecha, enfermedad del nodo sinusal, estenosis significativa de la arteria del nodo aurículo-ventricular, cirugía cardíaca previa y enfermedad de la válvula mitral (en especial de etiología reumática) son situaciones que favorecen el sustrato arritmogénico7. La elevación del péptido natriurético atrial se ha relacionado con un aumento de incidencia de FA en el POCC8.
c. Otras comorbilidades
Se ha asociado un aumento de arritmias en el POCC con la presencia de obesidad, enfermedad pulmonar obstructiva crónica y accidente cerebrovascular previo9.
2. Dependiente de la cirugía
a. Trauma e inflamación
El trauma producido por la cirugía cardíaca predispone a las arritmias auriculares y ventriculares. Específicamente, se ha vinculado a mecanismos inflamatorios en la producción de FA. Los elementos clínicos sugestivos de pericarditis (roce pericárdico, fiebre, cambios en el electrocardiograma y dolor de tipo pleurítico) se relacionan con riesgo de FA. La presencia de derrame pericárdico es un factor trascendente para desarrollar arritmias supraventriculares10.
b. Stress hemodinámico e isquemia
Los cambios ocurridos durante la cirugía cardíaca como el agrandamiento de las cavidades cardíacas de forma aguda, cambios en la presión arterial, trauma secundario a la canulación, así como la lesión isquémica, juegan un rol primordial en la producción de arritmias.
La hipoxemia, la hipercapnia, las catecolaminas exógenas y endógenas, el desequilibrio acido-base, asociado a otras alteraciones del medio interno, también son factores contribuyentes.
El uso de circulación extracorpórea, el tiempo de clampeo aórtico, el tipo de cardioplejia, la técnica y táctica quirúrgica utilizada y el entrenamiento del operador son también determinantes críticos de isquemia perioperatoria y eventual infarto11.
Por ejemplo, se ha observado menor incidencia de FA con el uso de la revascularización sin circulación extracorpórea, debido al descenso en el síndrome de respuesta inflamatoria sistémica12.
c. Uso de drogas
La suspensión del tratamiento betabloqueante en perioperatorio se ha asociado a un aumento de las taquicardias supraventriculares13. El uso de dobutamina incrementa en un 15% la incidencia de arritmias ventriculares. Algo similar se ha observado con el uso de milrinona, un inhibidor de la fosfodiesterasa, que se ha asociado a series cortas de taquicardia ventricular (TV) en más del 17% de los casos. Tanto la dopamina como la dobutamina pueden causar taquicardia sinusal14 con el consecuente incremento en el consumo miocárdico de oxígeno e isquemia.
d. Alteraciones electrolíticas
La hipopotasemia es un factor conocido en la generación de arritmias en el POCC, más frecuentemente ventriculares. Esto se debe a la modificación en las propiedades electrofisiologías de los miocitos cardíacos, incluyendo una prolongación de la pendiente en la fase 3 de la despolarización (incremento del potencial de acción), cambios en la automaticidad y en las velocidades de conducción15. Se debe intentar mantener niveles de potasio en sangre en el límite superior de la normalidad, es decir, entre 4,5 y 5 mEq/l.
El nivel de magnesio en sangre es discutido en la génesis de arritmias. Dado que la magnesemia disminuye frecuentemente luego de la cirugía cardíaca (más específicamente con el uso de circulación extracorpórea), se recomienda mantener el nivel humoral normal16,17.
e. Otros factores
La disección de la grasa anterior durante la cirugía compromete un sector que contiene ganglios parasimpáticos y estaría relacionada con el aumento de arritmias, principalmente de FA18.
En las cardiopatías congénitas es frecuente la aparición de arritmias como complicación en el POCC vinculadas a la afectación miocárdica por la presencia de grandes líneas de sutura y cicatrices generadas durante la cirugías de reparación19.
Considerando todo lo previamente expuesto, puede afirmarse que la presencia de arritmias en el POCC es un fenómeno multifactorial: aún se desconocen muchos de los desencadenantes, y la interacción entre estos. La atribución de un único factor predisponente sería un encare simplista de un proceso complejo.
Aspectos clínicos y terapéuticos
a. Extrasistolía ventricular y taquicardia ventricular no sostenida
La EV es frecuente en el POCC. Su presencia puede estar relacionada con alteraciones electrolíticas, fenómenos isquémicos, metabólicos o mecánicos. Los pacientes con EV aisladas no tienen mayor riesgo en el posoperatorio inmediato y no determinan mayor riesgo de arritmias mortales. Fuera del contexto del POCC inmediato, algunos estudios han demostrado una asociación entre la EV y resultados adversos. La detección de EV, particularmente si es multifocal y frecuente, se ha asociado a un aumento de mortalidad, eventos isquémicos y riesgo de ataque cerebrovascular. El tratamiento farmacológico disponible no ha cambiado el pronóstico20. Por otro lado, e independientemente de la cardiopatía de base, la EV frecuente mantenida a mediano y largo plazo puede desencadenar disfunción ventricular21, denominada miocardiopatía inducida por arritmias (MIA)22. Las EV frecuentes pueden, por sí solas, causar MIA, o contribuir en su peoría en pacientes con disfunción ventricular previa. El mecanismo responsable no está dilucidado totalmente, pero se considera que la disincronía ventricular es central. Debe considerarse la posibilidad de una MIA cuando la incidencia de EV es mayor al 10% de los latidos, y sobre todo si supera el 20% en 24 horas. Además de la incidencia, otras características de las EV han sido consideradas favorecedoras del desarrollo de MIA: el ancho del QRS de las EV (>150 ms), la presencia de episodios de TVMNS, el origen diferente al del ventrículo derecho, el eje de despolarizacion superior, las EV interpoladas o con acoplamiento variable y aquellas que tienen conducción retrógrada22. El principal factor de mortalidad no es la presencia ni la carga arrítmica, sino la existencia de disfunción sistólica del ventrículo izquierdo23. La detección de EV determina la necesidad de evaluar y estudiar de forma sistemática a nuestros pacientes.
La TVMNS podría aparecer debido a causas similares a las EV en pacientes con función ventricular normal o anormal. Fuera del POCC sucede lo mismo que en el caso de EV, se asocia a un aumento de la mortalidad en pacientes con enfermedad cardiovascular. Tampoco requiere medidas específicas para su tratamiento ya que estas no han cambiado el pronóstico.
Hay que recordar que, tanto las EV frecuentes como la TVMNS son factores a considerar, ya que su presencia empeora el pronóstico20.
a.1. Tratamiento
La EV asintomática no requiere tratamiento específico en la etapa inicial. Se deben corregir las causas reversibles que favorezcan dicha situación (alteraciones del medio interno). Se indicará el uso de betabloqueantes guiados según la enfermedad de base y la sintomatología. En pacientes con compromiso de la función del ventrículo izquierdo, la lidocaína puede ser útil en etapas iniciales para suprimir EV sintomática sin modificar la mortalidad24. El uso de antiarrítmicos clase I para la supresión de las EV no tiene efecto beneficioso, al contrario, se ha observado un aumento de la mortalidad vinculado a su uso25,26.
b. Arritmias ventriculares sostenidas
Las arritmias ventriculares sostenidas (TV y fibrilación ventricular) son infrecuentes luego de la cirugía. Se ha reportado una incidencia de paro cardíaco que oscila entre el 0,7% y el 5,2% en el POCC, desde el año 1998 en EEUU27, siendo la incidencia de las arritmias ventriculares variables en los distintos estudios. Nagaage y Cowen describieron que la fibrilación ventricular (FV)y TVMS ocurrieron en el 70% de los paros cardíacos del POCC28. La mayoría de los eventos ocurren en las primeras 24 horas, y hasta la mitad de los casos en las primeras tres horas desde el final de la cirugía27.
Existe una clara asociación entre la presencia de arritmias ventriculares y disfunción ventricular, siendo éste uno de los factores predisponentes fundamentales. Otras condiciones favorecedoras incluyen el desequilibrio electrolítico, la hipoxia, la inestabilidad hemodinámica, oclusión de bypass coronarios con isquemia e infarto perioperatorio, fenómenos de isquemia/reperfusión, uso de antiarrítmicos (vinculado a proarritmias) e inotrópicos.
La TVMS se produce más frecuentemente en pacientes con antecedentes de infarto de miocardio, la zona limítrofe entre cicatriz y tejido viable representa el sustrato electrofisiológico del mecanismo de reentrada.
Dentro de las TV polimórficas sostenidas, es importante diferenciar si el intervalo QT se encuentra normal o prolongado. En el primer caso, la presencia de fenómenos perioperatorios isquémicos podría favorecer su aparición con rápida degeneración en FV. En el segundo caso, lo más habitual es que se trate de un QT prolongado adquirido por fármacos (antiarrímicos tipo IA y III) y favorecido por diselectrolitemias (hipopotasemia).
Siempre que sea posible se realizará un electrocardiograma (ECG) de 12 derivaciones en todas las taquicardias de complejos anchos para su posterior análisis, además, en los pacientes con electrodos epicárdicos, tanto auricular como ventricular, se deberían tomar registros durante el evento, permitiendo ver criterios diagnósticos de TV, como la disociación AV. Si la condición del paciente no permite realizar el registro del ECG, se comenzará con maniobras de reanimación inmediatas, como desarrollaremos posteriormente.
El paciente con arritmias ventriculares sostenidas y disfunción ventricular tiene peor pronóstico a corto y largo plazo, con una mortalidad hospitalaria de hasta el 50%. De los que sobreviven, el 40% presentan recurrencia arrítmica y el 20% morirá a los 24 meses, de causa cardiovascular7.
b.1. Tratamiento
El tratamiento indicado y más efectivo en situación aguda para las arritmias ventriculares es la cardioversión y/o desfibrilación eléctrica. Esta será la estrategia inicial ante cualquier paciente con repercusión hemodinámica vinculada a una taquicardia en el POCC independientemente del origen de la arritmia.
El uso de drogas y de sobreestimulación ventricular con marcapaso epimiocárdico se reserva para pacientes hemodinámicamente estables.
Como hemos analizado previamente, debemos descartar causas desencadenantes y/o de mantenimiento de las arritmias en el POCC, como son las alteraciones del medio interno, electrolíticas, la isquemia o las complicaciones mecánicas de la cirugía.
Los fármacos antiarrítmicos son un grupo heterogéneo que se utilizan con el objetivo de aliviar los síntomas y evitar complicaciones producidas por las arritmias. Buscan suprimirlas, controlar su frecuencia y/o prevenir su recurrencia, con el objetivo de prolongar la supervivencia y reducir el riesgo de muerte súbita.
Sin embargo, debe resaltarse que no solo son poco efectivos para controlar el ritmo cardíaco, sino que pueden producir importantes reacciones adversas graves, tanto cardíacas como extra-cardíacas y, en ocasiones, inducir o perpetuar arritmias (efecto conocido como proarritmia farmacológica). El riesgo de proarritmia potencialmente letal aumenta en el tratamiento crónico y en pacientes con cardiopatía estructural. Además, en la mayoría de los casos desconocemos los mecanismos implicados en la génesis y/o mantenimiento de las arritmias, por lo que el tratamiento antiarrítmico es empírico.
Drogas antiarrítmicas más comúnmente utilizadas en el posoperatorio de cirugía cardíaca
a. Amiodarona
Antiarrítmico de clase III (prolonga el potencial de acción y el período refractario de los tejidos cardíacos). Es el fármaco más utilizado en nuestro medio como primera línea. Es un derivado yodado que presenta múltiples mecanismos de acción, ya que bloquea canales de sodio, potasio y calcio. Presenta propiedades farmacológicas de todos los grupos antiarrítmicos. Por sus características, presenta múltiples efectos colaterales, tanto en su uso agudo como a largo plazo. Los efectos adversos son múltiples en la esfera digestiva, neurológica, ocular, tiroidea, renal y pulmonar. A nivel cardiovascular, los efectos adversos son hipotensión arterial en la administración intravenosa (IV), bradicardia, bloqueo aurículo-ventricular, insuficiencia cardíaca y arritmias ventriculares. Sin embargo, produce menos efectos proarrítmicos y torsade de pointes (menor al 1%), que otros antiarrítmicos.
La administración inicial se realiza por vía IV en infusión de 300 mg (5-7 mg/kg, ampollas de 150 mg) en solución de dextrosa al 5%, en 30 a 120 minutos. Posteriormente se puede indicar en infusión continua 10-20 mg/kg/día con límite diario de 1.500 mg29.
La administración IV directa en al menos tres minutos debe limitarse a las situaciones de emergencia cuando las demás alternativas terapéuticas hayan fracasado, como es el caso de la resucitación cardio-pulmonar en el tratamiento de la FV resistente a la desfibrilación.
b. Lidocaína
Antiarrítmico de clase Ib. Es un bloqueante puro de los canales de sodio en su estado inactivo, prolongando su reactivación. A concentraciones terapéuticas no modifica la frecuencia sinusal, la velocidad de conducción o los períodos refractarios (no modifica el QRS). Sin embargo, suprime el automatismo anormal, el automatismo del sistema de His-Purkinje y los post-potenciales tempranos y tardíos.
En el ventrículo isquémico predominan los canales de sodio inactivos, por lo que la lidocaína tiene alta afinidad, deprimiendo la velocidad de conducción y suprimiendo eficazmente la TV y EV. Su mecanismo de acción acorta el potencial de acción y el período refractario ventricular, logrando una repolarización ventricular más homogénea previniendo así las reentradas.
Los efectos adversos más comunes son neurológicos (mareo, temblor, visión borrosa, confusión, vértigo, somnolencia, desorientación y disartria), a dosis elevadas puede causar convulsiones. A nivel cardiovascular puede causar bradicardia, bloqueo, hipotensión ensanchamiento del QRS y proarritmia. La lidocaína es el fármaco antiarrítmico que menos deprime la contractilidad cardíaca.
Frecuentemente usada como primera línea en tratamiento de TV y FV asociadas a cardiopatía isquémica, a cirugía cardíaca y a la intoxicación digitálica (aunque con eficacia discutida). La dosis recomendada es de 0,5-1,5 mg/kg en bolo y en infusión continua de 1-4 mg/minuto durante 24 a 48 horas29).
c. Procainamida
Antiarrítmico de clase Ia. Presenta alta afinidad por el estado activo de los canales de sodio prolongando la reactivación. Además, deprime la contractilidad cardíaca y la conducción a través de nodo aurículo-ventricular por bloquear la corriente I de calcio y prolonga la repolarización, ya que actúa bloqueando diversos canales de potasio enlenteciendo su salida. Disminuye el automatismo sinusal y de los marcapasos ectópicos ventriculares. En infusión, en más del 50% de los pacientes sufren hipotensión. Puede producir bloqueo aurículo-ventricular, ensanchamiento del QRS y prolongar el QT, que obliguen a su suspensión.
La procainamida no puede ser usada de forma crónica, ya que el 80% de los pacientes desarrollan a cabo de 6 meses anticuerpos antinucleares y el 20% síndrome tipo lupus eritematoso.
El estudio PROCAMIO es el primer ensayo aleatorizado en evaluar en la vida real, el uso de procainamida y amiodarona en pacientes con taquicardia de QRS ancho bien tolerada, presumiblemente TV (en un análisis posterior de los trazados por parte de dos electrofisiólogos se catalogó como tal el 90%). Este trabajo consiguió establecer, en pacientes con o sin cardiopatía estructural, que la procainamida presenta menos efectos adversos mayores que la amiodarona. Los autores, sin embargo, reconocen una mayor tasa de eventos con amiodarona respecto a los datos disponibles en la literatura. La procainamida es claramente más eficaz que la amiodarona para cardiovertir la taquicardia de QRS ancho, con un 67% de éxito a los 14 ± 10 minutos de iniciada la perfusión, siendo este dato concordante con los escasos trabajos disponibles sobre el fármaco en este contexto clínico30.
La procainamida se encuentra disponible en nuestro medio. Dado los resultados de este ensayo debería ser difundida y utilizada de forma más frecuente.
La dosis recomendada intravenosa directa es 7-10 mg/kg, para evitar hipotensión la dosis no debe superar 50 mg/min con una dosis máxima a administrar de 1 gramo. La dosis de mantenimiento es de 2-6 mg/min, la dilución se realiza en suero fisiológico.
d. Betabloqueantes
Antiarrítmicos de clase II, bloquean los receptores β -adrenérgicos, inhibiendo las acciones cardíacas de las catecolaminas. Se usan poco en el contexto agudo del POCC. Son fármacos versátiles que han demostrado mejorar la mortalidad cardiovascular en múltiples situaciones que debemos conocer y manejar adecuadamente. En este contexto del POCC pueden ser útiles en pacientes con tormenta arrítmica resistente a otros tratamientos. A largo plazo son los antiarrítmicos de elección en la prevención de la muerte súbita.
Estimulación
En paciente con TVMS lentas, bien toleradas y que presenta cables epicárdicos ventriculares, se pueden realizar ráfagas de estimulación para interrumpir la taquicardia. Se debe tener un cardiodesfibrilador rápidamente accesible ya que puede degenerar en TVMS con repercusión hemodinámica o FV. En portadores de TV polimórfica, la estimulación ventricular por encima de su ritmo basal puede ayudar homogenizar la repolarización y prevenir nuevos eventos arrítmicos.
Cardioversión eléctrica
La cardioversión eléctrica y la desfibrilación tienen indicación indudable en aquellos pacientes con FV y TV con repercusión hemodinámica, y constituyen también la primera línea en caso del paciente bajo sedación. En pacientes con TVMS y estabilidad hemodinámica deberá realizarse sedación previa a la maniobra y cuidados apropiados de la vía área. La dosis de energía recomendada en desfibriladores bifásicos es de 150-200 Julios31.
Paro cardíaco en el posoperatorio de cirugía cardíaca
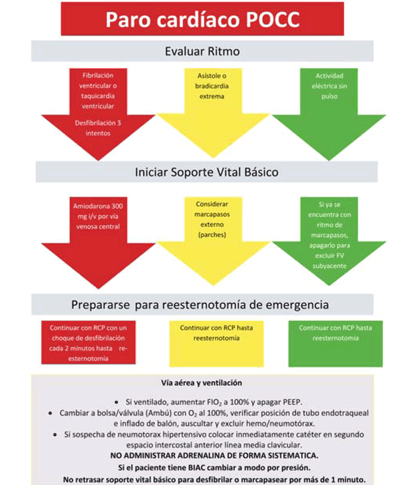
Es un evento singular donde la implementación de las pautas ACLS pueden generar daño. Están descritas guías específicas de reanimación para este grupo de pacientes, desarrolladas por la STS (Sociedad de Cirujanos Torácicos)27.
Cuando el paro cardíaco ocurre poco después de la cirugía cardíaca, las maniobras más importantes son la desfibrilación, marcapaseo y una rápida reesternotomía, que podrán restauran la circulación precozmente. El uso de epinefrina de forma sistemática puede no ser beneficioso, por lo que no se recomienda. Cuando el paro es inminente se podrán utilizar dosis reducidas de la misma (bolos 50-300 g): los pacientes que respondan a estas dosis orientan a un problema médico, los que no respondan orientarán a una alteración quirúrgica, por lo cual el objetivo es la reesternotomía precoz que podrá resolver el problema. Se podrá considerar la reconexión a circulación extracorpórea en aquellos que no respondan a las medidas convencionales. Los pasos de actuación se describen en la (figura 1).
Manejo electrofisiológico: cardiodesfibrilador implantable, ablación y fármacos a largo plazo
Un agresivo manejo desde el punto vista electrofisiológico a corto y largo plazo es fundamental para mejorar el pronóstico.
Aquellos pacientes que presentan TVMS/FV en el POCC sin causa reversible, deben ser evaluados para implante de cardiodesfibrilador (CDI) y/o realización de estudio electrofisiológico con eventual ablación del sustrato arrítmico.
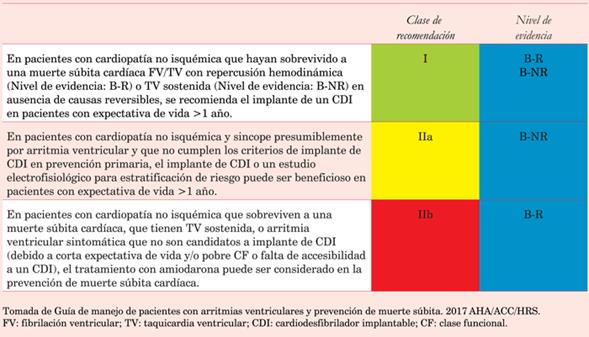
Los pacientes con compromiso de la fracción de eyección del ventrículo izquierdo (<35%) y signos/síntomas de insuficiencia cardíaca, deberán ser derivados para el implante de un CDI. Se describen las indicaciones actuales de CDI según las Guías AHA/ACC/HRS del 2017 para las arritmias ventriculares20(tabla 1), (tabla 2), (tabla 3), (tabla 4).
Tabla 1: Indicación de implante de cardiodesfibrilador en prevención primaria de muerte súbita cardíaca en cardiopatía isquémica.
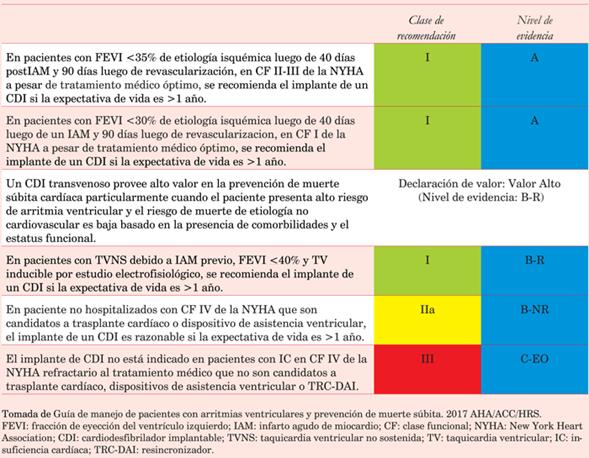
Tabla 2: Indicación de implante de cardiodesfibrilador en prevención secundaria de muerte súbita cardíaca en cardiopatía isquémica.
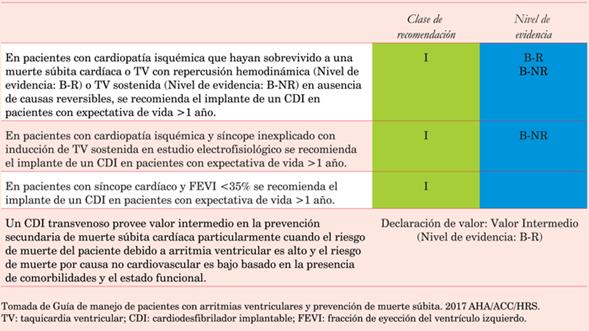
Tabla 3: Indicación de implante de cardiodesfibrilador en prevención primaria de muerte súbita cardíaca en cardiopatía no isquémica.
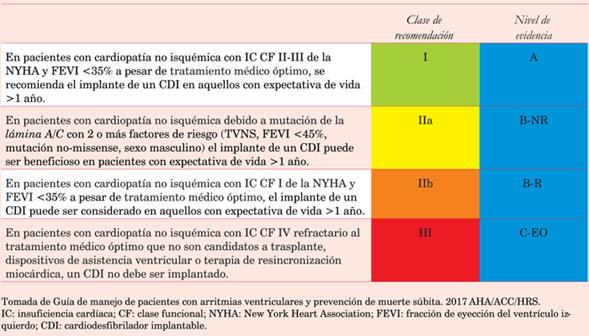
Tabla 4: Indicación de implante de cardiodesfibrilador en prevención secundaria de muerte súbita cardíaca en cardiopatía no isquémica.
La ablación por catéter siempre es una opción terapéutica a tener en cuenta en pacientes con taquicardias ventriculares o EV que desencadenan TV polimórfica o FV cuando estas arritmias no responden a tratamiento convencional con antiarrítmicos, aunque en el contexto del POCC es excepcional la realización de este procedimiento, no debemos olvidar que esta herramienta se encuentra disponible en nuestro medio.
A largo plazo el tratamiento farmacológico adecuado para cada situación clínica será fundamental. Se debe manejar el arsenal terapéutico disponible con probada mejoría en la sobrevida y prevención de muerte súbita como son los bloqueadores beta, inhibidores del eje renina-angiotensina, antagonistas de la aldosterona, inhibidor de la neprilisina asociado a antagonista de angiotensina (sacubitrilo-valsartán), estatinas e inhibidores del cotransportador de sodio-glucosa tipo 2 (dapagliflozina y empagliflozina).
Lamentablemente, otros antiarrítmicos no han mejorado la sobrevida de los pacientes a largo plazo.
Conclusiones
Las arritmias ventriculares sostenidas en el POCC, aunque se presentan en baja frecuencia, son una complicación grave que aumenta la morbi-mortalidad, alargan la estancia en cuidados intensivos y aumentan los costos en salud.
La evidencia del tratamiento en este contexto es escasa. Actuar de forma rápida, identificando causas secundarias, así como el manejo adecuado del arsenal terapéutico para cada situación, nos permite mejorar la sobrevida de los pacientes.