Introducción
Durante largo tiempo se consideró que el corazón estaba fuera del ámbito accesible a la cirugía. En 1896 Stephen Paget escribió: “La cirugía cardíaca (CC) ha alcanzado los límites marcados por la naturaleza; ninguna nueva técnica o descubrimiento puede superar las dificultades naturales que ofrece reparar una afección cardíaca”1. Sin embargo, los avances en este campo han sido continuos y extraordinarios, y el 20 de mayo de 1953 el doctor John H. Gibbon Jr., realiza la primera CC (cierre septal auricular) con circulación extracorpórea (CEC)2. Este logro técnico permitió resolver una diversidad de patologías que previamente implicaban una evolución inexorablemente adversa, pero también generó desafíos derivados de las profundas modificaciones fisiológicas que transitoriamente desencadena, entre las cuales se incluye la de la hemostasia.
En Uruguay se realizan aproximadamente 2.500 CC por año3. El sangrado en el posoperatorio de estos pacientes no es infrecuente, y puede abarcar desde un sangrado insignificante que no requiere tratamiento específico, a una hemorragia severa con necesidad de implementar diversas estrategias. Se han desarrollado guías de manejo y protocolos para el pre, intra y posoperatorio, buscando mejorar el manejo de estos pacientes.
La presente revisión tiene como objetivo analizar los mecanismos subyacentes al sangrado y actualizar intervenciones destinadas a prevenir y tratar esta complicación. Se tratará el manejo rutinario en la evaluación de riesgos, prevención, monitorización de la hemostasis y tratamiento del sangrado en el paciente habitual, sin incluir el análisis de conductas y situaciones especiales que serán motivo de consideración futura (cirugía pediátrica, coagulopatías prexistentes, síndrome de Heyde, testigos de Jehová, etcétera).
Manejo de la hemostasia
Es necesario considerar: a) factores predictores de sangrado y requerimientos de hemoderivados en CC; b) peculiaridades de la coagulopatía asociada a la CEC; c) sistemas de monitorización de la hemostasia disponibles; y d) propuestas de manejo de la hemorragia asociada a la CC y su reposición.
Para ello abordaremos cinco puntos:
1. Valoración preoperatoria del riesgo de sangrado.
2. Coagulopatía asociada a la CEC
3. Profilaxis del sangrado.
4. Sistemas de monitorización de la hemostasia en CC.
5. Terapéutica del sangrado.
1. Valoración preoperatoria del riesgo de sangrado
Se han identificado varios factores de riesgo de sangrado en el período preoperatorio (tabla 1).
Tabla 1: Factores de riesgo asociados a sangrado o transfusión sanguínea durante o después de cirugía cardíaca. Modificado de 4.
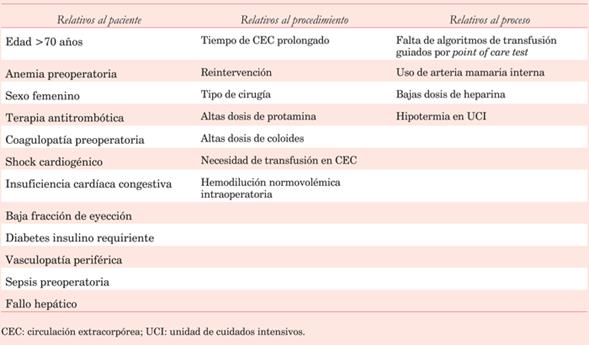
Destacan los pacientes >70 años, con volumen sanguíneo reducido (baja superficie corporal, anemia o ambos), cirugías de emergencia o complejas (reintervenciones, cirugías no coronarias, cirugías sobre aorta, endocarditis).
Con respecto al tipo de cirugía y en orden descendente existe mayor riesgo en la patología de aorta ascendente, CC combinada (valvular y coronaria), valvular aislada y finalmente coronaria pura.
Tanto la identificación de estos factores como la implementación de medidas de conservación de sangre, la corrección de la anemia preoperatoria, el uso de fármacos antifibrinolíticos, recuperadores de sangre y algoritmos de transfusión guiados por monitorización de la hemostasia en block quirúrgico, tienen un nivel de evidencia A para mejorar la evolución y disminución del sangrado4.
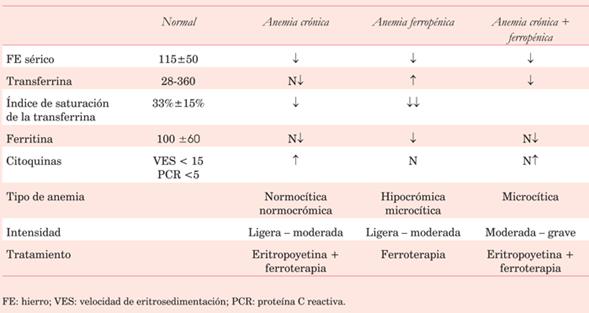
1.a Anemia preoperatoria
Está asociada a mayor mortalidad perioperatoria y aumento de la probabilidad de transfusiones5,6. Se debe evitar llegar a cirugía con dosificaciones de hemoglobina (Hb) <10 g/dl, que constituye un predictor de injuria renal, daño neurológico, sangrado y disfunción plaquetaria.
En la tercera parte de los pacientes anémicos >65 años, la principal etiología es el déficit fundamentalmente de hierro, pero también de vitamina B12 o folatos. Otro tercio es secundario a causas inflamatorias crónicas o enfermedad renal y el resto es de causa desconocida. Investigar su causa y corregirla en la medida de lo posible antes de la cirugía debe ser nuestro objetivo.
Con niveles de Hb <12 g/dl en mujeres y 13 g/dl en hombres se considera útil analizar los parámetros hematimétricos, poniendo énfasis en el volumen corpuscular medio, metabolismo de hierro y en caso de necesidad, titular vitamina B12, ácido fólico y perfil inflamatorio (proteína C reactiva y VES).
Estos valores establecen un diagnóstico diferencial, permitiendo un tratamiento apropiado (tabla 2).
El tratamiento de la anemia ferropénica con hierro intravenoso es de elección sobre la vía oral en la población quirúrgica. Si bien el aporte de hierro se calcula mediante la fórmula de Ganzoni (Déficit total de hierro = peso (Kg) x Hb deseada-Hb actual (g/dl) x 2,4 + 500), una infusión preoperatoria de hierro-sacarosa de 200 mg cada 48h hasta totalizar 1000 mg recupera la anemia en el 58% de los pacientes y puede aumentar la Hb en 1-2 g/dl. El compuesto hierro-carboximaltosa permite dar la dosis total del déficit calculado en una sola administración.
La anemia ferropénica se puede presentar aislada en pacientes con insuficiencia cardíaca congestiva (ICC) o asociada al síndrome cardiorrenal (anemia, ICC y enfermedad renal crónica (ERC)). En estos pacientes el tratamiento con eritropoyetina recombinante humana (EPO) puede mejorar la capacidad funcional, sin mayor mortalidad ni efectos adversos7. Se considera razonable tratar con EPO y hierro una semana antes de la CC a los pacientes con anemia preoperatoria, los de alto riesgo de sangrado y los que rechazan los hemocomponentes (indicación clase IIa). Como contraindicaciones de EPO se incluyen cardiopatía isquémica inestable y arteriopatía grave4. El predepósito de sangre autóloga, si bien es posible en pacientes seleccionados, es difícilmente practicable, ya que se necesita una logística especial en los servicios de hemoterapia, con la cual no contamos en la actualidad.
1.b Tratamiento antiagregante y anticoagulante
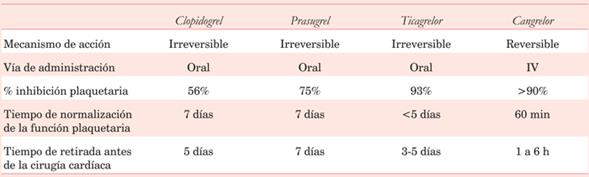
La mayoría de los pacientes que requieren una cirugía coronaria están en tratamiento crónico con ácido acetilsalicílico (AAS). Los pacientes que cursan un síndrome coronario agudo (SCA) pueden estar recibiendo doble antiagregación (AAS y clopidogrel/prasugrel/ticagrelor). Aproximadamente un 10% -15% de éstos, requerirán cirugía de urgencia. Las guías actuales8 recomiendan:
- Todo paciente que tiene indicación de AAS, debe continuar recibiéndola hasta el día de la cirugía, salvo aquellos con riesgo de sangrado muy significativo (antecedentes heredo-familiares de coagulopatías, ERC, testigos de Jehová, cirróticos o que hayan recibido fibrinolíticos en los días previos) en los que se valora la suspensión cinco días antes.
- Suspender clopidogrel/prasugrel como mínimo cinco días antes; óptimo siete días.
- Cirugía de urgencia o emergencia en pacientes portadores de stents farmacoactivos implantados seis meses antes (o seis semanas en los convencionales) no suspender la doble antiagregación, asumiendo un mayor riesgo de sangrado9.
En la (tabla 3) se muestran las características de los antiagregantes de uso habitual.
Inhibidores de la glucoproteína IIb IIIa
Con el uso de tirofiban el 90% de la función plaquetaria se recupera a las 4-8 h; debe suspenderse por lo menos 4 h pre CC. Con respecto al eptifibatide, se recupera entre el 50%-80% de la función plaquetaria tras las 4 h de suspensión. El abciximab, con una vida media de más de 12 h, obligaría a retrasar la cirugía al menos 48 h.
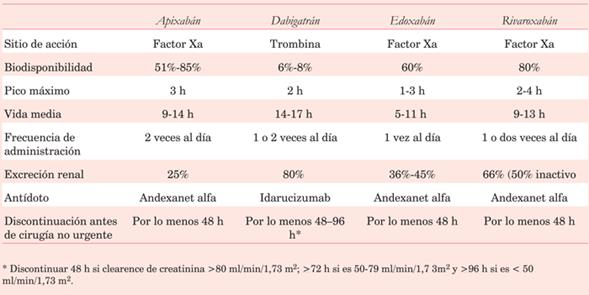
Respecto al tratamiento anticoagulante oral, tiene especial interés el manejo de los fármacos antivitamina K en situaciones de urgencia. Se debe suspender el medicamento y administrar vitamina K 5-10 mg IV. En caso de emergencia, (trasplante cardíaco, disección de aorta) se requiere reposición con plasma fresco congelado y/o complejo protrombínico (indicación clase I, nivel de evidencia C)10 La dosis única de complejo protrombínico se administra si INR >3, 30 U/kg; y si INR <3, 10 U/kg. Los anticoagulantes orales directos deben suspenderse al menos 48 h antes de la cirugía (tabla 4). Respecto a los test básicos de la coagulación: dabigatrán altera el tiempo de trombina, mientras que rivaroxabán, apixabán y todos los compuestos anti-X, pueden alterar el tiempo de protrombina. La determinación de su concentración plasmática (no disponible en nuestro medio) permite realizar la cirugía cuando es <30 ng/ml, y sería necesario posponerla 12 h frente a concentraciones de 30-200 ng/ml y 24 h entre 200-400 ng/ml.
En caso de recibir heparina de bajo peso molecular (HBPM) se aconseja su suspensión entre 18-24 h antes de la CC. Con la heparina no fraccionada (HNF) 4 h es suficiente, si bien en pacientes de riesgo isquémico elevado se puede mantener hasta la llegada a block.
2. Hemostasia y coagulopatía asociada a la circulación extracorpórea
La CEC experimentó desde 1953 hasta la fecha un notable avance gracias al cual hoy se pueden realizar prácticamente todos los procedimientos quirúrgicos sobre el corazón. Tiene como finalidad perfundir y proteger los órganos, manteniendo un aporte de sangre y oxígeno a los tejidos durante el periodo de reparación quirúrgica donde es necesario remplazar parcial o totalmente las funciones cardíaca y pulmonar en forma temporaria. Como contrapartida, es profundamente antifisiológica por los siguientes cambios:
1. La sangre entra en contacto con superficies extrañas al endotelio.
2. Se excluyen los pulmones y el corazón del circuito, con lo cual se eliminan las funciones metabólicas y de filtro, y se compromete su autorregulación.
3. Cambio de flujo pulsátil a flujo continuo.
4. Cambios agudos de temperatura (normotermia, hipotermia).
5. Hemodilución.
6. Uso de anticoagulantes sistémicos y su reversión.
Todas estas modificaciones llevan a que el paciente bajo CEC se someta a riesgos y complicaciones como embolias, trastornos de la coagulación, alteraciones de la inmunidad, activación del sistema de respuesta inflamatoria y respuesta neuroendócrina11. Los trastornos de la hemostasia se producen a todos los niveles, pero los más relevantes son sobre las plaquetas, las cuales disminuyen durante la CEC en cantidad por destrucción, hemodilución, secuestro, y en su capacidad funcional.
El circuito de CEC necesita ser cebado con soluciones electrolíticas para evitar embolia aérea. El volumen de este cebado es generalmente 30% el de la volemia de un adulto.
Una hemodilución leve reduce la viscosidad de la sangre e incrementa el flujo cerebral. Sin embargo hemodiluciones moderadas a severas pueden resultar en disminución de transporte de oxígeno e isquemia tisular. El valor de hematocrito aceptable varía entre 18%-30%, dependiendo de la edad, comorbilidades y tipo de procedimiento. Los daños potenciales de la hemodilución han sido exhaustivamente estudiados12,48, con evidencia de que un valor medio por debajo de 25% se asocia a mayor morbilidad. Existen diversas estrategias para el manejo de la anemia intraoperatoria (figura 1).

Figura 1: Estrategias para disminuir la anemia intraoperatoria. Modificado de24. EPO: eritropoyetina; Fe: hierro
En conclusión: una anemia moderada con hematocrito entre 21%- 25% es generalmente bien tolerada en la mayoría de los pacientes sometidos a CC con CEC, mientras que la anemia severa por hemodilución puede asociarse con daño orgánico, particularmente en los pacientes añosos.
La disminución del número de plaquetas secundaria a la hemodilución asociada a la CEC suele ser del 30%-50%. La trombina, la plasmina, el ADP liberado por los hematíes dañados en la CEC y la heparina, son potentes estímulos para la activación plaquetaria. La hipotermia contribuye a la disfunción, dado que enlentece la actividad enzimática de la coagulación, disminuye la síntesis de factores, altera la función plaquetaria e induce fibrinólisis13,14).
La trombocitopenia y la disfunción plaquetaria se consideran la principal anormalidad responsable del sangrado luego de CC con CEC15,16,17. Tradicionalmente se consideraba la activación de la coagulación a través de los factores de contacto, pero también se estimula la formación de trombina por la generación y activación de mediadores inflamatorios que favorecen la expresión sistémica del factor tisular18. Todas estas alteraciones son dependientes del tiempo de CEC: a mayor duración, mayor disfunción19. Una vez realizada la corrección quirúrgica y finalizada la CEC, debe neutralizarse la actividad de la heparina mediante la utilización de sulfato de protamina.
Esta reversión no está exenta de riesgos; puede producir reacciones que van desde hipotensión leve, disminución del inotropismo y liberación de histamina, hasta una vasoconstricción pulmonar severa con riesgo vital, efectos poco frecuentes y relacionados con la exposición previa y con la velocidad de administración del fármaco20.
La respuesta inflamatoria es el resultado de la actuación sinérgica de los tres grandes sistemas humorales de protección del organismo: sistema de coagulación (factor XII de Hageman), sistema de las cininas y sistema de activación del complemento. Esta respuesta es autolimitada y tiende a normalizarse en las primeras 12-24 h del posoperatorio, dependiendo del tiempo de clampeo aórtico, de CEC y del tipo de cirugía. Se pueden evidenciar dos fases, una inicial proinflamatoria con incremento en la actividad celular (leucocitosis de todas sus líneas celulares) con la consecuente degranulación y posterior disminución en la actividad de estas células. Esta fase está en íntima relación con el contacto de la sangre con superficies extrañas, activación del sistema del complemento, el sistema de calicreínas-fibrinólisis y el sistema de la coagulación. Se genera una respuesta difusa con elevación marcada del complemento, principalmente las anafilotoxinas C3a y C5a21, lo cual lleva a activación, migración y degranulación de los polimorfonucleares (PMN), activación de linfocitos T y B, y producción de interleukinas (IL)22, específicamente IL 1, IL 6 e IL 819. Es de destacar que los niveles pico de IL 6 se correlacionan con el grado de disfunción miocárdica y con el tiempo de clampeo23. Durante esta fase se observan las secuelas pulmonares que van desde hipoxemia leve hasta distrés respiratorio severo, síndrome de fuga capilar con incremento de la permeabilidad, lesión plaquetaria, hemólisis y fibrinólisis.
La segunda es la fase anérgica, donde hay una disminución de la respuesta inmunológica tanto humoral como celular. Las causas de la disminución de la inmunidad humoral (hemodilución, formación de macroagregados, disminución de la producción de anticuerpos, consumo en el oxigenador, desnaturalización de proteínas y migración intersticial por alteración de la permeabilidad capilar), llevan a una reducción de la actividad bactericida con descenso de la concentración de inmunoglobulinas, complemento y capacidad de opsonización22. La inmunidad celular se ve afectada por disfunción de los PMN, macrófagos y linfocitos tanto de la línea T como B, con la consecuente disminución fagocítica11. Esto aumenta el riesgo de infecciones, pues por un lado, se han roto las barreras naturales de protección (monitorización hemodinámica invasiva, sonda vesical, incisión quirúrgica, vía aérea) y por otro lado, se ha reducido la capacidad de respuesta. De un adecuado balance entre estas dos fases dependerá la recuperación o el daño de órganos. Es de resaltar que estas fases también se pueden encontrar en la cirugía sin CEC, aunque la respuesta inflamatoria es menor22, con menos producción de IL (figura 2).
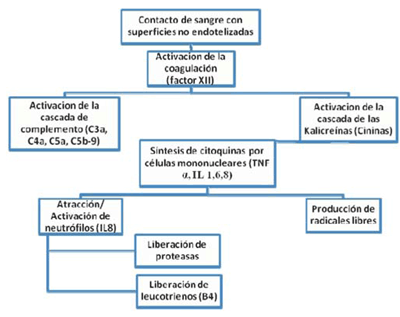
Figura 2: Mecanismo básico de la respuesta inflamatoria sistémica. Modificado de25. TNF: factor de necrosis tumoral; IL: interleuquina.
3. Profilaxis del sangrado
3.a Evitar el consumo de factores
Iniciar y mantener la anticoagulación durante la CEC es fundamental para proteger los factores y evitar la formación de trombos dentro del circuito extracorpóreo. En condiciones usuales sólo los factores II, V, VII y X disminuyen. La HNF es el fármaco de elección, debido a su rápido inicio de acción y por contar con un agente neutralizante. Se une con gran afinidad a la antitrombina III y potencia aproximadamente 1.000 veces su actividad. Las dosis recomendadas son 2-4 mg/kg (10 mg=1.000 UI) para alcanzar un tiempo de coagulación activado (TCA) >480 s. Existen sistemas sofisticados que permiten monitorizar la concentración de heparina circulante durante la CEC. La neutralización con sulfato de protamina se realiza con un ratio de 0,8-1,3 a 1. Se ha definido la resistencia a la heparina como la falta de respuesta adecuada después de una dosis estándar, aunque sin un adecuado consenso, por lo que sobre su frecuencia existe una variabilidad en la literatura entre 5%-60% de los pacientes intervenidos26. La HNF es casi exclusivamente utilizada para anticoagulación en CEC, pero el paciente expuesto anteriormente a heparina tiene riesgo de desarrollar anticuerpos contra el complejo heparina-factor 4 plaquetario (heparina-PF4). La administración de heparina en presencia de estos anticuerpos anti heparina-PF4 puede resultar en trombocitopenia inducida por heparina (TIH) o en una complicación más grave: el síndrome de trombosis y trombocitopenia inducida por heparina. En estos pacientes, de muy alto riesgo, existen alternativas al uso de heparina27. En nuestro medio no se han reportado dificultades para el mantenimiento de la anticoagulación en CEC.
Se deben considerar especialmente los pacientes >65 años, los portadores de trombocitosis, el uso preoperatorio de heparina y el déficit de antitrombina conocido. En caso de que el TCA con la dosis estándar no llegue a 300 s, en un paciente adulto se administran dos unidades de plasma fresco (con lo que se asegura el aporte de antitrombina III), se controla nuevamente el TCA y se procede a la entrada en CEC. Si bien las guías estadounidenses recomiendan la administración de concentrado de antitrombina, no se dispone en nuestro país de antitrombina comercial4.
3.b Controlar la fibrinólisis
La hiperfibrinólisis se desencadena por la activación de la coagulación al entrar en contacto la sangre con el circuito, por el activador tisular del plasminógeno inducido por niveles altos de bradicinina y por disminución de su inhibición; nuevamente aquí la hipotermia juega su rol favorecedor28. Tanto las guías europeas como estadounidenses4,29 hacen una indicación IA de los fármacos antifibrinolíticos como profilácticos para disminuir el sangrado, las transfusiones y la necesidad de reintervención en pacientes de CC.
Existen dos tipos de fármacos: a) inhibidores directos del plasminógeno: los análogos de la lisina, como el ácido tranexámico (Transamina®) y el ácido épsilon-amino-caproico (EACA) (Ipsilon®); y b) los inhibidores de la serinproteasa: aprotinina30-32. El ácido tranexámico es entre 5-10 veces más potente que EACA y tiene una vida media más larga. La aprotinina es un polipéptido extraído del pulmón bovino; inhibe tripsina, quimotripsina, plasmina, trombina y calicreína a través de la formación de complejos reversibles inhibidos por enzimas33.
En mayo de 2008 la FDA suspendió la licencia de la aprotinina en Estados Unidos, por lo que además se discontinuó su producción. Esto fue debido al resultado del estudio BART, que mostró aumento significativo de la mortalidad entre los pacientes que la recibieron34. Sin embargo, por su mayor potencia y sus propiedades antiinflamatorias, persiste el interés por este fármaco, y hay autores que sugieren que el perfil riesgo-beneficio en pacientes de alto riesgo es favorable35,36. Actualmente ha sido reaprobada en países europeos y en Canadá. Todavía no está disponible en Estados Unidos ni en nuestro medio.
La seguridad de los análogos de la lisina está menos estudiada. En Uruguay es más usada la transamina con respecto a EACA; su vida media es de 80 min, y se elimina en un 95% por vía renal. La principal complicación en el posoperatorio temprano son las convulsiones, y están relacionadas con dosis >100 mg/kg. Existen varios protocolos, desde 50 mg/kg previo a la incisión de la piel y similar dosis luego de la reversión de heparina a la salida de CEC, hasta una dosis de 12,5 mg/kg seguida de infusión continua de 6,5 mg/kg/hora + 1 mg/kg en el cebado de CEC, que según estudios farmacocinéticos proporciona una concentración plasmática de 345 micromoles/min, teniendo en cuenta la función renal.
Con respecto al EACA se realiza dosis carga en la inducción anestésica 1-15 g, manteniendo 1-2 g/h durante la cirugía. El efecto adverso más importante es la nefrotoxicidad.
4. Monitorización de la hemostasia peroperatoria
A pesar de los avances en los sistemas de monitorización de la hemostasia, estos no son buenos predictores de sangrado37. Es razonable que en el paciente “sangrante”, un rápido y preciso diagnóstico de las causas del sangrado oriente la indicación del tratamiento más eficaz y reduzca las necesidades de transfusión y el número de reintervenciones por sangrado.
Las pruebas de laboratorio tienen sus limitaciones:
a. Tiempo de proceso (30-45 min).
b. Recuento plaquetario: informa número pero no función.
c. El tiempo de protrombina y KPTT se realizan en plasma, detectan déficit de los factores pero no la interacción que in vivo tienen esos componentes plasmáticos con los celulares, finalizan con la producción de trombina antes de que la fibrina sea polimerizada por el factor XIIIa y de que el fibrinógeno establezca puentes entre las plaquetas a través de los receptores GPIIb-IIIa.
d. No aporta pruebas para detectar estados de hiperfibrinólisis.
e. En la determinación del fibrinógeno (método de Clauss) si se utiliza el método óptico puede estar sobrestimado por los productos de degradación de fibrinógeno, pigmentos biliares, Hb libre o elevada concentración lipídica, no así cuando se utiliza el método mecánico.
Para sortear algunas de estas limitaciones contamos con los sistemas de monitorización en la cabecera del paciente (point of care tests):
TCA: permite monitorizar la anticoagulación con heparina durante la CEC utilizando celite o caolín para acelerar el proceso, activando la vía de contacto. Tiene dos propósitos: a) asegurar la dosis de heparina necesaria para suprimir la actividad de la trombina; y b) detectar si hay heparina residual posterior a su neutralización con protamina. El valor del TCA se correlaciona linealmente con la concentración de heparina y los protocolos son de 3-4 mg/kg para conseguir un TCA entre 400-480 s. La respuesta a la heparina varía de un paciente a otro; tampoco hay un valor de TCA óptimo para mantener la anticoagulación adecuada durante la CEC. Hay condiciones que lo prolongan: hipotermia, hemodilución, trombocitopenia y trombocitopatías38.
Tromboelastografia (TEG) y tromboelastometría (ROTEM): utilizan tests dinámicos para evaluar las características del coágulo, basándose en la medición de la viscoelasticidad de una muestra de sangre entera después de activar la coagulación con un reactivo específico39. Analizan el cambio en las propiedades viscoelásticas durante la formación y lisis del coágulo. Según los reactivos utilizados se obtienen diferentes tests que en 10-20 min informan la presencia o ausencia de coagulopatía y de su causa. Permiten detectar los efectos de la hemodilución sobre la firmeza del coágulo y la disfunción plaquetaria no secundaria a fármacos40. Son el patrón de referencia en el diagnóstico de la hiperfibrinólisis, con un alto valor predictivo negativo41. Si bien son point of care tests y hay reactivos que permiten realizar pruebas durante la CEC, también es cierto que existen limitaciones técnicas y curvas de aprendizaje42. Desde hace varios años existe bibliografía que avala la introducción de esta monitorización y su combinación con algoritmos transfusionales en el manejo del sangrado peroperatorio de CC para reducir la tasa de transfusiones, resultando costo-efectiva43-45. El sistema ROTEM ha presentado un nuevo módulo que se puede incorporar al dispositivo y permite además el análisis simultáneo de la agregación plaquetaria utilizando agregometría de impedancia46.
5. Objetivos terapéuticos en el sangrado masivo
En los pacientes sometidos a CC el sangrado es un evento común. Aproximadamente 10% de ellos presentan sangrado severo y cerca de 5% requieren reintervención47,48.
Hay evidencia de que tener menor sangrado mejora los resultados y evita transfusiones, lo que se asocia con disminución en la morbilidad posoperatoria, incluyendo menos infecciones, fibrilación auricular, complicaciones respiratorias, injuria renal aguda y disminución de mortalidad a corto y largo plazo49,50.
El sangrado es, por tanto, un importante indicador de resultado en estudios randomizados, pero a diferencia de otras complicaciones, como injuria renal, infarto de miocardio o eventos neurológicos, no existe una definición estandarizada de sangrado posoperatorio, lo que dificulta la interpretación y posterior tratamiento. Es por tanto importante tener una definición más precisa de entidad de sangrado.
5.a Definición de sangrado excesivo en el peroperatorio de cirugía cardíaca
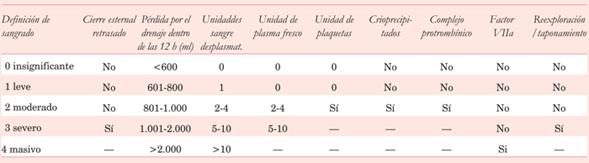
En 2014 se propuso por un comité de expertos47 el uso de una definición universal de sangrado perioperatorio en CC de adulto para estandarizar la nomenclatura, mejorar las definiciones y ayudar en trabajos futuros. Usando solo parámetros clínicos relevantes, se crea un sistema de cinco clases que puede ser aplicado tanto en la práctica diaria como en investigaciones clínicas. Es un instrumento en la mejora de la calidad, y una herramienta útil para proponer, evaluar e implementar soluciones adaptadas a cada centro, para reducir el sangrado y las necesidades de transfusión. Está basado en siete eventos que ocurren en la cirugía o en el primer día de posoperatorio (tabla 5).
1.Cierre esternal retrasado. Identifica a aquellos pacientes con sangrado intraoperatorio severo y refractario, que abandonan el block quirúrgico con packing de compresas como coadyuvante hemostático.
2.Gasto por el tubo de drenaje. Usado de rutina en la práctica clínica, ha sido adoptado como medida en trabajos de investigación, con sus limitaciones. Se inicia con el cierre esternal y se contabiliza durante las primeras 12 h, ya que refleja eventos tempranos y excluye la etapa intraoperatoria.
3.Transfusión de hemocomponentes. Si bien no mide directamente el sangrado y hay amplia variabilidad en las indicaciones de transfusiones, existe relación con la magnitud del sangrado. Se contabilizan las transfusiones que se realizan después del cierre esternal. El mismo criterio se utiliza para el uso de plaquetas, plasma fresco congelado y crioprecipitados.
4.Uso de crioprecipitados. Al ser el fibrinógeno el primer factor en consumirse durante la activación de la coagulación y si bien su disponibilidad y uso varía en diferentes regiones, es un marcador relevante de sangrado significativo.
5.Uso de concentrado de factores. Complejo protrombínico y fibrinógeno comercial. Si es necesario su uso, por lo menos se trata de un sangrado moderado o clase 2.
6.Uso de factor VIIa. Indicado en sangrado refractario que pone en riesgo la vida. Sabemos que en principio debe ser evitado por el riesgo de complicaciones tromboembólicas, limitando su uso a situaciones en las que otras opciones terapéuticas han fallado51.
7.Reintervención. Técnica de rescate común cuando no se logra contener el sangrado, aunque no inocua ni exenta de efectos adversos. Es, por sí misma, una medida de que el sangrado es severo52 (tabla 5). Puede ocurrir en forma precoz o tardía, y es un indicador de calidad del procedimiento quirúrgico35,53,54.
Esta clasificación ha probado su eficacia como herramienta descriptiva y en la predicción de resultados clínicos. La clase de sangrado (0-4) se asocia a diferentes porcentajes de mortalidad. En dos tercios de los pacientes cursando un posoperatorio CC es insignificante o leve, con baja mortalidad, sin diferencia en la mortalidad entre sangrado insignificante y leve. El sangrado moderado sí tiene un incremento en la mortalidad, mayor aún en las categorías de sangrado severo y masivo. Por lo tanto, los esfuerzos para transformar un porcentaje de pacientes de sangrado moderado a insignificante o leve son de beneficio. Los efectos sobre la estadía en terapia intensiva o el tiempo de extubación de los pacientes merecen más estudios.
La evolución en las primeras 24 h del posoperatorio es crucial desde el punto de vista del sangrado, tomando importancia el ritmo en las primeras horas, que pasa a ser uno de los indicadores clave para la reintervención, ya que cuanto más prolongado es el sangrado, más se agrava una potencial o manifiesta coagulopatía.
Si bien según los autores hay varias reglas a seguir para catalogar un sangrado excesivo, pueden considerarse los criterios mencionados en la (tabla 6).
De acuerdo a esta cuantía hay que valorar la posibilidad de reexploración, así como si hay sospecha clínica aunque el gasto por los drenajes sea escaso. Esta sospecha clínica debe plantearse ante un paciente con taquicardia, hipotensión, aumento de la presión venosa central, cese abrupto del gasto por los drenajes, alteraciones en los tests de hemostasis que no mejoran y acidosis persistente, lo que conduce a una deuda de oxígeno y shock. Como corolario, la necesidad de reexploración no la decide aisladamente ningún estudio de coagulación, ni tampoco si se trata de un sangrado médico o quirúrgico.
5.b Detener la hemorragia
Confirmar o descartar coagulopatía para decidir reintervenir o indicar el producto sanguíneo a transfundir.
5.c Mantener la perfusión y la oxigenación tisular
Restaurar el volumen sanguíneo con cristaloides isotónicos y suero salino hipertónico, teniendo la precaución de no incrementar la coagulopatía por hemodilución. Considerar el uso de hipotensión permisiva (PAM 50 mmHg). Contemplar el uso de vasoconstrictores para mantener la presión arterial después de la administración de fluidos. Mantener la oxigenación tisular con niveles de Hb entre 7-9 g/dl mediante la administración de sangre desplasmatizada.
5.d Uso de fármacos en forma empírica
Desmopresina en dosis de 3 μg/kg. Solo tiene indicación profiláctica en pacientes con enfermedad renal crónica y en la enfermedad de Von Willebrand (indicación IIa). Se puede repetir a las 2 h.
5.e Corregir la coagulopatía
Reponer factores de la coagulación y plaquetas con el uso racional de componentes sanguíneos y fármacos pro hemostáticos.
Sangre desplasmatizada. Es una indicación I evidencia B transfundir en base a las condiciones clínicas del paciente en vez de utilizar un nivel fijo de hemoglobina55,56. Las guías más recientes (EACTS y EACTA) proponen reponer con niveles <7,5 g/dl, lo cual es clínicamente razonable, práctico y aceptado en la mayoría de los centros. Hay evidencia de que la fecha de caducidad de la sangre transfundida no afecta la mortalidad, los eventos adversos ni las infecciones nosocomiales57-59.
La leucorreducción de la sangre desplasmatizada es un procedimiento estándar en Europa, no así en Latinoamérica. Si bien no hay diferencias en mortalidad, existe indicación I evidencia B para reducir las complicaciones infecciosas. Se asume que los monocitos alogénicos son la causa de la inmunomodulación, así como péptidos antigénicos leucocitarios y mediadores solubles que se transfunden sobre todo con la sangre desplasmatizada60. La inmunomodulación se ha asociado a aumento de morbimortalidad en CC y a un aumento del riesgo de infecciones61,62.
En nuestro país en la mayoría de los centros la desleucotización se realiza en el momento de la transfusión y no todas las unidades se transfunden desleucotizadas, ya que su uso estaría indicado además en pacientes que presenten reacciones de escalofrío-hipertermia por anticuerpos antileucocitarios; en prevención de la aloinmunización por anticuerpos leucoplaquetarios y como alternativa a productos citomegalovirus negativos. Las transfusiones de sangre recuperada del campo operatorio son recomendadas y están asociadas con disminución de la anemia y menos unidades de sangre transfundidas, así como menor riesgo de complicaciones pulmonares posoperatorias63.
Concentrados plaquetarios (de pool de donantes o de donante único). No hay estudios concluyentes que muestren a un valor de recuento plaquetario o un estudio funcional que identifique el umbral para indicar su reposición ni que ésta sea la principal estrategia para disminuir o detener el sangrado microvascular. A pesar de ello, un recuento <50.000/mm3 es un valor recomendado luego de la neutralización de la protamina, y de preferencia luego del cierre del esternón (indicación IIa evidencia C)64. Si hay antecedentes de consumo de antiagregantes plaquetarios (inhibidores P2Y12), los tests de función plaquetaria no están disponibles en la urgencia.
En este caso se administra desmopresina en dosis de 0,3 g/kg en 100ml de suero fisiológico en 30 minutos. Para el ticagrelor administrado en las12h previas, la transfusión de plaquetas es inefectiva65,66. En otros medios existe el CytoSorb®, dispositivo que absorbe el ticagrelor y el rivaroxaban; se acopla al circuito de CEC.
Plasma fresco congelado. No hay evidencia para el uso de este hemocomponente en forma preventiva67. En las últimas guías especializadas existe una tendencia a recomendar el uso de complejo protrombínico para la corrección de los factores específicos de la coagulación diagnosticados por point of care test o por el laboratorio en pacientes sangrantes en lugar de plasma fresco68. No existe evidencia de que su uso profiláctico o terapéutico disminuya el sangrado en el posoperatorio de CC. Como conlleva los efectos secundarios de los hemocomponentes es una indicación IIb; puede ser usado en caso de sangrado posoperatorio67-69. Su uso es adecuado cuando está aumentado el tiempo de protrombina. También con KPTT prolongado, lo que está indicando un problema en el componente intrínseco de la coagulación o persistencia de heparina circulante.
Crioprecipitados. Actualmente no están disponibles en la mayoría de los países europeos. En Uruguay, si bien ha disminuido su producción ya que los principales requirientes son los pacientes hemofílicos y se tratan con factor VIII o IX comercial, aún existe disponibilidad en los servicios de hemoterapia. Puede ser usado a una dosis de 1 Unidad cada 10 kg de peso. Su indicación es el déficit de fibrinógeno. Como dijimos, es el primer factor que se consume en la coagulación y deberá ser repuesto en un paciente sangrando cuando este sea <1,5-2 g/l. Las dosis iniciales de fibrinógeno comercial (Haemocomplettan®) son de 25-50 mg/kg de peso46.
Si bien inicialmente los resultados fueron promisorios, se han publicado resultados contradictorios con respecto a sangrado y tasa de transfusiones70. Contrariamente, en Estados Unidos está considerado off-label (fuera de indicación aprobada), por lo que no está disponible en muchos centros.
Efecto rebote de heparina. Es descrito como el restablecimiento de un estado de heparinización después de haber revertido la heparina. Ocurre por una rápida distribución y aclaramiento de la protamina que lleva a la desunión con la heparina. También hay liberación de heparina de tejidos considerados sitios de almacenamiento (endotelio y tejido conectivo). Puede presentarse hasta seis horas después de finalizada la cirugía, y se detectan mediante el aumento de TCA y/o KPTT.
Control del efecto de los nuevos anticoagulantes:
Dabigatran. Su antídoto aprobado es el idarucizumab, un fragmento de anticuerpo monoclonal. Se administra en infusión IV rápida en dosis de 5 g (2 viales), con respuesta en 15 minutos. No es preciso corregir la dosis por insuficiencia renal o hepática. Contiene sorbitol; no debe usarse en pacientes intolerantes a lactosa.
Otra opción es la hemodiálisis.
Rivaroxabán, edoxabán y apixabán. Para controlar sus efectos contamos como antídoto con andexanet-alfa (reversión específica) en dosis de 400-800 mg en bolo IV en 15-30 minutos; hay que reiterarlo a las 2 h.
Como intervenciones alternativas:
a) Complejo protrombínico 25-50 UI/kg.
b) Feiba (complejo protrombínico activado) 30-50 U/kg.
c) Factor VII (Novoseven®) 90-100 g/kg. Solo debe ser usado como último recurso, y debe recordarse que puede ser efectivo si no hay hipotermia, hipocalcemia o hipofibrinogenemia.
Optimizar las condiciones básicas para una hemostasia competente
Evitar la hipotermia, manteniendo la temperatura central >33°C, calentando fluidos y recurriendo al uso de colchón y manta térmicos. Corregir la acidosis, procurando un pH >7,22 mediante la modificación de parámetros del ventilador y uso de bicarbonato de sodio. Evitar la hipocalcemia, manteniendo el calcio iónico entre 4,4-5,2 mg/dl (1,1 -1,3 mmol/l), Manejo criterioso de la anemia, respetando la dosis máxima recomendada de coloides71.
Los trastornos de la hemostasia diagnosticada en el laboratorio sin sangrado, ya sea por los tests estándar o los point of care, no deben ser tratados, ya que su corrección no aporta beneficio, exponiendo a los pacientes al riesgo de inmunomodulación, infección, aloinmunización, etcétera72,73.
Hemostáticos tópicos. Diversas sustancias biocompatibles como fibrina, gelatinas y drogas son usadas en cirugía para mejorar la hemostasia cuando las suturas, la compresión o la electrocoagulación son insuficientes. Existen pocos estudios observacionales con escasa evidencia de mejora de estos productos, con los que se intenta dar un soporte al coágulo74.
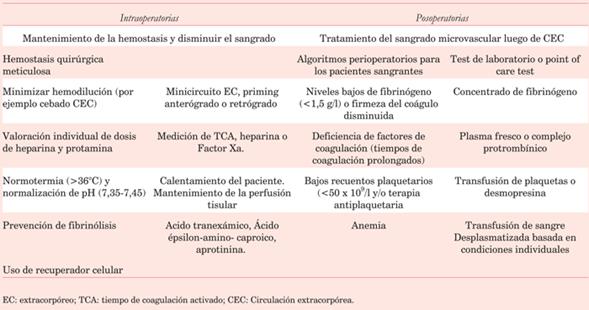
El tratamiento del sangrado en estas cirugías comienza con la preparación del paciente en el preoperatorio y se intensifica en el intra y posoperatorio con una batería de medidas que deben ser adaptadas a cada paciente. Como corolario, la (tabla 7) ordena globalmente los conceptos.
Tabla 7: Intervenciones intra y posoperatorias para evitar el sangrado excesivo en cirugía cardíaca. Modificado de68.
Conclusiones
Existe un grupo de pacientes con variadas patologías cardiovasculares que requieren CC convencional con CEC. La CC y especialmente la CEC generan diversos grados de activación del sistema inflamatorio de causa multifactorial, donde tienen un rol relevante las comorbilidades preexistentes. Varios son los sistemas y órganos blanco afectados por esta activación, en particular la hemostasia. Los avances actuales sobre fisiología, fisiopatología y nuevos sistemas de monitoreo han ampliado nuestro conocimiento sobre los mecanismos de la coagulación y sus alteraciones. Contamos con mayor disponibilidad de hemocomponentes y hemoderivados, recursos valiosos en el intento de recomponer la homeostasis de acuerdo a la evidencia. Sabemos de la existencia de predictores de sangrado, así como también que el principal tratamiento es la profilaxis. Finalmente, más allá de la existencia de guías, niveles de evidencia, protocolos de manejo y recursos disponibles, hay un grupo de pacientes que van a tener un sangrado aumentado que escapa a nuestra capacidad de predicción.