Servicios Personalizados
Revista
Articulo
Links relacionados
Compartir
Revista Uruguaya de Cardiología
versión impresa ISSN 0797-0048versión On-line ISSN 1688-0420
Rev.Urug.Cardiol. vol.35 no.1 Montevideo 2020 Epub 01-Abr-2020
https://doi.org/10.29277/cardio.35.1.15
Controversias en cardiología
Miocardiopatía hipertrófica: encare clínico y opciones de tratamiento
Hypertrophic cardiomyopathy: clinical approach and treatment options
Cardiomiopatia hipertrófica: abordagem clínica e opções de tratamento
La miocardiopatía hipertrófica (MCH) constituye una enfermedad compleja y muy variable en cuanto a su presentación morfológica, fisiopatológica y sintomática, así como en su pronóstico. Su intrincado sustrato genético ha sido objeto de una permanente y productiva investigación en las últimas décadas. En correspondencia con esta complejidad, su manejo clínico representa un desafío, aun para los cardiólogos más experimentados.
La presente controversia comienza con una valiosa actualización por parte del Dr. Walter Reyes sobre la valoración del riesgo individual de muerte súbita en el paciente portador de esta patología, sin duda el más temido evento que pueda presentarse durante su transcurso. En este abordaje se podrá apreciar la evolución de los conceptos, desde la aplicación de los clásicos factores de riesgo obtenidos de los primeros estudios en poblaciones más o menos seleccionadas, hasta las recomendaciones más recientes de la American Heart Association y la European Society of Cardiology, capitalizando la nueva información. Luego, como es habitual y dado el objetivo esencialmente práctico de esta sección, se propone una viñeta sobre un caso de MCH obstructiva en la que el autor aplica, a forma de ejercicio clínico, la información brindada en la revisión previa.
A continuación se plantea la controversia propiamente dicha, donde el debate se centra en la elección de la técnica más apropiada de reducción septal en el caso propuesto, cuyas características apuntan a la necesidad de un abordaje invasivo. Dos prestigiosos invitados exponen sus argumentos en favor de cada alternativa. El Dr. Hartzell Shaff propone la miectomía septal quirúrgica como el procedimiento más adecuado, y el Dr. Pedro Trujillo plantea la ablación septal percutánea como solución de elección. El desarrollo de ambas exposiciones permitirá al lector apreciar la importancia de un enfoque individualizado, dada la riqueza de información clínica, anatomofuncional y propia de cada procedimiento que se requiere para inclinar la balanza en favor de uno u otro. Ambos autores coinciden en el beneficio de contar con un equipo especializado y experimentado para la obtención de buenos resultados con cualquiera de las técnicas.
Palabras clave: Cardiomiopatía hipertrófica; Muerte súbita; Terapias de reducción septal; Ablación septal con alcohol; Miectomía Septal
Hypertrophic cardiomyopathy is a complex and highly variable disease in terms of morphological, pathophysiological and symptomatic presentation, as well as in its prognosis. Its intricate genetic substrate has been subject of permanent research in recent decades. Corresponding to this complexity, its clinical management represents a challenge, even for the most experienced cardiologists.
The present controversy begins with a valuable update by Dr. Walter Reyes about assessment of individual risk of sudden death in the patient with this disease, without doubt the most feared event that may occur during its course. In this approach, evolution of concepts can be appreciated, from the application of the classic risk factors obtained from the first studies, to the most recent recommendations of the American Heart Association and the European Society of Cardiology.
Since the practical objective of this section, a clinical case is proposed on an obstructive hypertrophic cardiomyopathy in which the author applies, as a clinical exercise, the information provided in the previous review.
Next, the controversy itself arises, where the debate focuses on the choice of the most appropriate septal reduction technique. Two prestigious guests present their arguments in favour of each alternative. Prof. Hartzell Shaff proposes surgical septal myectomy as the most appropriate procedure, and Dr. Pedro Trujillo proposes percutaneous septal ablation as the solution of choice. The exposures will allow the reader to appreciate the importance of an individualized approach, given the amount of clinical, anatomic, functional and specific information of each procedure that is required to tip the balance in favour of one or the other. Both authors agree on the benefit of having a specialized and experienced team to obtain good results with any of the techniques.
Key words: Hypertrophic cardiomyopathy; Sudden death; Septal reduction therapies; Alcohol septal ablation; Septal myectomy
A cardiomiopatia hipertrófica é uma doença complexa e altamente variável em termos de apresentação morfológica, fisiopatológica e sintomática, bem como em seu prognóstico. Seu intrincado substrato genético tem sido objeto de pesquisa permanente nas últimas décadas. Correspondendo a essa complexidade, seu manejo clínico representa um desafio, mesmo para os cardiologistas mais experientes.
A presente controvérsia começa com uma atualização valiosa do Dr. Walter Reyes sobre a avaliação do risco individual de morte súbita no paciente com esta doença, sem dúvida o evento mais temido que pode ocorrer durante seu curso. Nessa abordagem, a evolução dos conceitos pode ser apreciada, desde a aplicação dos fatores de risco clássicos obtidos nos primeiros estudos, até as recomendações mais recentes da American Heart Association e da European Society of Cardiology.
Como o objetivo prático desta seção, é proposto um caso clínico em uma cardiomiopatia hipertrófica obstrutiva, no qual o autor aplica, como exercício clínico, as informações fornecidas na revisão anterior.
Em seguida, surge a própria controvérsia, onde o debate se concentra na escolha da técnica de redução septal mais apropriada. Dois convidados de prestígio apresentam seus argumentos em favor de cada alternativa. O professor Hartzell Shaff propõe a miectomia septal cirúrgica como o procedimento mais apropriado e o Dr. Pedro Trujillo propõe a ablação septal percutânea como a solução de escolha. As exposições permitirão ao leitor apreciar a importância de uma abordagem individualizada, dada a quantidade de informações clínicas, anatômicas, funcionais e específicas de cada procedimento, necessárias para inclinar a balança em favor de uma ou de outra. Ambos os autores concordam com o benefício de ter uma equipe especializada e experiente para obter bons resultados com qualquer uma das técnicas.
Palavras chave: Cardiomiopatia hipertrófica; Morte súbita; Terapias de redução septal; Ablação septal com álcool; Miectomia septal
Bibliography:
1. Kimmelstiel C, Zisa D, Kuttab J, Wells S, Udelson J, Wessler B, et al. Guideline-based referral for septal reduction therapy in obstructive hypertrophic cardiomyopathy is associated with excellent clinical outcomes. Circ Cardiovasc Interv. 2019; 12(7):e007673. doi: 10.1161/CIRCINTERVENTIONS.118.007673 [ Links ]
2. Khalpey Z, Korovin L, Chitwood WJr, Poston R. Robot-assisted septal myectomy for hypertrophic cardiomyopathy with left ventricular outflow tract obstruction. J Thorac Cardiovasc Surg. 2014; 147(5): 1708-9. doi: 10.1016/j.jtcvs.2013.12.017 [ Links ]
3. Chou N, Okano R, Tedoriya T, Wu I, Yu H, Chen Y, et al. Robotic transmitral approach for hypertrophic cardiomyopathy with systolic anterior motion. Circ J. 2018; 82(11):2761-6. doi: 10.1253/circj. CJ-17-1369 [ Links ]
4. Gilmanov D, Bevilacqua S, Solinas M, Ferrarini M, Kallushi E, Santarelli P, et al. Minimally invasive septal myectomy for the treatment of hypertrophic obstructive cardiomyopathy and intrinsic mitral valve disease. Innovations (Phila) 2015; 10(2): 106-13. doi: 10.1097/IMI.0000000000000132 [ Links ]
5. Valeti U, Nishimura R, Holmes D, Araoz P, Glockner J, Breen J, et al. Comparison of surgical septal myectomy and alcohol septal ablation with cardiac magnetic resonance imaging in patients with hypertrophic obstructive cardiomyopathy. J Am Coll Cardiol. 2007; 49(3):350-7. doi: 10.1016/j.jacc. 2006.08. 055 [ Links ]
6. Nguyen A, Schaff H, Hang D, Nishimura R, Geske J, Dearani J, et al. Surgical myectomy versus alcohol septal ablation for obstructive hypertrophic cardiomyopathy: a propensity score-matched cohort. J Thorac Cardiovasc Surg. 2019; 157(1): 306-15.e3. doi: 10.1016/j.jtcvs.2018.08.062 [ Links ]
7. Nguyen A, Schaff H, Nishimura R, Dearani J, Geske J, Lahr B, et al. Does septal thickness influence outcome of myectomy for hypertrophic obstructive cardiomyopathy? Eur J Cardiothorac Surg 2018; 53(3):582-9. doi: 10.1093/ejcts/ezx398 [ Links ]
8. Batzner A, Pfeiffer B, Neugebauer A, Aicha D, Blank C, Seggewiss H. Survival after alcohol septal ablation in patients with hypertrophic obstructive cardiomyopathy. J Am Coll Cardiol. 2018; 72(24): 3087-94. doi: 10.1016/j.jacc.2018.09.064 [ Links ]
9. Quintana E, Sabate-Rotes A, Maleszewski J, Ommen S, Nishimura R, Dearani J, et al. Septal myectomy after failed alcohol ablation: does previous percutaneous intervention compromise outcomes of myectomy? J Thorac Cardiovasc Surg. 2015; 150(1): 159-67.e1. doi: 10.1016/j.jtcvs.2015.03.044 [ Links ]
10. Cui H, Schaff H, Nishimura R, Geske J, Dearani J, Lahr B, et al. Conduction abnormalities and long-term mortality following septal myectomy in patients with obstructive hypertrophic cardiomyopathy. J Am Coll Cardiol. 2019; 74(5):645-55. doi: 10.1016/j.jacc.2019.05.053 [ Links ]
Articles
Viñeta clínica
Paciente de sexo femenino, 60 años, procedente de Montevideo.
Sin antecedentes familiares patológicos.
Antecedentes personales de dislipemia, hipertensión arterial con cifras habituales de 130/80 mmHg y máximas de 150/90 mmHg, diabetes mellitus tipo 2 insulino-requirente, con mal control metabólico y gonartrosis. Portadora de miocardiopatía hipertrófica asimétrica diagnosticada a los 55 años.
Historia de dos meses de evolución de disnea clase funcional III NYHA (New York Heart Association). Relata hace una semana sensación de mareos al cambiar de posición. Niega historia de ángor, síncope o palpitaciones. En el examen físico, presenta soplo sistólico 3/6 en mesocardio que se intensifica con maniobra de Valsalva.
Electrocardiograma: ritmo sinusal de 60 cpm, sobrecarga auricular izquierda, hipertrofia del ventrículo izquierdo (VI).
Ecocardiograma transtorácico: fracción de eyección del VI de 60%; VI de dimensiones normales con grosor parietal severamente aumentado en forma asimétrica a predominio septal, donde alcanza un máximo de 35 mm, con pared posterior de 14 mm; gradiente intraventricular de 15 mmHg y subvalvular de 35 mmHg que aumenta con maniobra de Valsalva a 90 mmHg, y aparece movimiento anterior sistólico de la válvula mitral, cuya valva anterior se encuentra elongada. Aurícula izquierda de 45 mm. Insuficiencia mitral leve. Holter: ritmo sinusal, frecuencia cardíaca promedio de 65 cpm, máxima de 87 cpm y mínima de 56 cpm; no se registran arritmias.
En tratamiento con losartán 50 mg/día, atenolol 150 mg cada 12 horas, hidroclorotiazida 25 mg/día, atorvastatina 10 mg/día, metformina 850 mg/día, insulina NPH 20 UI 8 a.m. y 10 UI 8 p.m., y tramadol 50 mg cada 12 horas.
Articles
El desafío de prevenir la muerte súbita en la miocardiopatía hipertrófica
Introducción
Prevenir la muerte súbita cardíaca (MSC) en la miocardiopatía hipertrófica (MCH) es un desafío clínico. Es una complicación devastadora, más frecuente en jóvenes, lo que le agrega dramatismo, sobre todo en atletas, siendo en muchos casos la primera manifestación clínica1,2. Desde hace aproximadamente 25 años está disponible el cardiodesfibrilador implantable (DAI), una herramienta terapéutica efectiva para la interrupción de las arritmias malignas que ocasionan la MSC. El DAI ha transformado la prevención de esta complicación en una realidad alcanzable3. Una precisa estratificación de riesgo es imprescindible para optimizar su indicación1-4.
Epidemiología
La MCH es la más frecuente de las cardiopatías hereditarias, 1/500 (7.000 en Uruguay aproximadamente). Se trasmite en forma autosómica dominante con una expresión fenotípica variable, y es ocasionada fundamentalmente por mutaciones específicas en genes del sarcómero. La penetrancia de la mutación aumenta con la edad y lo hace más precozmente en varones. Existen factores modificadores que pueden acelerar o enlentecer la manifestación fenotípica. En portadores de la mutación, un estilo de vida saludable disminuye sus consecuencias clínicas, mientas otros factores como la obesidad, la hipertensión, y la apnea del sueño pueden agravarla en la edad adulta5. Está claramente subdiagnosticada y en una gran mayoría de casos, subtratada. La incidencia de MSC se estima en 1%-2%/año. Es la forma de muerte cardiovascular más común en jóvenes, mientras en la edad media lo es la insuficiencia cardíaca y en adultos mayores el accidente cerebrovascular. La MSC es rara en >60 años6.
Factores de riesgo de MSC
Clásicamente se han definido como factores de riesgo: la historia familiar, episodio de MSC o de taquicardia ventricular sostenida o no sostenida, síncope inexplicado, grosor parietal > 30 mm y respuesta anormal de la presión arterial al esfuerzo3,4. También se han considerado en pacientes particulares, la obstrucción del tracto de salida ventricular izquierdo, la fibrilación auricular, la presencia de aneurisma apical y el antecedente de ablación con alcohol. Siempre debe descartarse la existencia de cardiopatía isquémica concomitante, asociación que agrava el pronóstico. El ECG basal muestra en la mayoría de los pacientes signos de hipertrofia ventricular, pero se ha reportado que el 6% tienen un registro normal, hecho que se correlaciona con un mejor pronóstico7. Analizaremos algunos de estos factores.
Grosor parietal >30 mm
Este dato ecocardiográfico, representativo de una hipertrofia ventricular extrema, es un factor de riesgo independiente de MSC, de mayor significación en <40 años. Spirito y colaboradores siguieron durante 6,5 años un grupo de 480 pacientes consecutivos con MCH y los dividieron de acuerdo con el grosor parietal determinado por ecografía. El riesgo de MSC aumenta progresivamente con el grosor parietal. El riesgo acumulado fue de 20% a 10 años y de 40% a 20 años para el grupo con grosor >30 mm, y la mayoría de los pacientes de este grupo eran jóvenes asintomáticos o con síntomas leves. La mediana de edad de los pacientes incluidos con espesor parietal >30 mm era de 28 años8.
Arritmias ventriculares no sostenidas
La detección de episodios de taquicardia ventricular no sostenida, definida como 3 o más episodios de 3 o más complejos ventriculares o uno o más episodios de >10 complejos en Holter de 24-48 horas, es considerado un factor de alto riesgo de MSC y por sí sola, constituye indicación de implante de DAI3,9. Cuando se asocia a otros factores su significación pronóstica aumenta.
Síncope
Se ha reportado una incidencia de síncope de 15%-25% en portadores de MCH. Es considerado un factor de riesgo mayor de MSC, también fundamentalmente en jóvenes10. El mismo puede deberse a causas arrítmicas (taquicardia ventricular, fibrilación auricular) o a mecanismos hemodinámicos (obstrucción del tracto de salida, vasodilatación inapropiada) siendo muchas veces muy difícil establecer su causa. Es obligatorio realizar una investigación etiológica exhaustiva, ya que con frecuencia puede requerir un tratamiento adicional al DAI para controlar los síntomas, como en casos con obstrucción severa o arritmias supraventriculares11.
Comportamiento anormal de la presión arterial en el esfuerzo
Se define habitualmente como una caída tensional por debajo de los valores basales, o la incapacidad de aumentar la presión >20 mmHg durante el esfuerzo. Este hallazgo se ha relacionado a un peor pronóstico en pacientes <50 años; sin embargo, tiene un valor predictivo positivo muy bajo por lo cual no debe considerarse aisladamente para tomar decisiones terapéuticas. Su valor predictivo negativo por el contrario es elevado (95%) por lo cual sería de utilidad en ausencia de otros factores, para definir una población de bajo riesgo11).
Obstrucción del tracto de salida ventricular izquierdo
La presencia de un gradiente pico de reposo o con Valsalva en el tracto de salida ventricular izquierdo >30 mmHg se considera predictor de progresión de los síntomas de insuficiencia cardiaca, y de muerte. La mortalidad se duplica, y en >40 años multiplica por 4 el riesgo de progresión a la falla cardiaca y muerte. Mayores gradientes no implican mayor riesgo12. Su ponderación como factor de riesgo de MSC tiene matices en las Guías, como se verá más adelante. Los pacientes con gradientes >50 mmHg y sintomáticos a pesar del tratamiento médico requieren de tratamiento adicional para la obstrucción como se discutirá en la presente controversia. El tratamiento farmacológico (betabloqueantes, anticálcicos) si bien disminuye el gradiente y mejora los síntomas, no ha demostrado disminuir el riesgo de MSC.
Otros factores de riesgo
Resonancia nuclear magnética, realce tardío con gadolinio
La mayoría de pacientes con MCH presenta fibrosis miocárdica puesta en evidencia por la presencia de realce tardío con gadolinio (LGE, su sigla en inglés) en una resonancia cardíaca. La magnitud de este se ha relacionado con el pronóstico en diversas comunicaciones13-16. Mentias y colaboradores14 analizaron 1.423 pacientes consecutivos con MCH de riesgo bajo o intermedio de acuerdo con las guías europeas17 y función ventricular normal, en los cuales se determinó el LGE como porcentaje de la masa ventricular. Incluyeron pacientes con y sin obstrucción, con y sin DAI y posmiectomía. El punto final considerado fue mortalidad o descargas apropiadas del DAI; se evaluó el riesgo de MSC a 5 años en función del porcentaje de LGE. Un porcentaje mayor al 15% se asoció con mayor mortalidad y descargas del DAI, y esto es así también en los pacientes posmiectomía o sin obstrucción. Un reporte de 2019 de Todiere y colaboradores15, también en una población de riesgo intermedio (<6% de acuerdo con guías europeas), definen un umbral de 10% de LGE como el mejor para predecir eventos arrítmicos mayores. La probabilidad de un evento mayor fue 2,5% en aquellos con LGE <10% y de 23,4% cuando el LGE fue >10%. Aunque estos hallazgos requieren de mayor confirmación (sobre todo el umbral a considerar), su importancia no es discutida y deben ser tenidos en cuenta para optimizar la indicación de un DAI, fundamentalmente en casos de riesgo intermedio. De hecho el grupo de Maron y colaboradores, en cuyas investigaciones se basan las guías americanas, lo incluyen actualmente como un factor de riesgo mayor13,16).
Aneurisma apical
Aunque afecta a un reducido número de pacientes (2%), su presencia debe siempre descartarse. Muchas veces pasan desapercibidos en un ecocardiograma, siendo solo detectables por resonancia, asociados a un grado significativo de fibrosis. Es un importante factor de riesgo de complicaciones graves incluyendo la MSC18.
Test genético
La investigación genética ha permitido avanzar notablemente en las bases moleculares de la MCH, ha posibilitado el diagnóstico de fenocopias como la enfermedad de Fabry, y también la identificación de más de una mutación en algunos pacientes. Sin embargo, sus resultados aún no son considerados relevantes para la estratificación de riesgo de MSC y por lo tanto tampoco para definir conductas17,18. Tiene además limitaciones. En 1/3 de los pacientes con la enfermedad manifiesta, no se detectará una mutación, lo cual no significa que no tiene la enfermedad ni que esta no sea de causa genética. En otros se detectará una variante de significado incierto (VUS, variant of unknown significance). Estos hechos jerarquizan la importancia del asesoramiento genético en el manejo clínico. Muchas veces se generan expectativas injustificadas sobre sus resultados, tanto en pacientes y sus familias como en los médicos tratantes, siendo imprescindible disponer de apoyo especializado para lograr una interpretación correcta de su valor, alcances y consecuencias.
De cualquier manera, los estudios genéticos deben incluirse en el esquema de evaluación de las familias afectadas4. Por el momento debemos considerarla una prueba de valoración familiar más que individual. Se han identificado mutaciones en múltiples genes vinculados a la MCH, aproximadamente el 50% de ellas en el gen MYBPC3 y otras muy poco frecuentes o excepcionales. Un completo panel de genes puede actualmente ser secuenciado simultáneamente utilizando técnicas de secuenciación masiva (NSG, next generation sequencing) permitiendo detectar múltiples mutaciones en el mismo o diferentes genes. La presencia de más de una mutación implica un mayor riesgo de MSC. Además, el estudio genético permite, en el tamizaje familiar, descartar para un seguimiento posterior a los que no la presentan. El consejo y asesoramiento genético debe realizarse en todo paciente con MCH17.
La abrumadora evolución de la investigación genética avanza, entre otros aspectos, en lograr una correlación genotipo-fenotipo que pueda servir de apoyo en el asesoramiento y la toma de decisiones con los pacientes. En este sentido y a modo de ejemplo, destacamos un artículo recientemente publicado por un grupo belga19. Se analizaron 378 pacientes con MCH y estudio genético, entre los cuales en 141 (37%) se encontró una mutación, en 181 ninguna, y en 56 una VUS. Se identificó una serie de variables que se correlacionó con una prueba genética positiva: historia familiar de MCH o de MSC, edad al diagnóstico <45 años, síncope, grosor parietal >20 mm, hipertrofia asimétrica y ausencia de ondas T negativas en cara lateral en el ECG. Se identificó además una mutación en el gen MYBPC3, cuyos portadores tienen un riesgo significativamente mayor de MSC comparado con otras mutaciones o con aquellos sin una mutación definida.
Guías American Heart Association/American College of Cardiology18
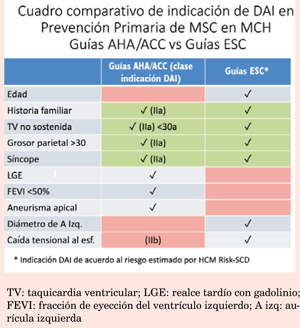
Publicadas en 2011, estas Guías mantienen vigencia, aunque se han incorporado progresivamente nuevos conceptos de acuerdo con la evolución de la información. En la (tabla 1) resumimos los criterios de riesgo actualmente establecidos3,18 que según sus autores son comparativamente superiores tanto en especificidad como sensibilidad al modelo de la Sociedad Europea17.
El número de factores de riesgo presentes en un paciente no aumenta aritméticamente el riesgo. La mayoría de los pacientes con más de un factor de riesgo no tiene más MSC y muchos de los que presentan esta complicación tienen un solo factor de riesgo, hecho que dificulta la toma de decisiones adecuadas18. La decisión será siempre individualizada y deberá considerar la edad, fortaleza de la evidencia del o los factores de riesgo presentes y el balance riesgo-beneficio del implante, además de la opinión y expectativas del paciente y su familia.
Guías European Society of Cardiology (tabla 2)17
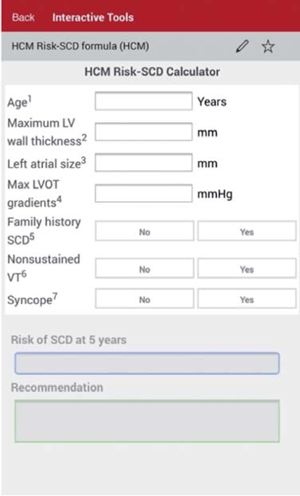
En esta actualización se registra una modificación con respecto a lo que se establecía en las anteriores guías ESC en las cuales se indicaba un DAI cuando existían dos o más factores de riesgo. Basados en un estudio retrospectivo multicéntrico que incluyó a 3.675 pacientes se desarrolló y validó un nuevo modelo predictivo de MSC denominado HCM Risk-SCD, que utiliza las variables consideradas como factores de riesgo mayores, incluyendo la edad y como particularidad el diámetro antero-posterior de la aurícula izquierda; no considera la respuesta de la presión arterial al esfuerzo17,20. El modelo establece la probabilidad de un episodio de MSC en 5 años y de acuerdo con ella establece el grado de recomendación de la indicación de DAI. Se considera alto riesgo cuando las probabilidades son >6% (indicación IIa), bajo riesgo cuando son <4% (IIb o III, individualizado) y de riesgo intermedio cuando es >4%-<6% (indicación IIb). Este modelo de predicción tiene la ventaja de estar fácilmente disponible online o a través de una aplicación en los teléfonos inteligentes (figura 1), permitiendo rápidamente, con los datos clínicos necesarios, disponer de una valoración del riesgo. Los datos necesarios surgen de la historia personal y familiar, del ecocardiograma y del Holter, fácilmente disponibles en la práctica habitual, y para el seguimiento se sugiere reiterar la estratificación cada 1-2 años. Debe tenerse presente también que los pacientes >65 años están poco representados y no puede ser usada en <16 años.
Debe quedar claro que las definiciones de las Guías (ambas) no provienen de ensayos clínicos randomizados (no existen), sino de estudios retrospectivos, observacionales o de cohortes, de donde surge la relación de determinadas características con el pronóstico (tabla 3).
La paciente
Con la información disponible en la viñeta clínica trataremos de establecer una recomendación en cuanto a la prevención de MSC con DAI en esta paciente. Como en todos los casos en que se considere este tratamiento, las comorbilidades y fundamentalmente la opinión y expectativas de la paciente y su familia deben tenerse en cuenta. Razonaremos en dos escenarios: la situación actual y la probable luego del tratamiento intervencionista (miectomía o ablación con alcohol) que es factible requiera.
Resumiendo, se trata de una paciente de 60 años, sin historia familiar, sin antecedente de síncope y sintomática por compromiso de la clase funcional. Se refiere en la viñeta clínica que presenta “mareos con los cambios de posición”; interpretamos que esto significa que la paciente presenta un síntoma leve al pararse, hecho quizás vinculado a la obstrucción al tracto de salida y que clínicamente no impresiona como sugestivo de un trastorno del ritmo. Se refiere un Holter de 24 horas sin arritmias. No se ha realizado resonancia cardíaca (RNM).
De acuerdo con las Guías ACC/AHA presenta un solo factor de riesgo mayor: el grosor parietal de 35 mm, hecho que por sí solo se considera indicación de implante de DAI, sobre todo en jóvenes. Recordemos que la MSC es menos frecuente luego de los 30-40 años y rara luego de los 60 años. Por otra parte, tiene obstrucción severa del tracto de salida del VI; 90 mmHg con Valsalva. La relación entre el gradiente en reposo y el riesgo, si bien es estadísticamente significativa, no es lo suficientemente categórica como para establecer este parámetro como factor de riesgo independiente de MSC, pero merece ser tenido en cuenta. Este es un caso en el cual los datos del nivel de LGE en una resonancia adquieren mayor jerarquía en la decisión de implante de DAI. Pero está condicionada al tratamiento que se resuelva para la obstrucción al tracto de salida izquierdo, una prioridad en este momento.
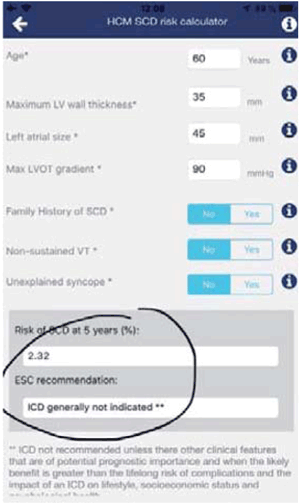
La aplicación HCM-Risk SCD recomendada por la ESC (figura 2), establece una probabilidad de MSC a 5 años para esta paciente de 2,32%, sin indicación actual de implante de DAI. Queremos destacar que, si bien el dato disponible del Holter de 24 horas no muestra arritmias, habitualmente es necesaria una monitorización más prolongada para descartarlas definitivamente. Si esta paciente tuviera episodios de taquicardia ventricular no sostenida, el riesgo sería de 5,22% y entonces el implante de DAI debería considerarse.
Luego del tratamiento intervencionista de la obstrucción la paciente deberá ser revalorada clínicamente, con ecocardiograma, Holter y resonancia cardíaca con LGE. El modelo europeo HCM-Risk SCD no ha sido validado para pacientes posmiectomía quirúrgica ni posablación con alcohol. Existe evidencia, sin embargo, de que la miectomía quirúrgica utilizando las técnicas quirúrgicas y de preservación miocárdica modernas y realizada en un centro experimentado, tiene muy baja mortalidad (0,8%) y mejora significativamente el pronóstico de los pacientes, siendo predictor independiente de ausencia de descargas del DAI en aquellos que lo portaban, y logrando una expectativa de vida en la población de 60 años o más, similar a la población general16,17. Es probable, si el resultado quirúrgico en esta paciente es positivo, que sea razonable descartar el implante de un DAI. Luego de la ablación con alcohol se es más liberal respecto a la indicación de DAI. El procedimiento genera un infarto septal que habitualmente involucra una masa ventricular mayor a la resecada quirúrgicamente.
Es un potencial sustrato de arritmias ventriculares; por tanto, la utilización de esta técnica puede considerarse un factor de riesgo “iatrogénico” de MSC. Los datos disponibles de la ablación con alcohol, que aún es utilizada en centros muy especializados, para pacientes seleccionados, básicamente aquellos con contraindicación quirúrgica, y su probable influencia pronóstica con respecto a la MSC, son aún preliminares y no permiten conclusiones definitivas16).
En suma, en el caso que nos ocupa, la decisión final dependerá del procedimiento de tratamiento intervencionista utilizado, de los resultados de éste y de la valoración posterior.
Articles
La ablación septal con alcohol es el tratamiento de elección
1. Análisis clínico global y diagnóstico
Se trata de una mujer de 60 años, con múltiples factores de riesgo cardiovascular, portadora de soplo sistólico en mesocardio grado 3/6, compatible con obstrucción del tracto de salida del ventrículo izquierdo, sin irradiaciones y que se exacerba con maniobra de Valsalva (disminución del retorno venoso y aumento de la contractilidad), lo que es concordante con el antecedente de MCH obstructiva. El síntoma dominante es la disnea de esfuerzo, clase funcional (CF) III de la NYHA, vinculada a falla diastólica de un VI rígido y con relajación ventricular anormal, cuyo sustrato es hipertrofia severa, fibrosis e isquemia.
El ecocardiograma confirma la MCH (grosor parietal >15 mm que no puede ser explicado por las condiciones de carga del paciente)1) y su fenotipo septal asimétrico y obstructivo. Se destaca en lo anatómico un septum interventricular de 35 mm de espesor máximo, válvula mitral elongada y aurícula izquierda dilatada. En lo funcional, el movimiento anterior sistólico de la valva anterior mitral, gradiente subvalvular reposo/Valsalva de 35/90 mmHg, gradiente medio ventricular de 15 mmHg e insuficiencia mitral leve.
Recibe tratamiento a dosis muy elevadas de betabloqueantes que logran el objetivo de frecuencia cardíaca (Holter), con probables efectos secundarios (hipotensión ortostática) y mala respuesta por mantenerse en CF III, constituyendo un comportamiento refractario.
2. Tratamiento
El tratamiento de la MCH obstructiva requiere comprensión de los mecanismos fisiopatológicos subyacentes y debe ser individualizado, teniendo en cuenta la gravedad de la obstrucción, presencia de síntomas, comorbilidades cardíacas, riesgo quirúrgico, experiencia local en las terapias invasivas y preferencias del paciente.
Esta paciente tiene indicación de reducción septal invasiva (hipertrofia septal de 35 mm, gradiente provocado en el tracto de salida del ventrículo izquierdo >50 mmHg, con disnea en CF III de la NYHA a pesar de un tratamiento farmacológico a la máxima dosis tolerada)1. La terapia de reducción septal incluye la miectomia septal (MS) y la ablación septal con alcohol (ASA), recomendándose que estas sean llevadas a cabo dentro de un programa integral y multidisciplinario del cuidado de esta enfermedad2. En ambas terapias el objetivo principal es reducir el septum basal y por tanto la obstrucción producida por el contacto de la valva anterior (efecto Venturi) y el septum interventricular.
No existen estudios randomizados que comparen ambos tratamientos, existiendo estudios observacionales y metaanálisis que confirman resultados similares en cuanto a mortalidad, mejoría hemodinámica y funcional, ocurrencia de arritmia ventricular, reintervención y regurgitación mitral posprocedimiento, evaluados a corto y largo plazo3. Asimismo se identifica una diferencia significativa en cuanto a ocurrencia de bloqueo completo de rama derecha (BCRD) y necesidad de marcapasos (MP) en el grupo de pacientes tratados con ASA. Si bien la MS es considerada el tratamiento de reducción septal “gold estándar”, una importante consideración es la selección de pacientes para ambas técnicas, para lo que es necesario en esta paciente una evaluación con ecocardiografía transesofágica y/o RNM, asi como una angiografía coronaria. Deberían considerarse como hechos mayores a favor de la MS la identificación de enfermedad coronaria severa, las alteraciones estructurales del aparato válvular mitral (inserción anómala de músculos papilares y valvas redundantes) y la ausencia de anatomía de ramos coronarios septales favorables para ASA. Otra característica a considerar es la hipertrofia masiva (septum de 35 mm), grupo de pacientes donde los resultados con ASA globalmente son menos eficaces y la MS se ve favorecida por resultados más predecibles. La presencia de un gradiente medio ventricular de 15 mmHg (que no aumenta con Valsalva) no es un objetivo terapéutico inicial y sí lo es la obstrucción producida por la valva anterior mitral en contacto con el septum basal. De confirmarse un gradiente medio ventricular dinámico mayor, es un argumento a favor de la MS con técnica ampliada, ya que la ASA tiene resultados menos predecibles en esta variante anatomica. El riesgo quirúrgico no parece jugar un papel en la decisión en nuestra paciente ya que no presenta comorbilidades mayores que condicionen la cirugía.
Por su parte la ASA tiene la ventaja de ser un procedimiento mínimamente invasivo, sin necesidad de anestesia general ni de incisión torácica, con menos dolor e incomodidad general para el paciente, menor tiempo de recuperación y estadía hospitalaria. Además la ASA tiene resultados comparables a la MS, pero la reducción de gradientes puede ser más tardía (3 meses). En este caso particular, si se descartan contraindicaciones mayores para ASA (enfermedad coronaria severa, alteraciones estructurales del aparato valvular mitral y anatomía de ramos septales no favorable) podría considerarse como alternativa (si el paciente no acepta la cirugía) como un tratamiento inicial menos invasivo, con un riesgo más elevado de necesidad de MP (10%-15%)4. En tal caso debe identificarse en primera instancia por angiografía el ramo perforante responsable de la irrigación del septum basal que determina la obstrucción del tracto de salida del VI (habitualmente primera o segunda rama septal de la arteria descendente anterior, mas raramente naciendo de otro origen)5,6). Esta correlación entre un ramo septal particular y el sector a infartar con alcohol, se logra con la inyección de contraste ecográfico por la rama involucrada y la visualización por ecocardiograma (vista apical cuatro cámaras y paraesternal eje largo) de la zona de irrigación coincidente con el contacto mitro septal. La identificación de la subdivisión izquierda del perforante involucrado y la administración de bajos volúmenes de etanol absoluto (1-2 cm3) se asocian a menor incidencia de complicaciones, en especial bloqueo cardiaco7.
Conclusión
Hemos analizado a una paciente de 65 años, portadora de una MCH obstructiva, sintomática en CF III de la NYHA y refractaria al tratamiento médico, que presenta indicación de reducción septal. Debe complementarse su análisis con un ecocardiograma transesofágico o RNM y angiografía coronaria, para descartar anomalías del aparato valvular mitral y evaluar la asociación con enfermedad coronaria y distribución de ramos septales respectivamente. La ASA puede ser la opción de tratamiento inicial, menos invasiva, si el paciente no acepta la cirugía, con resultados globalmente similares en múltiples aspectos a corto y largo plazo y un riesgo más elevado de desarrollo de bloqueo cardíaco que debe minimizarse con la aplicación de la técnica más ajustada.
Bibliografía:
1. Elliott PM, Anastasakis A, Borger MA, Borggrefe M, Cecchi F, Charron P, et al. 2014 ESC guidelines on diagnosis and management of hypertrophic cardiomyopathy: the task force for the diagnosis and management of hypertrophic cardiomyopathy of the European Society of Cardiology (ESC). Eur Heart J. 2014;35(39):2733-79. doi: 10.1093/eurheartj/ehu284 [ Links ]
2. Gersh BJ, Maron BJ, Bonow RO, Dearani JA, Fifer MA, Link MS, et al. 2011 ACCF/AHA Guideline for the diagnosis and treatment of hypertrophic cardiomyopathy: a report of the American College of Cardiology Foundation/American Heart Association task force on practice guidelines. Developed in collaboration with the American Association for Thoracic Surgery, American Society of Echocardiography, American Society of Nuclear Cardiology, Heart Failure Society of America, Heart Rhythm Society, Society for Cardiovascular Angiography and Interventions, and Society of Thoracic Surgeons. J Am Coll Cardiol. 2011;58(25): e212-60. doi: 10.1016/j.jacc.2011.06.011 [ Links ]
3. Agarwal S, Tuzcu EM, Desai MY, Smedira N, Lever HM, Lytle BW, et al. Updated meta-analysis of septal alcohol ablation versus myectomy for hypertrophic cardiomyopathy. J Am Coll Cardiol. 2010; 55(8):823-34. doi: 10.1016/j.jacc.2009.09.047 [ Links ]
4. Faber L, Meissner A, Ziemssen P, Seggewiss H. Percutaneous transluminal septal myocardial ablation for hypertrophic obstructive cardiomyopathy: long term follow up of the first series of 25 patients. Heart 2000; 83(3):326-31. doi:10.1136/heart. 83.3.326 [ Links ]
5. Holmes DR, Jr, Valeti US, Nishimura RA. Alcohol septal ablation for hypertrophic cardiomyopathy: indications and technique. Catheter Cardiovasc Interv. 2005; 66(3):375-89. doi:10.1002/ccd. 20500 [ Links ]
6. Singh M, Edwards WD, Holmes DR, Tajil AJ, Nishimura RA. Anatomy of the first septal perforating artery: a study with implications for ablation therapy for hypertrophic cardiomyopathy. Mayo Clin Proc. 2001;76(8):799-802. [ Links ]
7. Veselka J, Duchonová R, Procházková S, Pálenícková J, Sorajja P, Tesar D. Effects of varying ethanol dosing in percutaneous septal ablation for obstructive hypertrophic cardiomyopathy on early hemodynamic changes. Am J Cardiol. 2005; 95(5): 675-8. doi:10.1016/j.amjcard.2004.10.050 [ Links ]
Articles
La miectomía septal es el tratamiento de elección
En pacientes con MCH, la obstrucción del tracto de salida del VI es causada por la hipertrofia septal y el movimiento sistólico anterior (SAM) asociado de la valva de la válvula mitral. La terapia de reducción septal es el tratamiento de elección para aquellos pacientes cuyos síntomas son refractarios al tratamiento médico máximo. La MS y la ASA son los dos métodos de reducción septal más utilizados. Aunque la miectomía septal es reconocida como el tratamiento preferido por la mayoría de los médicos, la ablación septal con alcohol también se usa ampliamente en centros que carecen de experiencia con la miectomía quirúrgica. De hecho, ASA tiene un efecto similar a largo plazo sobre la supervivencia en pacientes seleccionados en comparación con la MS. Para los candidatos a terapia de reducción septal, la elección del tratamiento debe hacerse con plena consideración de las diferencias entre ambos procedimientos.
El caso presentado es un paciente típico con MCH obstructiva. Presenta hipertrofia severa del VI con grosor septal de 35 mm. Un hallazgo importante es un gradiente de presión medioventricular, además de gradiente de presión subaórtico, una característica que debería influir fuertemente en la elección de la terapia. Es importante destacar que la paciente sería una buena candidata para cirugía, con riesgo muy bajo del procedimiento (<1%).
La MS transaórtica extendida es un tratamiento apropiado para la mayoría de pacientes con MCH obstructiva. La operación descrita por Morrow se ha refinado considerablemente, con énfasis en extender la longitud de la resección septal hacia el ápex del ventrículo más allá del área de contacto mitro-septal para eliminar el SAM. Existe un amplio espectro anatómico de MCH obstructiva, desde hipertrofia septal basal relativamente aislada hasta segmentos largos de hipertrofia septal que se extienden por el ventrículo medio y el ápex. La miectomía quirúrgica permite el alivio de la obstrucción en todos los niveles, y el abordaje transaórtico puede complementarse con el abordaje transapical en la obstrucción medioventricular.
De hecho, la extirpación de una longitud adecuada de miocardio septal es la clave para un alivio adecuado del gradiente. La imposibilidad de llevar la resección septal lo suficientemente lejos hacia el ápex es la causa más común de un procedimiento quirúrgico fallido.
En la práctica contemporánea de los centros especializados de MCH, la mortalidad hospitalaria asociada a MS es <1% y el alivio de la obstrucción y la mejoría de los síntomas se logra en más del 95% de los pacientes1. La miectomía exitosa elimina o reduce la insuficiencia valvular mitral mediada por SAM, puede reducir del tamaño de la aurícula izquierda y determinar un pequeño grado de remodelación inversa del ventrículo izquierdo.
Las complicaciones después de la miectomía son raras cuando se realizan en centros experimentados. El defecto septal ventricular iatrogénico ocurre en menos del 1% de los pacientes, y el bloqueo cardíaco completo posoperatorio que requiere estimulación permanente se ha informado en 1%-4% de los pacientes2. Sin embargo, el riesgo de bloqueo cardíaco completo aumenta al 20%-30% en pacientes con bloqueo de rama derecha preexistente como ocurre comúnmente después de la ASA. Evitar el bloqueo cardíaco y la necesidad de un MP permanente es importante, especialmente en pacientes jóvenes, ya que el ritmo ventricular estimulado se asocia de forma independiente con mayor mortalidad después de la miectomía2.
El alivio de la obstrucción del flujo de salida por la MS puede extender la sobrevida de pacientes con MCH. Aunque no se han realizado ensayos randomizados que involucren la miectomía quirúrgica, en estudios no randomizados, da como resultado una excelente supervivencia a largo plazo, similar a la de la población general durante la primera década después de la operación. En un estudio, la ausencia de muerte relacionada con la MCH después de la MS fue del 98% y 95% a los 5 y 10 años, respectivamente3. Esta sobrevida fue superior a la de los pacientes con MCH obstructiva que no se sometieron a la miectomía quirúrgica. De manera similar, la tasa de MSC o descarga adecuada del DAI después de la miectomía es muy baja3.
La insuficiencia mitral en pacientes con MCH obstructiva generalmente se debe a SAM de la válvula mitral, y la eliminación del SAM por miectomía elimina o disminuye la fuga de la válvula mitral. Aproximadamente 5% de los pacientes que se someten a MS quirúrgica tienen enfermedad valvular mitral intrínseca debido a flacidez o prolapso de segmentos de la valva y/o calcificación anular. Cuando es necesario un procedimiento directo sobre la válvula en el momento de la miectomía, se debe realizar una reparación valvular siempre que sea posible en lugar de reemplazo, ya que esto se asocia con mejor sobrevida a largo plazo.
En general, la miectomía quirúrgica es ventajosa en comparación con ASA en lo que respecta al alivio del gradiente y mejora sintomática. Un metaanálisis realizado por Osman demostró que una repetición de la intervención fue más frecuente después de ASA que luego de la MS (11% versus 1,5%)4, y en nuestra experiencia, con un seguimiento a largo plazo, más de 1/3 de los pacientes que recibieron una ASA requerirán reintervención dentro de los 10 años siguientes al procedimiento inicial5.
El paciente presentado tiene hipertrofia ventricular difusa y obstrucción tanto en el ventrículo medio como en el tracto de salida. La MS proporcionaría un alivio de la obstrucción, que se logra con una extensión adecuada de la miectomía6. Para los pacientes con obstrucción ventricular media asociada, generalmente extendemos la miectomía lo más posible hacia el ápex. Si existe obstrucción residual luego de finalizar la circulación extracorpórea, se realiza una miectomía adicional a través del abordaje transapical7.
El éxito de la ASA depende del curso anatómico de la rama septal de la arteria descendente anterior. No se muestra información sobre la anatomía coronaria de este paciente, y no sabemos si la ASA es aplicable. El área infartada con ASA generalmente se limita al septum subaórtico, y expandir la ablación sería técnicamente difícil y potencialmente riesgoso. Además, el alivio de la obstrucción con ASA es menos seguro en pacientes con hipertrofia septal grave.
Las directrices del ACC/AHA sugieren que los pacientes con grosor septal masivo cercano o superior a 30 mm pueden experimentar poco o ningún beneficio de la ASA8. Esto también está respaldado por las directrices de la Sociedad Europea de Cardiología. Este paciente tiene un grosor septal de 35 mm y puede no ser un buen candidato para ASA.
Es importante tener en cuenta que el gradiente de presión en este paciente es bastante lábil, leve en reposo pero aumentó considerablemente después de la provocación. Durante la MS, la disminución de la obstrucción es inmediata y el gradiente de presión provocado se puede medir de forma segura provocando una contracción ventricular prematura. La disminución máxima del gradiente de presión después del ASA generalmente se retrasa hasta 3 meses8. Como se indicó anteriormente, es probable que el paciente tenga un mejor alivio de la obstrucción con la MS en comparación con la ASA.
Teniendo en cuenta los antecedentes de dislipemia, diabetes mellitus tipo 2 mal controlada e hipertensión arterial, la paciente debe ser examinada para detectar enfermedad coronaria. De presentarse, las enfermedades cardiovasculares pasibles de intervención quirúrgica, como enfermedad de las arterias coronarias e insuficiencia valvular mitral intrínseca pueden tratarse en el momento de la MS.
También se deben considerar las complicaciones a largo plazo y del procedimiento. La anormalidad de conducción más común después de la MS es el bloqueo de rama izquierda (BRI), que ocurre en aproximadamente el 38% de los pacientes sometidos a MS. Nuestro seguimiento a largo plazo ha demostrado que BRI no afecta la sobrevida después de la miectomía2. El bloqueo cardíaco completo se asocia con una supervivencia reducida, pero es muy infrecuente (<1%) en pacientes con conducción preoperatoria normal2. La ASA tiene una incidencia mucho mayor de bloqueo cardíaco completo (10%-20%)9. Además, se asocia con una alta incidencia de BRD. Teniendo en cuenta la tasa de reintervención relativamente alta después de ASA, el BRD confiere un alto riesgo de bloqueo cardíaco completo en pacientes que requieren una miectomía quirúrgica posterior.
Aunque la ASA ofrece una opción adicional para pacientes sintomáticos con MCH obstructiva, el mecanismo de alivio de gradiente (infarto septal) limita sus indicaciones y efectividad. La MS ofrece un alivio inmediato más predecible de la obstrucción del tracto de salida del VI con excelentes resultados a largo plazo y, por lo tanto, sería preferible para esta paciente. Sin embargo, debe tenerse en cuenta que la experiencia del operador influye en el efecto y la seguridad tanto de la miectomía quirúrgica como de la ASA10. La disponibilidad y experiencia de quienes realizan los dos procedimientos deben considerarse en la toma de decisiones clínicas. El paciente debe estar completamente informado de todos los aspectos de los procedimientos antes de tomar una decisión terapéutica.
Bibliografía:
1. Maron BJ, Dearani JA, Ommen SR, Maron MS, Schaff HV, Nishimura RA, et al. Low operative mortality achieved with surgical septal myectomy: role of dedicated hypertrophic cardiomyopathy centers in the management of dynamic subaortic obstruction. J Am Coll Cardiol. 2015;66(11):1307-8. doi: 10.1016/j.jacc.2015.06.1333 [ Links ]
2. Cui H, Schaff HV, Nishimura RA, Geske JB, Dearani JA, Lahr BD, et al. Conduction abnormalities and long-term mortality following septal myectomy in patients with obstructive hypertrophic cardiomyopathy. J Am Coll Cardiol. 2019;74(5):645-55. doi: 10.1016/j.jacc.2019.05.053 [ Links ]
3. Ommen SR, Maron BJ, Olivotto I, Maron MS, Cecchi F, Betocchi S, et al. Long-term effects of surgical septal myectomy on survival in patients with obstructive hypertrophic cardiomyopathy. J Am Coll Cardiol. 2005;46(3):470-6. doi:10.1016/j.jacc.2005.02.090 [ Links ]
4. Osman M, Kheiri B, Osman K, Barbarawi M, Alhamoud H, Alqahtani F, et al. Alcohol septal ablation vs myectomy for symptomatic hypertrophic obstructive cardiomyopathy: Systematic review and meta-analysis. Clin Cardiol. 2019;42(1):190-7. doi: 10.1002/clc.23113 [ Links ]
5. Nguyen A, Schaff HV, Hang D, Nishimura RA, Geske JB, Dearani JA, et al. Surgical myectomy versus alcohol septal ablation for obstructive hypertrophic cardiomyopathy: a propensity score-matched cohort. J Thorac Cardiovasc Surg. 2019;157(1): 306-15.e3. doi: 10.1016/j.jtcvs.2018.08.062 [ Links ]
6. Schaff HV, Said SM. Transaortic extended septal myectomy for hypertrophic cardiomyopathy. Oper Tech Thorac Cardiovasc Surg. 2012;17(4):238-50. doi: 10.1053/j.optechstcvs.2012.04.002 [ Links ]
7. Hang D, Schaff HV, Ommen SR, Dearani JA, Nishimura RA. Combined transaortic and transapical approach to septal myectomy in patients with complex hypertrophic cardiomyopathy. J Thorac Cardiovasc Surg. 2018;155(5):2096-102. doi: 10. 1016/j.jtcvs.2017.10.054 [ Links ]
8. Gersh BJ, Maron BJ, Bonow RO, Dearani JA, Fifer MA, Link MS, et al. 2011 ACCF/AHA Guideline for the diagnosis and treatment of hypertrophic cardiomyopathy: a report of the American College of Cardiology Foundation/American Heart Association task force on practice guidelines. Developed in collaboration with the American Association for Thoracic Surgery, American Society of Echocardiography, American Society of Nuclear Cardiology, Heart Failure Society of America, Heart Rhythm Society, Society for Cardiovascular Angiography and Interventions, and Society of Thoracic Surgeons. J Am Coll Cardiol. 2011;58(25): e212-60. doi: 10.1016/j.jacc.2011.06.011 [ Links ]
9. Batzner A, Pfeiffer B, Neugebauer A, Aicha D, Blank C, Seggewiss H. Survival after alcohol septal ablation in patients with hypertrophic obstructive cardiomyopathy. J Am Coll Cardiol. 2018; 72(24): 3087-94. doi: 10.1016/j.jacc.2018.09.064 [ Links ]
10. Kim LK, Swaminathan RV, Looser P, Minutello RM, Wong SC, Bergman G, et al. Hospital volume outcomes after septal myectomy and alcohol septal ablation for treatment of obstructive hypertrophic cardiomyopathy: US nationwide in patient database, 2003-2011. JAMA Cardiol. 2016;1(3):324-32. doi: 10.1001/jamacardio.2016.0252 [ Links ]
Articles
Respuesta del Dr. Pedro Trujillo
Comentarios finales
Para concluir, me parece relevante mencionar tres aspectos adicionales que contribuyen a la controversia planteada:
1. La existencia de diferencias notorias en la efectividad y morbimortalidad de las terapias de reducción septal entre los centros especializados de referencia y los centros generales (no de referencia). Este hecho es apreciable en Uruguay y en el mundo, imponiendo la necesidad de un vínculo con estos centros especializados para minimizar diferencias en los resultados y optimizarlos.
2. La necesidad de un “MCH team” con representantes de ambas terapias de reducción septal (cardiólogo intervencionista y cirujano cardíaco) para la toma de decisiones terapéuticas.
3. Subrayar que la disponibilidad e idoneidad del operador son los criterios más importantes para lograr buenos resultados tanto en la MS como en la ASA
Articles
Respuesta del Dr. Hartzell Schaff
El Dr. Trujillo resumió las ventajas y limitaciones de la ASA y la MS, pero varios puntos son controvertidos.
Estamos de acuerdo en que ASA es menos invasivo, siendo esta su principal ventaja. A diferencia de la ASA, la MS quirúrgica se realiza bajo anestesia general y confiere los riesgos comunes de la cirugía cardiovascular. A pesar de esta diferencia, Kimmelstiel informó que la estadía hospitalaria es comparable entre los pacientes que se someten a MS y ASA1. En algunos centros, la MS se realiza de forma mínimamente invasiva con abordaje robótico o por minitoracotomía derecha2-4. Los resultados también son excelentes. Sin embargo, es importante tener en cuenta que la consideración de mayor invasividad, no debe limitarse a las heridas quirúrgicas externas, sino también al daño del músculo cardíaco. El infarto de miocardio permanente y sus secuelas luego de realizar una ASA deben considerarse al comparar la invasividad5.
El Dr. Trujillo también mencionó que ASA y MS tuvieron resultados similares con respecto a la mejora hemodinámica, la regurgitación mitral posterior al procedimiento y la tasa de reintervención. Esto es inconsistente con varios estudios previos. Aunque la CF después de ASA puede ser comparable a la que sigue a la MS, esto se logra en muchos pacientes después de un nuevo procedimiento de ASA o de una MS. Además, el gradiente residual pos-ASA parece ser significativamente más alto que los gradientes después de MS6. La cohorte más grande reportada de pacientes derivados a ASA, tenía un gradiente residual en reposo de 34 ± 30 mmHg, en comparación con un gradiente de presión residual mínimo, después de MS7. Esto se acompaña de una mayor frecuencia y gravedad de la insuficiencia valvular mitral relacionada con SAM1. Los gradientes residuales y los síntomas dan como resultado una tasa relativamente alta de intervención en pacientes después de ASA, que oscila entre 7,1% y 35%1,6,8. En contraste, la ausencia de nueva intervención después de MS es del 99%6. La MS después de una ASA fallida puede aliviar los gradientes y los síntomas, pero la operación después de un infarto septal previo se asocia con mayor riesgo de muerte cardíaca, insuficiencia cardíaca avanzada y descargas de DAI9. Además, la necesidad de MP permanente aumenta en pacientes sometidos a MS después de ASA, lo que aumenta la morbilidad, mortalidad y costos, y puede llevar a una menor sobrevida alejada10.
En conclusión, creemos que la MS quirúrgica es la opción óptima para la reducción septal en la mayoría de los pacientes con MCH. Tiene claras ventajas en términos de reducción predecible de gradientes de presión y baja tasa de reintervención, en comparación con ASA. Esta última generalmente es menos invasiva y puede ser una alternativa para aquellos pacientes con síntomas refractarios al tratamiento médico máximo, que no pueden tolerar un procedimiento cardíaco abierto.
Bibliografía
1. Kimmelstiel C, Zisa D, Kuttab J, Wells S, Udelson J, Wessler B, et al. Guideline-based referral for septal reduction therapy in obstructive hypertrophic cardiomyopathy is associated with excellent clinical outcomes. Circ Cardiovasc Interv. 2019; 12(7):e007673. doi: 10.1161/CIRCINTERVENTIONS.118.007673 [ Links ]
2. Khalpey Z, Korovin L, Chitwood WJr, Poston R. Robot-assisted septal myectomy for hypertrophic cardiomyopathy with left ventricular outflow tract obstruction. J Thorac Cardiovasc Surg. 2014; 147(5): 1708-9. doi: 10.1016/j.jtcvs.2013.12.017 [ Links ]
3. Chou N, Okano R, Tedoriya T, Wu I, Yu H, Chen Y, et al. Robotic transmitral approach for hypertrophic cardiomyopathy with systolic anterior motion. Circ J. 2018; 82(11):2761-6. doi: 10.1253/circj.CJ-17- 1369 [ Links ]
4. Gilmanov D, Bevilacqua S, Solinas M, Ferrarini M, Kallushi E, Santarelli P, et al. Minimally invasive septal myectomy for the treatment of hypertrophic obstructive cardiomyopathy and intrinsic mitral valve disease. Innovations (Phila) 2015; 10(2): 106-13. doi: 10.1097/IMI.0000000000000132 [ Links ]
5. Valeti U, Nishimura R, Holmes D, Araoz P, Glockner J, Breen J, et al. Comparison of surgical septal myectomy and alcohol septal ablation with cardiac magnetic resonance imaging in patients with hypertrophic obstructive cardiomyopathy. J Am Coll Cardiol. 2007; 49(3):350-7. doi: 10.1016/j.jacc.2006. 08.055 [ Links ]
6. Nguyen A, Schaff H, Hang D, Nishimura R, Geske J, Dearani J, et al. Surgical myectomy versus alcohol septal ablation for obstructive hypertrophic cardiomyopathy: a propensity score-matched cohort. J Thorac Cardiovasc Surg. 2019; 157(1): 306-315.e3. doi: 10.1016/j.jtcvs.2018.08.062 [ Links ]
7. Nguyen A, Schaff H, Nishimura R, Dearani J, Geske J, Lahr B, et al. Does septal thickness influence outcome of myectomy for hypertrophic obstructive cardiomyopathy? Eur J Cardiothorac Surg 2018; 53(3):582-9. doi: 10.1093/ejcts/ezx398 [ Links ]
8. Batzner A, Pfeiffer B, Neugebauer A, Aicha D, Blank C, Seggewiss H. Survival after alcohol septal ablation in patients with hypertrophic obstructive cardiomyopathy. J Am Coll Cardiol. 2018; 72(24): 3087-94. doi: 10.1016/j.jacc.2018.09.064 [ Links ]
9. Quintana E, Sabate-Rotes A, Maleszewski J, Ommen S, Nishimura R, Dearani J, et al. Septal myectomy after failed alcohol ablation: does previous percutaneous intervention compromise outcomes of myectomy? J Thorac Cardiovasc Surg. 2015; 150(1): 159-67.e1. doi: 10.1016/j.jtcvs.2015.03.044 [ Links ]
10. Cui H, Schaff H, Nishimura R, Geske J, Dearani J, Lahr B, et al. Conduction abnormalities and long-term mortality following septal myectomy in patients with obstructive hypertrophic cardiomyopathy. J Am Coll Cardiol. 2019; 74(5):645-55. doi: 10.1016/j.jacc.2019.05.053 [ Links ]
Articles
Septal alcohol ablation is the treatment of choice
1. Clinical analysis and diagnosis
60-year-old woman, multiple cardiovascular risk factors, with a systolic murmur in mesocardium, 3/6 grade, compatible with obstruction to the left ventricular outflow tract, without irradiation and exacerbated with Valsalva maneuver (decreased venous return and increased contractility), which is consistent with obstructive hypertrophic cardiomyopathy (HCM). Dyspnea on exertion NYHA III is the main symptom, linked to diastolic failure of a rigid left ventricle and abnormal ventricular relaxation, whose substrate is severe hypertrophy, fibrosis and ischemia.
Echocardiogram confirms the HCM (parietal thickness >15 mm that cannot be explained by patient’s loading conditions)1 and its asymmetric and obstructive septal phenotype. Interventricular septum 35 mm of maximum thickness, elongated mitral valve and dilated left atrium stands out anatomically. Functionally, the anterior systolic movement of the anterior mitral leaflet, subvalvular gradients (rest/Valsalva) of 35/90 mmHg, average ventricular gradient of 15 mmHg and mild mitral insufficiency.
She receives beta blockers treatment at very high doses, reaching heart rate objective (Holter), with probable side effects (orthostatic hypotension) and poor response due to staying in NYHA III, constituting a refractory behavior.
2. Treatment
The treatment of obstructive HCM requires understand the underlying pathophysiological mechanisms and should be individualized, taking into the account severity of the obstruction, presence of symptoms, cardiac comorbidities, surgical risk, local experience in invasive therapies and patient preferences.
This patient has indication of invasive septal reduction (35 mm septal hypertrophy, gradient caused in the left ventricular outflow tract >50 mm Hg, with dyspnea in NYHA functional class III despite pharmacological treatment at maximum tolerated dose)1. Septal reduction therapy includes septal myectomy (SM) and alcohol septal ablation (ASA), recommending that these are carried out within a comprehensive and multidisciplinary program of care2. In both therapies the main goal is to reduce the basal septum and therefore the obstruction produced by contact of the mitral anterior leaflet (Venturi effect) and interventricular septum.
There are no randomized studies comparing both treatments, but there are observational studies and meta-analysis that confirm similar results in terms of mortality, hemodynamic and functional improvement, occurrence of ventricular arrhythmia, reintervention and post procedure mitral regurgitation, evaluated in the short and long term3. Similarly, a significant difference in the occurrence of complete right bundle branch block (CRBBB) and the need for pacemaker (PM) is identified in the group of patients treated with ASA. Although SM is considered the “gold standard” septal reduction treatment, a major consideration is the patients selection for both techniques. Then, is necessary in this patient an evaluation with transesophageal echocardiography or MRI, as well a coronary angiography. The identification of severe coronary disease, structural alterations of mitral valve apparatus (anomalous insertion of papillary muscles and redundant leaflets) and the absence of coronary anatomy favorable to ASA, should be considered as major events in favor of SM. Another characteristic to consider in this patient is massive hypertrophy (35 mm septum), belonging to a group of patients where the results with ASA are generally less effective and SM is favored by more predictable results. An average ventricular gradient of 15 mmHg (which does not increase with Valsalva) is not an initial therapeutic objective. The obstruction produced by the anterior mitral leaflet in contact with the basal septum need to be treated. If a greater dynamic mid-ventricular gradient is confirmed, it is an argument in favor of the SM with extended technique, because ASA has less predictable results in this anatomical variant. Surgical risk does not play a role in the therapeutic decision in our patient since it does not present major comorbidities that condition the surgery.
ASA has the advantage of being a minimally invasive procedure, without need of general anesthesia or thoracic incision, with less pain and general discomfort for the patient, less recovery time and hospital stay. In addition, the ASA has comparable results as mentioned, but the reduction of gradients can be delayed (3 months). In this particular case, if major contraindications for ASA are ruled out (severe coronary disease, structural disorders of mitral valve apparatus and anatomy of septal branches not favorable for ASA), it could be considered as alternative (for instance, if the patient does not accept surgery) being a less invasive initial treatment, with a higher risk of need for MP (10-15%)4. In this case, the perforant branch must be identified initially by angiography (usually 1st or 2nd septal of the anterior descending artery, more rarely being born from another origin) responsible for the irrigation of the basal septum that determines the obstruction of the outflow tract of the left ventricle5,6. This correlation between a certain septal branch and the sector to be infarcted with alcohol is achieved with the injection of ultrasound contrast by the branch involved and the visualization by echocardiography (4 chambers and para-sternal long axis views) of the irrigation zone matching with the mitral-septal contact. The identification of the left sub division of the perforant involved and the administration of low volumes of absolute ethanol (1-2 cm3) are associated with fewer complications, especially heart block7.
3. Conclusions
We have analyzed a 65-year-old female patient with an obstructive HCM, symptomatic in NYHA III and refractory to medical treatment, which has an indication of septal reduction. Its analysis should be complemented with a trans esophageal echocardiogram or MRI and coronary angiography, to rule out abnormalities of the mitral valve system and evaluate association with coronary heart disease and distribution of septal branches, respectively. ASA may be the least invasive initial treatment option if the patient does not accept surgery, with globally similar results in multiple aspects in the short and long term and a higher risk of developing heart block that should be minimized with the application of the tightest technique.
Bibliography:
1. Elliott PM, Anastasakis A, Borger MA, Borggrefe M, Cecchi F, Charron P, et al. 2014 ESC guidelines on diagnosis and management of hypertrophic cardiomyopathy: the task force for the diagnosis and management of hypertrophic cardiomyopathy of the European Society of Cardiology (ESC). Eur Heart J. 2014;35(39):2733-79. doi: 10.1093/eurheartj/ehu284 [ Links ]
2. Gersh BJ, Maron BJ, Bonow RO, Dearani JA, Fifer MA, Link MS, et al. 2011 ACCF/AHA Guideline for the diagnosis and treatment of hypertrophic cardiomyopathy: a report of the American College of Cardiology Foundation/American Heart Association task force on practice guidelines. Developed in collaboration with the American Association for Thoracic Surgery, American Society of Echocardiography, American Society of Nuclear Cardiology, Heart Failure Society of America, Heart Rhythm Society, Society for Cardiovascular Angiography and Interventions, and Society of Thoracic Surgeons. J Am Coll Cardiol. 2011;58(25): e212-60. doi: 10.1016/j.jacc.2011.06.011 [ Links ]
3. Agarwal S, Tuzcu EM, Desai MY, Smedira N, Lever HM, Lytle BW, et al. Updated meta-analysis of septal alcohol ablation versus myectomy for hypertrophic cardiomyopathy. J Am Coll Cardiol. 2010; 55(8):823-34. doi: 10.1016/j.jacc.2009.09.047 [ Links ]
4. Faber L, Meissner A, Ziemssen P, Seggewiss H. Percutaneous transluminal septal myocardial ablation for hypertrophic obstructive cardiomyopathy: long term follow up of the first series of 25 patients.Heart. 2000; 83(3):326-31. doi:10.1136/heart. 83.3.326 [ Links ]
5. Holmes DR, Jr, Valeti US, Nishimura RA. Alcohol septal ablation for hypertrophic cardiomyopa-thy: indications and technique. Catheter Cardiovasc Interv. 2005; 66(3):375-89. doi:10.1002/ccd.20500 [ Links ]
6. Singh M, Edwards WD, Holmes DR, Tajil AJ, Nishimura RA. Anatomy of the first septal perforating artery: a study with implications for ablation therapy for hypertrophic cardiomyopathy. Mayo Clin Proc. 2001;76(8):799-802. [ Links ]
7. Veselka J, Duchonová R, Procházková S, Pálenícková J, Sorajja P, Tesar D. Effects of varying ethanol dosing in percutaneous septal ablation for obstructive hypertrophic cardiomyopathy on early hemodynamic changes. Am J Cardiol. 2005; 95(5): 675-8. doi:10.1016/j.amjcard.2004.10.050 [ Links ]
Articles
Septal myectomy is the treatment of choice
In patients with hypertrophic cardiomyopathy (HCM), left ventricular outflow tract obstruction is caused by septal hypertrophy and associated systolic anterior motion (SAM) of the mitral valve leaflet. Septal reduction therapy is the treatment of choice for those patients whose symptoms are refractory to maximal medical treatment. SM and transcatheter alcohol septal ablation (ASA) are the two commonly used methods of septal reduction. Although SM is recognized as the preferred treatment by most clinicians, alcohol septal ablation is also widely used in centers lacking experience with surgical myectomy. Indeed, ASA has a similar long-term effect on survival in selected patients compared to SM. For patients who are candidates for septal reduction therapy, the choice of treatment must be made with full understanding and consideration of the differences between the two procedures.
The case presented is a typical patient with obstructive HCM. She has severe hypertrophy of the left ventricle with a septal thickness of 35 mm. An important finding is a midventricular pressure gradient in addition to a subaortic pressure gradient, a feature which should strongly influence the choice of therapy. Importantly, the description of the patient suggests that she would be a good candidate for operation with a very low predicted periprocedural risk (<1%).
Transaortic extended SM is an appropriate treatment for the broadest range of patients with obstructive HCM. The operation described by Morrow has been considerably refined with emphasis on extending the length of septal excision toward the apex of the ventricle beyond the area of mitral septal contact to eliminate SAM. There is a wide anatomic spectrum of obstructive HCM from relatively isolated basal septal hypertrophy to long segments of septal hypertrophy extending the mid ventricle and apex. Surgical myectomy allows relief of obstruction at all levels, and the transaortic approach can be supplemented with transapical approach to midventricular obstruction. Indeed, excision of an adequate length of septal myocardium is the key to adequate gradient relief, and failure to carry the septectomy far enough toward the apex of the heart is the most common cause of an unsuccessful surgical procedure.
In contemporary practice at specialized HCM centers, hospital mortality associated with SM is <1% and relief of obstruction and improvement in symptoms is achieved in over 95% of patients1. Successful myectomy eliminates or reduces SAM mediated mitral valve regurgitation and leads to reduction in left atrial size and a small degree of left ventricular reverse remodeling.
Complications following myectomy are rare when performed in experienced centers. Iatrogenic ventricular septal defect occurs in less than 1% of patients, and postoperative complete heart block (CHB) necessitating permanent pacing has been reported in 1-4% of patients2. Risk of CHB is, however, increased to 20 to 30% in patients with pre-existing right bundle branch block as commonly occurs following alcohol septal ablation. Avoiding CHB and need for permanent pacemaker is important, especially in young patients, as ventricular paced rhythm is independently associated with increased mortality in patients postmyectomy2.
Relief of outflow obstruction by SM may extend the longevity of patients with HCM. Although randomized trials involving surgical myectomy have not been performed, in nonrandomized studies, myectomy results in excellent long-term survival similar to that in the general population during the first decade postoperatively. Indeed, in one study freedom from HCM-related death after SM, was 98% and 95% at 5 and 10 years, respectively3. This survival was superior to that achieved by patients with obstructive HCM who did not undergo surgical myectomy. Similarly, the rate of sudden cardiac death or appropriate implantable cardioverter-defibrillator discharge after myectomy is very low3.
Mitral valve regurgitation in patients with obstructive HCM is usually due to SAM of the mitral valve, and elimination of SAM by myectomy will abolish or improve mitral valve leakage. Approximately 5% of patients undergoing operation for septal myectomy will have intrinsic mitral valve disease due to flail or prolapsing leaflet segments and/or annular calcification, and when a direct procedure on the valve is necessary at the time of myectomy, valve repair should be performed whenever possible rather than replacement as this is associated with improved late survival.
In general, surgical myectomy is advantageous compared to ASA in regard to gradient relief and symptomatic improvement. A meta-analysis by Osman and associates demonstrated that repeat intervention was more common following ASA than SM (11% versus 1.5%)4, and in our experience, with extended late follow-up, more than one-third of patients undergoing ASA will require reintervention 10 years after the initial procedure5.
The patient presented has diffuse ventricular hypertrophy and obstruction in both the mid ventricle and outflow tract. SM provides predictable relief of obstruction which is achieved by adequate length of myectomy6. For patients with associated mid-ventricular obstruction, we usually extend the myectomy toward the apex as far as possible. If residual obstruction exists after weaning from bypass, further myectomy will be performed through the transapical approach7.
Successful alcohol septal ablation depends on the anatomical course of the septal branch of the left anterior descending coronary artery. Information on the coronary anatomy of this patient is not shown, and we do not know if ASA is applicable. The ablated area with ASA is usually limited to the subaortic septum, and expanding the ablation would be technically difficult and potentially risky. Moreover, relief of obstruction with ASA is less certain in patients who have severe septal hypertrophy. The American College of Cardiology/American Heart Association guidelines suggest that patients with massive septal thickness approaching or exceeding 30 mm may experience little or no benefit from septal ablation8. This is also supported by the European Society of Cardiology guidelines. This patient has a septal thickness of 35 mm and may not be a good candidate for ASA.
It is important to note that the pressure gradient in this patient is quite labile, mild at rest but increased considerably after provocation. During SM, the decrease of the obstruction is immediate and the provoked pressure gradient can be measured safely by eliciting a premature ventricular contraction. Remyectomy can be done immediately if the initial relief of obstruction is unsatisfactory. The maximal decrease of pressure gradient following ASA, however, is usually delayed for up to 3 months8. As stated above, the patient is likely to have a better relief of obstruction with septal myectomy compared to ASA.
Considering the history of dyslipidemia, poorly controlled type II diabetes mellitus, and arterial hypertension, the patient should be screened for coronary artery disease. Concomitant cardiovascular diseases appropriate for surgical intervention, such as coronary artery disease and intrinsic mitral valve regurgitation can be addressed at the time of septal myectomy.
Procedural and long-term complications should also be considered. The most common conduction abnormality following septal myectomy is left bundle branch block (LBBB), which occurs in approximately 38% of the patients undergoing septal myectomy. Our long-term follow-up has shown that LBBB does not impact survival following myectomy2. Complete heart block is associated with reduced survival, but it is very rare (<1%) in patients with normal conduction preoperatively2. Alcohol septal ablation has a much higher incidence of complete heart block (10%-20%)(9). Additionally, alcohol septal alcohol ablation is associated with a high incidence of right bundle branch block (RBBB). Considering the relatively high reintervention rate after ASA, a RBBB confers a high risk of complete heart block in patients who require subsequent surgical myectomy.
Though ASA provides an additional choice for symptomatic patients with obstructive HCM, the mechanism of gradient relief, septal infarction, limits its indications and effectiveness. SM offers more predictable immediate relief of left ventricular outflow tract obstruction with excellent long-term outcomes, and therefore would be preferred for this patient at our Clinic. However, it should be noted that experience of the operator influences the effect and safety of both surgical myectomy and ASA.(10) The availability and expertise of those performing the two procedures must be considered in clinical decision making The patient needs to be fully informed of all aspects of the procedures before she makes a decision for therapy.
Bibliography:
1. Maron BJ, Dearani JA, Ommen SR, Maron MS, Schaff HV, Nishimura RA, et al. Low operative mortality achieved with surgical septal myectomy: role of dedicated hypertrophic cardiomyopathy centers in the management of dynamic subaortic obstruction. J Am Coll Cardiol. 2015;66(11):1307-8. doi: 10.1016/j.jacc.2015.06.1333 [ Links ]
2. Cui H, Schaff HV, Nishimura RA, Geske JB, Dearani JA, Lahr BD, et al. Conduction abnormalities and long-term mortality following septal myectomy in patients with obstructive hypertrophic cardiomyopathy. J Am Coll Cardiol. 2019;74(5):645-55. doi: 10.1016/j.jacc.2019.05.053 [ Links ]
3. Ommen SR, Maron BJ, Olivotto I, Maron MS, Cecchi F, Betocchi S, et al. Long-term effects of surgical septal myectomy on survival in patients with obstructive hypertrophic cardiomyopathy. J Am Coll Cardiol. 2005;46(3):470-6. doi:10.1016/j.jacc.2005.02.090 [ Links ]
4. Osman M, Kheiri B, Osman K, Barbarawi M, Alhamoud H, Alqahtani F, et al. Alcohol septal ablation vs myectomy for symptomatic hypertrophic obstructive cardiomyopathy: Systematic review and meta-analysis. Clin Cardiol. 2019;42(1):190-7. doi: 10.1002/clc.23113 [ Links ]
5. Nguyen A, Schaff HV, Hang D, Nishimura RA, Geske JB, Dearani JA, et al. Surgical myectomy versus alcohol septal ablation for obstructive hypertrophic cardiomyopathy: a propensity score-matched cohort. J Thorac Cardiovasc Surg. 2019;157(1): 306-15.e3. doi: 10.1016/j.jtcvs.2018.08.062 [ Links ]
6. Schaff HV, Said SM. Transaortic extended septal myectomy for hypertrophic cardiomyopathy. Oper Tech Thorac Cardiovasc Surg. 2012;17(4):238-50. doi: 10.1053/j.optechstcvs.2012.04.002 [ Links ]
7. Hang D, Schaff HV, Ommen SR, Dearani JA, Nishimura RA. Combined transaortic and transapical approach to septal myectomy in patients with complex hypertrophic cardiomyopathy. J Thorac Cardiovasc Surg. 2018;155(5):2096-102. doi: 10. 1016/j.jtcvs.2017.10.054 [ Links ]
8. Gersh BJ, Maron BJ, Bonow RO, Dearani JA, Fifer MA, Link MS, et al. 2011 ACCF/AHA Guideline for the diagnosis and treatment of hypertrophic cardiomyopathy: a report of the American College of Cardiology Foundation/American Heart Association task force on practice guidelines. Developed in collaboration with the American Association for Thoracic Surgery, American Society of Echocardiography, American Society of Nuclear Cardiology, Heart Failure Society of America, Heart Rhythm Society, Society for Cardiovascular Angiography and Interventions, and Society of Thoracic Surgeons. J Am Coll Cardiol. 2011;58(25): e212-60. doi: 10.1016/j.jacc.2011.06.011 [ Links ]
9. Batzner A, Pfeiffer B, Neugebauer A, Aicha D, Blank C, Seggewiss H. Survival after alcohol septal ablation in patients with hypertrophic obstructive cardiomyopathy. J Am Coll Cardiol. 2018; 72(24):3087-94. doi: 10.1016/j.jacc.2018.09.064 [ Links ]
10. Kim LK, Swaminathan RV, Looser P, Minutello RM, Wong SC, Bergman G, et al. Hospital volume outcomes after septal myectomy and alcohol septal ablation for treatment of obstructive hypertrophic cardiomyopathy: US nationwide in patient database, 2003-2011. JAMA Cardiol. 2016;1(3):324-32. doi: 10.1001/jamacardio.2016.0252 [ Links ]
Articles
Dr. Pedro Trujillo Final comments
In conclusion, it seems relevant to mention three additional aspects that contribute to the controversy:
1. The existence of notable differences in the effectiveness, morbidity and mortality of septal reduction therapies between specialized reference centers and general (non-reference) centers. This fact is noticeable in Uruguay (and all over the world), imposing the need for a link with these specialized centers to minimize differences in outcomes, and optimize them.
2. The need for an “HMC team” with specialists of both septal reduction therapies (interventional cardiologist and cardiac surgeon) for therapeutic decision making.
3. The availability and suitability of the operator are the most important criteria for achieving good results in both, SM and ASA.
Articles
Reply of Dr. Hartzell V. Schaff
Dr. Trujillo summarized the advantages and limitations of ASA and SM, but several points are controversial.
We agree with him that ASA is less invasive, which is the main advantage of ASA. In contrast to ASA, surgical myectomy is carried out under general anesthesia and confers the common risks of cardiovascular surgery. Despite the difference in invasiveness, Kimmelstiel et al reported that the hospital stay is comparable between patients undergoing myectomy and those undergoing ASA1. In some centers, SM has been performed minimal-invasively with robotic approaches or right mini-thoracotomy2-4. The results were also excellent. It is important to note, however, that consideration of invasiveness should not be limited to external surgical wounds but also to damage to the heart muscle. Permanent myocardial infarction and its sequelae after ASA should be considered when comparing invasiveness5.
Dr. Trujillo also mentioned that ASA and myectomy had similar results with regards to hemodynamic improvement, postprocedure mitral regurgitation, and reintervention rate. This is inconsistent with several prior studies. Although functional class after ASA may be comparable to that following SM, this is achieved in many patients after reintervention for repeat ASA or for surgical myectomy. Further, the residual gradient post-ASA appears to be significantly higher than gradients after myectomy6. The largest reported ASA cohort had a residual resting gradient of 34±30 mmHg, compared to the minimal residual pressure gradient following myectomy7, and this is accompanied by greater frequency and severity of SAM-related mitral valve regurgitation1. The residual gradients and symptoms result in a relatively high rate of reintervention in patients following ASA. The reported reintervention rate after prior ASA ranges from 7.1% to 35%1,6,8. In contrast, the reported freedom from repeat intervention after myectomy is 99%6. SM after failed ASA can relieve gradients and symptoms, but operation following prior septal infarction is associated with increased risks of cardiac death, advanced heart failure, and implantable cardioverter-defibrillator discharges9. Moreover, the need for permanent pacing is increased in patients undergoing myectomy after ASA which increases both morbidity and cost and may lead to reduced late survival10.
In conclusion, we believe that SM is the optimal choice for septal reduction for most patients with obstructive hypertrophic cardiomyopathy. It has clear advantages in terms of predictable reduction of pressure gradients and low reintervention rate when compared to ASA. Alcohol septal ablation is generally less invasive and can be an alternative for those patients with medically refractory symptoms who cannot tolerate open-chest cardiac procedures.