Introducción
La elevación de las troponinas por encima del percentil 99 de la normalidad en un contexto sugerente de isquemia miocárdica, configura la base del diagnóstico clínico de infarto agudo de miocardio (IAM)1. La etiología más frecuentemente reconocida es la enfermedad coronaria obstructiva (EC)2. Estudios clásicos demuestran que hasta un 10% de los pacientes con IAM con elevación del segmento ST no presentan lesiones coronarias obstructivas cuando se estudian en las primeras 24 horas desde el inicio del dolor3 y que aproximadamente 60% de los pacientes con IAM sin elevación del segmento ST presentan un vaso ocluido o subocluido en similares condiciones4. En series actuales la coronariografía no revela lesiones coronarias significativas (obstrucción 50%) en 1%-14% de los IAM5-8.
El término MINOCA (infarto agudo de miocardio sin lesiones coronarias obstructivas) fue utilizado por primera vez en el año 2013 por el profesor John Beltrame9, aunque el paciente que cumple los criterios diagnósticos de IAM, pero sin lesiones coronarias obstructivas, ha representado un dilema etiológico y terapéutico desde el inicio del uso de la angiografía coronaria10. El interés por esta entidad se ha retomado con mayor impacto desde la aparición de la resonancia magnética cardíaca (RMC) y la imagen intravascular, que han permitido establecer con claridad creciente las diversas causas desencadenantes y desarrollar una estrategia terapéutica dirigida7,8,11.
MINOCA se presenta con mayor frecuencia en población femenina y comparativamente más joven, con menos factores de riesgo cardiovascular tradicionales para EC y comorbilidades, pero con mayor frecuencia de estados de hipercoagulabilidad5,7,8. Se ha descrito una mortalidad hospitalaria en torno a 0,8%, principalmente de causa cardiovascular12, riesgo de muerte o rehospitalización cardiovascular al año de 11,5%12, e incidencia de muerte cardiovascular, IAM o síndrome coronario agudo (SCA), insuficiencia cardíaca y accidente cerebrovascular a los siete años de 17,4%13. Por lo tanto, lejos de ser una entidad benigna, MINOCA tiene un pronóstico adverso y puede mostrar un resultado significativamente peor en presencia de EC13,14. El conocimiento sobre este tema se ha incrementado de forma exponencial en los últimos años, pero persisten interrogantes que complejizan su abordaje diagnóstico y terapéutico.
Definición y diagnóstico
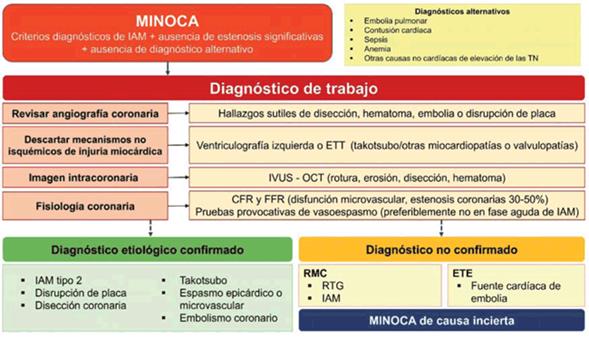
Los consensos internacionales más recientes definen como MINOCA a la documentación clínica de IAM junto a la demostración de arterias coronarias sin lesiones obstructivas significativas (tabla 1)8,15. El problema clínico se inicia cuando un paciente con dolor torácico y troponinas positivas o elevación del segmento ST en el electrocardiograma (EGC), presenta una angiografía sin obstrucción coronaria severa. Es aquí donde un análisis cuidadoso y una alta sospecha clínica son fundamentales para descartar enfermedades con alta mortalidad, como disección de aorta o embolia pulmonar y excluir otros diferenciales posibles, a veces con sintomatología poco específica, como miocarditis y miocardiopatía de takotsubo. Una vez descartadas estas etiologías, es posible plantear que el paciente presenta MINOCA, iniciando un diagnóstico de trabajo con distintas causas16).
La identificación etiológica es esencial para definir el tratamiento adecuado a la fisiopatología y al pronóstico del paciente13,15-17. Las herramientas diagnósticas iniciales del MINOCA incluyen la historia clínica, ECG, troponinas, ecocardiografía transtorácica, angiografía coronaria con test de vasorreactividad y ventriculografía izquierda18. El motivo de consulta suele ser dolor torácico y se manifiesta en el ECG más frecuentemente sin elevación del segmento ST5,8. El valor de corte angiográfico de obstrucción coronaria < 50% es arbitrario y deben reconocerse factores limitantes: existe variabilidad inter e intraobservador de la estimación angiográfica de las estenosis, la trombosis es un proceso dinámico y la presencia de estenosis coronarias significativas no descarta de forma absoluta la posibilidad de MINOCA8,19.
En el escenario agudo se recomienda realizar ventriculografía izquierda o un ecocardiograma transtorácico, o ambos, para valorar la existencia de alteraciones segmentarias de la contractilidad. La embolia pulmonar puede ser la causa de la injuria miocárdica y la aproximación diagnóstica será mediante dímeros D o angiotomografía de arterias pulmonares, o ambos8,14,18. Se debe considerar el uso de RMC con realce tardío con gadolinio, imagen intracoronaria con ultrasonido intravascular (IVUS), o con tomografía de coherencia óptica (OCT)8,14,16,18. No hay un algoritmo consensuado para el abordaje de los MINOCA, pero diferentes estrategias han sido propuestas en artículos de opinión y de posición, y pueden ayudar a la toma de decisiones (figura 1)8,14.
Causas de MINOCA
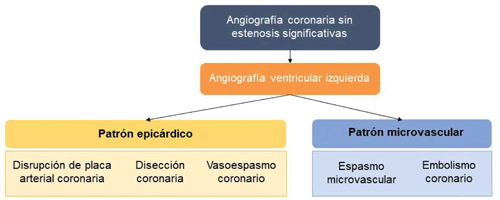
Basándose en el resultado de la ventriculografía izquierda se reconoce la existencia de dos patrones característicos18(figura 2):
- Patrón epicárdico: presenta anomalías de la motilidad en el territorio de una arteria coronaria epicárdica.
- Patrón microvascular: las anomalías de la motilidad son regionales, con una extensión mayor a la determinada por una única arteria coronaria epicárdica.
Patrón epicárdico
1. Disrupción de placa
La disrupción de placa, principal etiología del IAM tipo 1, puede presentarse sin EC significativa y en ausencia de trombo intracoronario, aunque los pacientes suelen tener algún grado de aterosclerosis, así sea mínimo8,18. La ausencia de estenosis coronarias significativas en la angiografía no excluye la posibilidad de accidente de placa y los estudios muestran que las técnicas de imagen intravascular permiten identificar rotura, ulceración o erosión de placa hasta en 40% de los pacientes con MINOCA20,21. Dadas las implicancias de este hallazgo, tanto el IVUS como la OCT deberían formar parte del algoritmo diagnóstico, siendo la OCT la técnica preferida por su mayor resolución8,15,16,18.
Es conocido que la trombosis es un fenómeno dinámico, donde la lisis endógena existe como mecanismo protector frente a la obstrucción coronaria, lo que explica la ausencia de lesión coronaria obstructiva en presencia de una disrupción de placa aterosclerótica22. La necrosis resulta de la interacción entre la trombosis, el embolismo y el vasoespasmo que se suceden antes y durante la lisis del trombo y puede ser evidenciada mediante RMC. Esta suele mostrar edema miocárdico en áreas grandes, y, eventualmente, áreas de necrosis más pequeñas en el territorio vascular involucrado, hallazgos que apoyan este mecanismo, aunque no descartan vasoespasmo coronario epicárdico como factor etiológico aislado. En otros casos, la RMC puede mostrar una pequeña área bien definida de realce tardío con gadolinio, posiblemente secundaria a obstrucción de vasos pequeños, lo que sugiere embolización de restos aterotrombóticos8,16,18. La terapia antiplaquetaria recomendada en el IAM y las estatinas están indicadas en los pacientes con sospecha o confirmación de disrupción de placa y MINOCA16,23.
2. Disección coronaria espontánea
Es la etiología responsable de hasta una cuarta parte de los SCA en mujeres menores de 50 años24, y de 1,7%-4% de los SCA en general(25-28). Mucho más frecuente en mujeres con escasos factores de riesgo cardiovascular, representa la principal causa de SCA durante el embarazo y parto28. Genera obstrucción de la luz coronaria con la consecuente isquemia miocárdica y puede no ser evidente en la angiografía coronaria, como puede ocurrir con el hematoma intramural, por lo que la imagen intracoronaria muchas veces es esencial en el diagnóstico25. La arteria descendente anterior es la más frecuentemente involucrada(28). Suele manifestarse electrocardiográficamente con elevación del segmento ST y troponinas muy elevadas. Varios factores han sido implicados en la generación de la disección, como la presencia de displasia fibromuscular en la vasculatura coronaria, factores genéticos, influencia hormonal, enfermedades inflamatorias sistémicas, junto a desencadenantes ambientales o estresores16,18,25,28.
Se recomienda un manejo conservador en la mayoría de los casos, y los estudios demuestran que la disección suele resolverse espontáneamente luego de los primeros 35 días25,28,29. En los pacientes con disección de tronco de la coronaria izquierda, isquemia persistente o inestabilidad hemodinámica, puede ser necesario recurrir a la revascularización mediante angioplastia o cirugía de revascularización miocárdica, según las características de la disección y la experiencia del centro25,28. La angioplastia de estas lesiones puede generar progresión de la disección, por lo que no se recomienda su uso sistemático25. Si bien no existe evidencia sólida al respecto, hay consensos que recomiendan el uso de terapia antiplaquetaria doble, y, recientemente, la terapia antiplaquetaria única15 y betabloqueantes, sin estar indicada la terapia con estatinas dado que generalmente ocurre en ausencia de enfermedad aterosclerótica15,16,25,28. El pronóstico se encuentra signado por una tasa de eventos adversos a mediano y largo plazo como dolor torácico, ansiedad y depresión, eventos cardíacos mayores, IAM recurrente, disección recurrente, revascularización anticipada, insuficiencia cardíaca congestiva, accidente cerebrovascular y muerte, de entre 10% y 30% a los tres años, siendo el más frecuente de estos eventos la recurrencia de la disección28.
3. Vasoespasmo coronario
Las pruebas provocadoras de espasmo han resultado positivas en 27%-30% de pacientes con MINOCA8,30).
En la fisiopatología del vasoespasmo está implicada la reactividad aumentada del músculo liso a sustancias endógenas o exógenas, como el tabaco, fármacos (triptanos, pseudoefedrina, inotrópicos), drogas de uso recreativo (metanfetaminas, cocaína), hipertensión y estrés18. Clínicamente puede manifestarse como angina crónica atípica o como un evento agudo intercurrente8. El paro cardíaco y la muerte súbita son un riesgo en estos pacientes, y pueden ocurrir en ausencia de EC14. Son sugestivos de vasoespasmo los episodios recurrentes de dolor en reposo, que responden rápidamente a nitratos de corta duración, especialmente si está acompañado de cambios transitorios del segmento ST en el ECG y de un patrón circadiano nocturno8. Por tratarse de un fenómeno dinámico su diagnóstico es muy difícil sin un test de provocación. Las pruebas de provocación durante la angiografía coronaria con ergonovina o acetilcolina intracoronarias han demostrado ser efectivas en el diagnóstico, siendo preferida la última por su corta vida media. El resultado positivo se asocia a un pronóstico clínico adverso, en cuanto a mortalidad cardiovascular, mortalidad por cualquier causa, SCA recurrente y peor calidad de vida31. No obstante, algunos autores recomiendan no realizarlas por el riesgo de vasoespasmo intratable, fundamentalmente vinculado al uso de ergonovina14. Por este motivo, se recomienda diferir los estudios de vasorreactividad con respecto al escenario agudo8. Montone y colaboradores reportaron los primeros datos de seguridad de una prueba provocadora de espasmo (usando ergonovina o acetilcolina) en las primeras 48 horas de admisión en 80 pacientes con MINOCA, que fue positiva en 37 pacientes (46,2%) y no registraron eventos adversos mayores, incluyendo infarto recurrente o muerte31.
Los calcioantagonistas son el tratamiento de elección; en casos de angina refractaria pueden asociarse dihidropirídinicos y no dihidropiridínicos. Los nitratos son de utilidad en la fase aguda, pero su beneficio a largo plazo es menos claro. Otros fármacos que han demostrado ser efectivos son nicorandil y cilostazol8,15,18,30. En pacientes con eventos arrítmicos de riesgo para muerte súbita, puede ser necesario considerar el implante de un cardiodesfibrilador8,32.
Patrón microvascular
1. Espasmo microvascular
De acuerdo con los estudios disponibles, el 25% de los MINOCA tiene evidencia de espasmo microvascular, y algunos autores consideran este cuadro clínico como la expresión inestable de la angina microvascular crónica, siendo difícil establecer la superposición entre ambas.
La disfunción microvascular puede ser tanto la causa de la isquemia como una secuela de la injuria miocárdica isquémica o no isquémica15,33. Es más común en mujeres y en pacientes con factores de riesgo cardiovascular. La isquemia miocárdica se hace evidente a través del dolor anginoso acompañado de cambios electrocardiográficos, como desviación del segmento ST o la presencia de ondas T acuminadas en al menos dos derivaciones contiguas18,33.
Se ha utilizado acetilcolina intracoronaria, nitroprusiato de sodio, nitroglicerina y adenosina para valorar la disfunción microvascular, y el resultado patológico se relaciona en forma independiente con eventos cardiovasculares agudos en pacientes con y sin EC14. Pueden ser de utilidad las pruebas de reserva de flujo coronario para el estudio de la enfermedad de la microvasculatura8,14. El diagnóstico de disfunción de flujo coronario puede ser determinado por cualquiera de los siguientes criterios: 1) reserva de flujo coronario < 2,0 en respuesta a un estímulo vasodilatador como adenosina; 2) evidencia de espasmo microvascular diagnosticado durante prueba provocadora de espasmo: dolor torácico y cambios sugestivos de isquemia en el ECG inducidos por provocación de acetilcolina en ausencia de espasmo epicárdico (reducción del diámetro > 75%), o 3) flujo coronario deteriorado medido con recuento de cuadros TIMI (Thrombolysis in Myocardial Infarction) corregida15,34,35.
La angina por vasoespasmo microvascular persiste a pesar del tratamiento vasodilatador con antagonistas de los canales de calcio hasta en un 35% de los pacientes, con repercusión en la calidad de vida35, y es un posible sustrato fisiopatológico y anatómico para el desarrollo de insuficiencia cardíaca36. Los fármacos que han demostrado mayor beneficio en el alivio de la sintomatología son los calcioantagonistas y betabloqueantes, aunque no existen ensayos clínicos sobre este tema15.
2. Embolismo coronario
El embolismo coronario se incluye dentro del patrón microvascular en la clasificación propuesta, pero el émbolo puede ocluir una arteria coronaria de mayor calibre y presentarse como patrón epicárdico de MINOCA, o como una lesión coronaria obstructiva18. Puede originarse a partir de fuentes trombóticas cardíacas, como fibrilación auricular, valvulopatías, trombos intracavitarios, o a partir de trombos sistémicos, destacándose la presencia de desórdenes trombóticos hereditarios (factor V Leiden, deficiencia de proteínas C o S) o adquiridos (síndrome antifosfolipídico, trastornos mieloproliferativos)14,18.
Estudios de tamizaje de trombofilia en pacientes con MINOCA han reportado una prevalencia de 14% de desórdenes hereditarios8. La embolia no trombótica es ocasionalmente causa de MINOCA, ya sea a partir de vegetaciones valvulares en endocarditis bacteriana y no bacteriana, tumores cardíacos como mixomas y fibroelastoma papilar, embolias de aire o calcio14,18.
El embolismo coronario es responsable de hasta 4,3% de los casos de IAM con elevación del segmento ST en series recientes, y se asocia a una mayor mortalidad respecto a SCA de otras etiologías37. La embolia paradójica, que puede estar relacionada con foramen oval permeable, defecto septal atrial grande o fístula arteriovenosa coronaria18, se ha encontrado en 0,45% de los pacientes de una serie de 4.848 personas con IAM, estimándose una incidencia de al menos 10 casos por millón38. Existe un importante subdiagnóstico de la embolia coronaria en los pacientes con MINOCA, al igual que sucede con el resto de las etiologías. El tratamiento dependerá de la causa subyacente a la embolia18. La anticoagulación oral por tres meses estaría recomendada si la causa es un factor de riesgo procoagulante temporal y a largo plazo en presencia de un factor de riesgo persistente, como fibrilación auricular con score CHA2DS2-VASc >28,18.
Síndrome de takotsubo
Habitualmente desencadenado por un estrés emocional o físico, el síndrome de takotsubo suele presentarse como un SCA con o sin elevación del segmento ST, y es generador de una disfunción ventricular característicamente transitoria, de gravedad variable. En las últimas revisiones se recomienda descartar la presencia de takotsubo antes de plantear el diagnóstico de MINOCA1,15).
Los criterios diagnósticos internacionales propuestos recientemente (InterTAK Diagnostic Criteria) incluyen39,40:
1. Hipoquinesia, aquinesia o disquinesia transitoria de segmentos medios, basales o focales del ventrículo izquierdo, incluyendo el balonamiento apical. Las anomalías del movimiento son regionales y exceden una distribución vascular epicárdica, pero no es excluyente dado que puede existir un patrón focal en un territorio coronario.
2. El desencadenante suele preceder a la presentación clínica, pero puede no estar presente.
3. Los trastornos neurológicos como la hemorragia subaracnoidea, accidente cerebrovascular, convulsiones y el feocromocitoma pueden ser desencadenantes.
4. Suele presentar alteraciones en el ECG como elevación o depresión del segmento ST, inversión de la onda T y prolongación del intervalo QT corregido, pero existen casos infrecuentes, sin ningún cambio en el ECG.
5. Los biomarcadores cardíacos están moderadamente elevados en la mayoría de los casos. Es frecuente la elevación significativa del péptido natriurético cerebral.
6. La presencia de EC significativa no excluye la presencia de takotsubo.
7. Afecta generalmente a mujeres posmenopáusicas.
8. Ausencia de miocarditis.
La fisiopatología es compleja y variable, la estimulación simpática tiene un rol central con el consecuente aumento de las catecolaminas18,39, que puede ser causante de aturdimiento miocárdico por cardiotoxicidad, de espasmo epicárdico de múltiples vasos o espasmo microvascular, e incluso de accidente de placa y lisis espontánea de un trombo coronario18,39. Puede presentarse con un amplio espectro clínico, desde una afectación muy leve y difícil de diagnosticar, hasta cuadros de shock cardiogénico y muerte39. La ventriculografía izquierda es la herramienta diagnóstica de elección8,18,39. La ecocardiografía y la RMC son también valiosas en el proceso diagnóstico, siendo fundamental la última para excluir etiologías diferenciales de MINOCA40.
Miocarditis
En pacientes jóvenes los síntomas de miocarditis aguda pueden emular a los del IAM. Assomull y colaboradores11 analizaron pacientes con dolor torácico, troponinas positivas y angiografía sin lesiones coronarias obstructivas, encontrando signos de miocarditis en 50% de las RMC. En una revisión sistemática, la miocarditis fue la causa de MINOCA en 33% de los pacientes7. Recientemente, la cuarta definición de IAM estableció el concepto de injuria miocárdica como la elevación de las troponinas cardíacas de causa no isquémica, por lo que actualmente la miocarditis no es considerada etiología de MINOCA al no cumplir sus criterios diagnósticos1,15. Su presentación clínica es variable, en pacientes con un cuadro clínico clásico, el diagnóstico puede realizarse antes de la angiografía coronaria, pero en muchos escenarios efectuar el diagnóstico no es fácil y depende de una alta sospecha clínica.
Dada su importancia pronóstica y su manejo diferente respecto al IAM, la miocarditis debe ser considerada antes de iniciar la elaboración diagnóstica de MINOCA8,9,15.
Tromboembolia pulmonar
La tromboembolia pulmonar puede ser causa de elevación de las troponinas cardíacas. Al ser una patología de alta mortalidad y con tratamiento efectivo conocido, hay que sospecharla antes de efectuar el diagnóstico de MINOCA8,15,41. La angiotomografía de arterias pulmonares debe ser solicitada con fundamento clínico y no está indicada en todos los pacientes sin lesiones coronarias obstructivas (9,41.
Tratamiento
En los pacientes con MINOCA, el tratamiento no es la revascularización coronaria, lo que conlleva una dificultad terapéutica al no existir guías estandarizadas para su abordaje. Un análisis por puntaje de propensión de 9.136 pacientes con MINOCA del registro SWEDEHEART, comprobó que el tratamiento con estatinas, con agentes moduladores del sistema renina-angiotensina, y posiblemente con betabloqueantes, disminuye el riesgo de eventos adversos cardiovasculares mayores, no así el tratamiento con agentes antiplaquetarios17. Sin embargo, hasta la fecha no existen ensayos clínicos randomizados sobre tratamiento del MINOCA y dada la heterogeneidad de los pacientes incluidos bajo este término tan amplio, el consenso actual es que debe realizarse un abordaje individualizado según el mecanismo fisiopatológico involucrado (tabla 2)11,13,15.
Pronóstico
Ciliberti y colaboradores reportaron, tras el análisis de un registro retrospectivo, una mortalidad de 17,4% en el seguimiento a siete años en pacientes con MINOCA13. De acuerdo con los datos de un registro canadiense que analizó 2.092 pacientes afectados por MINOCA, la mortalidad hospitalaria fue de 0,8% versus 2,7% observada en pacientes con SCA y EC. La tasa de muerte o reinfarto al año fue significativamente mayor en los pacientes con EC, pero se registró un valor de 5,3% en los pacientes con MINOCA12. Por lo tanto, la información disponible desestima su benignidad, aunque presentan un pronóstico más favorable que los pacientes con EC. No existen estudios prospectivos publicados que aporten datos definitivos14,42. La concomitancia de EC ensombrece el pronóstico de los MINOCA, incluso cuando las estenosis coronarias son leves a moderadas13,14, pero su ausencia no implica buen pronóstico43.
El número de arterias coronarias enfermas, independientemente de la severidad, se ha relacionado con peores resultados a largo plazo13. Otros factores de mal pronóstico son: edad, tabaquismo, diabetes, hipertensión arterial, fracción de eyección ventricular izquierda reducida y presencia de enfermedad pulmonar obstructiva crónica, de manera similar a lo que ocurre en pacientes con EC43,44. Las mujeres tienen mayor incidencia de eventos cardiovasculares adversos en el seguimiento45.
Conclusiones
El MINOCA requiere una elaboración diagnóstica con un amplio abanico de etiologías a sospechar de acuerdo con el contexto clínico. Esto posibilita la aproximación a patologías con diferente valor pronóstico que se benefician de tratamientos específicos no incluidos en las recomendaciones para los IAM de acuerdo con la práctica clínica actual.
Perspectivas
La terminología que engloba al MINOCA es motivo de discusión, de manera que hay investigadores que lo incluyen dentro de un grupo más abarcativo denominado Síndromes Coronarios Agudos en pacientes con Arterias Coronarias Angiográficamente Normales o Casi Normales (ACS-NNOCA), integrando además a los pacientes que se presentan con angina inestable14,19. A pesar de los acuerdos, referidos fundamentalmente al uso de la ventriculografía izquierda, imagen intracoronaria, ecocardiografía y RMC, permanecen sin respuesta interrogantes importantes, como la pertinencia y oportunidad de pruebas de vasorreactividad coronaria14,31. En nuestro medio, donde los recursos diagnósticos son limitados, muchas veces no se logra conocer la etiología involucrada, permaneciendo estos pacientes dentro de la categoría de causa incierta. La cardiología ha avanzado enormemente en el tratamiento de la EC, pero este grupo de pacientes sin lesiones coronarias obstructivas ha sido rezagado durante años al creer que su pronóstico no llegaría a ser fatal o que eran consecuencia de troponinas falsamente positivas9. En Latinoamérica, no existe información publicada sobre la evolución de este grupo de pacientes y si son sometidos al procedimiento diagnóstico recomendado. Parecería, por lo tanto, importante aunar esfuerzos y diseñar un registro nacional con el objetivo de progresar en el abordaje integral del IAM.