¿Qué aporta este estudio al conocimiento actual?
El uso de anticoagulación en pacientes con bioprótesis aórtica se asocia a menor riesgo de trombosis subclínica. Sin embargo, el procedimiento acarrea mayor riesgo de sangrado sin afectar la mortalidad, ni el riesgo embólico. Por lo tanto, hasta que se definan las consecuencias de la trombosis subclínica en la evolución a largo plazo, la anticoagulación debería reservarse a pacientes con bajo riesgo de sangrado.
Introducción
La incidencia de la enfermedad valvular aórtica de causa degenerativa ha ido aumentando en las últimas décadas debido al incremento de la esperanza de vida de la población, lo que representa un gran reto a nivel sanitario, social y económico1. La sustitución valvular aórtica (SVA) es el tratamiento curativo para esta enfermedad y es una de las intervenciones quirúrgicas más frecuentes en los centros de cirugía cardíaca a nivel mundial. Para la SVA pueden utilizarse bioprótesis o válvulas mecánicas y su elección dependerá de varios factores, dentro de los cuales se encuentran la edad y el terreno del paciente1. En los últimos años ha surgido la SVA transcatéter (TAVI) de la válvula aórtica, reservada inicialmente para pacientes de alto riesgo.
Dentro de las ventajas de la utilización de las bioprótesis destacan su menor riesgo trombogénico en comparación con las válvulas mecánicas y el no requerimiento de tratamiento antitrombótico de por vida. Como desventaja, presentan menor durabilidad2.
La trombosis de una válvula biológica es infrecuente, con una incidencia anual de 0,01%-1,26%. Representa una complicación grave que puede llevar a la muerte o generar secuelas permanentes que disminuyen la calidad de vida3. El riesgo de experimentar eventos tromboembólicos es mayor durante los 90 días posteriores a la SVA, tiempo que se considera necesario para la endotelización del implante2.
En cuanto a la trombosis subclínica de la válvula bioprotésica, se puede valorar mediante estudios imagenológicos, como la tomografía computarizada (TC) de cuatro dimensiones, siendo este el método de imagen más sensible para detectar la forma de apertura/cierre limitado de la válvula y el engrosamiento de esta4. Otro estudio de imagen complementario es la ecocardiografía, que puede apreciar hallazgos compatibles con trombosis subclínica como el aumento de los gradientes transaórticos, reducción del área de la válvula aórtica <1,2 cm2 y la movilidad anormal de la cúspide, que predicen la presencia de trombosis valvular5.
Actualmente existe evidencia que relaciona la trombosis subclínica de la válvula bioprotésica con el deterioro hemodinámico valvular prematuro y la degeneración estructural de la válvula6. Además, la trombosis subclínica de la valva puede constituir un factor de riesgo para eventos cerebrales subagudos u otros eventos tromboembólicos6.
Las guías actuales de la Sociedad Europea de Cardiología (ESC) y la European Association for Cardio-Thoracic Surgery (EACTS) recomiendan considerar la anticoagulación oral (ACO) durante los primeros 90 días del posoperatorio de SVA, con una recomendación IIb, nivel de evidencia C7. Las guías 2017 de la American Heart Association/American College of Cardiology/American College of Chest Physicians recomiendan su utilización por al menos tres a seis meses pos-SVA con una recomendación IIa, nivel de evidencia B-NR8.
A pesar de estas recomendaciones, existe un debate constante acerca de los beneficios y los riesgos de la utilización de ACO. Muchos profesionales no se adhieren a estas recomendaciones y cuestionan su utilización en ausencia de otras patologías tromboembólicas, como fibrilación auricular, estados de hipercoagulación, tromboembolia venosa, etcétera, con la justificación de que existe falta de estudios clínicos que demuestren su beneficio8.
El objetivo de nuestro trabajo es realizar un metaanálisis para evaluar si el uso de ACO por un mínimo de 90 días disminuye o previene la aparición de eventos trombóticos o trombosis subclínica en pacientes con SVA quirúrgica biológica o TAVI, así como evaluar el riesgo de sangrado, fenómenos embólicos y mortalidad.
Material y métodos
El presente estudio muestra los resultados de una revisión sistemática con metaanálisis. Se efectuó una búsqueda de artículos en bases de datos electrónicas: PubMed, Cochrane Central, Biblioteca Cochrane y SciELO utilizando términos MEsH y conectores booleanos. Los términos de búsqueda fueron los siguientes: “Anticoagulation AND bioprosthetic aortic valves” y “Anticoagulation AND TAVI OR TAVR”. La búsqueda contuvo todos los estudios publicados hasta la fecha, sin restricción de idioma. Se evaluaron artículos relacionados durante la búsqueda, así como también las referencias de las revisiones del tema.
El metaanálisis incluyó: 1) Ensayos clínicos controlados aleatorizados, estudios prospectivos y retrospectivos. 2) Población: pacientes con SVA con prótesis biológica a través de TAVI o SVA quirúrgica. 3) Intervención: administración de ACO con warfarina o nuevos anticoagulantes orales (NACO) al menos por 90 días luego de la cirugía. 4) Intervención comparativa: sin administración de anticoagulación o administración de simple o doble terapia antiplaquetaria. 5) Variables resultado: presencia o ausencia de eventos trombóticos, tanto clínicos como subclínicos. Se tomaron en cuenta estudios donde se observó la presencia de elementos clínicamente objetivables luego de la sustitución valvular, tales como accidentes cerebrovasculares (ACV), accidentes isquémicos transitorios (AIT) y trombosis clínica de la prótesis biológica, y estudios en los que se evaluaron hallazgos imagenológicos de trombosis de bioprótesis subclínica, definiéndola como el engrosamiento de los velos, la disminución en la movilidad de estos o aumento de >10 mmHg en el gradiente transprotésico9-12.
Para el análisis de los eventos clínicos se excluyeron aquellos trabajos que: a) no cumplieran con los criterios de inclusión previamente mencionados; b) incluyeran a pacientes que tuvieran indicación de anticoagulación por otra patología previa a la cirugía; c) los pacientes fueran sometidos a sustitución valvular mitral, y d) grupos con menos de 10 pacientes.
En la evaluación de trombosis valvular subclínica se utilizaron los mismos criterios de inclusión previamente mencionados, incluyendo, además, pacientes con anticoagulación por otra causa previa a la realización del estudio. Comparte los mismos criterios de exclusión que el análisis previo, a excepción de los trabajos en los cuales los pacientes fueron sometidos a doble sustitución valvular independientemente del tipo de procedimiento, o sustitución de válvula mitral.
La selección de artículos se realizó en etapas por dos grupos independientes de estudiantes. En cada etapa se realizó un análisis exhaustivo de artículos y se seleccionaron aquellos que cumplían con los criterios de inclusión, posteriormente se debatió entre los grupos la selección final.
Estadística
Los estadísticos de resumen utilizados fueron odds ratio (OR) para las variables categóricas. Según la heterogeneidad de los pacientes incluidos, se utilizó un modelo de efectos randomizados o fijo para poder calcular el estadístico de resumen y su intervalo de confianza (IC) de 95%, el cual se basó en I2. Los resultados del metaanálisis se presentaron como diagrama de bosque. El análisis fue realizado usando Review Manager Versión 5.3 (The Cochrane Collaboration, Update Software, Oxford).
Resultados
Mediante la búsqueda sistemática inicial se identificaron 233 artículos. De estos, se excluyeron 96 luego de evaluar el título. De los restantes, se analizó el resumen y se descartaron 113 artículos. Los motivos por los cuales se descartaron estos artículos se encuentran especificados en la (figura 1). Se revisaron a texto completo 24 trabajos, de los cuales se seleccionaron ocho para el análisis clínico y cinco para la evaluación de trombosis protésica.
Análisis de eventos clínicos
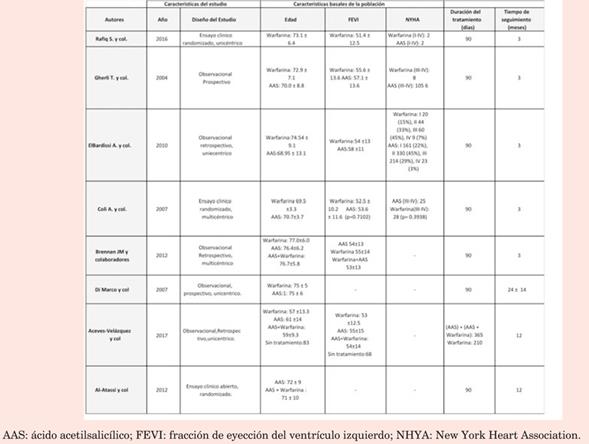
En la (tabla 1) se muestran las características de los estudios incluidos. Los mismos fueron observacionales retrospectivos13-15 y prospectivos16,17), incluyendo ensayos clínicos aleatorizados18-20. Los estudios incluyeron un total de 22.875 pacientes, de los cuales 13.248 no recibieron anticoagulación y 9.627 sí la recibieron. De los pacientes incluidos, 12.075 recibieron cirugía de revascularización coronaria (CRM), además de la SVA.
Embolia
Todos los trabajos aportaron datos de eventos embólicos. A partir de los resultados obtenidos de los ocho estudios, la incidencia de eventos embólicos osciló entre 1%13 y 5%14 para el grupo de anticoagulados, y entre 0%14 y 7%13 para los no anticoagulados. El análisis global demostró que no existe diferencia significativa en la incidencia de eventos embólicos entre ambos grupos (OR=1,01; IC95%: 0,63-1,61; p=0,98). El grado de heterogeneidad fue bajo con un I2=0%, por lo que utilizamos un modelo de efectos fijo. Ninguno de los estudios seleccionados mostró resultados estadísticamente significativos para esta variable (figura 2).
Sangrado
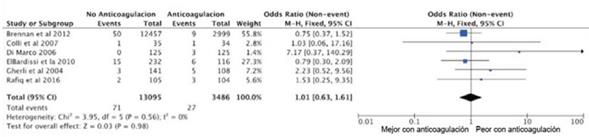
El sangrado fue una variable secundaria a estudiar relacionada con el uso de la terapia antitrombótica. La incidencia de sangrados mayores osciló para el grupo de warfarina entre 0%16 y 8,8%19, en comparación con el grupo control que osciló entre 0%16 y 3,5%14. El análisis global demostró que existe una superior incidencia de sangrado mayor en pacientes que recibieron tratamiento antitrombótico (OR=1,60; IC95%:1,04-2,48; p=0,03). El grado de heterogeneidad en este caso también fue bajo con un I2=0%, y se utilizó un modelo de efectos fijo (figura 3).
Mortalidad
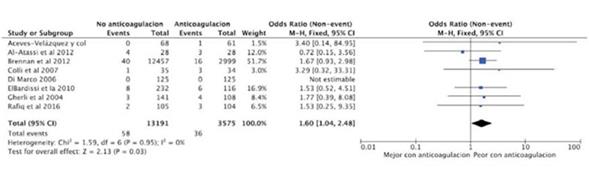
La mayor parte de las defunciones ocurrió luego de los 90 días posteriores a la cirugía13,14,17,19,20. En tres de los trabajos incluidos, el seguimiento fue mayor15,16,18. El mayor seguimiento tuvo una media de 24 meses ± 1416. La incidencia de muerte en el grupo de warfarina osciló entre 0%15,18 y 5,9%19, siendo para el grupo control entre 0% 15,18 y 5,7% 19. En este caso, el grado de heterogeneidad de los resultados fue moderado (I2=56%), por lo cual se utilizó un modelo de efectos randomizados. Encontramos que no existe diferencia significativa en la mortalidad a corto plazo entre los pacientes que recibieron terapia antitrombótica y quienes no la recibieron (OR=1,10; IC95%: 0,77-1,56; p=0,61). El estudio de Aceves-Velázquez y colaboradores15, junto con Al-Atassi y colaboradores18, no reportaron dicha variable, por lo que no fueron incluidos en el análisis estadístico (figura 4).
Análisis de trombosis protésica
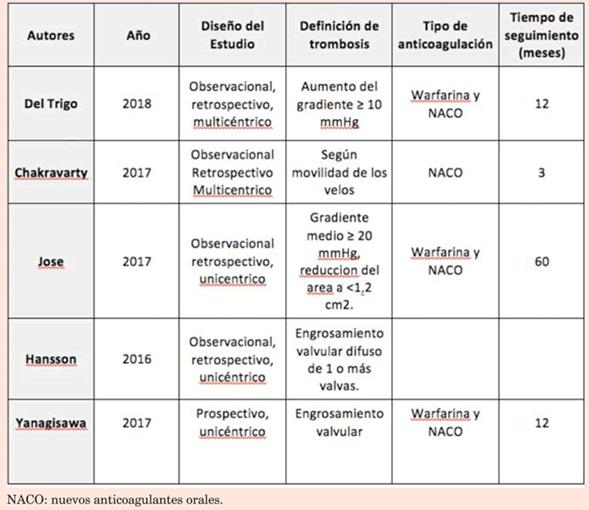
En la (tabla 2) se muestran las características de los estudios incluidos. Se seleccionaron un total de cinco estudios, cuatro fueron observacionales retrospectivos6,10-12 y uno prospectivo9. Los estudios incluyeron un total de 4.469 pacientes, de los cuales 4.331 recibieron TAVI y 138 SVA quirúrgica.
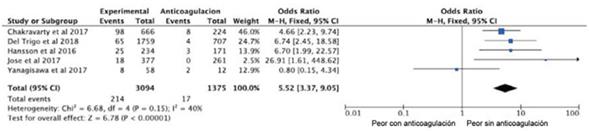
Dado que la mayoría de los pacientes que surgen del análisis recibieron TAVI, los resultados expresan principalmente la incidencia de trombosis protésica luego de dicho procedimiento. El grado de heterogeneidad fue moderado (I2=40%), por lo cual el análisis se realizó mediante un modelo de efectos randomizados. El no uso de ACO demostró aumentar significativamente el riesgo de trombosis protésica (OR=5;52; IC95%: 3,37-9,05) (figura 5).
Discusión
El metaanálisis realizado evidencia que el uso de ACO en pacientes que recibieron SVA está asociado a un menor riesgo de trombosis protésica a pesar de demostrar un mayor riesgo de sangrado. Asimismo, no hallamos evidencias estadísticamente significativas en el uso de ACO para prevenir la aparición de eventos trombóticos clínicamente objetivables. Estos hallazgos se contraponen con las recomendaciones actuales brindadas por las guías internacionales para el manejo de estos pacientes.
Si bien las bioprótesis valvulares aórticas se consideran menos trombogénicas en comparación a las prótesis mecánicas, existe riesgo de desarrollar eventos tromboembólicos2. Algunos autores consideran que la incidencia de trombosis valvular puede estar subestimada, ya que en los primeros estudios efectuados en pacientes con SVA, no estaba indicado el ecocardiograma de rutina, por lo cual la trombosis valvular no siempre era constatada21. El riesgo de presentar trombosis valvular y eventos tromboembólicos es mayor durante los primeros 90 días posteriores a la SVA2,22. Sin embargo, no existe consenso actual sobre el uso de anticoagulación luego de dicho procedimiento23.
La evidencia inicial en apoyo de la ACO temprana surgió de los resultados de un estudio retrospectivo unicéntrico realizado por Heras y colaboradores22, lo que influyó en gran parte del desarrollo de las directrices actuales. En este estudio se analizaron los pacientes que recibieron SVA mecánica o biológica, aórtica o mitral, en tres intervalos de tiempo hasta 90 días después de la cirugía. Se observó que en los primeros 10 días hubo una tasa de eventos tromboembólicos significativa en los pacientes que recibieron SVA con bioprótesis sin ACO, disminuyendo significativamente la incidencia con el transcurso del tiempo. Por lo tanto, se concluyó que la ACO temprana se debe administrar durante al menos tres meses para prevenir la aparición de eventos trombóticos. Este documento influyó entre los miembros de la comunidad quirúrgica a favor de la ACO y alentó a realizar más investigaciones.
De la misma forma, Moinuddeen y colaboradores24, y Sundt y colaboradores25, concluyeron que la ACO precoz después de SVA no confiere ninguna ventaja en la prevención de eventos tromboembólicos. Los resultados de este último no identificaron diferencias significativas en las complicaciones tromboembólicas o hemorrágicas entre los dos grupos25. Se observó que la supervivencia y función valvular a largo plazo no se vieron afectadas negativamente al suspender la ACO temprana. No se reportaron eventos hemorrágicos debido a la administración de ACO24. Contrariamente a los estudios previos mencionados, Mérie y colaboradores26 publicaron en 2012, un estudio observacional, retrospectivo, que abarcó una población de 4.075 pacientes. Este trabajo demostró que suspender el tratamiento con warfarina durante los primeros tres meses después de la cirugía está asociado con un aumento significativo del riesgo de un evento clínico adverso, como ACV, muerte cardiovascular y complicaciones tromboembólicas. A consecuencia de este estudio, los autores cuestionan las pautas actuales sobre la duración del tratamiento antitrombótico después de SVA con prótesis biológicas.
Un reciente metaanálisis realizado por Riaz H. y colaboradores27, donde se compara el uso de ACO con warfarina y la terapia antiplaquetaria, concuerda con los hallazgos obtenidos en nuestro estudio. A diferencia de nuestro trabajo, esta publicación incluyó pacientes anticoagulados por otra patología previo a la cirugía, valorando únicamente la aparición de trombosis protésica. Consideramos que la inclusión de estas variables influye en los resultados obtenidos, siendo por lo tanto, menos preciso para valorar los eventos trombóticos luego de la SVA, y así evaluar la indicación de ACO en dichos casos. Los autores concluyeron la existencia de un incremento significativo en el riesgo de sangrado, sin un efecto favorable en la prevención de eventos tromboembólicos. Por lo dicho, recomiendan la realización de estudios randomizados con el objetivo de guiar las directivas del uso de ACO en la práctica clínica diaria.
La trombosis valvular es considerada una complicación infrecuente luego de la realización de la TAVI. Esta es diagnosticada con la aparición de eventos clínicos o a través de hallazgos ecocardiográficos28. La trombosis valvular subclínica fue recientemente descrita luego del advenimiento de la TC de alta resolución9. Las características de esta se han logrado demostrar por medio de este estudio, así como la respuesta frente a la administración de ACO para su resolución28.
Un conjunto de revisiones realizadas en el año 2017 por Nakatani S.29 y Jilaihawi H.30, destacan la importancia de la realización de una TC de alta resolución para detectar la trombosis valvular temprana, teniendo mayor sensibilidad que la realización de ecocardiograma transtorácico o transesofágico. La TC permite la detección de la patología en pacientes asintomáticos previo a la manifestación clínica, e incluso antes de la presencia de alteraciones hemodinámicas. La forma de presentación de la trombosis subclínica en la TC es bajo la limitación de apertura/cierre de la válvula, o el engrosamiento hipoatenuado de las valvas (HALT)29. La trombosis subclínica de la prótesis no tiene secuelas clínicas inmediatas, pero existe la posibilidad de manifestaciones tardías, generando complicaciones, como fenómenos embólicos o eventos clínicos.
Es por ello que se establece que la ACO puede prevenir y revertir la hipoatenuación observada y al mismo tiempo restablecer el movimiento normal de las valvas28. Nuestros resultados demuestran que los pacientes con ACO, luego de TAVI, presentan un riesgo significativamente menor de desarrollar trombosis subclínica.
Resta definir la relación riesgo/beneficio de dicha farmacoterapia en una población con alto riesgo de sangrado29,30.
Limitaciones
La amplia mayoría de los estudios incluidos en este metaanálisis corresponde a estudios observacionales, los que podrían estar sujetos a sesgo de selección, ya que la preferencia de administrar terapia antiplaquetaria, ACO o ninguna terapia, quedaba supeditada a la adherencia del médico tratante a las pautas actuales. Asimismo, también están condicionados por la presencia o ausencia de indicaciones previas para recibir ACO. Por otro lado, los regímenes antitrombóticos utilizados varían entre los diferentes trabajos, desde los grupos a comparar, a las dosis a administrar, lo cual genera variabilidad al momento de comparar los diferentes estudios.
Como se mencionó previamente, nuestros resultados demuestran el beneficio del uso de ACO en los primeros 90 días luego de la SVA para prevenir la aparición de trombosis protésica, en contraposición con el uso de terapia antiplaquetaria o sin mediar tratamiento.
Si bien la mayoría de los estudios toman como punto de partida un seguimiento mínimo de 90 días, pasado este lapso de tiempo, el seguimiento y los controles realizados por cada estudio fue diferente, generando diversidad al momento de evaluar los eventos clínicos y la trombosis valvular, requiriendo esta última un control imagenológico más riguroso. Adicionalmente hubo heterogeneidad a la hora de emplear técnicas de imagen para determinar la trombosis valvular, observando que no existen aún protocolos estandarizados que faciliten el diagnóstico precoz y oportuno de esta variable.
Conclusiones
En este metaanálisis se demostró que el uso de ACO en pacientes que recibieron SVA con TAVI o cirugía, está asociado a un menor riesgo de trombosis protésica subclínica, incrementando el riesgo de sangrado. No existió diferencia en mortalidad a mediano plazo en ambos grupos comparados. No se pudo demostrar estadísticamente el beneficio de la ACO para la prevención de eventos embólicos clínicos. Dado que los estudios incluidos para la realización de este trabajo fueron en su mayoría observacionales (retrospectivos y prospectivos), consideramos que la confirmación de nuestros resultados debe realizarse a través de ensayos clínicos aleatorizados, los que brindarían mayor evidencia científica.