Caso 1
Paciente de 68 años, sexo masculino (SM), abogado, hipertenso.
Infarto de miocardio (IM) de cara lateral tratado con angioplastia (ATC) primaria exitosa de rama marginal obtusa de arteria circunfleja hace tres años. Resto del árbol coronario con lesiones leves de descendente anterior (DA) y coronaria derecha (CD).
Medicación desde el alta: ácido acetilsalicílico (AAS): 100 mg/día, atorvastatina 20 mg/día, bisoprolol 10 mg/día y ramipril 5 mg/día.
Consulta para control, encontrándose asintomático.
Examen completo normal. Examen cardiovascular (CV): ritmo regular 60 ciclos por minuto (cpm). Presión arterial (PA) 114/68 mmHg.
Paraclínica: colesterol total (CT) 180 mg/dl, colesterol unido a lipoproteínas de alta densidad (C-HDL) 60 mg/dl, colesterol unido a lipoproteínas de baja densidad (C-LDL) 90 mg/dl, triglicéridos (TG) 150 mg/dl, índice CT/HDL 4, glicemia 0,80 g/l, creatininemia 1 mg/dl, azoemia 30 mg/dl, ionograma normal.
Pregunta 1. Señale lo correcto
1. Aumentaría la dosis de atorvastatina a 40-80 mg/día.
2. Mantendría la dosis actual de atorvastatina dado que el perfil lipídico es óptimo.
3. Agregaría ezetimibe 10 mg/día al plan terapéutico.
4. Solicitaría una dosificación de CPK antes de modificar la dosis de estatinas.
Estamos ante un paciente que ya sufrió un evento agudo coronario y, por lo tanto, se encuentra en categoría de prevención secundaria.
En primer lugar nos debemos preguntar si corresponde o no tratarlo con estatinas. Un fuerte cuerpo de evidencia ha demostrado el beneficio indiscutible en la reducción de eventos cardiovasculares adversos mayores (ECVM) con el uso de estos fármacos en prevención secundaria. Tres estudios (4S1, LIPID2 y HPS3) demostraron reducción de mortalidad total y cardiovascular. Este beneficio se vio con un amplio rango de valores basales de CT y C-LDL e incluso, en HPS, independientemente del valor inicial.
En el caso analizado, las cuatro opciones mantienen el tratamiento con estatinas, lo cual es correcto. La pregunta siguiente es si hay que modificar la dosis. Hay evidencia contundente del beneficio del uso de dosis altas de estatinas en prevención secundaria4-8.
Este paciente se debe analizar en el contexto de los estudios correspondientes a cardiopatía isquémica estable. En este sentido, el ensayo clínico aleatorizado (ECA) TNT4 incluyó pacientes con cardiopatía isquémica estable y C-LDL <130 mg/dl que fueron asignados a dosis de atorvastatina de 80 mg versus 10 mg. Se realizó un seguimiento medio de 4,9 años. Con la dosis más alta de atorvastatina se observó una reducción significativa del riesgo relativo de ECVM (incluyendo la mortalidad coronaria) de 22%. Hubo pocos efectos adversos con la dosis más alta de atorvastatina. Se observó una elevación persistente de las transaminasas hepáticas en 1,2% con atorvastatina 80 mg vs 0,2% con atorvastatina 10 mg (p<0,001). No hubo diferencia en cuanto a la tasa de mialgias (4,8% vs 4,7%, p=0,72), ni de rabdomiolisis, que ocurrió solo en cinco de los 10.001 pacientes incluidos en el estudio.
El ECA IDEA5 observó a pacientes con IM previo que fueron asignados a atorvastatina 80 o simvastatina 20 mg. Al cabo de un seguimiento medio de 4,8 años hubo una reducción significativa de IM no fatal, pero no del objetivo primario combinado de muerte coronaria, IM no fatal y paro cardíaco resucitado en el grupo asignado a atorvastatina 80 mg/día.
El ECA SEARCH6 incluyó a personas con IM previo a las que aleatorizó a simvastatina 80 mg o simvastatina 20 mg. El seguimiento medio fue de 6,7 años. Hubo una tendencia no significativa a la reducción de ECVM, con una incidencia de miopatía 30 veces mayor con la dosis más alta de simvastatina. Este estudio es el fundamento de la contraindicación de usar la dosis de 80 mg de simvastatina como opción terapéutica.
Considerando esta evidencia, las guías de American Heart Association/American College of Cardiology (AHA/ACC 2018)9 sugieren tratar a todo paciente en prevención secundaria con dosis altas de estatinas (excepto los mayores de 75 años, que no sean de muy alto riesgo, en quienes se puede iniciar dosis moderadas intentando posteriormente llegar a dosis altas). Estas mismas guías definen como dosis altas de estatinas a las que reducen 50% o más los niveles de C-LDL (tabla 1). Considerando potencia y balance riesgo/beneficio se sugiere usar con este fin atorvastatina 40-80 mg o rosuvastatina 20-40 mg.
Este paciente, entonces, está tratado en forma subóptima y habría que subir la dosis de atorvastatina a 40-80 mg por día.
Las guías AHA/ACC van un paso más allá y dividen a los pacientes en prevención secundaria en los de muy alto riesgo, o de no muy alto riesgo. Este paciente correspondería a los de muy alto riesgo (tabla 2), ya que tiene evento vascular previo (IM) y además padece dos condiciones de alto riesgo (edad > 65 años e HTA).
En estos casos se sugiere, en lo posible, llegar a dosis máximas de estatinas, debido a que en los estudios ya analizados el beneficio mayor se obtuvo con estas dosis. Además, basados en el estudio de PROVE-IT TIMI 227 y en el metaanálisis CTTC 201010, se sugiere un C-LDL objetivo < 70 mg/dl (ya que se descendería la tasa de ECVM).
De manera que aunando ambas recomendaciones, en este paciente se plantearía llegar a 80 mg de atorvastatina y a un C-LDL menor a 70 mg/dl. Si se logran ambos hechos, se dejaría con esa dosis.
En el caso de no tolerar 80 mg de atorvastatina, pero sí lograr un C-LDL < 70 mg/dl a la máxima dosis tolerada, también se mantendría dicha dosis.
Si con la máxima dosis tolerada de atorvastatina no se puede bajar el C-LDL a menos de 70 mg/dl, se plantea el uso de ezetimibe. El estudio IMPROVE - IT11 demostró en pacientes que habían padecido un síndrome coronario agudo reciente, una mayor disminución del C-LDL y una reducción significativa de ECVM, con la asociación de ezetimibe 10 mg a simvastatina 40 mg. Es por esto que las guías estadounidenses recomiendan la asociación de ezetimibe en pacientes de muy alto riesgo (como el que estamos analizando), cuando con las dosis máximas toleradas de estatinas no se logra un C-LDL < 70 mg/dl.
Puede ocurrir que se llegue a la máxima dosis tolerada de estatinas, se asocie ezetimibe y, aun así, no se logre bajar el C-LDL a < 70 mg/dl. Hay evidencia concluyente del beneficio del uso asociado de inhibidores de la proproteína convertasa subtilisin/kexin tipo 9 (PCSK9) y estatinas tanto en la reducción del C-LDL como de ECVM12,13, con pocos efectos colaterales significativos vinculables al uso de estos fármacos (solo irritación en el sitio de inyección). Sin embargo, el costo y la escasa disponibilidad en nuestro país, obligan a usar el juicio clínico para definir su eventual indicación.
Parece muy poco probable que nuestro paciente, que tiene C-LDL de 90 mg/dl bajo tratamiento con atorvastatina 20 mg, no logre disminuir el mismo a < 70 mg/dl con un aumento de dosis o asociación con ezetimibe.
Las guías europeas 201914 también consideran a este paciente como de muy alto riesgo por presentar enfermedad cardiovascular (CV) documentada. Concuerdan también en la conveniencia de lograr un descenso del C-LDL > al 50% del basal, pero sugieren, además, la necesidad de lograr valores objetivo de C-LDL < 55 mg/dl. Basan sus recomendaciones en la siguiente evidencia: 1) Los resultados de varios metaanálisis en pacientes de alto riesgo que evidenciaron una disminución progresiva de eventos proporcional al grado de descenso del C-LDL sin existir un umbral por debajo del cual dejara de observarse beneficio o hubiera perjuicio10-15. 2) La reciente publicación de tres estudios11-13 que mostraron disminución marcada de ECVM asociando ezetimibe o inhibidores PCSK9 a estatinas con un descenso asociado del C-LDL a valores < 55 mg/dl. Cabe acotar que en estos pacientes de muy alto riesgo la guía europea sugiere un C-LDL objetivo aun más bajo, < 40 mg/dl, si ocurriera un nuevo evento vascular dentro de los dos años posteriores al primero.
En nuestra opinión se debe destacar que no hay ECA que hayan evaluado eventos en función de distintos objetivos de C-LDL. Por otro lado, los estudios que alcanzaron niveles muy bajos de C-LDL no tienen un seguimiento suficientemente prolongado como para establecer con certeza la seguridad a largo plazo de esta conducta terapéutica. El juicio clínico ponderado es de nuevo insustituible en estos casos.
Como objetivos secundarios la guía europea recomienda bajar el colesterol no HDL a < 85 mg/dl y la apo B a < 65 mg/dl.
Con respecto a la evaluación de la medición sistemática de enzimas musculares o hepáticas se sugiere que en un sujeto asintomático bajo tratamiento con estatinas, no es necesario realizar una dosificación de CPK. Se debería realizar, al igual que un funcional hepático, previo al inicio del tratamiento para descartar predisposición al desarrollo de efectos colaterales o contraindicación al uso de éstas. El análisis de efectos adversos en los ECA sugiere que de acuerdo al balance costo/beneficio, los controles de CPK y funcional hepático, una vez iniciado el tratamiento, se realicen solo ante síntomas sugestivos de afectación muscular o hepática. Las guías europeas 201914 son concordantes en esta recomendación, pero sugieren control evolutivo de CPK en casos con alto riesgo de miopatía (muy añosos con comorbilidades, historia previa de síntomas musculares o uso concomitante de drogas que interactúen con las estatinas). Como siempre, debe primar el sentido común a la hora de tomar decisiones clínicas.
Caso 2
Paciente de 55 años, sexo femenino (SF), actriz.
Diabetes mellitus tipo 2 (DM2) desde hace diez años.
Hipertensión arterial (HTA) bien controlada. No tabaquismo.
Medicación: metformina 850 mg con almuerzo y cena, perindopril 10 mg/día y amlodipina 10 mg/día.
Consulta para control, asintomática.
Examen completo normal. PA: 128/72 mmHg.
Paraclínica: CT 208 mg/dl, C-HDL 38 mg/dl, C-LDL 120 mg/dl, TG 250 mg/dl, CT/HDL 5,47, glicemia 1,20 g/l, hemoglobina glicosilada (HbA1c) 6,9%, creatininemia 0,9 mg/dl, azoemia 40 mg/dl, ionograma normal.
Pregunta 2. Señale la opción correcta
1. Indicaría estatinas si hay lesión de órgano blanco.
2. Iniciaría gemfibrozil 600 mg v/o cada 12 horas.
3. Indicaría rosuvastatina 20 mg v/o por día.
4. Indicaría atorvastatina 40 mg y fenofibrato 100 mg v/o por día.
Se trata de una diabética tipo 2, mayor de 40 años, con otros factores de riesgo CV dados por la HTA y la disminución del C-HDL asociado a hipertrigliceridemia (dislipemia aterogénica con partículas de C-LDL pequeñas y densas), y que presenta un C-LDL de 120 mg/dl.
La primera pregunta que tendríamos que contestar es si esta paciente se beneficia o no de iniciar un tratamiento con estatinas.
En ese sentido, el único ECA que analizó los beneficios de una estatina en una población constituida en forma exclusiva por diabéticos fue el estudio CARDS16. Las características de nuestra paciente concuerdan con el tipo de personas reclutados en este trabajo. En efecto, CARDS incluyó diabéticos tipo 2, con edad entre 40 y 75 años, sin enfermedad CV previa, pero con riesgo CV aumentado por tener al menos una de las siguientes condiciones: retinopatía, albuminuria, tabaquismo o HTA. El C-LDL basal era <160 mg/dl, y los niveles de TG en ayunas eran <600 mg/dl. Los pacientes fueron aleatorizados a atorvastatina 10 mg por día o placebo. Los sujetos del grupo asignado a recibir atorvastatina tuvieron una reducción de 37% del objetivo primario de incidencia de ECVM (p=0,001). En los objetivos secundarios se observó una reducción de 36% en la tasa de eventos coronarios agudos, 31% en la necesidad de nueva revascularización y 48% en la tasa de accidente cerebrovascular (ACV).
HPS3 estudió una población de alto riesgo, diabéticos (n=5.963) o portadores de enfermedad arterial oclusiva sin diagnóstico previo de diabetes (n=14.573), con niveles de colesterol total >135 mg/dl. Demostró una disminución significativa del riesgo de desarrollo de ECVM con el uso de simvastatina 40 mg/día frente a placebo. En un subestudio de diabéticos17 hubo también una reducción significativa de 22% de ECVM (IC 95% 13-30, p<0,0001). El beneficio se mantuvo entre los 2.426 diabéticos cuyos niveles de C-LDL pretratamiento fueron < 116 mg/dl.
Un metaanálisis18 evaluó pacientes no diabéticos y diabéticos sin enfermedad CV establecida, pero que asociaban otros factores de riesgo CV. Se incluyeron diez ECA de tratamiento con estatinas (70.388 pacientes, 23% con DM). El seguimiento promedio fue de 4,1 años. El tratamiento con estatinas se asoció con una reducción significativa del riesgo de muerte (OR 0,88; IC 95% 0,81-0,96), ECVM (OR 0,70; IC 95% 0,61-0,81) y eventos cerebrovasculares (OR 0,81; IC 95% 0,71-0,93) en la población global. No hubo heterogeneidad del efecto entre diabéticos y no diabéticos.
Es claro, entonces, que esta paciente se beneficia del uso de estatinas para reducir el riesgo de ECVM. Su indicación es independiente de la existencia o no de daño de órgano blanco.
En cuanto a la intensidad del tratamiento, no existen estudios de prevención primaria que hayan comparado diferentes dosis de estatinas exclusivamente en pacientes diabéticos. Basados en CARDS, la indicación de dosis al menos moderadas en diabéticos entre 40 y 75 años es muy fuerte. Por otra parte, hay que destacar que el riesgo de morbilidad y mortalidad CV es más alto que el de los no diabéticos. Por ejemplo, algunos estudios equiparan el riesgo de mortalidad coronaria en diabéticos sin enfermedad coronaria conocida con el de individuos no diabéticos con infarto previo19,20. Otros trabajos sugieren que este riesgo es mayor que en los no diabéticos, aunque no tan alto como en los no diabéticos ya infartados21. Considerando este hecho y la evidencia antes mencionada, tanto las guías estadounidenses 2018, como las europeas 2019, recomiendan un tratamiento con estatinas. Por tratarse de una paciente diabética tipo 2 que asocia otros factores de riesgo CV mayores, como HTA y dislipemia, las guías estadounidenses la consideran de muy alto riesgo en tanto que las europeas la catalogan como de alto riesgo. Ambas coinciden en indicar una reducción de C-LDL >50% y las guías europeas recomiendan, además, reducir el C-LDL < 70 mg/dl, y como objetivo secundario el colesterol no HDL < 100 mg/dl y la apo B < 80 mg/dl. Por lo dicho, tanto rosuvastatina 20 mg como atorvastatina 40 mg son adecuadas en esta paciente. El objetivo sería una reducción del C-LDL >50%, en lo posible < 70 mg/dl.
El segundo punto a analizar es si habría mayor beneficio con el uso de fibratos en lugar de estatinas o asociados a ellas.
Con respecto al uso de fibratos como única droga hipolipemiante, un metaanálisis22 evaluó el impacto en la tasa de ECVM en diabéticos tipo 2. Incluyó a 11.590 pacientes de seis ECR. El uso de fibratos no tuvo efecto significativo sobre la mortalidad global o CV, así como tampoco sobre el riesgo de ACV, angina inestable o necesidad de revascularización coronaria. Sí hubo una disminución significativa del riesgo de IM no fatal de alrededor de 21% (RR acumulado 0,79; p=0,006) con estos fármacos. Por lo tanto, el beneficio de los fibratos resultó ser muy inferior al de las estatinas.
El estudio FIELD23 evaluó el uso de fenofibrato como única droga hipolipemiante en 9.795 diabéticos tipo 2 (edades entre 50 y 75 años), tanto en prevención primaria como secundaria. Los resultados fueron compatibles con el metaanálisis ulterior. A cinco años no hubo beneficio en el objetivo primario de eventos coronarios (muerte de causa coronaria o IM) (reducción de RR 11%; HR 0,89, IC 95% 0,75- 1,05; p=0,16). Sí evidenció un beneficio en el objetivo secundario de reducción tasa de eventos CV totales (la suma de muerte CV, IM, ACV y revascularización coronaria o carotídea) (HR 0,89, IC 95% 0,80-0,99; p=0,035) debido sobre todo a menos IM no fatales y menos revascularizaciones.
Con respecto a otro fibrato, el gemfibrozil, el subestudio de diabéticos de VA-HIT24 mostró un beneficio solo en varones con enfermedad arterial coronaria y niveles bajos de C-HDL, ya que el uso de esta droga se asoció con una reducción de ECVM.
Por lo tanto, se debe usar estatinas antes que fibratos para el tratamiento de la dislipemia en esta paciente, ya que el impacto en la reducción de eventos con las primeras es claramente mayor que con los segundos.
En cuanto a la asociación de estatinas y fibratos, el estudio ACCORD (rama de lípidos)25 analizó los efectos de fenofibrato asociado a simvastatina versus la misma estatina como único hipolipemiante en 5.518 diabéticos tipo 2 de alto riesgo. Tras 4,7 años de seguimiento no hubo diferencias significativas entre los dos grupos en la incidencia del punto final primario combinado de muerte CV, IM o ACV (HR 0,92; IC 95% 0,79-1,08; p=0,32), ni en la incidencia de los componentes individuales del mismo. En los análisis de subgrupos se detectó interacción cualitativa entre el sexo y el efecto del tratamiento (beneficio en hombres, tendencia a daño en mujeres; p=0,01), y una tendencia a mayor beneficio en los pacientes con C-HDL bajo y TG elevados (p=0,06).
Se concluye, entonces, que esta paciente no se beneficia de la asociación de estatinas y fenofibrato. Además, la asociación de estatinas con gemfibrozil está contraindicada por el alto riesgo de toxicidad muscular.
Por lo tanto, la respuesta correcta es la número 3, rosuvastatina a 20 mg/día.
Se destaca que si luego de ajustada la dosis de estatinas la paciente persiste con niveles de TG entre 135 y 499 mg/dl, las guías europeas sugieren asociar el éster etílico del ácido eicosapentanoico a dosis de 2 g dos veces al día basadas en el estudio REDUCE-IT26 de reciente publicación.
Caso 3
Paciente de 30 años, SM, carpintero.
AF de madre diabética y padre fallecido a los 44 años por IM.
Consulta para control. Está asintomático.
Examen completo: índice de masa corporal (IMC) 27 kg/m2. Presenta halo corneal y xantomas. PA 110/60 mmHg. Resto normal.
Paraclínica: CT 294 mg/dl, C-HDL 40 mg/dl, C-LDL 224 mg/dl, TG 150 mg/dl, CT/HDL 7,35, glicemia 0,92 g/L, HbA1c 5,1%, creatininemia 0,7 mg/dl, azoemia 24 mg/dl, ionograma normal.
Pregunta 3. Señale la opción correcta
1. Indicaría medidas de cambio de estilo de vida con descenso ponderal, dieta mediterránea, ejercicio aeróbico y realizaría un nuevo perfil lipídico en tres meses.
2. Indicaría todo lo anterior y tratamiento de alta intensidad con estatinas tratando de llegar a atorvastatina 80 mg/día o rosuvastatina 40 mg/día.
3. Determinaría el riesgo vascular a diez años antes de decir la conducta a seguir.
4. Indicaría atorvastatina 20 mg/día y ezetimibe 10 mg/día.
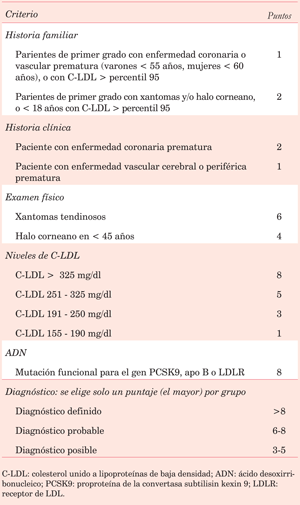
Se trata de un paciente menor de 40 años con antecedentes familiares de ECVM precoces (padre fallecido por IM a edad < 55 años), que presenta al examen clínico un halo corneano y xantomas, y a nivel de laboratorio un C-LDL > 190 mg/dl.
Las personas con niveles muy altos de C-LDL suelen tener hipercolesterolemias genéticamente determinadas: hipercolesterolemia familiar (HF), apolipoproteína B defectuosa familiar, o hipercolesterolemia poligénica, aunque también hay que descartar causas secundarias27.
Si consideramos los criterios diagnósticos para la HF de la Dutch Lipid Clinic Network (tabla 3), este paciente reúne 1 punto por el antecedente de familiar de primer grado con enfermedad vascular precoz, 6 puntos por la presencia de xantomas tendinosos al examen clínico y 3 puntos por presentar un C-LDL entre 191 - 250 mg/dl. Por lo tanto, con un puntaje total > 8 puntos (10 puntos) presenta un diagnóstico definitivo de HF.
La mayoría de los pacientes con HF heterocigota presentan síntomas por ateromatosis antes de los 40 años, y antes de los 20 años si padecen HF homocigota28.
No hay ECA que hayan analizado el beneficio del tratamiento con estatinas específicamente en esta población. Tampoco sería ético hacerlos por el riesgo muy aumentado de eventos vasculares que presentan y el claro beneficio de las estatinas en la morbimortalidad de los pacientes con hipercolesterolemia o con alto riesgo de eventos.
Es por ello que tanto las guías estadounidenses como las europeas aconsejan, más allá del cambio de estilo de vida, iniciar tratamiento de alta intensidad con estatinas en el momento del diagnóstico, con el objetivo de lograr un descenso del C-LDL >50% de su valor basal. Con respecto al C-LDL objetivo las guías estadounidenses sugieren valores < 100 mg/dl, mientras que las guías europeas sugieren un objetivo de C-LDL < de 70 mg/dl por los motivos ya expuestos.
Las dos guías sugieren la asociación de ezetimibe si no se logran las metas de C-LDL con el uso de estatinas. Ambas guías también plantean la eventual inclusión de inhibidores de PCSK9 en el plan terapéutico si no se logran las metas referidas con estatinas y ezetimibe, particularmente en sujetos de muy alto riesgo.
Por lo tanto, la respuesta correcta es la 2: indicaría todo lo anterior y tratamiento de alta intensidad con estatinas tratando de llegar a atorvastatina 80 mg/día o rosuvastatina 40 mg/día.
Se debe destacar que hay acuerdo entre las guías en considerar como pacientes de alto riesgo a los que tienen C-LDL > 190 mg/dl, independientemente de que se satisfagan o no los criterios diagnósticos de HF.
Caso 4
Paciente de 48 años, SM, raza blanca, bancario, sedentario.
Fumador con un índice de paquetes de cigarrillos anual (IPA) de 30. HTA tratada con telmisartán 80 mg/día y amlodipina 10 mg/día.
Consulta para control. Está asintomático.
Examen: IMC 24 kg/m2, PA 126/74 mm Hg, resto normal.
Paraclínica: CT 220 mg/dl, C-HDL 42 mg/dl, C-LDL 146 mg/dl, TG 160 mg/dl, CT/HDL 5,2, glicemia 0,92 g/l, HbA1c 5,1%, creatininemia 0,7 mg/dl, azoemia 24 mg/dl, ionograma normal.
Pregunta 4. Señale lo correcto
1. Tiene alto riesgo de ECVM, por lo que indicaría simvastatina 10 mg v/o por día a largo plazo.
2. Comenzaría con medidas de cambio de estilo de vida y revaloraría el perfil lipídico en tres meses.
3. Realizaría una evaluación formal del riesgo vascular a diez años antes de decidir la conducta a seguir.
4. Indicaría fenofibrato 160 mg/día.
En suma, se trata de un paciente de más de 40 años, tabaquista, hipertenso, bien controlado, con niveles de C-LDL en rango intermedio y una hipertrigliceridemia leve.
Este paciente pertenece a un grupo de sujetos en prevención primaria, con C-LDL >70 mg/dl y < 190 mg/dl, no diabético. Uno se pregunta si existe evidencia de beneficio del uso de estatinas en estos pacientes. Tres trabajos, AFCAPS/TexCAPS29, MEGA30 y JUPITER31 han estudiado el tema. El metaanálisis de los CTTC de 2010 ya citado es también relevante10.
Las guías estadounidenses abordan la indicación de estatinas a través de un análisis riesgo/beneficio. Proponen valorar el riesgo de eventos ateroscleróticos mediante un calculador denominado Pooled Cohort Equation (PCE) derivado de los grupos control de los tres estudios de prevención primaria arriba mencionados. Se valora así el riesgo natural de eventos de pacientes no tratados. La estimación del riesgo basal fue confirmada en un estudio observacional posterior32. Los factores involucrados en el cálculo del riesgo son edad, sexo, raza, CT, C-HDL, PA sistólica, uso de fármacos antihipertensivos, presencia o no de diabetes, y tabaquismo.
Por otro lado, tomaron como base para el cálculo de la disminución de riesgo el metaanálisis de los CTTC del 2010 10, que demostró una reducción de riesgo relativo de ECVM constante para cualquier valor de C-LDL entre 70 y 189 mg/dl. Si bien la disminución del riesgo relativo es constante, el descenso absoluto de riesgo CV va a ser tanto mayor cuanto mayor sea el riesgo basal. Las estatinas son fármacos seguros, pero que tienen efectos adversos potenciales en un bajo porcentaje de casos, incluyendo desarrollo de DM, miopatía y tal vez aumento de la incidencia de ACV hemorrágico. Se buscó, entonces, un nivel de riesgo por encima del cual el beneficio del uso de estatinas superara claramente los eventuales perjuicios. Se estimó que el inicio de estatinas a dosis moderadas o altas, en individuos de 40 a 75 años, con riesgo de eventos ateroscleróticos basal estimado >7,5%, tiene un beneficio significativo en la reducción de eventos que supera el riesgo de eventos adversos. Si el riesgo es > 20% a diez años es obligatorio el uso de estatinas y se aconsejan dosis altas.
En pacientes con riesgo entre 5%-7,5% algunos sujetos pueden beneficiarse con dosis moderadas de estatinas. Por debajo de 5%, no hay evidencia clara de beneficio neto.
Sin embargo, este análisis se podría relativizar por las siguientes razones:
- La población estudiada para calcular el riesgo basal de ECVM no incluyó hispanos. Por lo tanto, nuestra población en su mayoría no está contemplada.
- A edades mayores las PCE sobreestiman el riesgo.
- No se contemplaron una serie de factores que aumentan el riesgo en forma independiente a los incluidos en las PCE y que se detallan más abajo.
Considerando lo dicho, parece claro que se debe realizar una evaluación formal de riesgo de ECVM en este paciente para definir el uso de hipolipemiantes.
La guía europea es concordante con esta recomendación, pero sugiere usar la herramienta SCORE como calculador de riesgo. Se debe destacar que SCORE evalúa solo mortalidad.
Usando la PCE, el riesgo de ECVM de este paciente es de 10,6% y aplicando el SCORE el riego de mortalidad es de 2%, ambos a diez años.
Pregunta 5. Ante este nivel de riesgo indique la opción que considere correcta
1. Indicaría tratamiento de alta intensidad con estatinas, por ejemplo rosuvastatina 20 mg/día.
2. Indicaría atorvastatina 10 mg/día.
3. Realizaría un score de calcio.
4. Mediría el espesor medio-intimal carotídeo.
Estamos ante un paciente de riesgo intermedio para los estadounidenses (7,5%-19,9%) y moderado para los europeos (>1% y <5%). La guía estadounidense plantea que si el paciente tuviera alguno de los factores que aumentan el riesgo de ECVM, independientes del PCE, sería obligatorio el uso de estatinas (tabla 4). De los datos disponibles, no hay ninguno de estos factores. Es en esta situación donde debe primar el criterio clínico, así como la voluntad del paciente. Hay evidencia del beneficio del uso de estatinas en la reducción de eventos en este rango de riesgo. En el aumento del riesgo incide sobre todo el tabaquismo intenso (jerarquizado para definir la indicación del uso de estatinas en la guía estadounidense) más que la edad. Estos hechos minimizan la posibilidad de sobreestimación del riesgo. Por lo tanto, la guía estadounidense indicaría en este caso estatinas desde el inicio luego de una discusión con el paciente.
Decidido el uso de estatinas nos preguntamos qué dosis indicar. En sujetos con riesgo intermedio, sin factores agravantes, se sugiere el uso de estatinas a dosis moderadas (reducción de C-LDL entre 30%-50%).
De acuerdo con las guías europeas, ante un riesgo moderado con los niveles de C-LDL de este paciente, se sugiere cambio de estilo de vida, y si no se logra descender el C-LDL por debajo de 100 mg/dl, iniciar estatinas. Sin embargo, en estos pacientes de riesgo moderado, tanto los europeos como los estadounidenses destacan el valor de algunos estudios, como el score cálcico, que permiten reclasificar el riesgo del paciente y definir con mayor precisión la conveniencia o no del inicio de estatinas.
Por lo tanto, nos parece que no existe una única respuesta correcta y que administrar rosuvastatina a la dosis de 10 mg de entrada, como realizar un score cálcico, si está disponible en el medio en que el médico tratante actúa, son conductas adecuadas.
Caso 5
Paciente de 62 años, SF, bibliotecaria.
Exfumadora. HTA tratada con candesartán 8 mg/día e indapamida 1,25 mg/día. DM2 medicada con dieta y metformina 850 mg dos veces por día. ACV isquémico hace tres meses, sin secuelas.
Recibe, además, simvastatina 40 mg/día y AAS 100 mg/día.
Consultó por mialgias difusas a predominio proximal de un mes de evolución con leve disminución de fuerzas proximales en el examen clínico. Reflejo idiomuscular disminuido en todos los sectores explorados. Reflejos osteotendinosos presentes. PA 112/70 mmHg.
Creatinfosfoquinasa total 1.500 UI/l. Azoemia 30 mg/dl. Creatininemia 0,7 mg/dl. Orina normal.
Pregunta 6. El diagnóstico más probable es:
1. Rabdomiolisis por estatinas.
2. Miopatía por estatinas.
3. Mialgias por estatinas.
4. Miopatía inmunomediada por estatinas.
La afectación muscular vinculada a las estatinas es el efecto adverso más importante y frecuente de éstas.
El tipo de afectación muscular más frecuente está dado por las mialgias sin paresia, ni aumento significativo de la CPK. Es rara la miopatía estatínica en la que, además del dolor muscular, se asocia paresia y una elevación de la CPK, habitualmente superior a diez veces su valor normal.
Menos frecuente aún, pero muy grave, es la rabdomiolisis por estatinas con valores de CPK > 10.000 UI/l, mioglobinuria e injuria renal aguda.
Por último, existen reportes de casos de miopatía inmunomediada por estatinas, asociada a anticuerpos HMGCR y de resolución incompleta luego de suspendidos estos fármacos.
En este caso, el paciente presenta mialgias difusas con paresia proximal de los miembros, una CPK aumentada más de diez veces su valor normal, y no asocia proteinuria ni afectación de la función renal. Se interpreta, entonces, como una miopatía estatínica (respuesta número 2). Si tomadas las medidas correspondientes, no retrocede el compromiso muscular luego de un plazo adecuado, habría que pensar en la rara posibilidad de la miopatía inmunomediada33).
Pregunta 7. La conducta a seguir es
1. Suspender la simvastatina y sustituirla por rosuvastatina 20 mg v/o por día.
2. Suspender la simvastatina, esperar a que se normalice la CPK y reiniciar la droga a dosis de 20 mg v/o por día.
3. Suspender definitivamente el uso de estatinas.
4. Suspender la simvastatina e indicar fenofibrato 160 mg/día una vez normalizada la CPK con control clínico y de CPK seriados.
La primera acción a tomar es suspender la estatina. Excepto en la rabdomiolisis o en la miopatía autoinmune, la suspensión de las estatinas, en principio, no debería ser definitiva. Hay que esperar hasta la remisión de los síntomas y la normalización de la CPK. El lapso puede llevar de semanas a meses. Si no se logra, como ya se dijo, hay que considerar la miopatía inmunológica u otros diagnósticos.
Si luego de suspendidas las estatinas, los síntomas desaparecen y la CPK se normaliza, existen varias conductas posibles:
- Reiniciar la misma droga a dosis menores, y si hay recidiva, indicar nueva suspensión de la estatina en cuestión. Se intenta luego cambiar otra estatina a dosis bajas, por ejemplo, rosuvastatina 5 mg/día.
- Cambiar a otra estatina a dosis bajas probando tolerancia y eventualmente asociar otros hipolipemiantes (ezetimibe de primera elección, eventualmente inhibidores de la PCSK9 en pacientes de muy alto riesgo).
- Utilizar bajas dosis de estatinas en días alternos.
- Si no tolera ninguna estatina a dosis bajas, optar por otro tratamiento, como ezetimibe, y eventual asociación con otros hipolipemiantes.
Por lo tanto, no es correcto indicar rosuvastatina a dosis altas luego de la suspensión de simvastatina, ni cambiar a fenofibrato, sin hacer un nuevo intento con estatinas y eventualmente con ezetimibe. Tampoco se trata de una rabdomiolisis, ni tenemos por el momento evidencia de que se trate de una miopatía inmunomediada. Por lo tanto, no está indicada la suspensión definitiva de las estatinas en este primer evento de compromiso muscular. En suma, la respuesta correcta es la opción 2.