1. Introducción
El tratamiento de la hipercolesterolemia como factor de riesgo cardiovascular (CV) ha sufrido notorios cambios durante los últimos años. Si bien a principios de la década ya se disponía de fármacos con marcada actividad hipolipemiante, como las estatinas, los fibratos y los secuestradores de ácidos biliares, en ocasiones su uso no era suficiente para alcanzar los objetivos necesarios de reducción del colesterol, además de ser medicamentos con una alta tasa de efectos adversos1-3).
En esta década se han desarrollado grandes ensayos clínicos que introducen nuevas herramientas terapéuticas para el tratamiento de la hipercolesterolemia: en primer lugar apareció el ezetimibe (inhibidor de la absorción intestinal de colesterol a través del receptor NPC1-L1), cuyo ensayo clínico IMPROVE-IT, publicado en el año 2015, demostró beneficio adicional añadido al tratamiento con estatinas en pacientes con cardiopatía isquémica4. Posteriormente se publicaron dos grandes ensayos con fármacos inhibidores de la degradación del receptor de colesterol unido a las lipoproteínas de baja densidad (c-LDL) a través de la enzima proproteína convertasa subtilisina kexina tipo 9 (i-PCSK9): FOURIER en el caso de evolocumab en 2017 y ODYSSEY OUTCOMES en el de alirocumab en 2018 (este segundo focalizado en pacientes con cardiopatía isquémica), que demostraron resultados beneficiosos con la reducción adicional del colesterol aportada por las estatinas5,6. La publicación de estos grandes ensayos ha supuesto un cambio en el paradigma del tratamiento de las dislipemias: previo a la aparición de los mismos se postulaba la “hipótesis de las estatinas”, que defendía que no solo el descenso del colesterol, sino los efectos pleiotrópicos de éstas a otros niveles, sumaban beneficio a su uso (mejoría de la disfunción endotelial, inhibición de la inflamación, mejor metabolismo del óxido nítrico, efectos antioxidantes)7-9. Sin embargo, después de la publicación de estos ensayos, se ha visto que el beneficio se mantiene si se realiza un descenso puro de las cifras de colesterol con fármacos que no tienen otros efectos conocidos. Esta “hipótesis del c-LDL” como principal causante del riesgo CV, ha hecho cambiar el manejo hacia una postura que busca “the lower, the better” (cuanto más bajo, mejor) respecto a los niveles de c-LDL sanguíneo, comprobándose un descenso del 1% de eventos CV cada 1% de reducción del c-LDL, o un 20% de reducción de riesgo de eventos cada 1 mmol/l de c-LDL reducido (2-3 mmol/l para lograr una reducción del 50%)10).
A su vez, en estos años han surgido numerosos artículos que han ayudado a conocer mejor determinadas patologías, como la hipercolesterolemia familiar (HF) o la diabetes, lo cual ha facilitado la estratificación del riesgo de estos pacientes. Se ha logrado individualizar tanto su pronóstico como su tratamiento, facilitando información acerca de qué niveles de colesterol son los más adecuados para detener o revertir el proceso aterogénico.
Este cambio de paradigma se vio reflejado en una actualización de las guías de tratamiento de las dislipemias, tanto estadounidenses, a finales de 2018, como europeas en septiembre de 201911-14. El objetivo de este artículo es realizar un análisis comparativo de las principales novedades reflejadas en las mismas.
2. Análisis comparativo
a) Estimación del riesgo cardiovascular total y nuevos factores modificadores del riesgo
La estimación del riesgo cardiovascular total (RCVT) es el primer paso a seguir como guía para el tratamiento hipolipemiante.
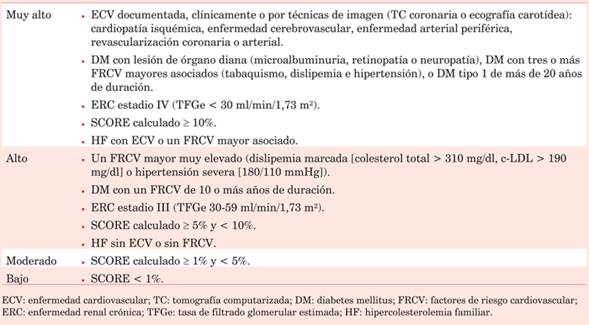
En el caso de las guías ESC, el sistema utilizado en pacientes > 40 años es el SCORE (Systematic Coronary Risk Estimation), que proporciona una estimación del riesgo de evento CV fatal a los diez años. Esta calculadora está disponible en dos versiones, para alto y bajo riesgo según la zona donde se aplique (por ejemplo, en España se utilizaría la versión de bajo riesgo)15. No es necesaria en pacientes de muy alto riesgo (siendo este apartado el que ha sufrido una reestructura significativa en las últimas guías) a saber: pacientes con enfermedad CV establecida (con la novedad en las últimas guías de que la documentación de la misma puede ser por pruebas de imagen, y no solo clínica, por ejemplo en el caso de la enfermedad coronaria), enfermedad renal crónica > estadio IIIa, diabetes tipo 2 con daño de órgano diana, más de tres factores de riesgo CV o diabetes tipo 1 de más de 20 años de evolución; o la HF asociada a cualquier otro factor de riesgo13. En pacientes < 40 años se proponen como estrategias la estimación de riesgo relativo o la estimación de la edad de riesgo. Una vez realizada esta estimación los pacientes son estratificados en cuatro grupos (tabla 1) según su riesgo (muy alto, alto, moderado y bajo).
En general, este apartado no ha sufrido grandes cambios. Sí se presenta como novedad en 2019 la extensión de la escala hasta pacientes de 70 años, confirmando que en prevención primaria la edad constituye un claro factor de riesgo para presentar enfermedad CV16. Llama la atención la falta de precisión al estratificar el riesgo individual de un paciente en el sistema SCORE a pesar de las continuas actualizaciones, no siendo posible calcular el riesgo individual en pacientes diabéticos o con HF16) .
Existen problemas añadidos al hecho de utilizar un único sistema de estratificación de riesgo. Por ejemplo, se ha demostrado que en el caso de la población española, la escala SCORE sobreestima el riesgo en su versión de bajo riesgo, que traería como consecuencia el sobretratamiento y consumo de recursos innecesarios17. Tomando en cuenta estas dificultades, las guías ofrecen una serie de factores modificadores (situación social precaria, estrés psicosocial, enfermedad renal o inactividad física, entre otros), que aumentan el riesgo CV de forma aditiva.
Las guías ACC/AHA del año 2018 proponen como herramienta fundamental para estratificar el riesgo en su población, la calculadora ASCVD Risk Estimator Plus, ofreciendo resultados según perfil individual, riesgo estimado a diez años y riesgo a lo largo de la vida, distribuyéndose en cuatro categorías: riesgo bajo (< 5%), riesgo límite (5%-7,4%), riesgo intermedio (7,5%-19,9%) y riesgo alto (> 20%). Añaden como novedad una categoría de muy alto riesgo para aquellos pacientes que han tenido más de una patología CV relacionada con aterosclerosis, o los que han tenido una, pero además poseen múltiples condiciones de alto riesgo. La aparición de factores intensificadores, tanto en situaciones de alto riesgo, como en otras situaciones, por ejemplo, la diabetes, es un punto en común y novedoso también en estas guías.
En ambas guías aparece la introducción de las técnicas de imagen CV como factor modificador del riesgo o reclasificadores en pacientes asintomáticos con un riesgo intermedio o límite (ACC/AHA) o bajo, o intermedio (ESC). En el caso de las guías estadounidenses se incluye el calcio coronario medido mediante el score de Agatston a través de la tomografía computarizada (TC), y en las guías europeas se incluye la visualización de enfermedad coronaria multivaso, con estenosis > 50% de dos o más vasos principales en la TC. También la ecografía vascular carotídea o femoral ha surgido como herramienta para evaluar la carga de enfermedad arteriosclerótica18-23. Obtener un resultado de alto riesgo en dichas pruebas (Agatston score > 100 o alto nivel de placas ateroscleróticas en la ecografía) supondría un dato a favor para iniciar tratamiento hipolipemiante en estos pacientes, dado el beneficio demostrado en reducir eventos CV, como se observó en el ensayo HOPE-324) .
b) Lípidos y lipoproteínas
Uno de los resultados obtenidos de los ensayos con i-PCSK9 es, como comentamos previamente, la consolidación del c-LDL como principal lipoproteína causante de la placa de ateroma que origina la enfermedad CV. Si bien en la mayoría de los individuos es un equivalente de lo que sería el colesterol no-HDL o la concentración de apo B, existen determinadas situaciones, como obesidad, diabetes, hipertrigliceridemia o niveles bajos de c-LDL, en las que puede subestimarse la cantidad de colesterol transportado por c-LDL y la concentración total de moléculas apo B y, por lo tanto, el riesgo CV. En estas situaciones ha aumentado el grado de recomendación (a clase I) de las últimas guías de la ESC en relación con la medida de apo B, dada la elevada prevalencia de sesgo en la medición del c-LDL, presente hasta en un 20% de los pacientes25.
Debe también destacarse el papel relevante que le otorgan las últimas guías de la ESC a la lipoproteína (a), después de los resultados obtenidos en el estudio ODYSSEY OUTCOMES6. Se considera la necesidad de realizar una medición de esta lipoproteína (recomendación clase IIa), ya que aquellos individuos con niveles elevados (> 180 mg/dl) tendrían un riesgo similar a los pacientes con HF heterocigota26-29.
c) Objetivos de tratamiento
Una de las principales y más controvertidas novedades de las guías ESC, ha sido el cambio en los objetivos de c-LDL propuestos, sobre todo en pacientes con enfermedad CV y coronaria establecida (tabla 2). Fundamentándose en los resultados obtenidos en los ensayos con i-PCSK9, FOURIER y ODYSSEY OUTCOMES, los pacientes de muy alto riesgo según el sistema de estratificación SCORE en prevención primaria o las situaciones previamente comentadas, definidas como de muy alto riesgo, deberían presentar niveles de c-LDL inferiores a 55 mg/dl, e incluso menores de 40 mg/dl en pacientes con enfermedad CV establecida si presentan de forma precoz (en los siguientes dos años) un nuevo episodio CV, independientemente del territorio afectado. Los pacientes de riesgo alto pasan a tener un objetivo de c-LDL de 70 mg/dl5,6.
Pero no solo importa el nivel de c-LDL alcanzado, sino también la rapidez en conseguir el mismo. En los pacientes que han sufrido cardiopatía isquémica, se recomienda alcanzar los niveles objetivo en un período de cuatro a seis semanas desde el inicio de la terapia hipolipemiante, escalando si fuese necesario a i-PCSK9. En pacientes que han presentado un evento CV en tratamiento con dosis máximas de estatinas en combinación con ezetimibe, se recomienda el inicio de i-PCSK9 durante el ingreso hospitalario.
Si bien en los ensayos clínicos de i-PCSK9 la reducción marcada de c-LDL (la media de c-LDL al final del ensayo FOURIER era de 29 mg/dl y en el ODYSSEY OUTCOMES de 53 mg/dl a los 48 meses) es la que ha llevado a proponer estos niveles, surgen algunas dudas a la hora de su implementación: en primer lugar, el efecto a largo plazo de estos fármacos, tanto a nivel de descenso mantenido del colesterol como a nivel de efectos adversos, ya que ninguno de los dos ensayos ha tenido un tiempo de seguimiento mayor de tres años5,6. Aunque existen ensayos de seguridad (a nivel cognitivo en el estudio EBBINGHAUS) actualmente son escasos y la información es limitada30. En segundo lugar, a pesar de los buenos resultados obtenidos en el descenso de eventos clínicos duros (reducción de hasta el 15% en un combinado de muerte CV, infarto agudo de miocardio, angina, revascularización o ictus), queda la duda de si es necesario un mayor tiempo de seguimiento para demostrar disminución de mortalidad CV como objetivo aislado. Por último, es fundamental considerar el aspecto fármaco-económico.
d) Terapia farmacológica
Si algo tienen en común las últimas guías publicadas a nivel europeo y estadounidense, es el papel principal que otorgan a las terapias con ezetimibe e i-PCSK9. Si bien en el caso de las guías de la ESC de 2016 ya se mencionaban ambas como una alternativa, en esta ocasión se presentan con el máximo grado de recomendación para las situaciones previamente comentadas12. La adición de estos tratamientos supone un descenso adicional de 15% del c-LDL en el caso de ezetimibe y de 25% en el caso de los i-PCSK9, sumado al 50% de reducción que puede obtenerse con un tratamiento óptimo a máximas dosis de estatinas de alta potencia. La combinación de los tres medicamentos podría alcanzar una reducción de 85% en los niveles de c-LDL13. El papel de otros tratamientos utilizados en la década previa, como fibratos o resinas de intercambio, pasa a ser secundario, debido a las dificultades en su uso: mala tolerancia clínica con un perfil de efectos adversos notorio y en ocasiones sinérgico con el de las estatinas (como puede ser la rabdomiólisis en el caso de los fibratos) y evidencia científica mucho menos potente que la de los grandes ensayos con ezetimibe e i-PCSK9.
Hay una mención específica con respecto a los conocidos efectos adversos de las estatinas en las guías de la ESC. Se realiza una clara distinción entre la miopatía por estatinas, con una afectación orgánica clara del músculo, y lo que se denomina statin-associated muscle symptoms (SAMS), entendiendo por tal, síntomas musculares que no tendrían una explicación orgánica. Esto se debe a la aparición de estudios ciegos en los que se demostró que la aparición de molestias musculares no era superior en los pacientes tratados con estatinas31-33).
En las guías ESC se mencionan otras terapias novedosas, aunque algunas ya mencionadas en anteriores versiones, de las que se necesitan más estudios que aporten evidencia para su uso, como serían los inhibidores de la CEPT (proteína transportadora de ésteres de colesterol), la lomitapida, el mipomersen, el ácido bempedoico o el inclisirán.
Con respecto a otros trastornos de los lípidos, aumenta el grado de recomendación (hasta clase IIa) para el uso de ácidos grasos omega 3 en el tratamiento de hipertrigliceridemias persistentes a pesar del tratamiento con estatinas34.
e) Cambios en situaciones y enfermedades especiales
Hipercolesterolemia familiar: la HF es uno de los puntos quizá más discordantes entre ambas guías. Si bien en las guías estadounidenses la sitúan como condición de alto riesgo, se necesitan otros factores accesorios para situarla como de muy alto riesgo. Tiene, además, niveles de c-LDL objetivos mayores que en las guías europeas, donde solo con un factor de riesgo adicional se debería potenciar al máximo la prevención en estos pacientes y conseguir objetivos por debajo de 55 mg/dl35.
Diabetes mellitus: al igual que ocurre con la HF, las guías ESC estratifican con un mayor nivel de riesgo a estos pacientes, exigiéndoles niveles objetivos de c-LDL más bajos. Además, existe la particularidad de que el c-LDL no se comporta de la misma manera que en individuos no diabéticos. Se ha demostrado que estas partículas tienen un comportamiento más aterogénico. Por este motivo, se recomienda la monitorización del colesterol no-HDL o del total de apo B sérico, ya que pueden ayudar a objetivar y determinar mejor el riesgo aterogénico. Por último, se añade la recomendación de intensificar adecuadamente la terapia con estatinas hasta la dosis máxima tolerada, previo al inicio de terapia combinada, primero con ezetimibe y posteriormente con i-PCSK936-39).
Ancianos: ambas guías coinciden en que en los pacientes mayores de 75 años el beneficio clínico es dudoso, y debe valorarse según la situación de riesgo individual, y otros factores como la polifarmacia o la enfermedad renal crónica.
3. Conclusiones
El tratamiento de las dislipemias ha sufrido importantes cambios en la última década, principalmente debido a la aparición de grandes ensayos clínicos con inhibidores de la absorción de colesterol (ezetimibe) e i-PCSK9. El tratamiento dirigido, adecuando la intensidad de la terapia hipolipemiante según la cuantificación del riesgo CV individualizado, es el objetivo principal en años venideros de acuerdo a la evidencia científica actual.