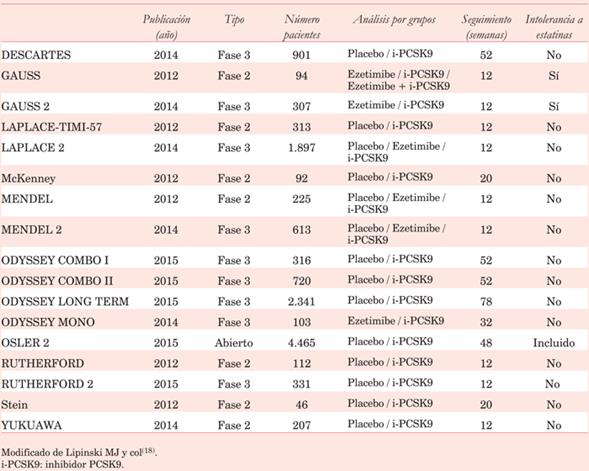
Introducción
Las estatinas continúan siendo los fármacos de elección para la reducción del riesgo cardiovascular (RCV) y el tratamiento de la mayoría de las dislipemias.
De acuerdo al estudio CTT (Cholesterol Treatment Trialist’s Collaborators), cada 39 mg/dl de reducción de colesterol asociado a lipoproteínas de baja densidad (C-LDL), se reduce el riesgo de eventos cardiovasculares mayores (MACE, por su sigla en inglés, Mayor Adverse Cardiovascular Events)1.
Aún no se ha establecido un límite inferior por debajo del cual una reducción adicional del C-LDL deje de incrementar el beneficio. En pacientes con alto o muy alto RCV, están indicadas dosis de estatinas de moderada-alta intensidad. En muchos casos éstas no son bien toleradas o no son suficientes para alcanzar el objetivo de C-LDL planteado2.
Previo a la era de los inhibidores de la proproteína convertasa subtilisina kexina tipo 9 (i-PCSK9), solo ezetimibe asociado a estatinas había logrado demostrar su eficacia no solo en reducir los niveles plasmáticos de C-LDL, sino también los eventos cardiovasculares, de acuerdo a los resultados del estudio recientemente publicado IMPROVE-IT3. La asociación con otros hipolipemiantes como fenofibrato o niacina no mostró beneficios, y con niacina se observaron inclusive efectos adversos (EAs).
De este modo los i-PCSK9 se convierten en una terapia innovadora eficaz y segura para el manejo del RCV en un número no menor de pacientes.
Rol de la PCSK9 en la regulación homeostática del colesterol
El receptor de C-LDL (R-LDL) es responsable del clearance de la mayoría de las lipoproteínas (LP) ricas en apolipoproteína B (apo B). Cada partícula de C-LDL se une al R-LDL en la superficie del hepatocito y el complejo es internalizado vía endocitosis4,5).
En ausencia de PCSK9, la partícula de C-LDL se escinde del R-LDL y es degradada a nivel lisosomal. En cambio, el R-LDL, intacto, es reincorporado a la superficie del hepatocito para continuar realizando el clearance de C-LDL y otras LP ricas en apo B. Este reciclaje del R-LDL ocurre unas 150 veces al día.
La presencia de PCSK9 altera este proceso con un impacto directo sobre el clearance y, por lo tanto, los niveles de C-LDL circulante. La unión de PCSK9 al complejo C-LDL/R-LDL determina que el C-LDL y el R-LDL no puedan escindirse, de modo tal que el complejo C-LDL/R-LDL/PCSK9 ingresa al lisosoma y es completamente degradado6,7. Como resultado, se reduce de forma marcada el número de R-LDL en la superficie hepática, con el consecuente incremento de los niveles plasmáticos de C-LDL.
En la (figura 1) se esquematizan los principales aspectos de la regulación homeostática del colesterol.
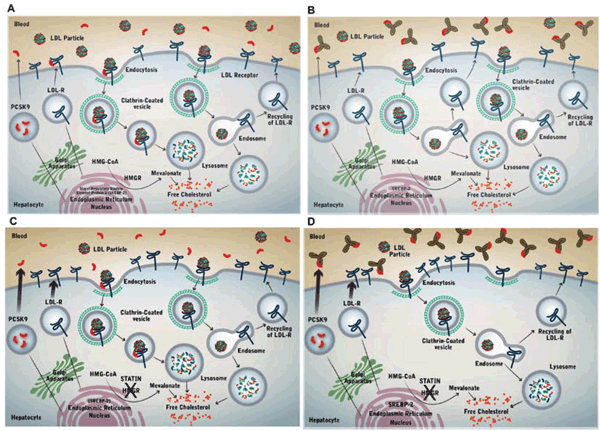
Figura 1: A) Relación dinámica entre PCSK9, R-LDL y C-LDL en pacientes sin hipolipemiantes. B) Impacto de i-PCSK9 en relación dinámica entre PCSK9, R-LDL y C-LDL en pacientes sin otros hipolipemiantes. C) Relación dinámica entre PCSK9, R-LDL y C-LDL en pacientes bajo estatinas. D) Impacto de i-PCSK9 sobre la relación dinámica entre PCSK9, R-LDL y C-LDL en pacientes bajo estatinas. Reproducida con autorización de McKenney JM5. HMGCoA: 3-hidroxi 3 metilglutaril coenzima A; HMGR: 3-hidroxi 3 metilglutaril coenzima A reductasa; LDL: lipoproteínas de baja densidad; C-LDL: colesterol asociado a LDL; R-LDL: receptor de LDL.
Variación de los niveles de PCSK9
Los niveles de PCSK9 varían interindividualmente en más de 100 veces. Existe, además, un ritmo circadiano con variaciones de PCSK9 circulante a lo largo del día.
Se han observado niveles superiores en:
Interacción de PCSK9 con la síntesis de colesterol
Ante la inhibición de la síntesis de colesterol, por ejemplo en respuesta al uso de estatinas, se produce una regulación en más de la síntesis de R-LDL y de la transcripción de PCSK9, en vistas a restaurar la reserva de colesterol (figura 1C)5.
Diferentes estudios han objetivado el incremento de los niveles de PCSK9 tanto con atorvastatina como con rosuvastatina, siendo mayor el incremento cuanto mayor es la dosis indicada. Al comparar un grupo control sin hipolipemiantes versus pacientes bajo tratamiento con estatinas se objetivó un incremento de 45% de los niveles de PCSK9 y de 77% cuando se asocian estatinas y ezetimibe8.
Mutaciones de PCSK9 y riesgo cardiovascular
Es, en efecto, del estudio de personas con mutaciones de pérdida o ganancia de función del gen que codifica la PCSK9, que se generaron las primeras hipótesis acerca de su implicancia en la homeostasis del colesterol.
En las mutaciones con ganancia de función de PCSK9 se produce hipercolesterolemia, con valores extremadamente altos de C-LDL, como es el caso de la hipercolesterolemia familiar (HF), que se asocia a muerte cardiovascular prematura9.
Por el contario, en mutaciones con pérdida de función de la PCSK9, la consecuencia es la hipocolesterolemia, con niveles promedio de C-LDL que oscilan en 20 mg/dl, y que conllevan reducción de MACE y longevidad.
En un metaanálisis que incluyó a más de 66.000 pacientes con la mutación específica de pérdida de función de PCSK9 R46L, ésta se asoció con una reducción de C-LDL de 12%, que se tradujo en una disminución de 18% en el riesgo de cardiopatía isquémica. Además, probablemente debido a la larga exposición a niveles bajos de C-LDL, la reducción del riesgo de ECV fue muy marcada, 88%.
La población con mutación homocigota de pérdida de función de PCSK9 muestra, en estudios clínicos, C-LDL entre 14-16 mg/dl. A pesar de que existió preocupación acerca del posible incremento de accidente cerebrovascular (ACV) hemorrágico, cáncer, hipertensión, disfunción neurocognitiva o reproductiva con niveles tan bajos de C-LDL, esta población se mantiene saludable, lo cual sugiere que la inhibición de PCSK9 per se no se asocia a EAs significativos4.
Inhibidores de la PCSK9
Resulta lógico, tras comprender el rol de esta proteína en el metabolismo lipídico, el interés en diseñar fármacos que tengan como diana terapéutica la PCSK9. El desarrollo de los i-PCSK9 comenzó hace algo más de diez años. Se trata de anticuerpos monoclonales que se unen a la PCSK9 circulante en plasma, evitando su unión al R-LDL.
Al día de hoy, dos i-PCSK9 se encuentran aprobados por la Food and Drug Administration (FDA) desde el año 2015:
Un tercer i-PCSK9, bococizumab, fue discontinuado en 2016 dada la alta tasa de atenuación de su efecto vinculado a inmunogenicidad. Esto se adjudicó a que se trataba de un anticuerpo humanizado y no completamente humano, a diferencia de alirocumab o evolocumab. Por la misma causa también se observaron reacciones en el sitio de punción en una alta proporción de pacientes.
Farmacocinética
Tras la inyección subcutánea de 150 mg de alirocumab, este aparece en plasma en minutos, alcanzando su concentración máxima en siete días, tras lo cual se produce un descenso gradual.
Los niveles de PCSK9 comienzan a descender en minutos tras la administración de alirocumab, alcanzando niveles próximos a 0 al final del primer día. La supresión completa persiste por aproximadamente diez días.
Los niveles de C-LDL comienzan a descender un día después de la administración de estos anticuerpos, alcanzando los niveles plasmáticos mínimos a los 14 días, ascendiendo progresivamente luego de este período. Esta cinética determina que el tiempo óptimo para repetir la dosis sea a los 14 días. Si no se administra una nueva dosis, los niveles plasmáticos de C-LDL vuelven a su punto de origen en aproximadamente 60 días (figura 2)5.
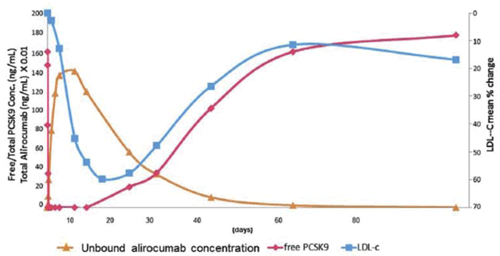
Figura 2: Relación dinámica entre PCSK9 libre, concentración de alirocumab, C-LDL luego de alirocumab subcutáneo. Reproducida con autorización de McKenney JM5. Unbound alirocumab concentration: concentración de alirocumab libre; LDL-c: colesterol asociado a lipoproteínas de baja densidad; free PCSK9: PCSK9 libre; PCSK9 Conc.: concentración de PCSK9; LDL-C mean % change: % medio de modificación de C-LDL.
En la (tabla 1) se resumen las principales diferencias farmacocinéticas entre alirocumab y evolocumab.
Efectos de los inhibidores PCSK9 sobre las fracciones lipídicas
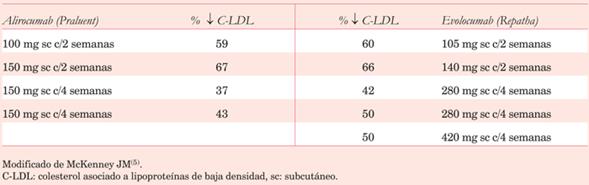
Tanto alirocumab como evolocumab determinan reducciones marcadas en los niveles plasmáticos de C-LDL. En la (tabla 2) se describen los porcentajes de descenso de C-LDL con ambos fármacos de acuerdo a la dosis y frecuencia de administración.
Tabla 2: Comparación del porcentaje de reducción de C-LDL luego de 12 semanas de alirocumab versus evolocumab.
Diversos estudios sugieren que los i-PCSK9 reducen los niveles de las LP ricas en TG. Esto es debido a que el clearance de estas LP se encuentra a cargo también del R-LDL. Por el contrario, se ha observado que en pacientes con mutaciones con ganancia de función de PCSK9, la concentración de LP ricas en TG, portadoras de apo B100, se encuentra aumentada al menos al triple. Sin embargo, al observar el perfil lipídico estándar los niveles de TG se reducen discretamente con los i-PCSK9, aproximadamente 15%, similar al efecto que producen las estatinas.
Los estudios en humanos no han podido demostrar que los i-PCSK9 determinen una reducción en la producción de LP de muy baja densidad (VLDL), ricas en TG, es decir, que el descenso en la concentración de TG se debería exclusivamente al aumento de su clearance10.
Los cambios que se producen en la concentración de colesterol asociado a LP de alta densidad (C- HDL) y de apo A1 con la administración de i-PCSK9 son similares a los observados con estatinas, un incremento modesto, próximo a 10%.
Si bien la regulación de producción y el clearance de LP(a) son poco conocidos, existe clara evidencia del poder proaterogénico y protrombótico de esta LP rica en apo B, cuyos niveles circulantes se encuentran genéticamente determinados. De acuerdo con Nordestgaard11, más del 30% de la población presenta niveles elevados de LP(a), y hasta el momento ningún fármaco ha demostrado una reducción que se acompañe de disminución de MACE. Llamativamente, el uso de i-PCSK9 determina una reducción de 25%-30% de los niveles de LP(a). Si bien el primer planteo es que este descenso se deba a un incremento de su clearance, a través de la sobreexpresión del R-LDL, la unión de la LP(a) al R-LDL es débil, y el porcentaje de descenso es aproximadamente la mitad del producido en el C-LDL. Los argumentos previos, entre otros, sugieren que debe existir un mecanismo diferente al clearance por el R-LDL que justifique este descenso. Aún no se encuentran disponibles estudios que demuestren que la reducción de LP(a) determinada por los i-PCSK9, se asocie a una reducción de MACE.
Indicaciones de inhibidores de PCSK9
En la actualidad existen tres grupos de pacientes que se benefician del uso de i-PCSK9.
1. Pacientes con enfermedad cardiovascular aterosclerótica (ECVA) establecida que no alcanzan los objetivos de tratamiento.
2. Pacientes con HF o hipercolesterolemia severa.
3. Pacientes con muy alto RCV e intolerancia a las estatinas.
Existe evidencia a favor en cada uno de los tres grupos que se analizará de forma breve a continuación.
Las guías de la National Lipid Association (NLA) del año 201512 definieron las indicaciones de los i-PCSK9 y fueron revisadas en 2017 en base a la nueva evidencia disponible13. En la (tabla 3) se esquematizan las indicaciones de la NLA 2017, que no difieren demasiado de las guías europeas (tabla 4)14.
Estudios de evidencia que justifican la indicación de inhibidores de PCSK9
En pacientes con enfermedad cardiovascular aterosclerótica establecida
El primer gran estudio con i-PCSK9 que analizó los eventos cardiovasculares fue el FOURIER15. En este estudio controlado, doble ciego, se randomizaron más de 27.000 pacientes con ECVA establecida y C-LDL 70 mg/dl, bajo tratamiento con dosis máximas toleradas de estatinas, a evolocumab versus placebo. El objetivo primario compuesto fue mortalidad cardiovascular, infarto de miocardio (IM), ACV no fatal, hospitalización por angina inestable o revascularización coronaria. El objetivo secundario fue mortalidad cardiovascular, IM o ACV no fatal (MACE). La media de seguimiento fue de 2,2 años, con media de edad de 63 años. A las 48 semanas se observó una reducción de C-LCL de 59%, con una media al inicio de 92 mg/dl versus 30 mg/dl al final del estudio (p<0,001). La reducción del desenlace primario en la rama evolocumab fue estadísticamente significativa, 9,8% versus 11,3% (reducción de 15%, p<0,001). El desenlace secundario se redujo en 20% con una p también estadísticamente significativa. El número necesario a tratar para prevenir un evento en dos años, fue 67. No se modificó, sin embargo, la mortalidad total ni cardiovascular.
El estudio ODYSSEY, ensayo multicéntrico aleatorizado, doble ciego, evalúa desenlaces cardiovasculares luego de un síndrome coronario agudo (SCA (IM o angina inestable)) y C-LDL >70 mg/dl, o C-No HDL >100 mg/dl16. Se randomizaron los pacientes tratados con dosis máximas toleradas de estatinas a dos ramas, alirocumab 75-150 mg sc cada dos semanas o placebo sc cada dos semanas, con un seguimiento de 2,8 años. Se incluyeron más de 18.500 pacientes; el desenlace primario fue el combinado de muerte cardiovascular, IM no fatal, ACV isquémico fatal y no fatal, y hospitalización por angina inestable. Como resultados, el desenlace primario se redujo 15%. La mortalidad total se redujo de forma significativa en la rama alirocumab (p=0,026). Alirocumab redujo también el IM no fatal, el ACV y la angina inestable. Si bien se observó una tendencia a la reducción en la mortalidad cardiovascular, esta no alcanzó significación estadística.
Este es el segundo estudio que confirma una reducción significativa de eventos cardiovasculares con el uso de i-PCSK9 en pacientes con cardiopatía isquémica tratados con dosis máximas toleradas de estatinas. Valida a estos fármacos como tratamiento eficaz y seguro para el manejo del RCV en pacientes con ECVA establecida, siendo su costo la principal limitante. En este sentido, se analizó que la mejor relación costo/beneficio se obtiene cuando se parte de C-LDL > 100 mg/dl17.
En pacientes con hipercolesterolemia familiar o hipercolesterolemia severa
Existe un gran cúmulo de evidencia que muestra un claro beneficio de los i-PCSK9 en hipercolesterolemias primarias.
En un metaanálisis publicado en 2016 se incluyeron 17 ensayos clínicos controlados randomizados que compararon a los i-PCSK9 con otros hipolipemiantes en pacientes con hipercolesterolemia primaria. Se incluyeron más de 13.000 pacientes, randomizando a cuatro ramas: i-PCSK9, placebo, ezetimibe, i-PCSK9 + ezetimibe18. La media de edad fue de 59 ± 10 años, 52% fueron hombres, 34% con enfermedad coronaria. La media de C-LDL fue de 122 ± 36 mg/dl.
Los i-PCSK9 redujeron de forma significativa el C-LDL, 57% al compararlo con placebo y 31% al hacerlo con ezetimibe (p<0,001). La mortalidad por todas las causas se redujo de forma significativa (p=0,01 OR 0,43). Sin embargo, se evidenció un incremento en la incidencia de efectos adversos neurocognitivos (OR 2,34). En la (tabla 5) se esquematizan los estudios incluidos y sus características principales.
En pacientes con intolerancia a estatinas
En pacientes con intolerancia total o parcial a las estatinas, se requieren alternativas terapéuticas. Se recuerda que del total de 20%-30% de pacientes en los que se plantea intolerancia, solo 5%-6% son realmente intolerantes una vez cumplidos los pasos diagnósticos adecuados19.
Si bien el ezetimibe puede ser una alternativa válida en los casos en que el C-LDL está cercano a la meta, los i-PCSK9 constituyen la mejor opción cuando se requieren descensos mayores.
En el estudio Gauss-220 se randomizaron 331 pacientes con intolerancia a estatinas por síntomas musculares, 30% de los cuales pudo recibir alguna estatina a mínimas dosis. Se randomizaron a ezetimibe o i-PCSK9 (evolocumab 140 mg sc cada dos semanas o 420 mg cada mes). Los resultados mostraron una reducción de 56% y 53% de los niveles de C-LDL con los planes de i-PCSK9 versus 18% y 15% en las ramas asignadas a ezetimibe. La discontinuación del tratamiento debida a EAs fue solo de 8% en la rama evolocumab versus 13% con ezetimibe.
En el estudio ODYSSEY ALTERNATIVE21 se evaluaron 314 pacientes con intolerancia a estatinas. Se asignaron a alirocumab 75 mg dos veces por semana, ezetimibe 10 mg o atorvastatina 20 mg diarios. Luego de 24 semanas de seguimiento, el 42% de los pacientes versus el 4% en la rama ezetimibe, habían logrado alcanzar sus objetivos de C-LDL de acuerdo a su RCV. En los pacientes asignados a alirocumab se reportaron síntomas músculo-esqueléticos en el 33% versus 41% con ezetimibe, y 46% con atorvastatina.
Efectos adversos de los inhibidores PCSK9
En el estudio ODYSSEY ALTERNATIVE21, se analizaron los EAs de alirocumab, ezetimibe y atorvastatina. Alirocumab fue bien tolerado, con menores tasas de síntomas musculares asociados a estatinas (SAMS) comparado con estatinas, con una p estadísticamente significativa y una tendencia a menores SAMS que en el grupo ezetimibe. Los EAs totales, y los responsables de discontinuación, no evidenciaron diferencias estadísticamente significativas21.
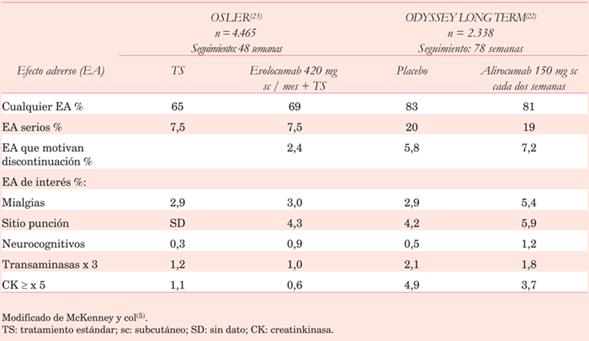
Dos grandes estudios con los principales i-PCSK9, ODYSSEY LONG TERM22 con alirocumab y OSLER23 con evolocumab, aportan más evidencia acerca de su seguridad. Ambos anticuerpos monoclonales se compararon con placebo o tratamiento estándar respectivamente. Tanto la elevación de transaminasas hepáticas, SAMS o diabetes incidental no muestran incremento significativo en los grupos con i-PCSK9.
Los efectos vinculados al sitio de punción ocurren generalmente entre el 2% y 5% de los casos, siendo estos porcentajes levemente superiores a los observados en los grupos placebo. El eritema se describe en 40% de los casos, y dolor, enrojecimiento, edema e induración, se registran en porcentajes próximos a 20%5. Se destaca que estas reacciones son leves, episódicas y autolimitadas.
En la (tabla 6) de observan los principales EAs observados en estos estudios22,23.
Conclusiones
Los i-PCSK9 son anticuerpos monoclonales que al unirse a la PCSK9 permiten descender los niveles de C-LDL a valores antes jamás sospechados. Esto es posible gracias a la recuperación del reciclaje del R-LDL a la superficie del hepatocito, lo cual mejora el clearance de todas las LP aterogénicas ricas en apo B, entre ellas el C-LDL. Su potencia y su seguridad los ha convertido en una excelente alternativa para el manejo de pacientes con hipercolesterolemia severa o intolerancia a estatinas, así como en pacientes con ECVA establecida. En este último grupo los i-PCSK9 no solo han demostrado alcanzar los objetivos de C-LDL, sino que la evidencia disponible permite afirmar que reducen el riesgo de MACE.
Previo a la aparición de estas nuevas drogas no existía alternativa eficaz para el manejo del RCV en estos grupos de pacientes. Si bien el costo es aún una barrera a nivel mundial, la tendencia es a un descenso del mismo, lo que permitirá ampliar las indicaciones.