Introducción
El uso de estatinas para reducir los niveles de colesterol unido a las lipoproteínas de baja densidad (C-LDL) y disminuir de esta forma los eventos cardiovasculares, constituye uno de los avances en prevención cardiovascular más relevantes de las últimas décadas.
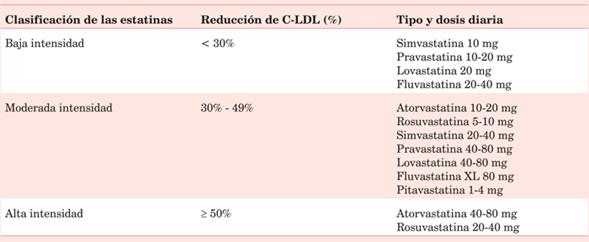
Su principal mecanismo de acción se basa en la inhibición competitiva, parcial y reversible de la enzima hepática 3-hidroxi-3-metilglutaril-coenzima A (HMG-CoA) reductasa, que cataliza la conversión de la HMG-CoA a mevalonato, precursor del colesterol1. Al disminuir la producción de colesterol intracelular, los hepatocitos aumentan la expresión de receptores de las LDL, lo que causa un mayor aclaramiento del C-LDL del plasma. La magnitud de esos cambios en el perfil de lípidos dependerá del tipo de estatina y de la dosis utilizada. Las que son capaces de disminuir un 50% o más el nivel de C-LDL se denominan de alta intensidad (tabla 1). En este grupo se encuentran la atorvastatina 40/80 mg/día y la rosuvastatina 20/40 mg/día.
Además de su principal mecanismo de acción, existe evidencia de que poseen otras propiedades que podrían ser útiles en la prevención y el tratamiento de la enfermedad aterosclerótica. Las acciones antioxidantes, antiinflamatorias, antitrombóticas o antiproliferativas (efectos pleiotrópicos), son ejemplos de ello2.
Estatinas de alta intensidad y regresión de la aterosclerosis
Varias investigaciones han estudiado si el uso de estatinas de alta intensidad impacta en la progresión (o genera regresión) de la aterosclerosis. El estudio METEOR3) mostró que en adultos de mediana edad con un puntaje de Framingham < 10% y evidencia de aterosclerosis subclínica, la rosuvastatina 40 mg/día produjo una reducción estadísticamente significativa en la tasa de progresión del espesor mediointimal carotídeo máximo durante dos años en comparación a placebo. El ensayo REVERSAL4 comparó atorvastatina 80 mg/día frente a pravastatina 40 mg/día en pacientes con lesiones coronarias menores a 50%, valorando los cambios del volumen de placa de ateroma coronario mediante ultrasonido intracoronario (IVUS) en un seguimiento de 18 meses. El tratamiento intensivo con atorvastatina redujo la progresión de la aterosclerosis coronaria. En comparación con los valores de referencia, los pacientes tratados con atorvastatina redujeron el C-LDL hasta 79 mg/dl y no cambiaron el volumen de la placa, es decir, no progresaron, mientras que los pacientes tratados con pravastatina 40 mg, alcanzando cifras de C-LDL de 110 mg/dl, aumentaron el volumen de la placa en 2,7%. El estudio ASTEROID5 mostró que el uso de rosuvastatina 40 mg/día produjo regresión de la aterosclerosis, al demostrar mediante angiografía cuantitativa la reducción porcentual del diámetro de las estenosis y el aumento luminal de las arterias coronarias. Asimismo, el estudio SATURN6 demostró con IVUS una regresión significativa de la aterosclerosis coronaria tras dos años de tratamiento con dos esquemas diarios de estatinas de alta intensidad: atorvastatina 80 mg o rosuvastatina 40 mg. Del mismo modo, el ensayo IBIS-47 demostró, luego de un seguimiento de 13 meses, la regresión de la aterosclerosis en las arterias coronarias no relacionadas con el síndrome coronario agudo (lesiones no culpables) con el uso de rosuvastatina a altas dosis.
En resumen, múltiples estudios han demostrado que las estatinas de alta intensidad impactan en la progresión de la placa aterosclerótica. ¿Cómo impactan estos hallazgos en los eventos clínicos? A continuación, analizaremos la evidencia clínica en diferentes escenarios.
Uso adecuado de las estatinas de alta intensidad en prevención secundaria
Entendemos por prevención secundaria al conjunto de medidas terapéuticas que buscan evitar un segundo evento vascular en el paciente con antecedentes de enfermedad coronaria, accidente cerebrovascular (ACV) isquémico o enfermedad vascular periférica clínica. En este grupo de pacientes hay consenso en que dichos fármacos constituyen una herramienta terapéutica esencial. ¿De dónde surge dicho consenso? ¿Cuál es el fundamento científico? En las últimas décadas, la evidencia proveniente de los grandes ensayos clínicos aleatorizados con estatinas demuestra que la disminución del colesterol reduce la mortalidad cardiovascular, la incidencia de infarto agudo de miocardio (IAM), ACV y la necesidad de revascularización.
Los primeros ensayos clínicos compararon estatinas de moderada intensidad versus placebo8-12. Como consecuencia, la eficacia y seguridad de las estatinas quedaba ampliamente demostrada. Posteriormente, se planteó la hipótesis de que utilizar estatinas de mayor potencia mostraría una mayor reducción de los eventos cardiovasculares en comparación a los esquemas menos intensivos. El estudio PROVE-IT13 incluyó 4.162 pacientes con síndrome coronario agudo que fueron aleatorizados a una estrategia “intensiva” (atorvastatina 80 mg) versus una estrategia “estándar” (pravastatina 40 mg). El punto final primario a dos años compuesto por muerte, IAM, angina inestable, ACV o revascularización disminuyó significativamente 16% en la rama intensiva. El ensayo A-to-Z14 aleatorizó 4.497 sujetos con síndrome coronario agudo a simvastatina 40 mg en el primer mes y luego 80 mg versus placebo durante los primeros cuatro meses seguido de simvastatina 20 mg. Luego de dos años hubo una reducción no significativa del punto final primario de 11%, con una disminución significativa de 25% en la muerte cardiovascular en la rama intensiva. El estudio TNT15 incluyó 10.001 pacientes con enfermedad coronaria crónica que fueron asignados en forma aleatoria a atorvastatina 10 mg versus atorvastatina 80 mg. El punto final primario para un evento cardiovascular mayor fue menor en el grupo tratado con dosis altas de estatinas (8,7% vs 10,9%, RRR 22%; p < 0,001). Finalmente, el ensayo clínico IDEAL16 aleatorizó 8.888 sujetos con antecedente de IAM a una estrategia de simvastatina 20/40 mg versus atorvastatina 80 mg. Luego de 4,8 años de seguimiento promedio hubo una reducción no significativa del punto final combinado primario, con una disminución significativa de 13% en los eventos cardiovasculares mayores a favor de la rama que utilizó estatinas en dosis altas. Un metaanálisis, que incluyó estos cuatro últimos ensayos, mostró que el tratamiento intensivo en comparación al tratamiento convencional se asoció con una reducción significativa de 16% en el punto final muerte cardiovascular o IAM, con un descenso también significativo en la incidencia de IAM y de ACV17. Del mismo modo, otro metaanálisis demostró que en comparación con un régimen menos intensivo, el uso de estatinas de alta intensidad redujo significativamente 15% los eventos cardiovasculares mayores (IC 95% 11-18; p<0,0001)18.
Recientemente, un estudio japonés evaluó 13.054 pacientes con enfermedad coronaria crónica a recibir pitavastatina 4 mg/día versus pitavastatina 1 mg/día19. Luego de 3,9 años de seguimiento promedio, las dosis más altas de pitavastatina se asociaron con una reducción significativa del punto final primario (muerte cardiovascular, IAM, ACV o angina inestable que requiere hospitalización) en comparación a las dosis más bajas de dicho fármaco (4,3% vs 5,4%; HR 0,81; IC 95% 0,69-0,95 p=0,01).
¿Qué información tenemos en cuanto a la prevención del ACV? El impacto cardiovascular de las estatinas de alta intensidad fue evaluado en el estudio SPARCL20. Se aleatorizaron 4.731 pacientes con antecedentes de ACV o accidente isquémico transitorio (AIT) a recibir atorvastatina 80 mg/día o placebo durante aproximadamente cinco años. El grupo que recibió estatinas mostró una reducción de 16% del punto final primario (ACV fatal y no fatal) y también en la recurrencia de isquemia cerebral (ACV o AIT), o eventos coronarios.
¿Y en cuanto a la enfermedad arterial periférica? No contamos con ensayos clínicos randomizados específicamente desarrollados en este tipo de población. Un pequeño estudio no aleatorizado mostró que en pacientes con enfermedad arterial periférica sintomática que eran enviados para angiografía o revascularización, el uso de estatinas de alta intensidad en comparación con las estatinas de baja/moderada intensidad se asoció con menor mortalidad (HR 0,52; IC 95% 0,33-0,85; p=0,004) y una menor incidencia de eventos vasculares mayores (HR 0,58; IC 95% 0,37-0,92; p=0,02)21. La evidencia es robusta, reproducible y coherente. Ahora bien, ¿qué dicen las principales recomendaciones o guías de práctica clínica sobre la utilización de las estatinas de alta intensidad en prevención secundaria?
Como detallamos anteriormente, los ensayos clínicos que compararon estatinas contra placebo, o estatinas de alta intensidad versus de moderada/baja intensidad, no guiaron el tratamiento basándose en “metas” de colesterol plasmático. En esta línea, las recomendaciones 2013 del American College of Cardiology/American Heart Association (ACC/AHA) recomendaban indicar estatinas de alta intensidad sin buscar un objetivo de C-LDL22. De alguna manera, simplificaba la administración de estatinas y evitaba que muchos pacientes recibieran incorrectamente dosis moderadas o bajas de estatinas si su C-LDL alcanzaba el objetivo terapéutico.
Sin embargo, una asociación lineal entre los valores de C-LDL y el riesgo de enfermedad cardiovascular se observó sistemáticamente en múltiples estudios de aleatorización mendeliana, estudios epidemiológicos de cohorte y ensayos clínicos23. Asimismo, ciertos análisis secundarios de algunos ensayos clínicos y metaanálisis mostraron una relación directa entre los valores de C-LDL alcanzados y los eventos clínicos (cuanto más bajo, mejor), sin encontrar un valor mínimo de colesterol C-LDL por debajo del cual el descenso no traiga aparejado un descenso del riesgo24,25. Esto último se vuelve a demostrar en los últimos ensayos clínicos que agregaron otros fármacos (ezetimibe e inhibidores de la PCSK9) a pacientes en prevención secundaria medicados con estatinas que alcanzaron niveles extremadamente bajos de C-LDL26-29. Esto hizo que otras recomendaciones, por ejemplo las guías europeas para el manejo de las dislipemias, focalizaran en alcanzar una “meta” de C-LDL más que en el tipo/dosis de estatina a utilizar30. Sin embargo, a decir verdad, para alcanzar el objetivo planteado para pacientes en prevención secundaria (< 70 mg/dl o 50% de reducción de C-LDL) probablemente necesitemos utilizar en la gran mayoría de los casos estatinas de alta intensidad.
Establecer si el uso de estatinas de alta intensidad es más importante que alcanzar el objetivo de C-LDL no fue investigado por ensayos clínicos randomizados. Sin embargo, un estudio prospectivo no randomizado evaluó el impacto de diferentes estatinas (alta intensidad versus no alta) en un grupo de pacientes con antecedentes de angioplastia coronaria y que estando medicados con estatinas alcanzaban la meta de C-LDL < 70 mg/dl. La incidencia de eventos vasculares mayores (muerte cardiovascular, IAM, ACV), aun ajustando por un puntaje de propensión, fue significativamente más baja en los sujetos que recibieron estatinas de alta intensidad en comparación a los esquemas con menor potencia (HR 0,36; IC 95% 0,19-0,69, p<0,01)31.
Una actualización reciente de las guías ACC/AHA 201832 recomienda nuevamente que los pacientes en prevención secundaria de alto o muy alto riesgo deberían recibir estatinas de alta intensidad, buscando una reducción de 50% o más en el nivel de C-LDL (tabla 2).
Tabla 2: Recomendaciones sobre la indicación de estatinas de alta intensidad en prevención secundaria según las últimas guías ACC/AHA 2018(32).
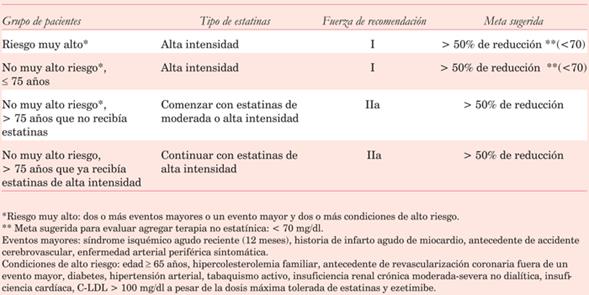
En nuestra región, un reciente documento de posición de la Sociedad Argentina de Cardiología (SAC) recomienda que todos los pacientes en prevención secundaria debieran recibir estatinas de alta intensidad33. La indicación debería realizarse tempranamente (en la internación) en los casos que cursan un evento agudo. El objetivo de C-LDL debería ser < 70 mg/dl o una reducción de 50%. Dicho documento refiere que sería razonable buscar un valor más bajo de C-LDL (< 55 mg/dl) en pacientes con riesgo extremo (enfermedad coronaria y diabetes, enfermedad coronaria e hipercolesterolemia familiar (HF), enfermedad coronaria progresiva a pesar del tratamiento, o enfermedad coronaria cuando existen antecedentes familiares de enfermedad cardiovascular temprana).
Uso adecuado de las estatinas de alta intensidad en prevención primaria
Incluimos en este grupo a los pacientes sin antecedentes de enfermedad coronaria, ACV isquémico o enfermedad vascular periférica clínica. Aunque con un riesgo cardiovascular mayor, se incluyen también los pacientes diabéticos o renales crónicos sin antecedentes vasculares.
Varios ensayos evaluaron el impacto de las estatinas en sujetos sin antecedentes cardiovasculares previos, aunque la gran mayoría de ellos analizaron estatinas de moderada intensidad34-39. El único trabajo que evaluó el uso de estatinas de alta intensidad en prevención primaria fue el estudio JUPITER40. Este comparó el efecto de rosuvastatina 20 mg versus placebo en 17.802 pacientes con C-LDL considerado “normal” (< 130 mg/dl) y proteína C reactiva (PCR) >2 mg/l. El estudio se suspendió tras un seguimiento medio de 1,9 años al detectarse una reducción significativa del punto final primario (muerte cardiovascular, IAM, ACV, revascularización y hospitalización por angina inestable) de 44%, una reducción de 54% en la ocurrencia de IAM, y una reducción de 20% en la mortalidad.
¿Cuáles son las recomendaciones de estatinas de alta intensidad según las diferentes guías de práctica clínica en prevención primaria? En principio, la población estratificada como de alto riesgo por puntaje de riesgo debería recibir estatinas de alta intensidad o, dicho de otra forma, esquemas de estatinas que logren reducir un 50% el C-LDL. Lo mismo ocurre con los sujetos con dislipemias severas, o bien porque tienen diagnóstico de HF o porque tienen un nivel de C-LDL > 190 mg/dl. No contamos con ensayos clínicos que hayan evaluado el impacto de las estatinas de alta intensidad específicamente en pacientes en prevención primaria con un puntaje de riesgo > 20% o con un C-LDL > 190 mg/dl. Sin embargo, un reciente subanálisis del estudio WOSCOPS41 demostró que en los pacientes en prevención primaria con un C-LDL basal >190 mg/dl, la administración de pravastatina en comparación con placebo redujo el riesgo de eventos cardiovasculares mayores en 25% (p = 0,037) durante el seguimiento del ensayo original y disminuyó el riesgo de muerte cardiovascular y muerte de cualquier causa en 25% (p = 0,009) y 18% (p = 0,004), respectivamente, en el seguimiento observacional posterior al estudio a 20 años.
Dependiendo de la guía analizada, algunos pacientes con diabetes, insuficiencia renal crónica o ateromatosis subclínica también serían candidatos a recibir estatinas de alta potencia30,32,33,42.
No contamos a la fecha con ensayos clínicos que hayan evaluado estatinas de alta intensidad solo en una población de pacientes diabéticos sin antecedentes vasculares. Sin embargo, el estudio CARDS43 demostró que la administración de atorvastatina 10 mg/día en pacientes diabéticos sin antecedentes de enfermedad cardiovascular redujo significativamente los eventos cardiovasculares mayores. Asimismo, un metaanálisis que incluyó solo pacientes con diabetes (14 ensayos clínicos aleatorizados, 18.686 pacientes) demostró que la terapia con estatinas redujo 9% la mortalidad de cualquier causa y 21% los eventos cardiovasculares mayores44.
Desafortunadamente, los pacientes con insuficiencia renal fueron generalmente excluidos de los ensayos clínicos. Como consecuencia, el impacto de las estatinas en esta población surge de análisis post hoc, y en la mayoría de estudios con estatinas de moderada intensidad. El estudio SHARP45 mostró una reducción de los eventos cardiovasculares de 17% (RR 0,83; IC 95% 0,74-0,94; p = 0,0021) con la combinación de simvastatina y ezetimibe en comparación con placebo, en una población de pacientes con insuficiencia renal crónica sin antecedentes de enfermedad coronaria. Asimismo, una reciente revisión sistemática mostró que las estatinas disminuyeron la muerte y los eventos cardiovasculares mayores un 20% en pacientes con insuficiencia renal sin hemodiálisis46. Sin embargo, dos ensayos clínicos no pudieron demostrar beneficio en los pacientes en hemodiálisis47,48.
Múltiples estudios epidemiológicos demostraron que la presencia de ateromatosis subclínica se asoció con un alto o muy alto riesgo cardiovascular49,50. No contamos con grandes estudios clínicos específicamente diseñados para evaluar el impacto de las estatinas en este tipo de pacientes. En un estudio aleatorizado de menores dimensiones, Arad y colaboradores evaluaron el efecto de administrar atorvastatina 20 mg más vitaminas C y E versus placebo en una población en prevención primaria (n=1.005) con un puntaje (score) de calcio elevado (> percentil 80)51. Luego de 4,3 años de seguimiento promedio, el grupo tratado con estatinas mostró una tendencia estadísticamente no significativa a tener menos eventos cardiovasculares (6,9% vs 9,9%, p = 0,08). En el subgrupo de pacientes con un score de calcio más elevado (>400 UA), la administración de atorvastatina se asoció con una reducción significativa de los eventos cardiovasculares de 42% (8,7% vs 15%, p=0,04). Recientemente, un estudio de cohorte (13.644 pacientes), seguidos por 9,4 años, demostró que las estatinas solo tenían impacto beneficioso en los sujetos que basalmente presentaban un score de calcio distinto a cero52.
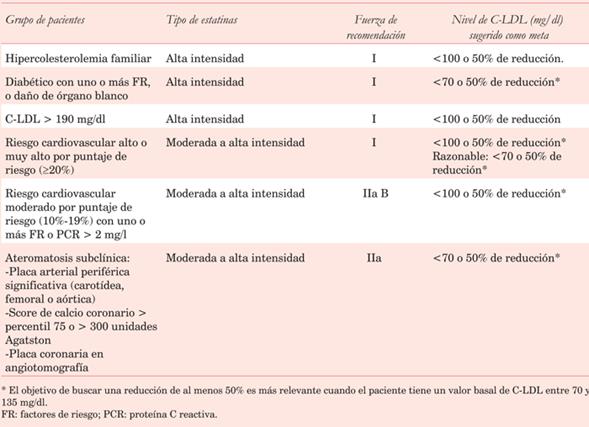
Las recomendaciones sobre la indicación de estatinas en prevención primaria, según las últimas guías ACC/AHA 201832 y el documento de posición de la SAC 201833, pueden observarse en la (tabla 3) y (tabla 4), respectivamente.
Tabla 3: Indicación de estatinas de alta intensidad en prevención primaria según las guías ACC/AHA 2018(32).
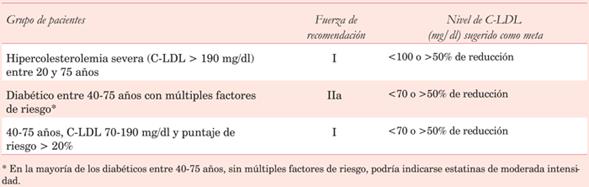
Tabla 4: Recomendaciones sobre la indicación de estatinas de alta intensidad en prevención primaria según la Sociedad Argentina de Cardiología33.
De la evidencia a la práctica: no hacemos lo que sabemos que hay que hacer
La utilización de estatinas en prevención cardiovascular ha aumentado considerablemente en los últimos años, entre otras cosas, por la abrumadora evidencia proveniente de los ensayos clínicos y por las claras indicaciones de las guías de práctica clínica confeccionadas por diferentes sociedades científicas. ¿Qué sucede con las estatinas de alta intensidad? Probablemente el preconcepto de potenciales efectos adversos con dosis más altas de estatinas, por parte de médicos y pacientes, sea una barrera para la correcta indicación de estos fármacos. Rosenson y colaboradores53 mostraron que en Estados Unidos la tendencia a prescribir estatinas de alta intensidad en pacientes que habían tenido un IAM aumentó considerablemente en dos sistemas de salud entre los años 2011 y 2014 (luego de publicadas las guías 2013 ACC/AHA). Dicha prescripción aumentó de 33% a 71,7% y de 24,8% a 57,5% en los sistemas de cobertura Market Scan y Medicare, respectivamente53. A pesar de que ninguna recomendación plantea usar diferentes estrategias hipolipemiantes entre hombres y mujeres, la realidad señala que la indicación de estatinas de alta intensidad es menor en el sexo femenino54.
Varios registros realizados en los últimos años sugieren que el tratamiento hipolipemiante y en consecuencia el cumplimiento de las metas lipídicas recomendadas es deficiente55-57. Recientemente, el estudio PURE58 demostró que el control de los factores de riesgo, incluyendo la dislipemia, es peor en los países pobres o de bajos ingresos. Asimismo, la encuesta EUROASPIRE V59, que analizó 8.261 pacientes con antecedentes vasculares (prevención secundaria) a los seis meses de tener el evento, demostró que si bien el 80% estaba medicado con estatinas, solo el 50% de ellos recibía las de alta intensidad. En ese contexto, el 71% de los sujetos tenía un C-LDL fuera de meta (>70 mg/dl).
En nuestra región, un estudio recientemente publicado analizó el tratamiento hipolipemiante a los 12 meses de haber tenido un síndrome isquémico agudo o revascularización coronaria. Solo el 48,4% recibió estatinas de elevada intensidad y el 54,7% no logró la meta de C-LDL <70 mg/dl60).
En prevención primaria sucede algo similar. Por ejemplo, Rodríguez y colaboradores61 demostraron que en un gran número de pacientes con un C-LDL > 190 mg/dl sin antecedentes cardiovasculares o diabetes, solo el 9,4% recibía estatinas de alta intensidad. Asimismo, en un registro español de pacientes con diagnóstico genético de HF, casi un tercio de la población no recibía el tratamiento hipolipemiante máximo62.
Conclusión
La evidencia que respalda el uso de estatinas de alta intensidad es contundente. Los grupos de pacientes que más se favorecen con su indicación son los sujetos en prevención secundaria, los pacientes con diabetes de mayor riesgo y los sujetos en prevención primaria de alto riesgo cardiovascular. En la práctica, a pesar de las recomendaciones claras de las diferentes guías, su uso es deficiente. Consecuentemente, los profesionales que atendemos este tipo de pacientes tenemos una enorme oportunidad de optimizar el tratamiento hipolipemiante y así disminuir el riesgo cardiovascular de nuestra población.