Sra. Editora:
Introducción
La rivastigmina es un fármaco perteneciente al grupo de los anticolinesterásicos. Posee una estructura fenil-carbamato y es un inhibidor pseudoirreversible de las enzimas acetilcolinesterasa y butirilcolinesterasa a nivel del sistema nervioso central (SNC)1. La enfermedad de Alzheimer y la enfermedad de Parkinson son patologías neurodegenerativas cada vez más frecuentes debido al aumento en la expectativa de vida y son causa de demencia en el adulto mayor. Estas patologías se asocian a la pérdida de neuronas colinérgicas en regiones del encéfalo relacionadas con aspectos de la memoria, existiendo una relación directa entre la disminución de la actividad colinérgica y el deterioro cognitivo2. Diversos estudios muestran que los países en vías de desarrollo actualmente tienen una frecuencia más elevada de demencias comparados con los países desarrollados2,3. América Latina ocupa el segundo lugar y Uruguay es el país más envejecido del con tinente2.
La rivastigmina retrasa la degradación de la acetilcolina liberada y mejora la neurotransmisión colinérgica; es por esto que se indica en enfermedad de Alzheimer, Parkinson y en el deterioro cognitivo leve (DCL)3. En los últimos años, en nuestro país, los parches de rivastigmina (PTR) están siendo indicados con más frecuencia en pacientes adultos mayores2.
Durante el tratamiento con rivastigmina por vía oral se describen efectos adversos gastrointestinales frecuentes; la absorción cutánea a través de los PTR disminuye la frecuencia de estos efectos, lo que justifica su uso3,4. Estos proporcionan concentraciones plasmáticas menores que se mantienen durante 24 horas, lo que se vincula con mayor tolerabilidad dada la disminución de efectos adversos gastrointestinales, permitiendo a los pacientes recibir una dosis terapéutica más elevada3. Sin embargo, el tratamiento debe iniciarse con la menor dosis posible (5 cm2 equivalentes a 4,6 mg cada 24 horas), para luego ir titulando la dosis según tolerancia, evitando la aparición de síntomas de intoxicación2,3. El aumento de la acetilcolina en la hendidura sináptica es responsable de la aparición de síntomas muscarínicos y nicotínicos en la intoxicación por rivastigmina, que se asemejan a los de la intoxicación por plaguicidas organofosforados y carbamatos5-7. Los más frecuentemente reportados incluyen: náuseas, vómitos, mareos, astenia, diarrea, dolor abdominal, pérdida del apetito, pérdida de peso, insomnio, síncope y bradicardia, siendo infrecuentes los de ori gen cardíaco5,6.
Existen pocos reportes de toxicidad cardiovascular por rivastigmina. Los casos graves se asocian a síncope, bradicardia y bloqueos auriculoventriculares (BAV)4-7. En estos se describe la necesidad de utilizar marcapasos (MP) externo o definitivo, o ambos6,7. Un estudio reciente sobre adultos mayores tratados con anticolinesterásicos concluye que estos aumentan el riesgo de síncope, bradicardia y fracturas por caídas6. El Centro de Información y Asesoramiento Toxicológico (CIAT) de Uruguay ha registrado casos de intoxicación por el uso de PTR con más frecuencia en el último año.
Se presentan dos casos clínicos de intoxicación aguda por PTR con toxicidad cardiovascular grave reportados al CIAT en el año 2017.
Casos clínicos
Se seleccionaron dos casos clínicos recibidos en el CIAT y asistidos en la Asociación Médica de San José en el período descrito.
Caso 1
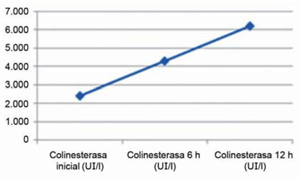
Paciente de 73 años, sexo femenino, DCL, tratada con PTR de 15 mg. Refiere aumento de la dosis en la última semana, cuando comienza con astenia, mareos, dolor abdominal y diarrea. Al ingreso: síncope. Electrocardiograma (ECG): ritmo sinusal de 75 cpm, intervalo QT corregido 452 ms, BAV de primer grado. En la evolución presenta dos nuevos episodios sincopales, alternando bradicardia sinusal de 30 cpm y BAV de segundo grado tipo 2:1 (figura 1). Se realiza masaje cardíaco externo (MCE), retomando ritmo sinusal de 70 cpm. Ingresa a unidad de cuidados intensivos presentando dos nuevos episodios de síncope y bradicardia extrema. Desde el CIAT, se hace diagnóstico de intoxicación aguda grave por anticolinesterásico. Se retira de región escapular un PTR de 15 mg y se administra 1 mg de atropina intravenosa. Dosificación de colinesterasa plasmática al ingreso descendida: 2.420 UI/l (rango normal = 5.320 a 12.920 UI/l). Recupera valores normales a las 12 horas (figura 2). Alta, con buena evolución a las 24 horas.
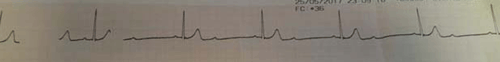
Figura 1: Bradicardia extrema de 30 cpm aproximadamente en contexto de bloqueo auriculoventricular 2:1.
Caso 2
Paciente de 78 años, sexo femenino, DCL, tres meses de tratamiento con PTR de 15 mg. Al ingreso: vómitos y diarrea de semanas de evolución, acentuándose en las últimas 24 horas, sudorosa, tendencia al sueño. Presión arterial: 140/80 mmHg, frecuencia cardíaca: 70 cpm. Estertores crepitantes en bases pulmonares, saturación de oxígeno: 89%. Durante la realización de ECG, presenta paro cardiorrespiratorio en asistolia de 30 segundos de duración, retoma circulación espontánea posterior a MCE, agregando vómitos. Presenta inestabilidad eléctrica, taquiarritmias y bradiarritmias alternando con ritmo sinusal (bradicardia sinusal, taquicardia sinusal, y fibrilación auricular) (figura 3) y síncopes reiterados. Se coloca MP externo y luego de valoración por cardiólogo y electrofisiólogo se implanta MP definitivo. Se retira PTR, pero dada la buena evolución se otorga alta con PTR de 5 mg. Posteriormente consulta en el CIAT, comprobándose colinesterasa plasmática de 1.640 UI/l. Se indica suspensión de PTR. De la consulta con cardiólogo se destaca que la paciente presentó en todo momento ritmo propio, no habiéndose registrado actividad del MP.
Discusión
En los casos clínicos descritos la sintomatología presentada desde el inicio del tratamiento con PTR fue fundamentalmente muscarínica (síntomas digestivos); sin embargo, lo que motivó la consulta fueron síntomas poco frecuentes y graves en la intoxicación por anticolinesterásicos, como síncope y BAV. En ambos casos la gravedad de la toxicidad cardíaca derivó en implante de MP (transitorio en el caso 1 y definitivo en el caso 2). La colinesterasa plasmática se mostró descendida en los dos casos, si bien en el primero fue posible la determinación durante el episodio agudo, en el segundo caso se realizó de forma tardía.
El diagnóstico de intoxicación por PTR se sospecha clínicamente y se confirma con el descenso de la enzima acetilcolinesterasa, que es el mejor biomarcador de efecto de un anticolinesterásico8,9. Pacientes en tratamiento con PTR que comienzan con síntomas muscarínicos de la esfera digestiva, o síntomas cardiovasculares como los descritos, deben hacer plantear precozmente el diagnóstico de intoxicación como en los casos presentados. En la intoxicación por rivastigmina con manifestaciones de toxicidad cardíaca grave, la falta de diagnóstico precoz y tratamiento antidótico específico, como es la atropina, pueden conducir a implante de MP6,10,11, como sucedió en el caso 2.
Si bien la rivastigmina posee mayor efecto a nivel del SNC, la presencia de tono vagal aumentado en los pacientes con Alzeihemer puede explicar la mayor frecuencia de síntomas cardiovasculares en esta población6,7. Se reportan con frecuencia situaciones de bradicardia, hipertensión o hipotensión, síncope y BAV durante el tratamiento con rivastigmina6,11.
La inhibición de las colinesterasas por la rivastigmina se da en forma reversible durante cuatro a seis horas, por esa razón su efecto es de corta duración5. Un reporte reciente observó la relación inversa entre la disminución de la concentración de rivastigmina y el aumento de la actividad de la butirilcolinesterasa durante el uso de PTR8. Asimismo, este estudio describe datos farmacocinéticos de los PTR; se evidenció que la inhibición de la enzima persistió durante 10 horas luego de retirar los parches, lo que sugiere que restos de rivastigmina pueden permanecer en la piel a modo de reservorio8. Por lo tanto, en la intoxicación por rivastigmina las colinesterasas pueden disminuir en las primeras 12 horas, pero su recuperación es rápida, como se observó en el caso 1, con valores de colinesterasa normales en 12 horas5,6. En los casos reportados de intoxicación por el uso de PTR, la resolución completa del cuadro ocurre en 24 horas, lo que coincide con el primer caso clínico presentado. La atropina es el antídoto específico al actuar de forma competitiva con la acetilcolina. Debe ser administrada frente a la presencia de síntomas muscarínicos6.
Conclusiones
Si bien existen pocos casos reportados de toxicidad cardiovascular por PTR con datos de colinesterasa plasmática, la experiencia del CIAT en intoxicaciones por otros anticolinesterásicos (por ejemplo, plaguicidas organofosforados y carbamatos) permite predecir que el descenso de ésta podría utilizarse como biomarcador precoz de intoxicación y ser útil en el seguimiento del tratamiento con PTR.
Con el fin de evitar la intoxicación es importante iniciar el tratamiento con dosis bajas y aumentar progresivamente titulando la dosis. La aparición de efectos adversos que no mejoran con el descenso de la dosis es un criterio de discontinuación del tratamiento.
Teniendo en cuenta el aumento de la expectativa de vida y la alta prevalencia mundial de enfermedades demenciales, es imprescindible que los pacientes en tratamiento con rivastigmina tengan un seguimiento periódico que permita evaluar la aparición de efectos adversos y signos precoces de intoxicación. Mediante el análisis de los casos descritos se aporta evidencia para el diagnóstico oportuno, tratamiento precoz y prevención de esta intoxicación mediante el seguimiento con biomarcadores como la acetilcolinesterasa.