Introducción
Los avances tecnológicos en ecocardiografía durante los últimos 30 años han aumentado la precisión en la evaluación anatómica y funcional de las cavidades cardíacas derechas, así como en la estimación de la presión arterial pulmonar (PAP) y en la evaluación hemodinámica pulmonar. El ecocardiograma es actualmente reconocido como un excelente método en la evaluación diagnóstica, pronóstica y evolutiva de la hipertensión pulmonar (HTP)1. La HTP crónica es una condición patológica definida como un valor sostenido de PAP media (PAPm) >25 mmHg en reposo, diagnosticada mediante cateterismo de cavidades derechas2. La PAPm normal es 14±3 mmHg, con un límite máximo normal de 20 mmHg. El significado clínico de la PAPm entre 21 mmHg y 24 mmHg es incierto; los pacientes en este rango deben tener un seguimiento clínico estrecho2. El rango fisiológico de PAP sistólica (PAPs) es dependiente de la edad y del área de superficie corporal, llegando hasta 40 mmHg en mayores de 50 años y en obesos (índice de masa corporal (IMC) >30 kg/m2)3. Este aumento en los valores de PAP es más común en diabéticos y probablemente se deba a menor complacencia arterial pulmonar o presiones de llenado del ventrículo izquierdo (VI) anormales4.
En el 6º Simposio Mundial de HTP5 se ha actualizado la clasificación clínica (tabla 1), agrupando los procesos y las enfermedades que la originan en cinco grupos que se diferencian por sus mecanismos fisiopatológicos, presentación clínica y opciones terapéuticas.
En la (tabla 2) se reúnen los diferentes tipos hemodinámicos junto a la correspondiente definición clínica. La enfermedad HTP inducida por ejercicio, no ha sido definida2. Las últimas guías recomiendan no utilizar este término debido a la falta de evidencia que demuestre a partir de qué valor de PAPm durante el ejercicio sobrevienen implicancias pronósticas6.
La ecocardiografía tiene un rol fundamental tanto en el screening e identificación de la HTP, como en la detección de patologías que la determinan (patología valvular o disfunción diastólica y sistólica izquierdas, cardiopatías congénitas, etcétera). En adición a la evaluación diagnóstica, la ecocardiografía aporta información anatómica y funcional de las cavidades derechas y del lecho pulmonar, y es fundamental en la estimación pronóstica. Es también un método alternativo en la evaluación de la progresión y de la respuesta al tratamiento en el seguimiento7.
Analizaremos la evidencia que sustenta la utilidad de la ecocardiografía en la evaluación de estos pacientes y los métodos ecocardiográficos para la estimación de la PAP. Si bien el estudio de referencia para el diagnóstico de HTP es el cateterismo derecho, se trata de un método invasivo no exento de riesgos y el ecocardiograma constituye una excelente alternativa.
Anatomía y fisiología del ventrículo derecho
El ventrículo derecho (VD) y el VI difieren tanto anatómica como funcionalmente. El VD presenta cambios acentuados durante el desarrollo, en especial después del nacimiento. La fisiología cardiovascular fetal presenta una circulación pulmonar de alta resistencia y una circulación sistémica de baja resistencia. A través del foramen oval y del ductus arterioso el flujo se dirige de derecha a izquierda de tal manera que las presiones aórtica y pulmonar se mantienen similares. Tanto el VD como la pared libre del VI tienen un grosor y una fuerza semejantes durante la vida fetal, con un septum interventricular rectificado8. Luego del nacimiento, la hipertrofia del VD disminuye y el corazón se remodela de acuerdo a su configuración característica: el VI de sección elíptica y el VD semilunar. Si bien antes del nacimiento la pared del VD y del VI tienen el mismo grosor, en adultos la pared del VD tiene normalmente un grosor <5mm, a diferencia del VI cuyo grosor es <10-11 mm8. La masa del VD corresponde a un sexto de la masa del VI9.
El VD puede manejar grandes volúmenes pero bajas resistencias; la resistencia de la circulación derecha es una décima parte de la circulación sistémica, de ahí que requiere un gradiente de perfusión de solo 5 mmHg para impulsar la sangre a través de la circulación pulmonar. Este requerimiento hemodinámico relativamente bajo permite que el VD, de paredes delgadas, bombee el mismo volumen que el VI de paredes más gruesas10.
El VD (a diferencia del VI) tiene tres porciones bien diferenciadas; un tracto de entrada, una porción trabeculada y un tracto de salida. La perfusión coronaria del VD también es diferente, normalmente el VI se perfunde en diástole, mientras que el VD se perfunde tanto en sístole como en diástole11.
La contracción ventricular izquierda depende del movimiento de torsión, rotación y acercamiento concéntrico de sus paredes, en cambio, la del VD está dada principalmente por el acortamiento de sus fibras longitudinales y por la tracción de su pared libre con disminución del área de superficie12; es una contracción secuencial que comienza en la porción trabeculada y culmina con la contracción del infundíbulo 25-50 ms después13. Estas peculiares características anatómicas y fisiológicas, junto con la posición retroesternal del VD, hacen que su valoración ecocardiográfica sea compleja7.
Destacamos que el principal predictor pronóstico en pacientes con HTP crónica es la disfunción sistólica del VD, y que ésta se asocia a peor pronóstico también en otras condiciones clínicas como insuficiencia cardíaca izquierda, infarto agudo de miocardio (con o sin compromiso del VD), tromboembolia pulmonar y cardiopatías congénitas14,15.
Evaluación ecocardiográfica
El informe ecocardiográfico debe sugerir la probabilidad de HTP en función de los elementos que permiten estimar la presión sistólica, diastólica o media en la arteria pulmonar más la presencia de elementos indirectos de HTP6.
Analizaremos los siguientes puntos:
A) Estimación de la presión en cavidades derechas
B) Estimación de la PAP sistólica
C) Estimación de la PAP diastólica
D) Estimación de la PAP media
E) Elementos indirectos de HTP
F) Clasificación del tipo de hipertensión pulmonar
A) Estimación de la presión en cavidades derechas
Presión auricular derecha
La presión auricular derecha (PAD) puede aumentar en diversas situaciones, entre otras, por HTP. Los elementos sugestivos de PAD elevada deben despertar la sospecha de HTP. Realizar el cálculo de la PAD de la manera más precisa es fundamental, ya que es clave en la estimación de la PAP.
Vena cava inferior: para la estimación de la PAD mediante ecocardiografía, el método más utilizado es la medición del diámetro de la vena cava inferior (VCI) y su colapso inspiratorio desde la ventana subcostal. La medición se realiza en decúbito dorsal, a 2 cm de la aurícula derecha (AD), en teleespiración en diástole y a continuación tras la inspiración profunda16). Para calcular el colapso de la VCI se utiliza el índice de colapsabilidad medido como: diámetro máximo de VCI - diámetro mínimo de VCI / diámetro máximo de VCI teniendo en cuenta las variaciones del tamaño de la VCI durante el ciclo respiratorio. La posición supina es importante dado que el tamaño de la VCI se ve afectado por la posición, siendo inferior en decúbito lateral izquierdo17. Si el diámetro es <2,1 cm con colapso inspiratorio >50%, se estima una PAD normal de 3 mmHg; si el diámetro es >2,1 cm y el colapso < 50% se estima una PAD de 15 mmHg. Cuando estos valores son discordantes, se sugiere usar otros índices (que se detallarán más adelante) o como segunda opción usar un valor intermedio de 8 mmHg(18). Si el colapso de la VCI es mínimo (<35%) u otros índices de PAD elevada están presentes, se recomienda estimar la PAD en 20 mmHg17.
Si bien algunos estudios sugieren que el índice de colapso de la VCI no predice con exactitud el valor numérico de la PAD19, la mayoría de los estudios demostraron buena correlación entre el índice de colapso de la VCI y un rango de PAD. Existen condiciones en las que puede haber dilatación de la VCI en ausencia de PAD elevada, como válvula de Eustaquio prominente, deportistas, área de superficie corporal elevada, ventilación mecánica, estrechez de la unión VCI-AD, tejido o red presente en la VCI17.
Índices alternativos para estimación de la presión auricular derecha
Cociente E/e’: otra medida para estimar la PAD que puede ser utilizada en casos ambiguos es el cociente E/e’ tricuspídeo. Mediante Doppler pulsado que registre la velocidad protodiastólica de llenado a nivel de la válvula tricúspide (E) y Doppler tisular que registre la velocidad de relajación del tejido a nivel de la pared lateral del anillo tricuspídeo en protodiástole (e’), se puede registrar el cociente E/e’. Un cociente E/e’ > 6 demostró asociarse a una PAD elevada: > 10 mmHg20. Esta medida es aplicable incluso en pacientes ventilados y puede ser una alternativa para los que presentan ventana subcostal subóptima. Es posible estimar la PAD utilizando la siguiente fórmula: PAD = 1,62 E/e’ + 2,13, descripta por primera vez por Sade y colaboradores21.
Patrón de flujo de las venas hepáticas: el flujograma normal de las venas hepáticas evaluadas mediante Doppler pulsado se caracteriza por tres ondas diferentes: una onda sistólica anterógrada (S), causada por la relajación de la AD y el descenso del anillo tricuspídeo durante la sístole del VD; una onda diastólica anterógrada (D), que ocurre durante el llenado ventricular rápido mientras la válvula tricuspídea está abierta; y una onda de flujo reverso (A) durante la sístole auricular.
Normalmente, el flujo sistólico es el predominante, con un cociente S/D > 1. Al aumentar la PAD, hay menor gradiente de presión entre las venas y la AD, con menor velocidad de flujo anterógrado sistólico, se pierde la predominancia sistólica del flujo y el cociente S/D <1. Este patrón se encontró en pacientes con PAD elevada (>8 mmHg), y también en casos de miocardiopatía restrictiva y de presiones de llenado del lado derecho elevadas17.
Las venas hepáticas derecha e izquierda se visualizan mediante la ventana subcostal. Al igual que la VCI, las venas se dilatan y pierden su colapso inspiratorio con el aumento de la PAD. El uso de estas venas puede ser una alternativa a la VCI. Deben recordarse factores que alteran su flujo independientemente de la PAD, como compliance y relajación auricular, insuficiencia tricuspídea (IT) severa, descenso del anillo tricuspídeo, presencia de fibrilación auricular, ventilación mecánica y antecedente de cirugía cardíaca17.
Tiempo de relajación isovolumétrica del VD: el tiempo de relajación isovolumétrica del ventrículo derecho (TRIVD), medido por Doppler tisular en el anillo lateral tricuspídeo, es el período entre el final del movimiento anular sistólico (onda S) y el inicio del movimiento anular diastólico temprano (onda e’). El TRIVD tiene una relación inversa con la PAD; en presencia de PAD aumentada, el cierre valvular tricuspídeo ocurre antes, de tal manera que el TRIVD se ve acortado22. Un TRIVD < 59 ms predice una PAD > 8 mmHg, con una sensibilidad de 80% y una especificidad de 88%17.
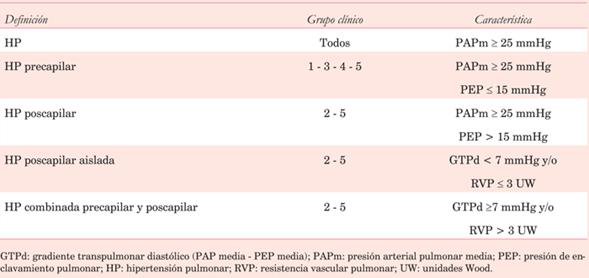
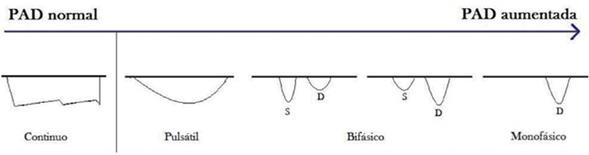
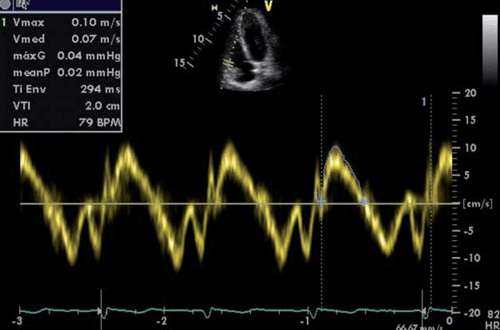
Flujo renal: se está investigando la evaluación de la PAD por Doppler del flujo renal en la insuficiencia cardíaca. Tang y colaboradores demostraron que la congestión venosa, con presiones derechas elevadas, altera el patrón de flujo venoso renal (normalmente continuo), haciéndolo pulsátil (discontinuo)23. El aumento de la PAD puede, entonces, manifestarse como un patrón bifásico durante cada ciclo cardíaco o por una disminución de la velocidad sistólica que evoluciona a un patrón monofásico diastólico, como se observa en la (figura 1)23. Los distintos patrones de flujo venoso renal se asocian pues con distintos niveles de PAD24.
Tamaño de la aurícula derecha: el aumento de la PAD lleva a dilatación de la AD. En un estudio de Patel y colaboradores se encontró que combinar la dilatación de la AD (definida por un volumen mediante eco 3D ?35 ml/m2) con el método de la variabilidad de la VCI, resultaba en un aumento de la sensibilidad para la detección de una PAD >10 mmHg25. Otro indicador indirecto de PAD elevada es el abombamiento del septum interatrial hacia la aurícula izquierda.
B) Estimación de la presión arterial pulmonar sistólica
La PSVD se puede determinar gracias a la suma del gradiente de presión sistólica entre VD-AD y la PAD; en ausencia de obstrucción en el tracto de salida del ventrículo derecho (TSVD) o en la válvula pulmonar y de defectos del tabique interventricular, la PSVD es equivalente a la PAPs26.
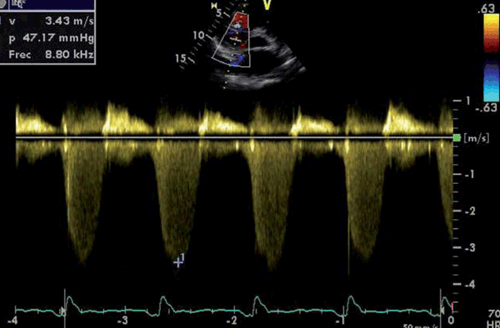
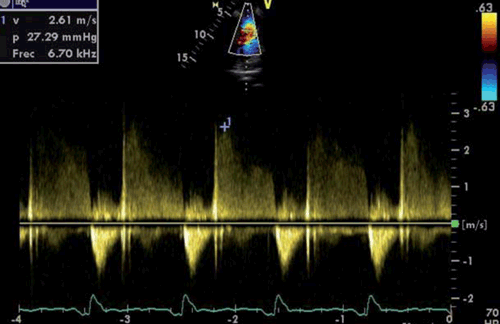
El gradiente de presión (delta P) VD-AD en sístole se estima gracias a la velocidad máxima del chorro de regurgitación tricuspídea (ITv-max), mediante la ecuación simplificada de Bernoulli (delta P=4 x (ITv-max)2)26. El método consiste en identificar mediante Doppler color el chorro de IT (en el paraesternal eje largo enfocado a VD, paraesternal eje corto, apical 4 cámaras o subcostal) y posteriormente usar el Doppler continuo para identificar la velocidad máxima de la IT27) (figura 2). La ITv-máx > 2,8 m/s indica presiones pulmonares por encima de la normalidad, con la excepción de ancianos y grandes obesos, en los cuales la PAPs tiende a ser más alta.
Ya en el año 1985, Currie y colaboradores demostraron que existe una buena correlación entre el gradiente transtricuspídeo y la PSVD determinada por cateterización cardíaca derecha28. En aquellos casos donde existe estenosis de la válvula pulmonar o del TSVD, este método sobreestima la PAPs, y el gradiente de presión máximo a través de la válvula o del TSVD debería restarse a la medida de la PAPs27.
En pacientes con IT muy severa, la curva con Doppler continuo puede estar cortada por una rápida igualación de las presiones VD-AD, por lo cual la PAPs podría subestimarse. Asimismo, la medición de las presiones puede ser inexacta en presencia de disfunción sistólica del VD27.
La ITv-máx debería medirse en múltiples ventanas, con la angulación correcta del transductor para obtener un ángulo de intersección entre el chorro y el haz de ultrasonido paralelo, buscando su máximo valor para evitar una subestimación de la PAPs29. La mejor señal de la IT se obtiene en una imagen intermedia entre las ventanas paraesternal y apical, o en un 4 cámaras enfocado al VD. Si no se obtiene una buena señal de IT, se puede considerar inyección de suero salino agitado27.
C) Estimación de la presión arterial pulmonar diastólica
La presencia de insuficiencia pulmonar (IP) mínima o leve es un hallazgo habitual en personas sanas. Es más frecuente en hombres, en blancos, y en jóvenes30,31. Grados mayores de IP pueden estar presentes en una variedad de condiciones patológicas y producir sobrecarga de volumen de las cavidades derechas.
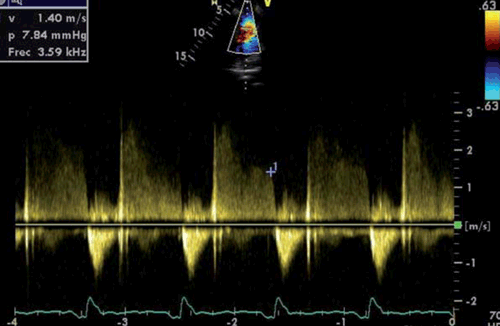
Desde la vista paraesternal eje corto podemos alinearnos con el chorro de regurgitación gracias a la señal Doppler color y registrar la señal Doppler continuo para obtener el trazo de la IP. Utilizando la ecuación de Bernoulli simplificada podemos estimar el gradiente de presión telediastólica entre la AP y el VD (figura 3).
En 1986, Tohru Masuyama describió la relación lineal existente entre el gradiente telediastólico medido de esta manera y el gradiente diastólico entre la AP y el VD medido por cateterismo32.
Para estimar la presión arterial pulmonar diastólica (PAPd) es necesario sumar el gradiente diastólico AP-VD y el valor de la presión diastólica final del VD (PDFVD) que, en ausencia de estenosis tricuspídea, se corresponde con la PAD, cuya estimación fue descripta previamente32. En presencia de IP severa, este método subestima la PAPd debido a que la pendiente de desaceleración es muy pronunciada y el flujo regurgitante en telediástole es próximo a cero32. Tampoco es un método válido en presencia de fisiología constrictiva o restrictiva, debido a que la elevada PDFVD determina una subestimación de la PAPd33.
D) Estimación de la presión arterial pulmonar media
Se pueden utilizar diversos métodos, tanto mediante el análisis del espectro Doppler del flujo regurgitante pulmonar, el tiempo de aceleración pulmonar en el TSVD o mediante la medición del gradiente medio de presión del flujo regurgitante tricuspídeo18. Se recomienda, cuando sea posible, realizar el cálculo de la PAPm mediante varios métodos, ya que la concordancia interna aumenta la precisión diagnóstica.
Análisis del flujo regurgitante pulmonar
El gradiente pico entre la AP y el VD (calculado mediante la ecuación de Bernoulli simplificada a partir de la velocidad máxima de la IP) permite estimar el gradiente medio entre la AP y el VD (figura 4). Para estimar la PAPm es necesario sumarle a este valor la presión estimada en el VD en diástole (comparable a la PAD). Este método ha sido validado ante las presiones registradas mediante cateterismo derecho22,32).
Tiempo de aceleración en el tracto de salida del ventrículo derecho
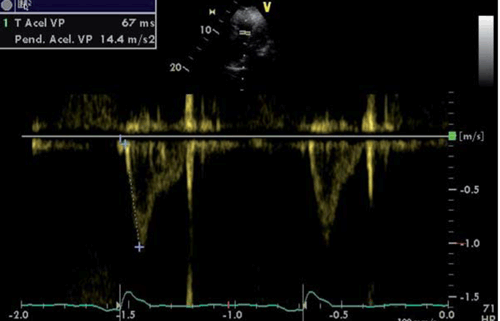
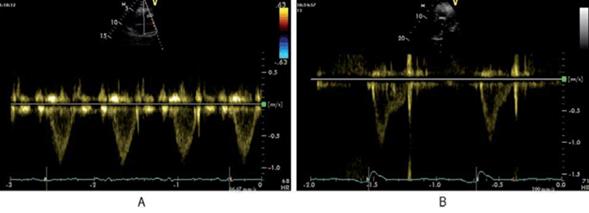
El registro con Doppler pulsado en el TSVD tiene normalmente un ascenso progresivo en forma de domo (figura 7A), pero en condiciones de poscarga aumentada, presenta una aceleración rápida, con un tiempo hasta la máxima velocidad acortado (figura 7B)34.
Es importante obtener un registro Doppler de buena calidad, con alta velocidad de barrido para aumentar la precisión en la medida del tiempo de aceleración (TA). El tiempo es medido desde el inicio de la onda Q en el registro del electrocardiograma (ECG) o desde el inicio del flujo hasta la máxima velocidad de flujo anterógrado (figura 5) a una frecuencia cardíaca entre 60 y 100 cpm. Un valor > 120 ms es normal, mientras que un valor menor a 100 ms es altamente sugestivo de HTP35.
El cálculo de PAPm se realiza mediante la siguiente fórmula: PAPm = 90 - (0,62 x TA) cuando el TA es menor a 120 ms35.
Por ejemplo, si el tiempo de aceleración es 105 ms, entonces: PAPm = 90 - (0,62 x 105) = 25 mmHg.
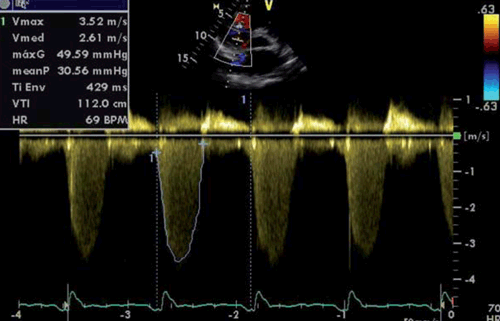
Medición del gradiente medio del flujo regurgitante tricuspídeo
El método más preciso para estimar la PAPm mediante ecocardiografía es la sumatoria de la PAD más el gradiente medio registrado mediante Doppler continuo del flujo regurgitante tricuspídeo (figura 6). Este método fue presentado por Arduen y colaboradores en 200936. Se realizaron mediciones intracardíacas instantáneas y se compararon con la estimación de la PAPm por este método en 102 pacientes. La media de la diferencia entre ambos gradientes fue de -1,6 mmHg, menor a la diferencia que presentó la estimación de la PAPs mediante el regurgitación tricuspídea (-6,4 mmHg) y que la PAPm usando el flujo regurgitante pulmonar (-13,9 mmHg).
E) Elementos indirectos de hipertensión pulmonar
En más de 15% de los estudios de ecocardiografía transtorácicos, el chorro de IT no permite estimar la PAP37. Los demás elementos diagnósticos frecuentemente no son obtenidos de manera óptima, por lo que se deben considerar otros elementos sugestivos de HTP de gran utilidad. El análisis de las presiones en las cavidades derechas debe basarse en la integración de múltiples parámetros combinados, y la concordancia entre los mismos refuerza su confiabilidad.
La dilatación de las cavidades derechas, del seno coronario y de la arteria pulmonar es un elemento sugestivo de sobrecarga de presión, aunque puede deberse, entre otras causas, a sobrecarga de volumen8. Serán analizados otros elementos sugestivos de HTP.
Morfología del espectro Doppler pulsado en el tracto de salida del ventrículo derecho
La presencia de una muesca o notch mesosistólico ha sido identificada como un elemento sugestivo de HTP debido a la poscarga aumentada que la caracteriza (figura 7B)34.
Morfología del septum interventricular
En condiciones normales el septum interventricular (SIV) es cóncavo desde el VI debido a la mayor presión de esta cavidad respecto al VD, tanto en sístole como en diástole; el VI se observa circular en la vista paraesternal eje corto y la relación entre el diámetro antero-posterior (Da-p) y el diámetro septo-lateral (Ds-l) es próxima a 1; esta relación se denomina índice de esfericidad (IE) y se calcula de la siguiente manera: IE = Da-p/Ds-l. Cambios sutiles en la presión ventricular derecha pueden determinar cambios en la relación del Da-p y Ds-l del VI. Un IE >1 debe elevar la sospecha de presiones aumentadas en cavidades derechas40.
En condiciones de sobrecarga de presión de las cavidades derechas, el SIV es rectificado o desplazado en dirección al VI y desde la vista paraesternal eje corto el VI adopta forma de D. Esto ocurre principalmente durante la sístole, aunque puede verse una rectificación sistodiastólica, dependiendo de la relación entre presiones de ambos ventrículos en las diferentes etapas del ciclo cardíaco38.
El fenómeno de rectificación del SIV también ocurre durante la sobrecarga de volumen del VD, como sucede en la IT o IP severas. En estos casos la rectificación del SIV se observa durante la diástole, a diferencia de lo que ocurre en la sobrecarga de presión39. Esta diferencia entre sobrecarga de volumen versus sobrecarga de presión es relativa y lo habitual es que ambas coexistan en mayor o menor medida.
Grosor parietal del ventrículo derecho
El grosor máximo normal de la pared libre del VD es de 5 mm, que puede ser medido desde la ventana subxifoidea o paraesternal eje largo (PEEL), tanto en modo M como en modo 2D. Debe realizarse en fin de diástole, por debajo del anillo tricúspide a nivel de la punta de la valva anterior tricuspídea cuando se encuentra totalmente abierta y paralela a la pared libre del VD, según las últimas guías9.
Si bien el grosor de la pared del VD puede verse aumentado en algunas enfermedades, como la miocardiopatía hipertrófica (MCH), o cardiopatías infiltrativas, es un elemento sugestivo de sobrecarga de presión ventricular derecha crónica41.
Tiempo de relajación isovolumétrica del ventrículo derecho
Mediante Doppler tisular sobre la base de la pared lateral del VD, podemos medir el TRIVD, desde la terminación de la onda S hasta el inicio de la onda e’ como fue descrpito previamente (figura 8). La prolongación de este período es la expresión de poscarga aumentada del VD. Si bien es un elemento poco específico de HTP, posee alta sensibilidad y un TRIVD <40 ms tiene un valor predictivo negativo de 100% para HTP42.
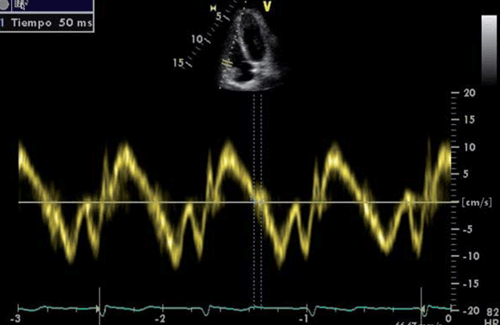
Figura 8: Medición del tiempo de relajación isovolumétrica del ventrículo derecho mediante Doppler tisular del anillo tricuspídeo.
Se ha sugerido que la corrección del TRIVD en función de la frecuencia cardíaca (FC) aumenta su eficacia, y que un valor de TRIVD corregido > 65 ms tiene alta sensibilidad y especificidad para predecir una PAPs > 40 mmHg43.
De todos modos, no es un elemento específico de HTP, y puede estar alterado en presencia de MCH, bloqueo completo de rama derecha (BCRD) y disfunción sistólica del VD44,45. Además, se ve modificado por las condiciones de carga auricular derecha. Cuando la PAD se encuentra en rango normal, el TRIVD aumenta de manera proporcional con la PAPs, pero en presencia de PAD aumentada, el cierre valvular tricuspídeo ocurre antes, de tal manera que el TRIVD se ve acortado22.
Índice de Tei
El índice de Tei o índice de performance miocárdica está determinado por la relación entre la sumatoria del TRIVD y la contracción isovolumétrica del VD (CIVD) dividido el tiempo eyectivo (TE). Es un parámetro combinado que evalúa la función sistodiastólica del VD46.
En la vista apical 4 cámaras se obtiene el registro Doppler tisular a nivel basal de la pared lateral del VD y se registra: TRIVD, CIVD y TE (figura 9). Puede calcularse mediante la siguiente fórmula: índice de Tei = TRIVD + CIVD/TE.
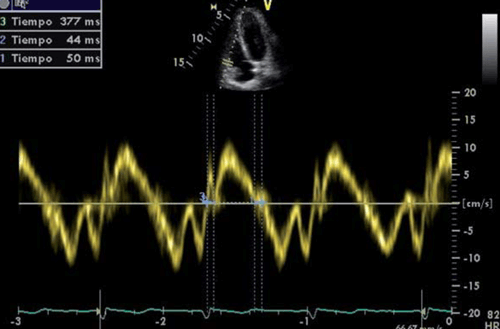
Figura 9: Medición del TRIVD, CIVD y TE mediante Doppler tisular del anillo tricuspídeo. TRIVD: tiempo de relajación isovolumétrica del ventrículo derecho; CIVD: contracción isovolumétrica del ventrículo derecho; TE: tiempo eyectivo.
Si bien fue descrito como un parámetro relativamente independiente de las condiciones de carga47, parece tener relación directa con la PAP y valores por encima de 36 son sugestivos de HTP48,49.
Análisis de la onda S del Doppler tisular en el anillo tricuspídeo
En pacientes con PAP elevada, la onda S del Doppler tisular del anillo tricuspídeo puede verse afectada. Un índice velocidad tiempo (VTI) < 2,5 cm o una velocidad máxima <12 cm/s son sugestivos de presión pulmonar > 40 mmHg50(figura 10). Si bien ha sido comparada con registros intracavitarios51, es un elemento tan solo sugestivo de HTP y no permite certificar ni cuantificar la misma.
F) Clasificación del tipo de hipertensión pulmonar
Se han desarrollado scores ecocardiográficos simples (Opotowsky y score simplificado D’Alto) que permiten diferenciar la HTP pre de la poscapilar de manera aceptable en comparación con el estudio hemodinámico invasivo. En estos scores la presencia de elementos ecocardiográficos sugestivos de aumento de la presión de la aurícula izquierda son los más importantes a la hora de diferenciar ambos grupos52-54.
La resistencia vascular pulmonar (RVP) está determinada por la relación entre el gradiente de presión transpulmonar y el flujo transpulmonar mediante cateterismo cardíaco derecho. Una RVP elevada en un paciente con HTP sugiere que la patología primaria es la vasculatura pulmonar en lugar del corazón izquierdo. Un valor >3 UW indica RVP elevada7. Si bien el cateterismo cardíaco derecho debe realizarse para un diagnóstico concluyente, la relación entre la IT-Vmáx y el VTI del TSVD medido por ecocardiografía podría proporcionar un importante parámetro en la evaluación de RVP. Esta se mide mediante la fórmula: RVP = (IT-Vmáx (m/s)/VTI del TSVD (cm) * 10) + 0,1655. La medición de la RVP mediante ecocardiografía no ha sido validada para iniciar o monitorear el tratamiento de la HTP56.
Conclusiones
En los últimos 30 años, importantes avances tecnológicos en la ecocardiografía han aumentado la capacidad para cuantificar la PAP. Hemos analizado la evidencia que sustenta la utilidad de los diferentes métodos ecocardiográficos para su estimación.
La ecocardiografía es actualmente reconocida como una técnica confiable en la estimación de la PAP y es de suma importancia que el cardiólogo tenga presente los diferentes métodos -directos e indirectos- que permiten evaluarla.