Principales aportes:
- Es el primer estudio nacional sobre septal pouch. Introduce la entidad en nuestro medio y la importancia de su identificación durante el estudio de imagen.
- Su valor patológico no ha sido aclarado y dada la alta prevalencia encontrada, podría tratarse de una variante de la normalidad.
- El estudio puede conducir a nuevas hipótesis, sobre todo vinculadas al rol del septal pouch en la etiopatogenia del accidente cerebrovascular.
Introducción
Los defectos del septum interauricular (SIA) son relativamente frecuentes y suelen ser congénitos. Entre estos se incluyen las comunicaciones interauriculares (CIA), los aneurismas del septum interauricular y el foramen oval permeable (FOP)1. La importancia de estas entidades radica en su alta prevalencia y la discutida asociación con fenómenos embólicos, lo que ha sido ampliamente descrito2,3).
Recientemente se ha señalado una nueva entidad conocida como septal pouch (SP) o “bolsillo septal”. Se trata de una estructura similar a un “bolsillo” o “divertículo” que surge desde el septum interauricular y se produce, en ausencia de un FOP, cuando existe una fusión incompleta a lo largo de la zona de superposición entre septum primum y septum secundum. Este “bolsillo” puede estar abierto hacia la aurícula izquierda (AI), dando lugar al left-sided septal pouch (LSSP) o hacia la aurícula derecha (AD) originando el right-sided septal pouch (RSSP). Existen también casos descritos de SP “doble”, es decir, un “bolsillo” abierto hacia la AI y otro hacia la AD4.
Esta entidad fue descrita por primera vez en el año 2006 por Breithardt y colaboradores5, como reporte del caso de una paciente joven con infarto de miocardio (IM) y oclusión trombótica aguda de la arteria circunfleja, en la que se detectó un SP con trombo en su interior en el ecocardiograma transesofágico (ETE), por lo que se planteó que el IM tuvo origen en una embolia a partir de esta anomalía. Luego de la primera descripción y de su asociación con un fenómeno embólico, Krishnan y colaboradores, en el año 2010, ponen nombre a la entidad y la describen por primera vez como SP6. El punto de máxima investigación del tema se centra en el LSSP como fuente potencial de formación de trombos; debido a sus características anatómicas podría tener un comportamiento similar a la orejuela izquierda, y se han reportado varios casos de trombo dentro del mismo7-10.
Sin embargo, la evidencia aún no es consistente para definir su valor patológico, siendo objeto de investigación por las potenciales consecuencias terapéuticas que podría tener una asociación entre SP y accidentes cerebrovasculares (ACV). En nuestro país no existen estudios acerca del tema y se desconocen la prevalencia y las características de esta entidad.
Nuestro objetivo primario es definir la prevalencia y caracterizar al SP en una cohorte de pacientes derivados a ETE por cualquier motivo. Secundariamente, determinar la concordancia interobservador para su diagnóstico.
Material y método
Se trata de un estudio observacional, descriptivo y analítico.
Se realizó un reclutamiento prospectivo de todos los pacientes derivados para ETE entre el 20 de abril de 2018 y el 30 de agosto de 2018 en el Centro Cardiovascular Universitario del Hospital de Clínicas. Se excluyeron los menores de 18 años y los que habían sido sometidos previamente a algún procedimiento sobre el septum interauricular. De todos los pacientes incluidos se recolectaron datos patronímicos, factores de riesgo cardiovascular, antecedentes personales de ACV, ritmo cardíaco y motivo de la realización del ETE. Se confeccionó una base de datos anónima con estas variables.
Protocolo de realización de ecocardiograma transesofágico
Se realizó ETE bidimensional con equipos GE Vivid IQ® VIVI IQ y Siemens Sequoia® CQ 512. El estudio fue realizado por médicos cardiólogos con experiencia (nivel II de ECOSIAC) en la realización del mismo, y las imágenes del SIA fueron guardadas en el equipo. El primer cardiólogo registró los datos correspondientes al observador uno. Posteriormente, dichas imágenes fueron revisadas y registrada la información en planilla independiente por un segundo operador de forma ciega al primero. Se realizaron enfoques para evaluar el SIA en vistas medio-esofágicas realizando un paneo del mismo de 0o a 180°. Mediante Doppler color se descartó flujo a través del SIA en reposo y luego de maniobra de Valsalva. No se realizó prueba con suero fisiológico agitado para comprobar la permeabilidad del SIA. Luego se evaluó si la fusión del SIA era completa o no y se clasificó a todos los pacientes en uno de los siguientes cuatro grupos: septum completamente fusionado, FOP, LSSP y RSSP. Se evaluó también la presencia de otros defectos del SIA usando criterios estándar para la evaluación de estas entidades (aneurisma del septum interauricular [ASIA], CIA). Para evaluar las dimensiones del LSSP se utilizó la vista bicava de 90o a 120°. La profundidad se midió obteniendo la máxima distancia desde la punta libre hasta la inserción de este en el SIA durante la diástole. Se evaluó, asimismo, la presencia de trombo en el SP.
Análisis estadístico
Se realizó un análisis descriptivo de la población incluida en el estudio. Las variables cualitativas se presentan en valor absoluto y frecuencia relativa. Las variables cuantitativas en mediana e intervalo intercuartilo. Se analizaron asociaciones por test de chi cuadrado entre la presencia de SP y otros factores como fibrilación auricular (FA)/flutter y ACV, utilizando como valor significativo una p<0,05. Para evaluar la concordancia interobservador en el diagnóstico se usó el índice Kappa. Se utilizó para el análisis el paquete estadístico IBM SPSS Statistics versión 22.
Resultados
Durante el período del estudio se realizaron en la institución 60 ETE. De estos, diez estudios fueron excluidos, tres de ellos por tener un dispositivo de cierre de una CIA, cinco por no contar con registro de las imágenes para poder ser evaluadas por el segundo operador y dos por tratarse de un segundo estudio en un mismo paciente. Por lo tanto, el número final de sujetos incluidos fue de 50.
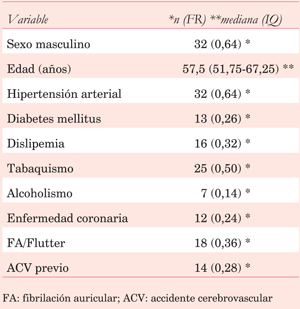
Las características basales de la población se expresan en la (tabla 1). El motivo más frecuente de solicitud del ETE, en 12 de los 50 sujetos (24%), fue descartar o valorar una endocarditis infecciosa. En segundo lugar, encontramos la valoración de valvulopatía mitral en nueve sujetos (18%) y ETE realizado previo a una ablación o cardioversión eléctrica de una arritmia auricular también en nueve sujetos (18%). En frecuencia menor se destacan la valoración etiológica de un ACV (7 sujetos, 14%) y la valoración de patología aórtica (6 sujetos, 12%).
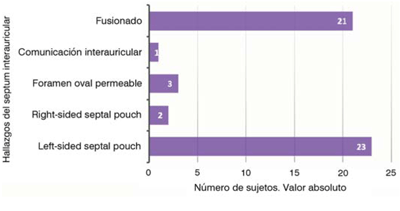
El estudio ecocardiográfico reveló la configuración del SIA, clasificando a todos los sujetos en los cuatro grupos expuestos anteriormente (SIA completamente fusionado, FOP, CIA o SP), y, a su vez, los pacientes en los cuales se realizó diagnóstico de SP se clasificaron en LSSP o RSSP. Para la exposición de estos resultados se utilizó la base de datos del operador uno, que fue el que realizó el estudio. Los resultados se exponen en la (figura 1) y es relevante resaltar que se diagnosticó SP en la mitad de los sujetos incluidos (25 pacientes), dentro de los cuales 23 (46% de toda la población, 92% de todos los SP) fueron clasificados como LSSP y dos como RSSP (4% de toda la muestra, 8% de todos los SP; no se detectaron casos de SP doble). Se muestra un ejemplo de LSSP en un sujeto del estudio en la (figura 2).
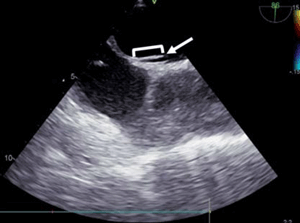
Figura 2: Ecocardiograma transesofágico en enfoque bicava a 86°, que evidencia la presencia de un left sided septal pouch (flecha). Se señala cómo se realizó la medida de la profundidad del mismo.
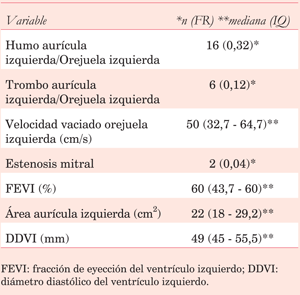
En cuanto a las características, se detectó la presencia de trombo a nivel del SP en un sujeto; la mediana de profundidad del mismo, medida como se detalló anteriormente, fue de 15 mm (IQ 12,5 - 21 mm). Los resultados de los demás estudios ecocardiográficos se exponen en la (tabla 2).
Respecto al objetivo secundario del estudio, se determinó la concordancia interobservador para el diagnóstico de SP y se obtuvo un índice Kappa de 0,68, con 84% de acuerdo entre observadores. Se realizaron asociaciones entre la presencia de SP y la de ACV. Se observó que 64% de los sujetos que tuvieron ACV tenían SP, mientras que en 44% de los que no tuvieron ACV se diagnosticó SP (p=0,21). También se buscó asociación entre la presencia de FA/flutter y la presencia de SP y se observó que 50% de los pacientes que tuvieron alguna de estas arritmias auriculares tenían SP, mientras que 50% de los que no tenían ninguna de ellas, tenía SP (p=1).
Discusión
Nuestro estudio encontró una alta prevalencia de SP, correspondiendo a la mitad de la población estudiada. La amplia mayoría correspondió a LSSP. A su vez, existió una buena concordancia en el diagnóstico entre los observadores, lo cual apoya estos resultados y hace reproducible el diagnóstico.
No existen estudios nacionales sobre el tema; si bien las investigaciones internacionales son escasas, reportan prevalencias variables de acuerdo al método que se utiliza para el diagnóstico. Cuando se realiza a partir de autopsias, la prevalencia es muy similar a nuestro estudio. Krishnan y colaboradores encontraron que 43,6% de la población estudiada tenía SP, y de esta, 90% era LSSP y 10% RSSP6. Holda y colaboradores describieron una prevalencia de 52,5% coincidiendo también en el franco predominio de LSSP4, y Klimek-Piotrowska y colaboradores, 51,2% de LSSP11. Cuando se realiza diagnóstico en pacientes vivos, a partir de ETE o tomografía computada multicorte (MSCT), la prevalencia reportada es menor. Holda y colaboradores describen una prevalencia de LSSP de 35,7% mediante MSCT12, y Sun y colaboradores de 23% por ETE (n=428 pacientes)13. En estos casos se considera el ETE como técnica de referencia, no habiendo podido demostrar la superioridad de la MSCT sobre el primero. Las ventanas descritas más adecuadas para examinar el SIA son la vista medio-esofágica de cuatro cámaras, el eje corto de la válvula aórtica y la vista bicava14,15. Nuestro estudio fue realizado con estos enfoques, por lo que es posible comparar los resultados. La alta prevalencia encontrada dentro de los reportes internacionales ha hecho plantear la posibilidad de que este hallazgo se considere una variante de la normalidad en la morfología del SIA4, aspecto que se encuentra en discusión.
En cuanto a las características de esta variante anatómica, la mediana de profundidad fue de 15 mm, que es mayor a lo reportado internacionalmente. Krishnan describe una media de 8,3 mm6 y Holda una media de 8,4 mm4 para la profundidad de los LSSP. Si bien encontramos una diferencia entre la profundidad medida en el estudio y la de los reportes internacionales, al tratarse de una entidad relativamente nueva, es escasa la experiencia en su caracterización, por lo cual se necesitan más observaciones, en mayor cantidad de sujetos y más experiencia en la medida para determinar las características de esta estructura.
En relación con la posible asociación entre SP y ACV, nuestro estudio evidenció una tendencia a mayor número de SP en sujetos con antecedentes de ACV respecto a los pacientes sin antecedentes, pero esto no alcanzó significancia estadística. A su vez, encontramos el caso de un paciente con trombo a nivel del SP que tenía dilatación severa de AI y ventrículo izquierdo (VI), fracción de eyección del VI severamente disminuida, velocidades de vaciado de la orejuela izquierda disminuidas, antecedentes de FA y ACV. Este es el principal punto de investigación del tema y existen reportes internacionales que evidencian asociación entre SP y cardioembolia. Wong y colaboradores publican, en el año 2015, el primer estudio que encuentra una asociación entre ambas entidades; este estudio retrospectivo encontró una prevalencia de casi el triple de LSSP en pacientes con ACV isquémico criptogenético en comparación con los no criptogenéticos (30% vs 10%, p=0,04 considerando significativo un valor de p<0,05), si bien el número de pacientes con ACV criptogenético era bajo (n=23)16. Posteriormente, Holda y colaboradores describieron en otro estudio retrospectivo, publicado en el año 2018, una prevalencia de 55,6% de LSSP en 126 pacientes con ACV criptogenético en comparación con una prevalencia de 40,9% en 137 pacientes controles sin ACV, diferencia estadísticamente significativa (p=0,02 para significancia estadística cuando p<0,05)17. Sun y colaboradores también encontraron una prevalencia de ACV isquémico de casi el doble en pacientes con LSSP con respecto a los pacientes sin LSSP en 324 sujetos sometidos a ETE, aunque también se trató de un número reducido (los pacientes con ACV en el grupo de LSSP fueron diez)13. Sin embargo, existen estudios que reportan la ausencia de relación significativa entre ambas entidades18,19. Una revisión sistemática del año 2017 de Strachinaru y colaboradores, que incluyó cinco estudios caso-control del tema y 14 reportes acerca de trombos en el LSSP, no encontró diferencias estadísticamente significativas entre la presencia de LSSP en pacientes con y sin ACV isquémico20. Si bien este punto es discutido, y se necesitan más estudios con un mayor número de sujetos para obtener resultados más fiables, todos los reportes coinciden en que la presencia de SP por sí misma no sería suficiente para la formación de trombos, y que sería necesario algún elemento de la clásica tríada de Virchow (estasis sanguínea, daño endotelial e hipercoagulabilidad) para favorecer la formación de trombo a dicho nivel7,21,22. Esto se evidencia en el caso que encontramos con trombo en esa localización, en el que se observaron varios factores adicionales que podrían contribuir a la estasis sanguínea y a la formación de trombo.
La falta de potencia estadística del estudio podría deberse al n pequeño. Se trata de un punto de investigación interesante para próximos trabajos sobre el tema, ampliando el número de pacientes.
Por último, encontramos una buena concordancia en el diagnóstico entre observadores con 84% de acuerdo entre dos ecocardiografistas experimentados, lo que hace reproducible el diagnóstico.
La importancia de nuestro estudio radica en que se trata del primer reporte nacional del tema acerca de una entidad relativamente “nueva”, que hasta el momento no era tenida en cuenta como fuente potencial de tromboembolismo. A su vez, no existen estudios que reporten la concordancia interobservador para el diagnóstico, aspecto que debe ser evaluado para confirmar su confiabilidad. Consideramos que es fundamental continuar el estudio de prevalencia y características morfológicas, y sobre todo acerca de la posible relación con la presencia de ACV, lo que tendría implicancias en el tratamiento.
Limitaciones
Se trata de un estudio unicéntrico y con un número pequeño de sujetos, lo que puede generar pérdida de potencia estadística para encontrar relaciones entre las variables. A su vez, hubiera resultado interesante realizar prueba con suero fisiológico agitado como elemento adicional para descartar la presencia de FOP, lo cual no pudo ser implementado y podría incluirse en estudios futuros.
Conclusiones
La prevalencia de SP fue de la mitad de la población estudiada, predominando ampliamente el LSSP, con buena reproducibilidad en su diagnóstico por ETE entre dos observadores. No encontramos asociación con significancia estadística entre la presencia de SP y ACV. Se trata de un hallazgo subdiagnosticado; interesa continuar investigando su posible asociación con ACV.