Introducción
La miocardiopatía inducida por arritmias (MIA) es relativamente frecuente, habitualmente está subdiagnosticada y, lo más importante, es una causa reversible de disfunción sistólica ventricular izquierda cuando diagnóstico y tratamiento son adecuados y oportunos. La disponibilidad de la ablación por catéter, recurso terapéutico que permite en la mayoría de los casos eliminar la arritmia sin los efectos colaterales o tóxicos de los fármacos y recuperar total o parcialmente la función ventricular, jerarquiza la importancia de su diagnóstico1-7.
Revisaremos algunos aspectos generales de esta patología y nos referiremos fundamentalmente a las arritmias que, por su alta prevalencia clínica, más frecuentemente son causa de MIA, la fibrilación auricular (FA) y la arritmia ventricular extrasistólica. Mencionaremos brevemente otras taquiarritmias supraventriculares y ventriculares y algunos trastornos del ritmo no rápidos que también comprometen la función.
Definición
MIA es clásicamente definida como la situación en la cual una arritmia supraventricular o ventricular resulta en un compromiso de la función sistólica ventricular7. Esto puede acontecer en un corazón estructuralmente sano, siendo la única causa de la disfunción sistólica y se denomina tipo 1. En estos casos el tratamiento de la arritmia normaliza la función ventricular. Se designa como tipo 2 cuando la arritmia agrava un compromiso funcional ventricular de otra etiología y el tratamiento de ella mejora parcialmente la función6,8. Recientemente se ha propuesto ampliar esta definición incluyendo también la disfunción auricular (cardiomiopatía atrial) generada por arritmias auriculares y el compromiso funcional ocasionado típicamente por la disincronía ventricular en casos de bloqueo de rama izquierda, estimulación del ápex del ventrículo derecho (situaciones que no abordaremos en este artículo) o extrasistolía ventricular de alta incidencia9.
En la medida en que no solo las arritmias rápidas pueden ocasionar compromiso funcional, el término taquimiocardiopatías no debería ser utilizado en forma genérica para caracterizar esta patología. Estrictamente se trata de miocardiopatías auriculares y ventriculares inducidas por arritmias.
Fisiopatología
Tres mecanismos primarios, solos o combinados, contribuyen en la génesis del compromiso contráctil sistólico: taquicardia, irregularidad y disincronía (Tabla 1)6.
La sola presencia de uno o más de estos trastornos no tiene siempre como resultado una miocardiopatía. Es necesario la existencia de factores asociados, algunos conocidos y potencialmente modificables, como la cardiopatía estructural de base, y otros no modificables, la edad y la predisposición genética6. También la duración y persistencia de la arritmia tiene trascendencia. De cualquier manera, existe evidencia de que una taquicardia >100 pm durante más de 15% del tiempo es causa potencial de disfunción ventricular2,8.
El mecanismo básico del desarrollo de MIA ha sido extensamente estudiado en animales, desarrollándose de una manera predecible frente a una estimulación rápida mantenida. La historia natural del remodelado ventricular y la falla cardíaca se ha podido entonces reproducir experimentalmente permitiendo estudiar en detalle la activación neurohumoral, los mecanismos celulares y vías moleculares. Los fenómenos involucrados en el desarrollo de MIA en humanos son menos claros7.
Aspectos clínicos
No hay una frecuencia cardíaca de referencia por encima de la cual la aparición de una MIA sea más factible y es probable también que esta sea variable con la edad. Pero sin dudas esta frecuencia es menor que lo que podríamos sospechar. Las taquiarritmias asintomáticas o poco sintomáticas con frecuencias no muy elevadas pero persistentes son la causa más frecuente.
Toda arritmia rápida persistente debe hacernos plantear el diagnóstico de MIA. La arritmia puede tener años de evolución y el deterioro de la fracción de eyección (FEy) lento, progresivo y en ocasiones tardío, hace que a veces este diagnóstico no se considere. Es necesario un alto grado de sospecha clínica. Es frecuente que una arritmia sea considerada una consecuencia de la miocardiopatía sin siquiera plantearse la situación inversa. En estos casos la arritmia no es correctamente tratada y la evolución no es buena. La clásica pregunta ¿qué es primero, el huevo o la gallina?, debe plantearse siempre cuando esta asociación está clínicamente presente. Si la duda persiste, debe tratarse adecuadamente la arritmia, si es posible en forma definitiva y valorar la respuesta clínica6-10.
Fibrilación auricular y miocardiopatía
La FA es la arritmia más frecuente en la clínica y la que más comúnmente se asocia a disfunción ventricular izquierda en adultos. Entre 10% y 50% de los pacientes con insuficiencia cardíaca tiene FA y en todos se admite que existe un componente mayor o menor de MIA11. La presencia de FA duplica el riesgo de presentar insuficiencia cardíaca, según datos de Framingham12.
Los tres mecanismos básicos propuestos en la génesis de MIA están presentes en los pacientes con FA6,7. La pérdida de la contracción auricular compromete significativamente el gasto cardíaco al perderse la contribución auricular al gasto sistólico y la sincronía atrioventricular; la irregularidad determina, además, que el llenado diastólico sea diferente en cada latido y por lo tanto el gasto sistólico variable; el descontrol de la frecuencia acentúa estos efectos negativos.
El control de la frecuencia, ya sea estricto o flexible, guiado por síntomas, no ha demostrado modificar significativamente la situación ni la evolución, lo cual parece razonable ya que solo controla uno de los mecanismos responsables (la frecuencia rápida). Cuando como último recurso para su control se llega a indicar una ablación del nodo auriculoventricular e implante de marcapaso (aun con estimulación biventricular) controlando otro factor, la irregularidad, los resultados tampoco son alentadores7.
Restaurar el ritmo sinusal y mantenerlo es el gesto terapéutico más efectivo en el paciente con FA y falla cardíaca, mejorando sensiblemente su evolución clínica y su pronóstico6,7. Los recursos disponibles son la cardioversión eléctrica para recuperar el ritmo sinusal y los fármacos, básicamente la amiodarona, o la ablación por catéter para el mantenimiento del ritmo. Dada la trascendencia del ritmo sinusal en los pacientes con falla cardíaca, no debería definirse una FA como permanente en ellos sin realizar al menos un intento de restaurar y mantener el ritmo normal.
El recurso más fácilmente disponible para el control del ritmo, los fármacos antiarrítmicos, tienen una eficacia limitada. El ensayo AF CHF aleatorizó 1.376 pacientes a una estrategia de control del ritmo (amiodarona + cardioversión) versus control de la frecuencia. La estrategia de control farmacológico del ritmo, con casi tres años de seguimiento, no mejoró la mortalidad global ni previno la progresión de la falla cardíaca13. Debe considerarse que 40% de los pacientes randomizados a control de la frecuencia estaban en ritmo sinusal, lo cual relativiza los resultados. El estudio CAFÉ-II comparó estas mismas estrategias (amiodarona+cardioversión vs control de frecuencia) en forma aleatoria en pacientes con FA persistente. A pesar de incluir solo 61 pacientes la estrategia de control del ritmo mejoró la calidad de vida, los niveles de pro-BNP y la función ventricular14. Como lo plantea un subanálisis del estudio AFFIRM, los resultados del mantenimiento del ritmo sinusal con fármacos están condicionados por sus efectos tóxicos y proarrítmicos15. La amiodarona, el fármaco más efectivo, también es la que mayores efectos colaterales o tóxicos presenta en su uso a mediano y largo plazo.
La ablación por catéter, procedimiento que consiste básicamente en el aislamiento eléctrico de las venas pulmonares en cuya desembocadura en la aurícula izquierda se genera la actividad eléctrica que “gatilla” la FA, es la estrategia base del procedimiento. En la FA paroxística y persistente los resultados de la ablación son superiores a los de los fármacos antiarrítmicos y en algunos casos constituye la primera opción de tratamiento. Estas dos terapias, además, no son excluyentes. En muchos pacientes, fármacos previamente inefectivos son efectivos posablación. El uso de la ablación, sola o con fármacos antiarrítmicos asociados, es de particular importancia en pacientes con disfunción ventricular izquierda6,7,16-18).
Una revisión sistemática de 19 ensayos clínicos valorando los resultados de la ablación de FA en un total de 914 pacientes con disfunción ventricular izquierda19 mostró que 57% mantenía ritmo sinusal luego de un procedimiento y 82% luego de más de un procedimiento o con la asociación de fármacos antiarrítmicos. La FEy mejoró globalmente 13,3%.
Otro ensayo, cuyo acrónimo es AATAC-AF, comparó ablación versus amiodarona en 203 pacientes con FA persistente y FEy <40%. A los dos años, 70% del grupo ablación estaba en ritmo sinusal versus 34% en el grupo amiodarona. Los pacientes tratados con ablación tuvieron menos mortalidad, menos hospitalizaciones por insuficiencia cardíaca y mejor calidad de vida.
En el ensayo clínico CAMERA-MRI4 se randomizaron 1:1, 68 pacientes con FA y miocardiopatía dilatada idiopática (FEy < 45%) a control estricto de la frecuencia versus ablación. Los pacientes sometidos a ablación mejoraron significativamente la FEy, su clase funcional y los niveles de BNP. Aquellos pacientes sin fibrosis auricular valorada por la presencia de realce tardío con gadolinio en resonancia cardíaca tuvieron una mejor evolución (56% normalizó la FEy posablación), haciendo notar la potencial importancia de esta técnica de imagen en la selección de pacientes.
Recientemente se publicó el esperado estudio CASTLE-AF5, ensayo internacional, multicéntrico, que randomizó 363 pacientes (FA paroxística o persistente, FEy <35%, y miocardiopatía isquémica o no isquémica) a ablación o fármacos; todos los pacientes eran portadores de un cardiodesfibrilador, por lo tanto la detección de FA era certera. El punto final primario compuesto, mortalidad global y hospitalizaciones por insuficiencia cardíaca, fue significativamente menor en el grupo ablación luego de un seguimiento medio mayor de tres años (HR 0,62; IC95% 0,43-0,87; p 0,007). La FEy mejoró globalmente en 8% en el grupo ablación a 60 meses, sin registrarse cambios en el grupo con tratamiento médico.
La ablación por catéter de la FA es una estrategia efectiva para el control del ritmo y los datos disponibles permiten afirmar que es una opción siempre a considerar para los pacientes con FA e insuficiencia cardíaca.
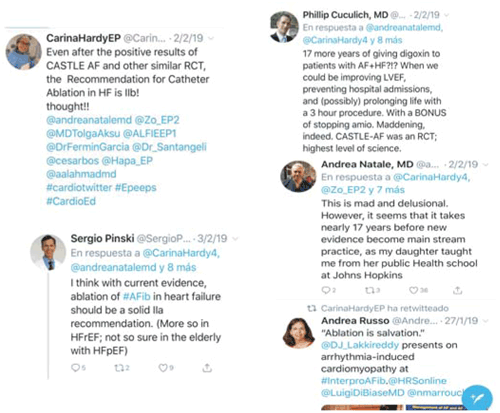
La Guía 2016 de la Sociedad Europea de Cardiología y el Consenso de Expertos 2017 de la Sociedad del Ritmo Cardíaco, junto con las Sociedades de Arritmias Europea, Latinoamericana y de la región Asia-Pacífico, establecen una indicación clase IIa para la ablación por catéter de la FA cuando existe disfunción ventricular16,17. Sin embargo, en enero de 2019, fue publicada una actualización de la Guía 2014 del Colegio Americano de Cardiología, la Asociación Americana de Cardiología y la Sociedad del Ritmo Cardíaco18 en la cual se establece en esta situación una indicación clase IIb. A pesar de lo reciente de esta publicación, ya ha generado controversia en la literatura, en páginas web especializadas y en las redes (Figura 1).
Citamos, por ejemplo, la opinión del Dr. John Mandrola en la página The Heart.Org Medscape Cardiology20: “CASTLE AF y AATAC tienen limitaciones -todos los ensayos clínicos las tienen- pero darles a estos pacientes la misma clase de recomendación que al uso de apixabán en pacientes con falla renal avanzada o del cierre de la orejuela izquierda, es una injusticia y hace dudar de la validez y fuerza del sistema de recomendaciones. Si deseáramos realizar más estudios, ¿cómo convencer a un paciente con insuficiencia cardíaca y FA refractaria al tratamiento farmacológico para que acepte participar en un ensayo randomizado donde uno de los grupos será asignado a una terapia inefectiva?”.
Parece una paradoja que a pesar de la aparición de ensayos clínicos que la respaldan y de los avances tanto tecnológicos como de la experiencia de los equipos humanos que han repercutido en la mejora de los resultados, se haya modificado la categoría de esta indicación. Seguramente en los próximos meses asistiremos a muchos debates sobre este punto en congresos y publicaciones.
El mantenimiento del ritmo sinusal ya sea con fármacos antiarrítmicos o con ablación, debe incluir siempre el tratamiento farmacológico óptimo de la insuficiencia cardíaca, el control de los factores de riesgo modificables de FA (por ejemplo, hipertensión, sobrepeso, apnea del sueño) y el uso de anticoagulantes orales de acuerdo con los scores de riesgo conocidos.
Otras taquiarritmias supraventriculares causantes de miocardiopatía
El flutter auricular puede comprometer también la FEy en un número no menor de pacientes. Considerando las dificultades para el control de la frecuencia en esta arritmia, la alta tasa de recurrencias y la eficacia y el bajo riesgo de la ablación, este es el tratamiento de elección cuando una MIA es sospechada21).
La taquicardia auricular ectópica o focal y la llamada forma permanente de taquicardia recíproca de la unión (PJRT por su sigla en inglés, también denominada taquicardia de Coumel) vinculada a una vía accesoria posteroseptal con conducción decremental, son frecuentemente incesantes y constituyen etiologías clásicas de MIA. Son más frecuentes en niños y jóvenes. El tratamiento curativo es la ablación, normalizándose la FEy22,23. La reentrada intranodal u otras formas de reentrada atrioventricular solo excepcionalmente comprometen la función ventricular.
Miocardiopatía inducida por extrasístoles ventriculares
Las extrasístoles ventriculares (EV) frecuentes pueden causar MIA o agravarla en pacientes con cardiopatía6,7. Se ha reportado una incidencia de MIA entre 9% y 34% en pacientes con extrasístoles ventriculares. El mecanismo responsable no está dilucidado totalmente, pero se considera que la disincronía ventricular es el fundamental; las alteraciones anatómicas y funcionales observadas son similares a las objetivadas con la estimulación crónica desde el ápex del ventrículo derecho. Hasta un 7% de los pacientes con EV del tracto de salida ventricular (sitio de origen muy frecuente de EV idiopáticas) desarrollan MIA24. El factor fundamental para el planteo diagnóstico es la incidencia de EV en 24 horas. Debe considerarse la posibilidad de una MIA cuando la incidencia de EV es mayor a 10% de los latidos y sobre todo si supera el 20%25.
Además de la incidencia, otras características de las EV han sido consideradas favorecedoras del desarrollo de MIA (Tabla 2). Se destacan: si son asintomáticas, el ancho del QRS de las EV (>150 ms), la presencia de episodios de taquicardia ventricular no sostenida, si existen otras EV también de origen en el ventrículo derecho, las EV interpoladas o con gran dispersión en los intervalos de acoplamiento, o aquellas que tienen conducción retrógrada.
Todos estos factores potencialmente agravan la disincronía ventricular7,26. Sin embargo, muchos pacientes con alta incidencia de EV no desarrollan MIA, y no está clara la conducta a seguir con ellos. Parece prudente, si además son asintomáticas, un seguimiento de la FEy, y si esta se deteriora, tratarlos7.
El tratamiento de la MIA generada por EV tiene como objetivo eliminar la arritmia. Aunque pueden utilizarse los fármacos antiarrítmicos son bien conocidas sus limitaciones. El uso de fármacos debería reservarse solo para aquellos pacientes que no pueden acceder a la ablación o en quienes esta no ha sido exitosa7. La ablación por catéter es el tratamiento más efectivo (70%-90% de éxito) y ha demostrado ser superior al tratamiento farmacológico mejorando significativamente la FEy aun en aquellos pacientes con cardiopatía estructural6,7,27,28.
Caso 1
J.M. 54 años, sexo masculino. Exfumador.
Historia de FA paroxística y persistente desde los 40 años de edad. Tratado farmacológicamente sin éxito. Debió suspender amiodarona por hipertiroidismo, actualmente compensado. Referido en consulta luego de ingreso por insuficiencia cardíaca aguda cursando episodio de FA persistente de larga duración (meses). Luego de mejoría parcial de la falla cardíaca con el tratamiento habitual (diuréticos, digoxina, betabloqueantes, inhibidores de la enzima convertidora), además del uso de anticoagulantes (rivaroxabán), fue cardiovertido eléctricamente en más de una oportunidad recurriendo siempre la FA en minutos. FEy: 29%. Pro BNP: 7.241 pg.ml.
En octubre de 2018 es sometido a procedimiento de ablación de FA. Inicialmente se trabaja en FA (dado el antecedente de recurrencia precoz en cardioversiones previas) realizándose aislamiento eléctrico de las cuatro venas pulmonares; culminado el mismo, se cardiovierte eléctricamente manteniéndose el ritmo sinusal. Se completa y confirma el aislamiento de las cuatro venas. Se realiza, además, ablación del istmo cavo-tricuspídeo generando bloqueo bidireccional a nivel de éste.
Posablación, el paciente se mantiene en ritmo sinusal, asintomático, y el ecocardiograma realizado tres meses después mostró una FEy de 55%.
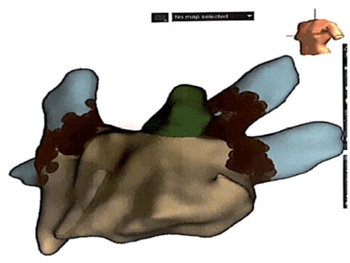
La figura (Figura 2) muestra la reconstrucción de la aurícula izquierda y venas pulmonares con sistema de navegación Ensite Precision. En verde la orejuela izquierda.
Caso 2. 29
J.G. 69 años, sexo masculino. Sin factores de riesgo cardiovascular conocidos. Sintomático por palpitaciones. Holter: EV monomorfa, >40% del total de latidos en 24 horas; además, episodios de taquicardia ventricular no sostenida y sostenida. FEy normal. Intento de ablación no exitoso (Figura 3). Dos años después consulta por disnea de esfuerzo y se constata FEy: 35%. Holter de similares características.
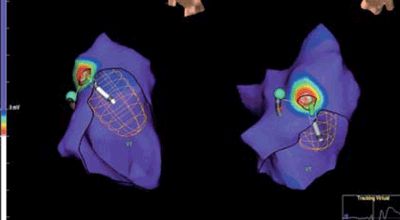
Se realiza nuevo procedimiento de ablación utilizando en esta oportunidad sistema EnSite con catéter Array (Figura 4). Se topografía sitio de origen a nivel del anillo tricuspídeo (hora 1-2 en oblicua anterior izquierda) y se elimina con aplicaciones de radiofrecuencia. En la evolución desaparición de la arritmia y normalización de la FEy.
Conclusiones
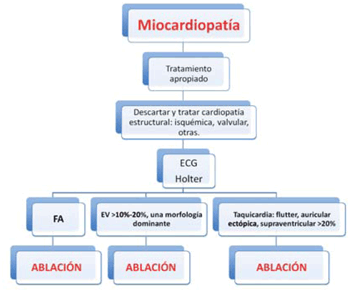
Las arritmias cardíacas son una causa frecuente y subdiagnosticada de compromiso de la función miocárdica. Toda alteración en la frecuencia o de la secuencia de la contracción cardíaca puede potencialmente comprometer su eficacia. Estos trastornos del ritmo pueden ser su causa exclusiva o un factor contribuyente en pacientes con cardiopatía estructural de base (Figura 5).
La FA es la arritmia que más frecuentemente se asocia con insuficiencia cardíaca y la estrategia de control del ritmo mediante ablación debe considerarse una terapia de primera línea en esta situación.
Las EV de alta incidencia deben valorarse como causa potencial de MIA y la ablación debe ser considerada cuando es sintomática o compromete la FEy.