Introducción
La ablación de la fibrilación auricular (FA) por radiofrecuencia (RF) se ha convertido en el tratamiento de elección para control de ritmo cuando la farmacoterapia ha fallado o como primera línea en casos determinados. Este procedimiento consiste en el aislamiento eléctrico de las venas pulmonares por fuera del ostium, a nivel antral1. La tecnología ha permitido mejorar el éxito de la ablación con procedimientos como la reconstrucción anatómica en tercera dimensión (3D) de las venas pulmonares, alcanzando una tasa de éxito de hasta 70% en la FA paroxística y 50% en la FA persistente2.
En los últimos años, debido a que aún existen pacientes en los que este procedimiento es inefectivo, se ha intentado definir qué factores se relacionan con la recurrencia de la FA, sin obtener respuestas claras3,4. Menos estudiado ha sido el remodelado que sufre la aurícula izquierda (AI) posterior a la ablación de las venas pulmonares y su papel en la recurrencia de la FA. Describimos la aparición de remodelado reverso en la AI posterior a la ablación de las venas pulmonares con RF, discutiendo su potencial aporte como predictor de recurrencia.
Presentación de casos
Describimos los casos de ocho pacientes que fueron sometidos a aislamiento de las venas pulmonares con reconstrucción anatómica en 3D por diagnóstico de FA entre marzo de 2016 y marzo de 2017, cuatro mujeres y cuatro hombres, con edad promedio de 46 años (28-67 años).
El procedimiento se realizó bajo anestesia general. Mediante accesos venosos se introdujeron catéteres intracavitarios, procediéndose a la punción transeptal para acceder a la AI. Se realizó la reconstrucción anatómica virtual de esta y de las venas pulmonares utilizando equipo EnSite Classic con sistema NavX (Figura 1). El sistema necesita de una referencia externa (parches cutáneos) y una interna (catéter en AI); permite, además, realizar integración de la imagen obtenida por tomografía multicorte o cardiorresonancia de la AI y las venas pulmonares5. Si el paciente se encontraba en ritmo sinusal, se inició el procedimiento colocando a nivel del ostium de cada una de las venas pulmonares un catéter decapolar circular de tipo Lasso, y se observó la presencia de potenciales fásicos que indican la actividad eléctrica de las venas pulmonares. Posteriormente se realizó estimulación desde diferentes puntos de la aurícula con el fin de valorar la conducción desde la aurícula a la vena. A partir de esa información se aplica RF rodeando la desembocadura de cada vena a nivel antral; en algunos casos se englobaron ambas venas dentro de la misma lesión circular. Finalmente se comprobó el aislamiento eléctrico (ausencia de conducción desde aurícula a vena, y desde vena a aurícula, y/o disociación de potenciales de vena). En el caso de que el paciente antes del procedimiento estuviese en FA, se realizó ablación anatómica al inicio y solo si esta persistía, se realizaba cardioversión eléctrica y posteriormente se comprobaba el aislamiento eléctrico de la misma manera6. Si luego del aislamiento de las venas pulmonares y poscardioversión eléctrica se identificaba un trigger focal por fuera del ostium de las venas pulmonares que iniciase nuevamente FA, se procedía a la ablación de estos sitios específicos7,8. El tiempo promedio de radioscopía fue de 63,7 minutos.
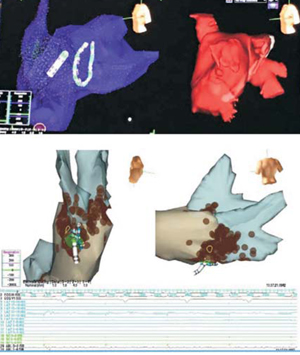
Figura 1: EnSite Classic con su sistema NavX. Arriba: reconstrucción anatómica de la aurícula izquierda y venas pulmonares mediante el uso de electrodos exploradores intracavitarios. Abajo: puntos de ablación (color marrón) fuera del ostium de las venas pulmonares.
Todos los pacientes fueron sometidos a ecocardiograma transesofágico entre uno y tres días previos al procedimiento, para descartar la presencia de trombo auricular.
Los pacientes que recibían anticoagulación oral crónica, fuera con warfarina o con anticoagulantes directos, continuaron con el tratamiento previo al procedimiento en todos los casos; a los que no recibían anticoagulación, se les administró warfarina por lo menos un mes previo al procedimiento. Todos fueron sometidos a anticoagulación oral previa. Los pacientes bajo tratamiento con warfarina tuvieron valores de INR entre 2 y 3 antes de la ablación. Luego de realizada la punción transeptal se utilizó heparina no fraccionada para mantener un tiempo de anticoagulación activado (TCA) de al menos 300 segundos. Luego de la ablación todos los pacientes permanecieron con anticoagulación durante dos meses de manera obligatoria, y posteriormente de acuerdo al riesgo trombótico según el score CHA2DS2VASc.
El remodelado de la AI posablación de las venas pulmonares fue evaluado con ecocardiograma transtorácico (ETT) bidimensional, utilizando un equipo Siemens Acuson Sequoia c512 con transductor 4v1c. En todos los casos se realizó un ecocardiograma basal en los cinco días previos a la ablación y dos ecocardiogramas posablación, al mes y a los tres meses respectivamente. Las variables que se usaron para evaluar el remodelado fueron: volumen auricular izquierdo biplano, fracción de eyección de la aurícula izquierda (FEAI) y strain longitudinal reservorio (pico sistólico) de la pared lateral de la AI (SLPSAL). El volumen auricular izquierdo fue medido aplicando el método de sumatoria de discos en biplano en las proyecciones apicales de 2 y 4 cámaras; además, fue ajustado a la superficie corporal como está actualmente recomendado9,10. La FEAI fue calculada mediante la fórmula: volumen máximo AI - volumen mínimo AI / volumen máximo AI x 100. El volumen máximo de la AI fue medido al final de la sístole ventricular izquierda, justo antes de la apertura de la válvula mitral, y el volumen mínimo al final de la diástole ventricular izquierda, justo después del cierre de la válvula mitral11.
El strain longitudinal se midió mediante VVI (velocity vector imaging) tanto a nivel basal, medio y apical solo de la pared lateral, con el fin de valorar un segmento no condicionado por estructuras vecinas y representativo de la función específica de la AI12) (Figura 2). Se comenzó el trazado a nivel del borde endocárdico del anillo mitral y se continuó con el borde endocárdico de la pared lateral hasta la porción apical de la misma, sin tomar en cuenta la porción septo-apical ni septales basal y media31. La variable medida del strain auricular fue el pico sistólico o fase reservoria, que representa la función de expansión de la AI, producida durante la sístole ventricular. Se promediaron el valor basal, medio y apical obtenidos en la pared lateral (Figura 2). Todos los pacientes estuvieron en ritmo sinusal durante la obtención del SLPSAL, con registro del electrocardiograma durante la obtención de los valores ecocardiográficos. La (Tabla 1) resume las variables ecocardiográficas usadas para la evaluación del remodelado reverso auricular, además de recurrencia o no de FA a los 3 y 6 meses.
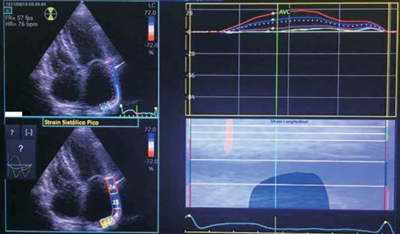
Figura 2: Strain longitudinal en pico sistólico medido a nivel de la pared lateral de la aurícula izquierda (SLPSAL).
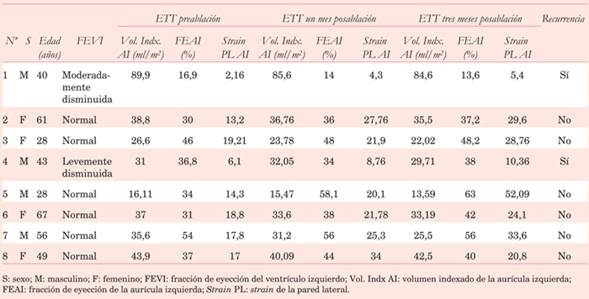
Tabla 1: Resultados de variables ecocardiográficas evaluadas preablación, uno y tres meses posablación. Recurrencia de fibrilación auricular evaluada por síntomas y por Holter
Para determinar la recurrencia de FA, tanto clínica como electrocardiográfica, se realizaron interrogatorios telefónicos y registros de Holter de 24 horas, a los 3 y 6 meses posintervención. La recurrencia de la FA se clasificó en tres tipos: temprana (durante los 3 primeros meses), tardía (entre los 3 y 12 meses) y muy tardía (después de los 12 meses), esta última no valorada13.
Caso 1
Hombre de 40 años, con antecedente de coartación de aorta corregida quirúrgicamente en la adolescencia. FA persistente de larga duración, con disfunción sistólica ventricular presumiblemente de origen taquimiocardiopático (fracción de eyección del ventrículo izquierdo (FEVI): 39%). Control de ritmo con amiodarona. Score CHA2DS2VASc de 1 y HASBLED de 1, anticoagulación con warfarina. Ablación de venas pulmonares sin complicaciones. En el ETT preablación se observó una AI severamente dilatada con función sistólica muy deprimida y SLPSAL severamente afectado. No se evidenció remodelado reverso significativo al mes ni a los tres meses posablación. En el seguimiento presentó recurrencia temprana y tardía de FA, tanto clínica como electrocardiográfica.
Caso 2
Mujer de 61 años, hipertensa, diabética. FA paroxística. Control de ritmo con amiodarona. Score CHA2DS2VASc de 3 y HASBLED de 2, anticoagulación con warfarina. Ablación de venas pulmonares sin complicaciones. En el ETT preablación se observó una auriculomegalia izquierda leve con función sistólica deprimida. Al mes y a los tres meses posablación, si bien no se observó una disminución significativa del volumen biplano de la AI, sí mejoraron la función sistólica y la compliance, en especial el SLPSAL, a más del doble del valor inicial. No se evidenció recurrencia clínica ni electrocardiográfica de FA en el seguimiento.
Caso 3
Mujer de 28 años, sin antecedentes patológicos a destacar. FA paroxística. Control de ritmo con propafenona. Sin anticoagulación debido a score CHA2DS2VASc de 1. Durante el procedimiento presentó FA que no revirtió con la ablación, por lo que se realizó cardioversión eléctrica. En ritmo sinusal se corroboró el aislamiento eléctrico entre venas y AI. Se buscaron posibles focos extrapulmonares de inicio de FA, hallándose actividad eléctrica a nivel de vena cava superior, por lo que se decidió aplicar RF a ese nivel, sin posterior desencadenamiento de FA. Como complicación tuvo taponamiento cardíaco, que se resolvió adecuadamente. En el ETT preablación se observó AI de tamaño normal, con FEAI ligeramente disminuida, y SLPSAL anormal. Al mes y tres meses posablación se observó remodelado reverso tanto estructural como funcional. No se evidenció recurrencia clínica ni electrocardiográfica de FA.
Caso 4
Hombre de 43 años, con antecedente de síndrome de Wolff-Parkinson-White en la niñez con ablación exitosa de vía accesoria. FA persistente de larga duración. Control de ritmo con propafenona. Score CHA2DS2VASc de 0, a pesar de lo cual se encontraba anticoagulado con warfarina y HASBLED de 0. Ablación de venas pulmonares sin complicaciones. En el ETT preablación se observó AI de tamaño normal con función sistólica y compliance deprimida, revelando un SLPSAL muy bajo. No se evidenció remodelado reverso significativo al mes ni a los tres meses posablación. En el seguimiento presentó recurrencia temprana de FA, tanto clínica como electrocardiográfica.
Caso 5
Hombre de 28 años, con antecedentes de válvula aórtica bicúspide, realiza actividad física moderada. FA paroxística. Sin control de ritmo. Score CHA2DS2VASc de 0 y HASBLED de 0, sin anticoagulación oral. Ablación de venas pulmonares sin complicaciones. En el ETT preablación se observó una AI pequeña con función sistólica disminuida. En el ETT al mes de la ablación, se normalizó la FEAI con mejoramiento del strain longitudinal, sin llegar a la normalidad. A los tres meses posablación tanto la FEAI como el SLPSAL alcanzaron valores normales. No se evidenció recurrencia clínica ni electrocardiográfica de FA.
Caso 6
Mujer de 67 años, con antecedentes de hipertensión arterial e hipotiroidismo. FA paroxística. Control de ritmo con amiodarona. Score CHA2DS2VASc de 3 y HASBLED de 2, anticoagulación oral con warfarina. Ablación de venas pulmonares sin complicaciones. En el ETT preablación se observó una auriculomegalia izquierda leve con función sistodiastólica alterada. En la evolución presentó remodelado reverso anatómico y funcional. No se evidenció recurrencia clínica ni electrocardiográfica de FA.
Caso 7
Hombre de 56 años, sin antecedentes patológicos a destacar. FA paroxística. Control de ritmo con propafenona. Score CHA2DS2VASc de 0 y HASBLED de 0, anticoagulación oral con rivaroxabán. Ablación de venas pulmonares sin complicaciones. En el ETT preablación se observó una AI levemente dilatada con FEAI normal y función diastólica por SLPSAL disminuida. En el ETT al mes de la ablación, el volumen disminuyó a valores normales y se objetivó leve mejoría del SLPSAL. A los tres meses posablación el volumen de la AI se mantuvo normal, con mejoría considerable del SLPSAL. No se evidenció recurrencia clínica ni electrocardiográfica de FA.
Caso 8
Mujer de 49 años, con antecedentes de hipertensión arterial. FA paroxística. Control de ritmo con propafenona. Score CHA2DS2VASc de 2 y HASBLED de 1, anticoagulación con warfarina. Como complicación de la ablación presentó sangrado del acceso venoso, que evolucionó favorablemente. En cuanto al ETT, llamó la atención la mejoría a nivel estructural y funcional que presentó al mes de la ablación; sin embargo, en el control de los tres meses nuevamente se evidenció un remodelado negativo comparado con el anterior, a pesar del cual no tuvo recurrencia clínica ni electrocardiográfica de FA en el seguimiento.
La (Tabla 1) resume los principales hallazgos clínicos y ecocardiográficos iniciales y evolutivos posablación.
Discusión
Como se evidencia en los casos descritos, la FA es una arritmia compleja que puede afectar a cualquier grupo de personas: jóvenes, gerontes, pacientes sin comorbilidades, hasta aquellos con múltiples enfermedades y factores de riesgo; sin embargo, todos los pacientes presentados en esta serie tienen en común la presencia de remodelado estructural de la AI de cualquier grado, detectado especialmente con el strain longitudinal en pico sistólico.
Son muchos los pacientes portadores de FA sintomática que ameritan una estrategia intervencionista. Cuanto mayor es el tiempo de evolución de la FA, más difícil es su control14. La FA lleva a más FA, esta se perpetúa en el tiempo y produce un remodelado tanto estructural como eléctrico en la AI. El remodelado estructural se expresa como alteración en la compliance, dilatación y disminución de la contractilidad auricular15. El remodelado eléctrico produce disminución de la conducción, potencial de acción, período refractario, longitud de ciclo y aumento del automatismo, además de heterogeneidad y anomalías en el manejo del calcio celular16.
Además del control del ritmo, otro objetivo de la ablación de las venas pulmonares, es frenar y eventualmente revertir estos cambios patológicos, proceso denominado: remodelado reverso. Este fue demostrado hace años, cuando se observó que con la restauración del ritmo sinusal luego de la cardioversión, mejoraba la AI tanto estructural como funcionalmente17. Sin embargo, hay poca evidencia sobre el remodelado posterior a la ablación con RF de las venas pulmonares y del papel de este remodelado como predictor de recurrencia.
El volumen auricular izquierdo ha sido la variable más estudiada, demostrándose que más que el diámetro es el volumen basal un predictor confiable de recurrencia18, y más aún si es indexado a la superficie corporal19. Una AI muy dilatada es compatible con una cámara cardíaca muy remodelada estructural y funcionalmente, planteándose que serán los casos con más recurrencias20. Varios autores han demostrado, mediante diferentes métodos de imagen, el remodelado reverso que sufre la AI posterior a la ablación21-23. La Meir y colaboradores consideran el remodelado reverso una disminución del volumen de 15% o más24. Menos claro está el hecho de si este remodelado reverso es un predictor de recurrencia de la FA. Sotomi y colaboradores demostraron que el remodelado estructural persistente de la AI, después de una inicialmente exitosa ablación de venas pulmonares, puede ser un importante factor de riesgo para la recurrencia muy tardía de FA no paroxística13. No existe evidencia sólida sobre este fenómeno en la FA paroxística. En los casos descritos se puede evidenciar que los cuatro pacientes (casos 3, 5, 6 y 7) que presentaron disminución significativa (>15%) del volumen de AI, no presentaron recurrencia de FA, mientras que en los casos en los que hubo recurrencia, el volumen auricular izquierdo no tuvo cambios significativos en la evolución.
La otra variable estudiada es la FEAI, igualmente con escasa evidencia al respecto. El mejoramiento en la FEAI es inversamente proporcional al volumen de AI, dependiente de este último para su cálculo13. Se ha descrito que la FEAI ajustada al volumen auricular izquierdo es una herramienta adecuada para predecir recurrencia25. En los casos descritos, en que recurrió la FA, la FEAI no se modificó en la evolución. Sin embargo, en términos generales, fue una variable muy cambiante de un caso a otro, sin una relación clara con el remodelado reverso y la recurrencia de FA.
El SLPSAL obtenido en vista apical de 4 cámaras es una medida de deformación auricular inversamente proporcional a la presión auricular26. El valor en pico sistólico corresponde a la sístole ventricular compatible con la fase de reservorio auricular (fase reservorio)27. La alteración de este valor demuestra una anomalía en el llenado auricular que refleja indirectamente alto contenido fibrótico15. Valores pico menores a 30% indican afectación significativa28. Sílvia Montserrat y colaboradores compararon el strain longitudinal y el strain rate auricular durante la sístole y diástole ventriculares, y observaron que el strain longitudinal durante la sístole fue un predictor independiente de supresión de FA después de una primera y segunda ablación por RF29.
En esta serie de casos los valores de strain en fase reservorio fueron obtenidos únicamente en vista apical de 4 cámaras, que, como lo demuestra un metaanálisis recientemente publicado, es adecuada siempre y cuando sea óptima32. Kuppahally y colaboradores demostraron que la fibrosis de la AI valorada por resonancia magnética tuvo correlación significativa con el strain en pico sistólico30. Si bien se ha demostrado, aunque con escasa evidencia, la existencia de remodelado reverso de la AI medido a través del strain, a partir del tercer mes posablación, no existe certeza sobre el momento exacto en que comienza a remodelarse reversamente la AI15,24. Se podría plantear entonces que el remodelado comienza mucho antes, y que estos cambios sutiles podrían ser detectados mediante el uso de SLPSAL. Tampoco existe evidencia sobre si este remodelado reverso precoz sería un predictor de recurrencia de FA a largo plazo. En la serie presentada, el SLPSAL mejoró de manera evidente en los que no recurrió la FA, a diferencia de los que sí presentaron recurrencia, en quienes no hubo cambios significativos en esta variable. El remodelado reverso por strain fue observado de forma tan precoz como un mes después de la ablación de las venas pulmonares, planteando la posibilidad de que este fenómeno ocurra en forma temprana. Los dos casos en quienes recurrió FA tuvieron un SLPSAL muy bajo (< 10), sugiriendo que una gran carga fibrótica preablación se puede relacionar con recurrencia.
De las tres variables ecocardiográficas estudiadas en esta serie, el SLPSAL es el que identificó remodelado reverso en mayor grado, debido posiblemente a la detección de cambios más sutiles; surgiendo, entonces, como una técnica factible que al igual que la resonancia magnética, aunque de forma indirecta, puede detectar fibrosis auricular. Además, se observó una relación directa entre el remodelado reverso estructural - funcional y la no recurrencia de FA.
Es importante destacar el hecho de que los dos pacientes de esta serie en los que recurrió la FA posablación tuvieron FA persistente de larga duración previo al procedimiento, hecho que como se observa en la tabla 1 podría relacionarse con el SLPSAL más que con el volumen de la AI o con la FEAI. El caso 4, a pesar de presentar un volumen auricular normal, tenía un SLPSAL muy deteriorado concordante con FA de larga data y probablemente con alta carga fibrótica.
Conclusión
En esta serie de casos se evidenció remodelado reverso estructural y funcional de la AI en la mayoría de los pacientes. En algunos, este remodelado reverso se evidenció tan precozmente como al mes posterior a la ablación, lo que fue demostrado por el SLPSAL. Los pacientes con recurrencia de FA no presentaron remodelado reverso y mostraron mayor deterioro de la función auricular previo a la ablación. Estos hallazgos permiten plantearnos algunas hipótesis a investigar sobre los predictores de recurrencia.














