Introducción
El strain de la aurícula izquierda (SAI) estimado por ecocardiografía bidimensional con speckle tracking ha adquirido importancia como parte de la evaluación de la función diastólica y estimación de las presiones de llenado del ventrículo izquierdo (VI), así como también en la predicción de eventos adversos en varias patologías, como insuficiencia cardíaca, fibrilación auricular (FA) e infarto agudo de miocardio (IAM)1-24.
La aurícula izquierda (AI) contribuye a la hemodinamia cardíaca, modulando el llenado del VI a través de la interacción de la función de reservorio, conducción y fuerza contráctil. La función de reservorio se corresponde con la contracción isovolumétrica del VI, su eyección y relajación isovolumétrica. Esta depende de la función sistólica del VI, el tamaño de la aurícula y su complacencia. La función de conducción se corresponde con la fase temprana de llenado ventricular y es modulada por la complacencia auricular y la relajación del VI. Por último, la función contráctil depende del retorno venoso pulmonar (precarga auricular), de la presión ventricular de fin de diástole (poscarga auricular) y de la reserva contráctil de la aurícula15,16,19,20.
El SAI es un parámetro de función auricular no volumétrico, es decir evalúa su función como bomba muscular, siendo muy importante la deformación del tejido auricular y el sentido en el que se realiza. A través del strain auricular longitudinal se pueden medir las funciones de reservorio, de conducción y de bomba, que se correlacionan inversamente con el grado de fibrosis estimado por resonancia nuclear magnética con realce tardío de gadolino. Un valor de strain bajo nos orienta hacia una aurícula fibrosa, no complaciente y con disminución de su capacidad contráctil24.
Sin embargo, en las últimas guías publicadas por la American Society of Echocardiography (ASE) y la European Association of Cardiovascular Imaging (EACVI) para la evaluación diastólica25 y la cuantificación de función y tamaño de las cámaras26 la estimación del strain auricular no ha sido incluida. La necesidad de una estandarización de la metodología, adquisición de mayor experiencia por los operadores, más estudios de reproducibilidad y de un software específico de strain auricular, son los fundamentos propuestos20,23-25,27-29.
Descripción del protocolo
La población estudiada estuvo constituida por habitantes adultos de Montevideo, del Complejo Juana de América y alrededores y del barrio Bella Italia, reclutados en el contexto del estudio GEnotipo Fenotipo y Ambiente de la HiperTensión arterial en el UruguaY (GEFA-HT-UY)30. Contamos con 538 participantes que realizaron la fase inicial del estudio y actualmente se está desarrollando la fase de seguimiento. La evaluación ecocardiográfica forma parte de esta cohorte desde fines del 2016.
Se utilizó un ecógrafo Vivid i (GE® Healthcare), transductor transtorácico de 3-5 MHz. Las imágenes adquiridas fueron analizadas en la estación de trabajo ECHOPAC, versión 110 (GE®), en la Unidad de Hipertensión Arterial del Hospital de Clínicas.
Para la medición del strain longitudinal auricular se obtuvieron vistas apicales de 2,3 y 4 cámaras, con un frame rate entre 50 y 90 fps intentando obtener las tres ventanas con un frame rate similar (idealmente un valor absoluto hasta 10 unidades menor respecto a la frecuencia cardíaca). La adquisición de la imagen se realizó sin zoom auricular (Figura 1A). Se elaboró un modelo tipo “ojo de buey” de la AI, la cual se dividió en 18 segmentos (Figura 2).
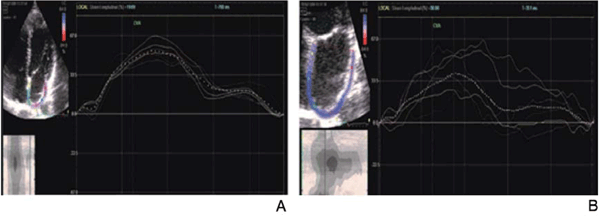
Figura 1: A) Ilustración del registro de strain auricular obtenido a partir de una vista de 4 cámaras sin zoom. A la izquierda se observa el seguimiento parietal por parte del software sobre la pared auricular de acuerdo con la etapa del ciclo cardíaco. A la derecha se observa el registro de strain auricular. Cada línea de color representa la deformación de cada sector de la pared auricular. La línea punteada refleja la deformación global de la aurícula acorde a la etapa del ciclo cardíaco. B) A la izquierda se observa el seguimiento parietal (trazado azul) del movimiento auricular de acuerdo con la etapa del ciclo cardíaco. A la derecha se ilustra el registro de strain auricular, obsérvese el constante movimiento ondulante y asincrónico de todas sus paredes.
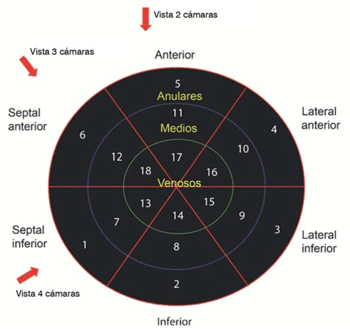
Figura 2: Se ilustra el “ojo de buey” de la aurícula izquierda, donde se divide en 18 segmentos, seis por cada vista apical.
La región de interés se trazó punto a punto, delineando el borde endocárdico auricular, desde la unión de la pared auricular con el anillo mitral hasta la unión de la pared auricular con el anillo mitral contralateral, no incluyendo en la región de interés dicho anillo, como tampoco las venas pulmonares ni la orejuela.
Se estableció el ancho de muestreo (ancho de ROI) como el mínimo ofrecido por el software, dada la poca variación del espesor de la pared auricular durante el ciclo cardíaco y durante los estados patológicos. Luego, el mismo software divide a la pared auricular en seis segmentos equidistantes para cada vista apical (Figura 3).
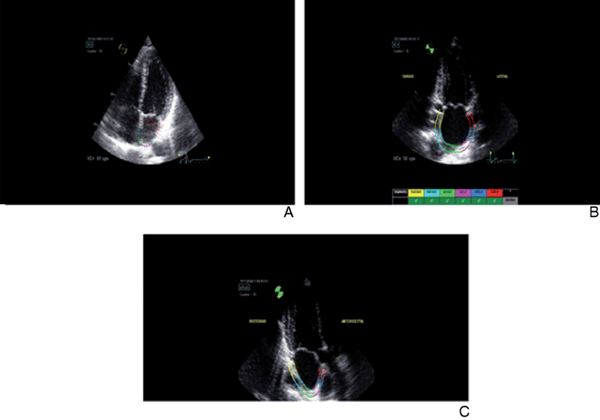
Figura 3: A) Trazado en vista de 4 cámaras, nótese la no inclusión del anillo mitral dentro de la región de interés. El ancho de la región de interés siempre será el mínimo propuesto por el software. B) Trazado en vista de 2 cámaras, donde el software divide a la aurícula izquierda en seis segmentos equidistantes. Nótese en los segmentos anulares (rojo y amarillo) la pequeña curvatura hacia la luz auricular de la región de interés para mejorar la calidad de seguimiento por el software. C) Trazado de la región de interés en vista de 3 cámaras, nótese la no inclusión de la pared inferior de la aorta dentro de dicha región.
A continuación, se realizó el seguimiento automático del área de interés y se calificó automáticamente en aprobado o no aprobado. Para la realización de nuestro protocolo se desestimó la aprobación automática del seguimiento y se priorizó el juicio del observador (Figura 4 A y B).
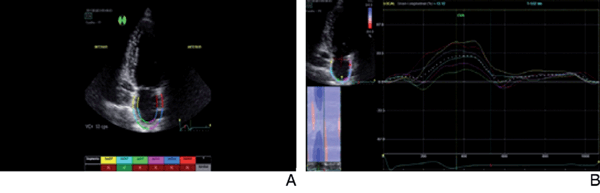
Figura 4: A) Ilustración del seguimiento de strain donde se define la región de interés desde el borde endocárdico, adecuando el ancho de la región de interés al mínimo disponible del software. Nótese la no inclusión del anillo mitral dentro de la región de interés. Un aspecto importante es que el software aprueba solamente un segmento de los seis evaluados, pero se observa un seguimiento armónico y continuo por parte del trazado (figura 4B) de todas las fases de la función auricular. B) Ilustración del registro de strain auricular luego de proceder a pesar de que el software no aprobó la mayoría de los segmentos. Obsérvese el correcto registro y la sincronía del movimiento de todos los segmentos auriculares acorde a cada fase auricular.
En cuanto al punto de comienzo del trazado de strain auricular se consideró la onda R del electrocardiograma (ECG) (Figura 5).
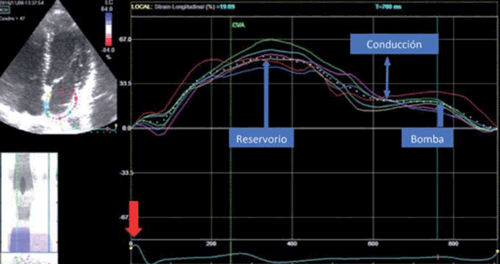
Figura 5: Trazado de strain auricular gatillado por onda R (flecha roja). Cada línea de colores denota la deformación de cada segmento de la pared auricular durante las diferentes fases. La línea punteada representa los promedios de los seis segmentos evaluados en una vista apical de 4 cámaras. Se obtienen dos picos positivos, el primero corresponde a la fase de reservorio, el segundo a la función de bomba auricular y la resta entre ambos picos a la función de conducción. No tomar en cuenta el cierre valvular aórtico para medir la función de reservorio.
Posteriormente el programa ilustró el gráfico de curvas donde en el eje de las X se presenta el tiempo y en el eje de las Y la medida de strain en valores porcentuales. Cuando las curvas de strain son gatilladas por el comienzo del QRS, todos los valores de strain son positivos y hay dos picos, el primero de los cuales se corresponde con la función de reservorio (Figura 5).
Se presentan entonces, por cada vista, seis curvas correspondientes a cada uno de los seis segmentos y una punteada que corresponde al promedio de todos los segmentos. En el primer pico de esta última, comprendido entre las ondas R y T del ECG (previo a la apertura de la válvula mitral), se encuentra el promedio de la función de reservorio de dicha vista. El segundo pico corresponde a la función de bomba y se encuentra inmediatamente después de la onda P del ECG. La diferencia entre el primer pico (función de reservorio) y el segundo (función de bomba) corresponde a la función de conducción auricular (Figura 5).
Para este protocolo se tomó solo el pico promedio de la función reservorio para cada vista (2, 3 y 4) y el pico reservorio de cada segmento de las paredes auriculares (18 segmentos). El valor de SAI global fue producto del promedio del global de reservorio de cada cámara.
Criterios de exclusión del protocolo
1. No incluir en la imagen la presencia completa de la AI en alguna de las vistas apicales.
2. Mala definición de la pared auricular.
3. Mal seguimiento y trazado del registro de strain en sus tres fases en alguna de las vistas apicales, a criterio del ojo del observador.
4. Imágenes con zoom auricular.
Discusión del protocolo
Se desaconseja la adquisición de imágenes auriculares con zoom. Nuestra experiencia de trabajo nos ha mostrado escaso seguimiento de la excursión parietal auricular por el software y adquisición de malos trazados de strain cuando se adquieren con zoom (Figura 1B).
En cuanto al seguimiento endocárdico, nos enfrentamos al punto más controvertido del procedimiento: definir si es adecuado o no. El software con el que contamos fue fabricado para evaluar y seguir el movimiento del VI, pero muchas veces no reconoce en forma automática la correcta excursión parietal auricular. En nuestra experiencia no hubo mejor observador ni evaluador que el propio ojo del operador. Este es quien debe definir si el seguimiento fue adecuado, y no el software. En primera instancia, el observador debe prestar atención a que el área de interés preestablecida se mueva sincrónica y armónicamente con las paredes auriculares. En segunda instancia, debe observar el trazado con las curvas de strain que identifican las tres fases de función auricular en cada línea que representa la deformación del sector auricular. Aunque es de conocimiento, en estados patológicos tales como FA, disincronía auricular, aneurisma interatrial o comunicación interauricular, estas tres fases no siempre se cumplen. Cabe mencionar que la priorización del ojo del observador no es privativa de nuestro equipo de trabajo. En el EACVI NORRE study31, estudio multicéntrico de la Sociedad Europea de Cardiología (ESC) y en un documento reciente publicado en 2018 por el grupo de trabajo de EACVI/ASE27 , se enfatizó en la importancia de este criterio (Figura 4B).
Gatillado del trazado: también existe controversia sobre si comenzar el trazado de SAI gatillado por la onda P del ECG o por la onda R. En la revisión y metaanálisis19 de Pathan y colaboradores, de los 40 estudios incluidos, 37 fueron gatillados por onda R. A su vez, en el EACVI NORRE study se utilizó la onda R como gatillo para el trazado de strain. Nuestro grupo de trabajo adhiere a la posición de comienzo del trazado por la onda R, ya que existe mayor evidencia disponible, permite estandarizar las medidas para toda la población y el análisis de pacientes que no se encuentren en ritmo sinusal.
Otro aspecto no estandarizado es qué vistas deben incluirse para el análisis: si solo 4 cámaras, si 2 y 4 cámaras o 2, 3 y 4 cámaras. En la revisión y metaanálisis mencionado19, 19 trabajos evaluaron el strain auricular solo en la vista de 4 cámaras, 17 en las vistas de 2 y 4, y solo cuatro estudios en la vista de 2, 3 y 4 cámaras, sin encontrar diferencias significativas en los valores de strain longitudinal de la AI. En el EACVI NORRE study31 se incluyeron las vistas 2 y 4 cámaras. En el documento de posición sobre strain auricular, publicado en 2018 por el grupo de trabajo de EACVI/ASE27, recomiendan la medición de SAI solamente por 4 cámaras, tomando como opción válida incluir también en el análisis la vista de 2 cámaras. En cuanto a la vista apical de 3 cámaras, fundamentan que puede ser dificultoso discernir entre la aorta ascendente y la pared anteroseptal auricular, lo que puede alterar la medición y los valores de strain.
En el presente protocolo se priorizó el análisis completo de la AI, considerando las tres vistas apicales, para obtener el valor global de SAI, como se realiza para el strain del VI.
Valores normales de SAI reportados por la bibliografía
Actualmente existen tres grandes trabajos que describen valores de SAI en la población normal.
La revisión sistemática y metaanálisis del año 201619, referido en el párrafo anterior, informa una media de 39,4% (con un intervalo de confianza de 95%, 38%-40,8%) para la función de reservorio. De los 40 estudios incluidos, 34 fueron realizados con la estación de trabajo Echo-Pac GE®.
The EACVI NORRE study31 describió una media de 42,5% (± 6,4) para población global, brindando también valores de acuerdo a rangos etarios. En cuanto a la metodología de trabajo, los trazados fueron gatillados por onda R y los promedios globales de SAI se obtuvieron de las vistas de 2 y 4 cámaras.
Por último, el estudio multicéntrico de Morris y colaboradores32 del año 2015, describe una media de 45,5% (±11,4), sin establecer diferencias en cuanto a etnia, pero sí en cuanto a rango etario. En cuanto a la metodología de trabajo, se utilizó para la adquisición de imágenes el dispositivo de ultrasonido Vivid 7 GE® y para el análisis la estación de trabajo Echo-Pac versión 113 de GE®. El trazado de strain fue gatillado por la onda R. Los valores globales de SAI se obtuvieron del promedio de las vistas de 2 y 4 cámaras.
Conclusiones
Hemos desarrollado un protocolo de medición de SAI “paso a paso” con el fin de incentivar y familiarizar al ecocardiografista con este método. Se describe en forma detallada cómo se realiza la medición del SAI y se contrasta con la evidencia actual disponible. Los autores se proponen evaluar su reproducibilidad tanto global como segmentaria e informar en un futuro valores normales de strain auricular en población sana uruguaya y contrastarlos con los valores propuestos por la mayor evidencia actual19,31,32).
Protocolo “paso a paso”
1. Visualizar la AI en su totalidad en vistas 2, 3 y 4 cámaras, sin zoom, con un frame rate de 10 por debajo de la frecuencia cardíaca del paciente. Es indispensable la monitorización ECG concomitante.
2. Trazar la región de interés, sin incluir el anillo mitral, las venas pulmonares ni la orejuela, con mínimo ancho de ROI.
3. El juicio del observador será el que prime sobre el software en la evaluación del seguimiento de las paredes auriculares.
4. Con el trazado gatillado por onda R, se deben tomar los picos de cada fase.
5. Se deben promediar los valores globales de cada vista.
6. El análisis segmentario tipo “ojo de buey” será opcional.
TIPS para la medición
- En algunas ocasiones, cuando el seguimiento de la pared auricular por medio del software o las curvas de strain obtenidas son asincrónicas, realizar nuevamente el trazado o corregir el área de interés puede optimizar el registro.
- Muchas veces el seguimiento de la pared auricular mejora reestructurando la región de interés, un poco más por dentro del endocardio o con una pequeña muesca hacia la luz auricular de los segmentos que están adyacentes al anillo mitral.
- Por último, en la vista de 3 cámaras es necesario no incluir la pared aórtica en el trazado para obtener valores fieles y un buen registro de strain (Figura 3C).














