Principales aportes
Se presenta una serie de casos de pacientes que desarrollaron disfunción ventricular por trastuzumab como manifestación de cardiotoxicidad. Destacamos la importancia de la evaluación y el seguimiento clínico e imagenológico por un equipo multidisciplinario y la creación de unidades de cardio-oncología que permitan brindar el mejor plan terapéutico a pacientes que recibirán tratamientos potencialmente cardiotóxicos.
Introducción
Las nuevas terapias oncológicas han logrado aumentar la sobrevida de pacientes con cáncer, teniendo sin embargo como consecuencia negativa el incremento del riesgo de eventos cardiovasculares (CV)1. Han sido creadas diversas sociedades de cardio-onco-hematología con el fin de generar recomendaciones de práctica clínica y formar profesionales capacitados para el manejo de las complicaciones CV del tratamiento del cáncer2.
La cardiotoxicidad por quimioterapia se define como el conjunto de enfermedades CV derivadas de los tratamientos oncológicos y su manifestación es variada (disfunción ventricular, insuficiencia cardíaca (IC), isquemia miocárdica, hipertensión arterial, arritmias, etcétera)3-5. La disfunción ventricular por quimioterapia en supervivientes de cáncer tiene importancia por su impacto en la morbilidad y mortalidad6,7.
La disfunción ventricular por trastuzumab (DV- TTZ), modelo de cardiotoxicidad tipo II8, consiste en injuria habitualmente reversible, transitoria y dosis independiente, en contraposición con el modelo de cardiotoxicidad dosis dependiente y frecuentemente irreversible generado por los antracíclicos9. Existen factores que aumentan el riesgo de disfunción ventricular durante el tratamiento del cáncer, dentro de los que se destacan la combinación de fármacos de alto riesgo (antraciclinas, ciclofosfamida y trastuzumab), uso concomitante de radioterapia torácica, cardiopatía isquémica, fracción de eyección del ventrículo izquierdo (FEVI) basal descendida e historia previa de cardiotoxicidad5,10-12.
El TTZ es un anticuerpo monoclonal humanizado dirigido contra el dominio extracelular del receptor del factor de crecimiento epidérmico humano tipo 2 (HER2/ErbB2). En pacientes con cáncer de mama, la sobreexpresión de dicho receptor está asociada con peor pronóstico, mayor agresividad y tasa de recurrencia13. El TTZ actúa generando una disrupción en las vías de activación intracelular críticas para el crecimiento celular14, generando un beneficio en la sobrevida de pacientes con cáncer de mama HER2 positivo(15,16). Estos receptores (ErbB2/ ErbB4) también se expresan en los cardiomiocitos y su activación mediante la vía de la neuregulina-1 (NRG-1) juega un rol protector contra el estrés miocárdico17. La acción del TTZ podría interferir con esta vía cardioprotectora y resultar en cardiotoxicidad18.
Se define la disfunción ventricular por quimioterapia como la reducción relativa de la FEVI >10% respecto a la basal, con FEVI final <53% (límite de la normalidad) en concordancia con las guías de la Sociedad Americana de Ecocardiografía y la Asociación Europea de Imagen Cardiovascular (cuantificación de cámaras cardíacas)19 y con el documento de consenso español de cardio-onco-hematología20. El límite inferior a la normalidad es definido por la Sociedad Europea de Cardiología como FEVI < 50 %5; sin embargo, valores de FEVI en el límite normal-bajo representan un factor de riesgo para el desarrollo de disfunción sistólica por TTZ11 y por antracíclicos10, por lo cual se considerará el punto de corte de 53% como límite inferior de la normalidad.
La detección precoz de DV-TTZ mediante ecocardiograma transtorácico (ETT) permite la modificación oportuna de esquemas terapéuticos y el inicio de fármacos cardioprotectores. Es el objetivo de esta serie de casos describir las características de la cardiotoxicidad por TTZ manifestada como DV-TTZ, evaluada por ETT y su evolución frente a la suspensión del tratamiento e inicio de fármacos cardioprotectores.
Material y métodos
Estudio observacional, retrospectivo. Se seleccionaron pacientes que iniciaron tratamiento con TTZ entre los años 2014 y 2017 y que cumplieron con los criterios de inclusión: indicación de TTZ por cáncer de mama (pauta de tratamiento definida por el oncólogo tratante), al menos cinco ETT consecutivos (uno de ellos previo al inicio del tratamiento) y que cumplieran criterios de DV-TTZ definida como la reducción relativa de la FEVI >10% respecto a la basal, con FEVI final <53%. En estas pacientes el tratamiento con TTZ fue suspendido transitoriamente y se inició tratamiento con carvedilol y enalapril (losartán en caso de intolerancia) a dosis recomendadas. Luego de la normalización de la FEVI (>53%), se reinstaló el tratamiento con TTZ continuando los controles clínicos e imagenológicos pautados, manteniendo el tratamiento cardioprotector. Las variables consideradas fueron: edad, estadio de la enfermedad, factores de riesgo CV (hipertensión arterial, tabaquismo, extabaquismo, dislipemia, diabetes), número de ciclos de TTZ, uso concomitante de otros fármacos cardiotóxicos y FEVI. Se calculó la FEVI mediante método de Simpson. Las variables numéricas se expresan como mediana y rango. Esta serie de casos forma parte de un proyecto llevado a cabo por la Unidad de Cardio-Oncología del Hospital de Clínicas y fue aprobado por el Comité de Ética del hospital.
Resultados
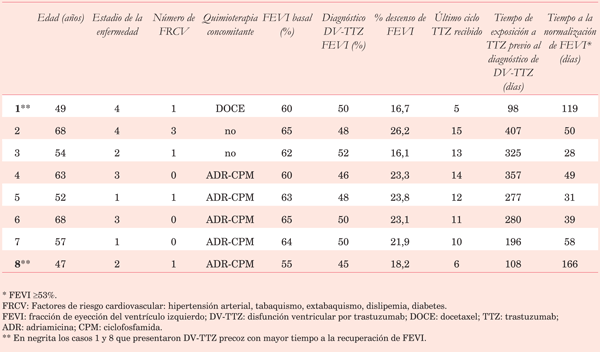
Cumplieron criterios de inclusión ocho de las 43 pacientes en riesgo de DV-TTZ (Tabla 1). Todas las pacientes se mantuvieron asintomáticas en la esfera CV. La mediana de edad fue de 55,5 años (47,0-68,0); las pacientes se encontraban en estadio I a IV de la enfermedad; se encontraron factores de riesgo CV en cinco pacientes: hipertensión arterial, extabaquismo y dislipemia; cinco pacientes recibieron tratamiento concomitante con fármacos de alto riesgo (adriamicina y ciclofosfamida) y una con un fármaco de moderado riesgo de cardiotoxicidad (docetaxel).
La mediana de FEVI basal fue 63% (55-65), la FEVI al momento del diagnóstico de DV-TTZ fue 49% (45-52) y el porcentaje de descenso relativo de FEVI fue 22,5% (16,1-26,2). Todas las pacientes suspendieron transitoriamente el tratamiento con TTZ e iniciaron enalapril (losartán si hubo intolerancia) y carvedilol a dosis indicadas por las recomendaciones internacionales. La normalización de la FEVI ocurrió en todos los casos. El tiempo entre el diagnóstico de DV-TTZ y la normalización de la FEVI tuvo una mediana de 49,5 días (28-166).
El tiempo de exposición a TTZ (hasta la última dosis recibida previo al diagnóstico de DV-TTZ) tuvo una mediana de 278,5 días (98-407). La DV-TTZ se manifestó precozmente en dos pacientes (ciclos 5 y 6 TTZ) y en el resto entre los ciclos 10 y 15. Las pacientes con manifestación precoz fueron las más jóvenes de la serie (49 y 47 años) y demoraron más tiempo en normalizar la FEVI (119 y 166 días respectivamente). Luego de la normalización de la FEVI se reinstaló el tratamiento con TTZ manteniendo la administración de fármacos cardioprotectores. En esta serie de casos todas las pacientes pudieron continuar el tratamiento con TTZ sin haber presentado nuevo descenso de la FEVI, manteniendo el tratamiento cardioprotector.
Discusión
Existe evidencia internacional sobre el efecto cardiotóxico de TTZ utilizado en el tratamiento del cáncer de mama y su carácter habitualmente reversible con la suspensión del tratamiento11. En Uruguay, contamos con un solo trabajo de cardiotoxicidad por TTZ, publicado en 2015 por Camejo y colaboradores21, que reporta 27% de toxicidad cardíaca.
En esta serie de casos, reportamos el seguimiento de un grupo de pacientes que desarrollaron DV-TTZ y que representa un trabajo inicial de la Unidad de Cardio-Oncología del Hospital de Clínicas. Es importante destacar la importancia de la evaluación y seguimiento por un equipo multidisciplinario y la creación de unidades de cardio-oncología que permitan brindar el mejor plan terapéutico a pacientes que recibirán tratamientos potencialmente cardiotóxicos5,22,23.
Las limitaciones de este estudio son inherentes a toda serie de casos, los resultados son descriptivos y no podemos afirmar asociación entre variables. Si bien contamos con la información sobre la presencia de factores que aumentan el riesgo de desarrollar DV-TTZ, como ser el uso de radioterapia en hemitórax izquierdo y el tratamiento combinado con adriamicina-ciclofosfamida (riesgo alto) y/o docetaxel (riesgo moderado), no es posible evaluar su asociación con el desarrollo de DV-TTZ. Tampoco contamos con información complementaria, como ser cuantificación de biomarcadores (troponinas), ni evaluación con técnicas de imagen adicionales, como el strain longitudinal global. De todas formas, consideramos que brinda información nacional y estimula la realización de estudios de mayor magnitud.
Con respecto al hallazgo de un comportamiento “diferencial” frente al TTZ, con disfunción ventricular más precoz y mayor retardo en la normalización de la FEVI, no existen reportes internacionales en ese sentido. Estudios prospectivos con mayor número de pacientes permitirán evaluar si este hallazgo es reproducible y analizar los factores asociados.
Es importante destacar que en todas las pacientes la disfunción ventricular fue reversible al suspender el tratamiento, pudiendo reiniciar TTZ luego de la normalización de la FEVI (manteniendo fármacos cardioprotectores). Hay escasa información sobre cuánto tiempo de exposición a TTZ es necesario para generar disfunción ventricular, así como también cuánto tiempo se requiere para la normalización de la FEVI. Según el reporte de Moilanen y colaboradores24, en la mayoría de los casos la disfunción ventricular fue detectada en los primeros seis meses de tratamiento y la normalización de la FEVI se observó en 62,5%. En el estudio de Camejo y colaboradores21, la mediana de tiempo a la aparición de cardiotoxicidad fue de nueve meses, en concordancia con la mediana de tiempo de exposición observada en esta serie de casos (278,5 días o 9,2 meses).
El diagnóstico de disfunción ventricular por quimioterápicos se basa principalmente en el descenso de la FEVI, pero existen estrategias complementarias dirigidas a un reconocimiento precoz, previo a la afectación de la FEVI10,19,25. La elevación de troponinas y el descenso del strain longitudinal global (SLG) son marcadores de daño estructural e identifican a un grupo de pacientes con peor pronóstico. La evaluación del SLG tiene un valor predictivo adicional a los parámetros tradicionales (clínicos y FEVI), considerando que su afectación precede al descenso de la FEVI. Un cambio mayor a 15% con respecto al basal es considerado anormal y predictor de progresión a disfunción ventricular y su alteración puede persistir luego de completar el tratamiento12,26-28. En el metaanálisis de Kalam y colaboradores, realizado en pacientes con disfunción ventricular de múltiples causas, el SLG fue superior a la FEVI en la predicción de mortalidad global y eventos cardíacos mayores29. El SLG podría constituirse en una herramienta para guiar el inicio de la terapia cardioprotectora en prevención primaria (en ausencia de descenso de FEVI). Contaremos con mayor evidencia una vez concluido el estudio SUCCOUR, que será el primer trabajo randomizado de SLG en pacientes que reciben cardiotóxicos30.
El tratamiento con quimioterapia coloca a los pacientes en un estadio A de IC y la reducción asintomática de FEVI observada en esta serie de casos puede ser considerada un estadio B de IC (daño estructural en ausencia de síntomas); el tratamiento farmacológico fue iniciado de acuerdo a las recomendaciones de las guías de práctica clínica31,32. La duración del tratamiento luego de la normalización de la FEVI es controvertida, no existiendo pautas claramente definidas actualmente.
Con respecto al uso de fármacos cardioprotectores en prevención primaria, la información proviene mayormente de pacientes que reciben quimioterapia en base a antraciclinas, favoreciendo el tratamiento profiláctico con bloqueantes neurohormonales (betabloqueantes (BB), inhibidores de la enzima convertidora (IECA), y antagonistas del receptor de angiotensina II (ARAII)33-42.
En pacientes con cáncer de mama que reciben TTZ, la utilización de BB e IECA en prevención primaria se ha asociado a disminución del riesgo de IC y disfunción ventricular. El uso continuado de BB en la publicación de Seiceian y colaboradores43, y la combinación BB-IECA, se asocia con un menor riesgo de cardiotoxicidad44,45. En el estudio PRADA, los ARAII también se han asociado con menor descenso en la FEVI46. Sin embargo, existen reportes con resultados contradictorios47,48. La publicación más reciente, CECCY trial48, realizado en pacientes con cáncer de mama HER2-negativo que reciben antraciclinas tuvo una incidencia de cardiotoxicidad de 13,5% a 14,5% y el carvedilol no fue eficaz para prevenir el descenso de la FEVI. Por lo tanto, aún no hay evidencia suficiente para indicar tratamiento farmacológico en prevención primaria de forma sistemática.
Conclusiones
En esta serie de casos observamos dos patrones diferentes de DV-TTZ, uno más precoz y con mayor retardo en la recuperación de la FEVI. La DV-TTZ fue reversible y todas las pacientes pudieron retomar el tratamiento con TTZ. Es intención del grupo de trabajo continuar investigando mediante estudios observacionales de cohorte y estudios clínicos randomizados prospectivos para conocer los factores de riesgo asociados al desarrollo de DV-TTZ, así como posibles medidas de prevención.