Sra. Editora:
Introducción
Las amiloidosis constituyen un grupo de enfermedades causadas por un depósito patológico extracelular de material proteico insoluble denominado amiloide que se acumula hasta producir atrofia y necrosis tisular, pudiendo afectar uno (localizada) o varios órganos (difusa o sistémica). La amiloidosis cardíaca es una entidad poco frecuente y progresiva que resulta en una cardiomiopatía restrictiva produciendo síntomas de falla cardíaca, pero puede ocasionar síncope, arritmias o ser un hallazgo de ecocardiografía como pseudohipertrofia del VI sin causa aparente1. Los dos subtipos más frecuentes de amiloidosis cardíaca son la primaria (amyloid light-chain o AL) y la tipo familiar o senil (trans thyretin-related o ATTR)2. Es esencial identificar el subtipo, ya que difieren en el pronóstico y opciones de tratamiento; la ATTR tiene una sobrevida a dos años de 98%-100%, mientras que la tipo AL está asociada a una mortalidad mayor de 50% a los seis meses3.
A diferencia de otros estudios complementarios como el electrocardiograma (ECG), la ecocardiografía (ECO) y la RM4, la imagen de medicina nuclear (MN) permite diferenciar entre los dos tipos más comunes de amiloidosis sin necesidad de acudir a la biopsia endomiocárdica5.
En el ECG se puede sospechar amiloidosis cuando existen bajos voltajes de nueva aparición, lo cual es más frecuente en el subtipo AL, mientras que en el ATTR se observa en menos de 25% de pacientes. Sin embargo, el hallazgo es de baja sensibilidad y especificidad, pues se evidencia en otras patologías y además no permite diferenciar entre ambos subtipos. Se han propuesto índices para mejorar el desempeño diagnóstico del ECG como el QT corregido > 440 ms y el índice de Sokolow-Lyon ?1,5 mV, pero aún sin lograr diferenciar los subtipos. Puede haber otros hallazgos como bloqueos, arritmias y retraso de conducción intraventricular que sugieren mayor probabilidad de presentar el subtipo ATTR, aunque con baja especificidad6.
En la ECO existe una constelación de hallazgos que sugieren amiloidosis cardíaca, como engrosamiento simétrico de la pared del VI causado por el depósito amiloide, que ocasiona un aspecto granular o patrón de “vidrio esmerilado”. Puede haber, además, engrosamiento de la pared del ventrículo derecho (VD), válvulas, septum interauricular, efusiones pleurales y pericárdicas y otros hallazgos, sin embargo no es posible diferenciar subtipos mediante esta técnica6.
En la RM, debido a la expansión intersticial causada por el depósito de amiloide, la retención de gadolinio (Gd) da lugar a un realce tardío (RT) y un score QALE (Query Amyloid Late Enhancement) elevado. El score QALE es una escala semicuantitativa de RT que asigna hasta 4 puntos al ápex, base, mitad del VI y VD. Un score QALE ³14 tiene sensibilidad de 82% y especificidad de 76% para el diagnóstico de amiloidosis, pero tampoco logra diferenciar con certeza entre los subtipos AL y ATTR7.
En MN han sido utilizados varios radiotrazadores capaces de evaluar diferentes componentes afectados por esta patología a nivel cardíaco: la inervación simpática, la perfusión, el metabolismo o el propio depósito de amiloide8. Los de mayor uso clínico por su bajo costo y alta exactitud para distinguir entre los subtipos AL/ATTR son los radiofármacos comúnmente utilizados para explorar el sistema óseo (difosfonatos marcados con Tecnecio-99m). En forma accidental se ha visto que estos compuestos se depositan en el miocardio de pacientes con amiloidosis cardíaca. Si bien el mecanismo no está suficientemente aclarado, la hipótesis más aceptada es que se debe a la alta concentración de calcio en el amiloide, al cual el fosfato se adsorbe, tal como sucede en el tejido óseo. La mayor concentración de calcio en las fibras del subtipo ATTR determina mayor intensidad de captación y permite dife renciar los dos subtipos9.
Entre los difosfonatos disponibles, el 99mTc- PYP (pirofosfato) es uno de los de mayor eficacia. La interpretación puede ser visual o usando un método semicuantitativo6. Este consiste en determinar un índice corazón (H) / hemitórax contralateral (CL) midiendo la captación en la imagen cardíaca, dividido por la captación en un área simétrica en el hemitórax contralateral10. Si este valor es >1,5 se asocia con una sensibilidad de 97% y especificidad de 100% para amiloidosis tipo ATTR6.
El método visual (escala de Perugini) se realiza asignando los siguientes grados:
Grado 0: ausencia de captación en área cardíaca.
Grado 1: captación leve, menor que el hueso.
Grado 2: captación moderada, igual al hueso.
Grado 3: captación elevada, mayor a la del hueso.
La sensibilidad de un grado 1, 2 o 3 para diagnóstico de subtipo ATTR es >99% con una especificidad de 68%; sin embargo, al considerar solo los grados 2 y 3, la especificidad aumenta a 87% manteniendo una alta sensibilidad de 91%11.
Caso clínico
Paciente masculino de 75 años, sin antecedentes de cardiopatía, hipertenso, dislipidémico e hipotiroideo, con cuadro de disnea progresiva. En el ECG se observa ritmo sinusal de 63 cpm, P y PR normales, con bloqueo completo de rama derecha, hemibloqueo anterior izquierdo y alteraciones difusas de repolarización, sin minivoltajes (Figura 1). El eco Doppler mostró severo engrosamiento del VI, hipocontractilidad global más marcada en pared anterior, fracción de eyección del ventrículo izquierdo (FEVI) de 30% y disfunción diastólica severa, configurando un patrón de miocardiopatía hipertrófica (Figura 2). Con este resultado se realiza RM que informa, en secuencia de RT, imposibilidad de anulación del miocardio con diferentes tiempos de inversión, compatible con la presencia de amiloidosis. Presenta además RT del VD, con QALE score de 12 (Figura 3). Dada la disnea aparentemente desproporcionada, se realiza centellograma de perfusión miocárdica con 99mTc-sestamibi con estrés farmacológico para descartar componente isqué mico, que no demuestra alteraciones de la perfusión y FEVI <50% (Figura 4).
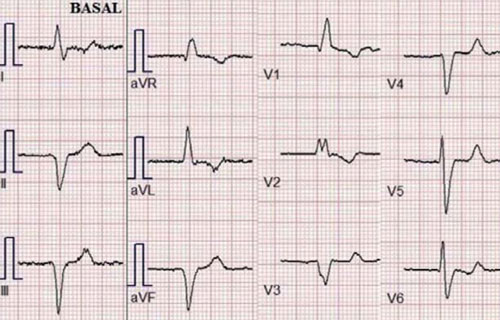
Figura 1: Electrocardiograma basal. Ritmo sinusal, P y PR normales. Bloqueo completo de rama derecha, hemibloqueo anterior izquierdo y alteraciones difusas de la repolarización, aunque sin evidencia de minivoltajes.
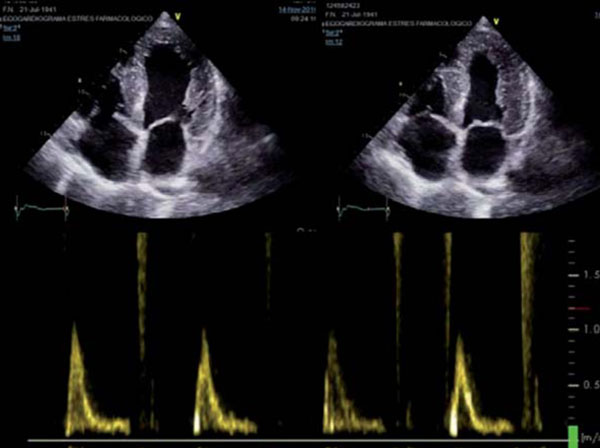
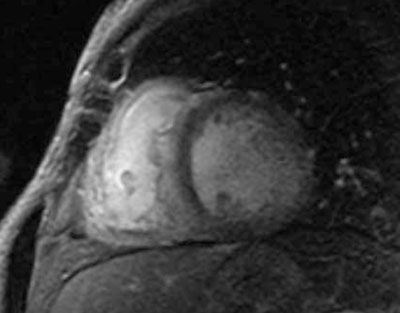
Figura 2: Ecocardiograma con enfoque apical de 4 cámaras en sístole (izquierda) y diástole (derecha) mostrando paredes engrosadas de manera concéntrica y simétrica, con aspecto de “vidrio esmerilado”. Patrón Doppler de tipo restrictivo (abajo), con llenado rápido y corto, onda e prominente y onda a de baja velocidad, ausencia de patada y desaceleración rápida.
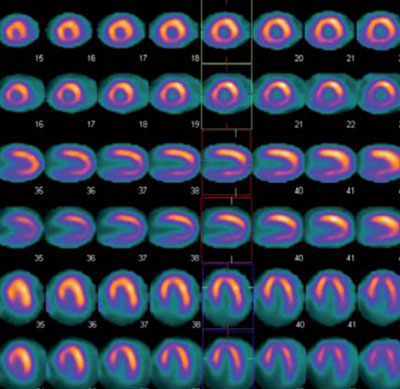
Figura 4: Estudio de perfusión miocárdica con 99mTc-sestamibi, estrés farmacológico con dipiridamol (línea superior) y reposo (línea inferior), el cual no evidencia zonas de hipoperfusión.
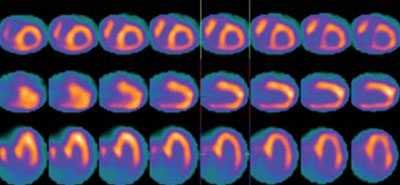
Se completa la evaluación con un centellograma con 99mTc-PYP, incluyendo imágenes planares y SPECT gatillado. Se demostró intensa captación difusa del radiotrazador en todo el miocardio, con grado 3 de Perugini (Figura 5) e índice H/CL de 1,84 (Figura 6). Las imágenes de SPECT evidenciaron, además, clara visualización del VD (Figura 7) y permitieron valorar la función ventricular, con resultados similares a los del estudio de perfusión miocárdica. Según la literatura, los hallazgos son patognomónicos de amiloidosis subtipo ATTR.
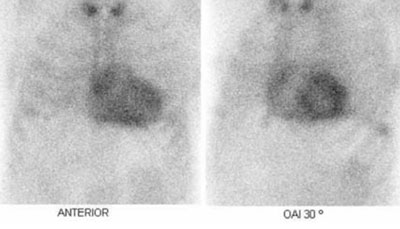
Figura 5: Imágenes planares con 99mTc-PYP en proyecciones anterior y oblicua anterior izquierda (OAI) 30º, mostrando captación cardíaca intensa y difusa, grado 3 en escala de Perugini (intensidad mayor que la del hueso).
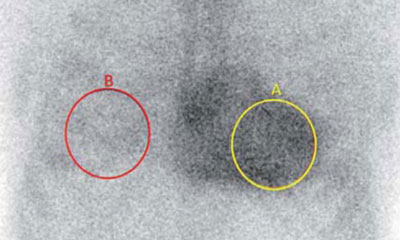
Figura 6: Método semicuantitativo sobre imagen planar en proyección anterior (cuentas en A=75.554, cuentas en B=41.134, relación H/CL=1,84).
Discusión
El centellograma cardíaco con difosfonatos es un estudio de imagen molecular ampliamente disponible en un servicio estándar de MN, económico, y con gran poder para el diagnóstico de amiloidosis cardíaca y diferenciación de subtipos AL y ATTR. Actualmente el patrón oro para el diagnóstico es la biopsia miocárdica con tinción rojo Congo y la inmunohistoquímica en grasa abdominal y de mucosas. Sin embargo, la imagen con difosfonatos brinda una herramienta no invasiva para reemplazar la biopsia y los riesgos que esta conlleva.
En este reporte de caso se presenta un paciente con ECO y RM sugestivos de amiloidosis y un estudio de perfusión miocárdica sin evidencia de isquemia. Se realiza un estudio con 99mTc-PYP compatible con amiloidosis subtipo ATTR. Debemos señalar que la diferencia de captación entre los dos subtipos (ATTR y AL) se debe a la mayor concentración de calcio en las fibras de amiloide en el subtipo ATTR, aunque en estadios tardíos del subtipo AL, la captación puede estar aumentada, en general sin llegar al grado 3 de Perugini. Los hallazgos dados por la técnica de MN, sumados al ECG, la RM y el eco Doppler tienen valor diagnóstico incremental, siendo el centellograma con 99mTc-difosfonatos el método que permite identificar mejor el subtipo de amiloide de forma no invasiva10,11. La limitación del caso actual es que no se cuenta con histopatología para certificar el diagnóstico, ya que no fue realizada la biopsia cardíaca.