1. Introducción
La insuficiencia cardíaca (IC) es altamente prevalente y tiene elevada morbilidad; su mortalidad promedio anual es de 40%-50% en los pacientes en fase avanzada (clase funcional IV de la New York Heart Association NYHA). La cirugía constituye una alternativa terapéutica en pacientes seleccionados con el potencial de mitigar los síntomas y cambiar el pronóstico1), (2), (3).
La coronariopatía ateromatosa continúa siendo la principal causa de IC con fracción de eyección del ventrículo izquierdo reducida (ICFEr) en nuestro medio y en el mundo. La misma se asocia con una mortalidad anual de 30%-50% a pesar del progreso logrado con el tratamiento médico y su efecto favorable en la sobrevida4), (5.
En pacientes con enfermedad arterial coronaria severa, la disfunción ventricular sin revascularización predice un alto riesgo de muerte, con una sobrevida a tres años de 24% aun con tratamiento médico óptimo5), (6.
En los pacientes con IC avanzada, el trasplante cardíaco fue durante mucho tiempo el tratamiento quirúrgico de elección. En muchos países ha sido exitoso, pero presenta como limitaciones: ausencia de suficientes donantes y no ser aplicable en pacientes de edad avanzada o en aquellos con comorbilidades severas7.
El objetivo global de la cirugía cardíaca en la falla cardíaca severa es mejorar la sintomatología y la sobrevida. Esto se podría obtener por dos mecanismos:
1. Tratando el insulto ventricular primario como es el caso de una patología coronaria o una valvulopatía primaria que hayan afectado el miocardio, situaciones en las que la cirugía sería la forma óptima de mejorar la función cardíaca o de evitar la progresión de su deterioro.
2. Reduciendo o remodelando anatómica y funcionalmente el ventrículo dañado, con aumento secundario del gasto cardíaco de no ser posible el tratamiento anterior (cirugía de restauración ventricular).
La cirugía puede lograr, en determinadas circunstancias, una mejora funcional del ventrículo izquierdo (VI), con reducción de sus volúmenes y aumento del gasto cardíaco.
Se ha denominado “cirugía de la insuficiencia cardíaca” a la cirugía diferente del trasplante, en pacientes con disfunción severa del VI y de alto riesgo; puede comprender la cirugía de revascularización miocárdica (CRM), la miorreducción y remodelación del VI, la cirugía reconstructora de la válvula mitral, la resincronización epicárdica, la introducción de los dispositivos de asistencia ventricular y la cirugía regenerativa.
2. Cirugía de la insuficiencia cardíaca isquémica
Es posible definir a la IC de origen isquémico o cardiomiopatía isquémica (CMI) por el antecedente de un infarto agudo de miocardio (IAM) o por evidencia objetiva de enfermedad arterial coronaria en una coronariografía o prueba funcional. Sin embargo, no siempre es fácil determinar que la isquemia es la causa de la falla cardíaca.
A los efectos de este artículo se aceptará como definición de CMI la propuesta por el grupo de Felker, considerando la presencia de disfunción sistólica (FEVIr) y de uno de los siguientes caracteres6:
- Pacientes con historia de IAM, o CRM o angioplastia transluminal coronaria (ATC).
- Pacientes con obstrucción severa de la arteria descendente anterior (ADA) >75%.
- Pacientes con obstrucción de dos o más vasos epicárdicos >75%.
El desarrollo y avance de las técnicas anestésico-quirúrgicas han permitido abordar la cirugía convencional en la CMI con muy buenos resultados, y diferentes estudios clínicos y registros han echado luz sobre el papel de la cirugía de la IC en estos pacientes.
El presente análisis se centrará en la cirugía de la CMI abordando la CRM aislada en los pacientes con disfunción severa del VI, la remodelación en pacientes con cicatrices o aneurismas del VI y la solución quirúrgica de la insuficiencia mitral (IM) isquémica crónica.
2.1. Revascularización miocárdica
La CRM está cumpliendo 50 años desde la realización del primer bypass aorto-coronario con vena safena interna por René Favaloro en la Cleveland Clinic, en mayo de 1967. Favaloro logró validar y sistematizar este procedimiento. Ese mismo año el cirujano ruso Kolessov realizó el primer bypass con arteria mamaria interna a la ADA sin el apoyo de la circulación extracorpórea. Estos fueron hitos fundamentales en la historia de la CRM que la han llevado a jugar un rol de referencia en el tratamiento de la enfermedad coronaria8), (9.
El beneficio anátomo-funcional de la CRM en la CMI se centra en dos aspectos: el rescate de las zonas hibernantes con remodelación inversa (recuperación de la FEVI o reducción de volúmenes, o ambos) evidenciada en distintos trabajos, y la prevención de nuevos episodios de infarto manteniendo la FEVI recuperada10.
La CRM, para ser efectiva, requiere la combinación de compromiso isquémico extenso de un territorio miocárdico viable, lesiones severas de grandes vasos epicárdicos y lechos coronarios revascularizables.
En pacientes con FEVI <30%, si las lesiones coronarias no son críticamente severas, no son proximales y no comprometen a todas o casi todas las arterias, es poco probable que la coronariopatía sea la causa de la enfermedad miocárdica y no justificaría el riesgo de una CRM. Por otra parte, si no existen por lo menos uno o dos buenos lechos, la cirugía puede no ser efectiva y su indicación dudosa, pues estos pacientes tienen un margen estrecho para la isquemia residual o el infarto perioperatorio. Kron ha demostrado que pacientes con FEVIr y malos lechos para la revascularización tienen alta morbimortalidad y pobre resultado a largo plazo11.
En 1990, los resultados del registro CASS a diez años permitieron establecer que los pacientes con FEVI <50% sometidos a CRM mostraban significativamente mayor sobrevida y menor índice de infartos que aquellos con tratamiento médico inicial12.
En un estudio observacional de la Yale University se analizó el efecto de la CRM en pacientes con FEVI <30%, bajo el concepto de revascularizar las distribuciones coronarias mayores sin malgastar el tiempo de isquemia en vasos secundarios o subóptimos y empleando en forma liberal el balón de contrapulsación aórtico. La sobrevida a uno, tres y cinco años fue de 87%, 77% y 60% respectivamente; la clase funcional mejoró (desde un promedio preoperatorio de 3,1 a 1,4); la FEVI pasó de 23,3% a 33,2%. Ningún paciente requirió trasplante; la mortalidad operatoria global fue de 5,3%5), (9), (10), (11), (13), (14.
Los pacientes con CMI pueden presentarse con síntomas anginosos o con síntomas de falla cardíaca. Según datos del registro CASS, los primeros tuvieron una sobrevida significativamente superior con la cirugía (80% vs 59%; p=0,01), mientras que en aquellos que se presentaban solo con síntomas de falla cardíaca, la sobrevida a diez años no varió (72% vs 76%). En el mismo sentido, los resultados del estudio Cooperativo de Veteranos, publicado en 1984, mostraban que, comparando la cirugía y el tratamiento médico en pacientes con angina estable, la primera era más beneficiosa con FEVI disminuida. Esto ha sentado las bases del consenso actual para preferir la CRM en los pacientes portadores de CMI que presentan ángor, lo que ha generado diferentes controversias12), (15.
La evidencia actual más firme para la toma de decisiones respecto a la CRM está dada por dos grandes estudios randomizados: el Surgical Treatment for Ischemic Heart Failure (STICH), publicado en 2011, y el Surgical Treatment for Ischemic Heart Failure Extension Study (STICHES), publicado en 201616), (17.
El STICH fue un estudio multicéntrico, randomizado, diseñado para comparar la eficiencia del tratamiento médico aislado versus el tratamiento médico más CRM aislada o CRM más remodelación ventricular en la CMI crónica. Incluyó a 1.212 pacientes con CMI definida, FEVI <35% y lesiones revascularizables, que no presentaban lesión de tronco de la coronaria izquierda ni ángor clase III o IV. El 31% de los pacientes reclutados presentaba lesión de dos vasos, el 60% lesión de tres vasos y 68% estenosis proximal de ADA.
En el análisis estadístico de los resultados a cinco años no hubo diferencias en el endpoint primario de muertes por cualquier causa entre el grupo del tratamiento médico aislado y el sometido a tratamiento médico más CRM. Se vio menor incidencia de los endpoints secundarios de muerte cardiovascular y muerte cardiovascular más hospitalización por causas cardíacas en el grupo de CRM.
El estudio STICHES analizó los resultados del STICH luego de un riguroso seguimiento de los pacientes inicialmente randomizados, durante diez años. En este caso se observó una diferencia significativa tanto en el endpoint primario como en los secundarios a favor del grupo con CRM (Figura 1A) (Figura 1B) y (Figura 1C).
Estos datos confirman el beneficio de la CRM en pacientes con severa disfunción ventricular que empieza a ser significativo después de los cinco años y resulta evidente a los diez años, con repercusión notoria en la sobrevida.
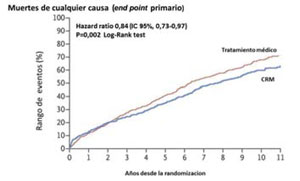
Figura 1A: Estimación de la frecuencia de muertes por cualquier causa por la curva de Kaplan-Meier. Tomado y adaptado de referencia 17. CRM: cirugía de revascularización miocárdica.
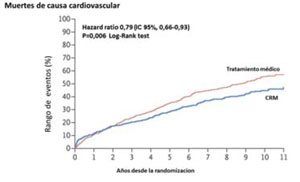
Figura 1B: Estimación de la frecuencia de muertes de causa cardiovascular por la curva de Kaplan-Meier. Tomado y adaptado de referencia 17.
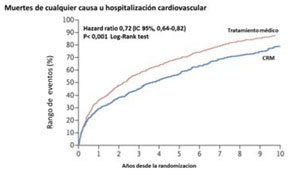
Figura 1C: Estimación de la frecuencia de muertes por cualquier causa e internaciones cardiovasculares por la curva de Kaplan-Meier. Tomado y adaptado de referencia 17.
2.1.1. Rol de la viabilidad miocárdica
Rahimtoola ha definido el miocardio hibernado como el estado de disfunción miocárdica ventricular persistente debido a la reducción de los flujos coronarios, que mejora luego de la revascularización. Esto implica una definición retrospectiva luego de ver los resultados18.
De lo anterior surge el concepto de viabilidad para describir el miocardio disfuncionante por patología coronaria con cicatrices limitadas o ausentes, con potencial para su recuperación funcional. Es entonces una definición prospectiva, pero no implica, necesariamente, evidencia de recuperación funcional después de la revascularización.
La detección de viabilidad miocárdica ha sido utilizada para identificar pacientes con CMI en los que la revascularización pudiese otorgar un beneficio en la sobrevida.
La viabilidad miocárdica se puede evaluar por diferentes procedimientos, como el ecocardiograma con estrés, la cardiorresonancia, el centellograma por perfusión o la tomografía por emisión de positrones.
En un metaanálisis publicado en 2002 por Allman y colaboradores se demostró una fuerte asociación entre la viabilidad miocárdica detectada en las pruebas no invasivas y la supervivencia después de la revascularización en pacientes con CMI, presentando un descenso de la mortalidad de 79,6% (16% vs 3,2%, p<0,0001) con el tratamiento quirúrgico respecto al tratamiento médico. La ausencia de viabilidad, en cambio, no se asoció con ninguna diferencia significativa en los resultados, independientemente de la estrategia de tratamiento19.
En un subestudio del STICH, sin embargo, empleándose la tomografía computarizada de emisión monofotónica simple (SPECT) o el ecocardiograma estrés con dobutamina, la determinación de la viabilidad miocárdica no identificó pacientes que pudieran obtener beneficio en la sobrevida al ser revascularizados20.
Bonow realizó otro subestudio del STICH con el objetivo de probar la hipótesis de que el volumen sistólico final del VI (VSFVI), como marcador de gravedad del remodelado ventricular, influiría en la relación entre viabilidad miocárdica y supervivencia. La mortalidad fue mayor entre aquellos con mayor dilatación del VI (>84 ml/m2) y ausencia de viabilidad, pero no se observó interacción entre VSFVI, el estado de viabilidad y la asignación de tratamiento21.
Gerber y colaboradores, en un estudio prospectivo, durante tres años, siguieron a 118 pacientes con CMI a quienes se les había estudiado con cardiorresonancia en busca de viabilidad. La supervivencia a tres años fue significativamente peor en los pacientes tratados médicamente con viabilidad respecto a los que no tenían viabilidad (48% vs 77% p=0,02). Sin embargo, en los pacientes revascularizados la supervivencia fue similar en ambas situaciones (88% y 71%, p=NS)22.
Por lo expuesto, la viabilidad miocárdica no debe ser el único factor considerado al definir la conducta terapéutica. Los criterios primordiales son: una gran extensión de miocardio en riesgo, con lesiones críticas y proximales, y buenos lechos distales21-23.
2.1.2. Contraindicaciones
Se ha demostrado que la falla del ventrículo derecho (VD) constituye una contraindicación relativa para la CRM. Pacientes con fracción de eyección del VD <40% tienen un riesgo marcadamente elevado para cirugía y una pobre sobrevida a largo plazo debiendo ser considerados candidatos para trasplante cardíaco5).
Si bien la reintervencion no está contraindicada, debe ser abordada con precaución, dado que impacta negativamente en los resultados y los pacientes deberían ser considerados para trasplante cardíaco11.
2.1.3. Importancia de los volúmenes
Existe evidencia de que pacientes con VSFVI aumentado, secundario a remodelación ventricular, tienen una baja expectativa de mejoría con la revascularización miocárdica aislada.
Yamaguchi y colaboradores demostraron que en pacientes con FEVI <30% con VSFVI indexado >100 ml/m2, la sobrevida a cinco años fue significativamente menor que en aquellos con VSFVI <100 ml/m2 (24.
Si bien se ha descrito una reducción posoperatoria del volumen del VI en pacientes revascularizados, en los casos de VI muy dilatado se recomienda asociar la remodelación ventricular.
2.2. Restauración ventricular en la cardiomiopatía isquémica
El corazón normal, como fuera descrito por Torrent-Guasp, tiene una forma elíptica con una orientación oblicua de sus fibras desde la porción media del ventrículo al ápex. Un acortamiento de 15% genera una FEVI de 60% debido al acortamiento en forma de torsión desde el ápex a la base. Por su parte, la detorsión al final de la sístole genera un 50%-60% del llenado ventricular rápido25.
En los pacientes con una severa CMI, en particular con IAM, existe una alteración regional o global en la estructura y morfología cardíacas que condiciona una alteración funcional. El remodelado consiste en la dilatación ventricular que progresivamente determina que el ventrículo adquiera forma esférica, con fibras horizontalizadas que pierden la eficiencia contráctil mencionada (Figura 2)26.
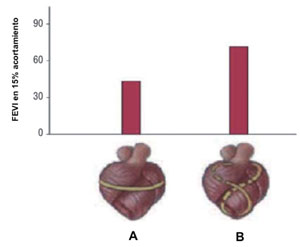
Figura 2: Diferencias en el rendimiento eyectivo de las fibras miocárdicas cuando el mecanismo de contracción es circunferencial (A) vs. espiral (B). Modificado de referencia 25.
Cuando ocurre un IAM, el músculo necrótico lentamente es sustituido por una variable cantidad de tejido fibroso. Cuando un territorio significativo es subsidiario de la arteria ocluida se genera un área de importante adelgazamiento de la pared del VI. El tamaño de esta área depende de la extensión de la circulación colateral (60% de los IAM ocurren en arterias con lesiones leves y por ende con mala circulación colateral) y de la capacidad reparativa del corazón, siendo la reperfusión precoz de la arteria culpable el factor de mayor jerarquía.
La pérdida de la capacidad contráctil genera dilatación en áreas distantes del infarto, determinando aumento de la tensión parietal, disminución del acortamiento sistólico e incremento del consumo de oxígeno. El IAM anterior es el factor iniciador en general, llevando a la pérdida de función de un sector de pared anterior y del septum interventricular.
En los pacientes que sufren IAM por oclusión de una arteria terminal, sin circulacion colateral, se puede generar una gran cicatriz que conduce al aneurisma clásico. En cambio, cuando hay una distribución intercalada de tejido muscular con tejido fibroso, se puede producir una cardiopatía isquémica dilatada.
Se han establecido tres patrones de acuerdo a la distribución del tejido cicatrizal25:
- Tipo 1. Aneurisma verdadero: geométricamente delimitado, con un cuello en todas las proyecciones.
- Tipo 2. Intermedio: la forma se caracteriza por un solo borde en dos dimensiones; en algún sector tiene cuello y en otro no.
- Tipo 3. CMI dilatada: no presenta cuello ni límites, sino que la dilatación es global.
Estos tres patrones se pueden reducir a dos si se considera solamente la extensión del infarto y del tejido cicatrizal:
- Disquinesia/aneurisma del VI: con el subsecuente afinamiento con movimiento paradojal de dicho segmento.
- Aquinesia-infarto VI: con tejido cicatrizal rodeado por una delgada lámina de tejido viable que previene la expansión y movimiento paradojal.
La importancia pronóstica de la remodelación del VI fue establecida por Yamaguchi y Vanoversheide, quienes demostraron que a pesar de una adecuada revascularización miocárdica la mortalidad y los reingresos por IC son más frecuentes en pacientes con VSFVI >100 ml/ m2(24), (27), (28.
White, en 1987, demostró que volúmenes >45 ml/m2 luego de un IAM son predictores de muerte por cualquier causa y >60 ml/m2 de muerte cardíaca (hasta 30% en el primer año)29.
También se estableció que con VSFVI >75 ml/m2 la revascularización miocárdica aislada no modifica el mismo (a pesar de evidenciar isquemia en la zona aquinética) y tampoco evita la progresión hacia la IC30.
Los trabajos de Dor abogan por una indicación precoz de resección y remodelamiento del VI, pues evidenciaron un descenso significativo de la sobrevida si el VSFVI >120 ml/m2, a pesar de la intervención31.
La plastia del VI, que incluye la resección/exclusión del tejido fibroso y su cierre con intención de restauración morfológica y funcional, buscando reestablecer la forma cónica del VI, fue descrita hace mucho tiempo en los trabajos señeros de Likoff y Bailey en los años 1950; en 1956, De Bakey describe la apertura, la resección fibrótica y el cierre lineal de la pared libre del VI32), (33.
En 1985, Vincent Dor describe una técnica para devolver la forma cónica al VI generando un neoápex, empleando para ello una sutura endoventricular. Jatene describió una técnica similar creando una nueva punta con una sutura externa. Ambos trabajos reconocen la importancia de excluir el sector de pared libre y la zona septal fibrótica34.
Actualmente la técnica de plastia ventricular más empleada es la señalada por Dor. Esta técnica se puede describir, de forma muy simplificada, en cuatro pasos: a) apertura del aneurisma; b) ubicación de sutura endoventricular en la unión de la zona fibrosa y muscular, creando un neoápex y recuperación de la forma cónica del VI; c) eventual cobertura por parche; d) cierre del tejido fibroso por encima con exclusión de áreas redundantes, reforzado con bandas de teflón35.
Si bien la indicación del tratamiento quirúrgico de un aneurisma con una gran zona disquinética no plantea mayor discusión, el tratamiento de áreas con disquinesia leve o aquinesia de poca extensión ha sido objeto de dudas. En vistas a dilucidar esta cuestión se desarrolló el registro Reconstructive Endoventricular Surgery, Returning Torsion Original Radius Elliptical Shape to the LV (RESTORE), que mostró una mortalidad hospitalaria de 5,3%, con sobrevida a cinco años de 68,6% y que fue notoriamente superior en el grupo disquinético respecto al aquinético (80% vs 65%)36.
En cambio, cuando se consideran los registros de la Society of Thoracic Surgery, la mortalidad fue de 10% en esta población, careciendo de población testigo. El grupo de la Cleveland Clinic comparó, en un estudio bajo el diseño propensity score, pacientes sometidos a CRM y remodelación ventricular con pacientes a los que se les realizó solo CRM; no hubo diferencias de sobrevida a uno y cuatro años37.
En el STICH se incluyeron 1.000 pacientes; en 499 pacientes se agregó remodelación ventricular al tratamiento médico y CRM, mientras que en 501 pacientes se realizó tratamiento médico y CRM aislada. Se observó una reducción mayor del volumen del VI en el primer grupo, no hallándose diferencias en cuanto a muerte y rehospitalizaciones a dos años15,38.
Los datos del STICH mostraron que los pacientes con VI menos dilatado y FEVI menos reducida pueden beneficiarse de una remodelación ventricular izquierda; mientras que aquellos con ventrículos muy dilatados y FEVI muy disminuida no se benefician. Un VFSVI posoperatorio <70 ml/m2, luego de revascularización miocárdica y remodelación del VI, resultó en mejor sobrevida.
A modo de conclusión: cuando existen grandes cicatrices y áreas disquinéticas está indicada la reconstrucción. Fuera de esta situación se debe definir la conducta en cada paciente considerando mayor beneficio en los ventrículos menos dilatados.
3. Cirugía de la válvula mitral en pacientes con severa disfunción del ventrículo izquierdo
La IM es una complicación frecuente en los pacientes con remodelación cardíaca y severa disfunción del VI, tanto de origen isquémico como no isquémico. Esta clase de IM se denomina secundaria (o funcional) para diferenciarla del compromiso anatómico valvular primario (IM orgánica), el cual puede, a su vez, generar remodelación y deterioro de la FEVI.
La IM secundaria isquémica crónica se define como aquella regurgitación mitral que ocurre más de una semana después de un IAM con: a) una o más anomalías segmentarias del movimiento de la pared ventricular izquierda; b) enfermedad coronaria significativa en el territorio que presenta el movimiento anómalo de la pared; c) valvas y cuerdas tendinosas estructuralmente normales. El tercer criterio excluye a los pacientes con IM orgánica y cardiopatía isquémica asociada41.
No es fácil establecer la prevalencia de la IM isquémica, que se asocia a mal pronóstico luego de un IAM o de una CRM. Los datos del registro SAVE mostraron una prevalencia de 19,4% en pacientes que habían sufrido un IAM. Por otra parte, ante la presencia de IM severa se comprobó una mortalidad al año de 52%, con IM leve a moderada de 22% y sin IM de 11%42-44.
La (Figura 3) grafica los resultados del trabajo de Grignoli mostrando la implicancia de la presencia de la IM y su severidad45.
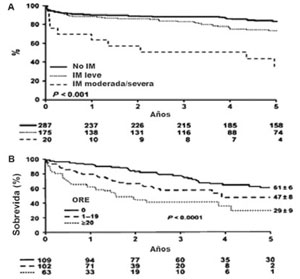
Figura 3: Sobrevida (±DE) luego del diagnóstico de IM isquémica. A) Según la severidad de la IM por volumen regurgitante. B) Según la evaluación del orificio regurgitante efectivo (ORE) si ³ 20 mm2 o < 20 mm2. Tomado y adaptado de referencia 44.
Hasta hace poco tiempo esta cirugía era considerada prohibitiva fundamentalmente por la sustitución valvular con disrupción del aparato subvalvular mitral; actualmente, con los nuevos conceptos fisiopatológicos y etiopatogénicos, que condujeron a variantes técnicas de importancia y con el progreso de los cuidados perioperatorios, se posibilitó su realización con buenos resultados. Un estudio en el cual 193 pacientes fueron sometidos a distintos métodos de reparación o sustitución valvular y de los cuales 77% estaba en clase funcional III-IV, con FEVI promedio de 23% y diámetro diastólico final promedio de 70 mm, registró una mortalidad a 30 días de 1%46).
3.1. Anatomía funcional mitral en la insuficiencia cardíaca
El cierre y la posición normal de las valvas son producto del equilibrio entre las fuerzas de cierre (contracción del VI) y las de tironeamiento ejercidas por el aparato subvalvular.
Hasta hace poco tiempo se consideraba que la IM secundaria (sobre todo la isquémica) se debía a la disfunción de los músculos papilares. Sin embargo, estudios experimentales demostraron que la disfunción aislada de los músculos papilares no produce IM y que, incluso, podría prevenirla47), (48.
La disfunción ventricular, como único elemento patológico (sin dilatación ni distorsión ventricular), no es suficiente para producir IM secundaria. El requisito inicial es la presencia de remodelación del VI, ya sea local o global, con una tendencia a la esfericidad y alteración en la relación geométrica entre el ventrículo y el aparato valvular mitral; el anillo mitral pierde a posteriori la forma en silla de montar y se dilata. Todo esto determina que las fuerzas de tracción se dejen de aplicar perpendicularmente al anillo mitral, haciéndolo tangencialmente y provocando IM secundaria (Figura 4)49), (50), (51), (52), (53), (54), (55.
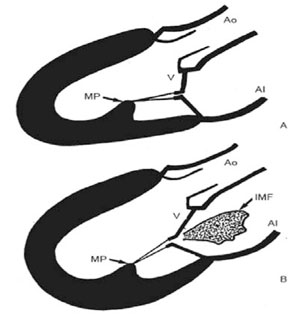
Figura 4: Representación esquemática de un VI normal (A) y de un VI con disfunción sistólica y esfericidad (B). La esfericidad es responsable del desplazamiento de los puntos de anclaje mitral y de coaptación insuficiente que conduce a la IM secundaria. Ao: aorta; IMF insuficiencia mitral funcional; MP: músculo papilar; V: valvas mitrales. Tomado de referencia 53.
Se puede afirmar que la génesis de la IM secundaria vinculada a la IC es una enfermedad eminentemente ventricular.
3.2. Componente dinámico de la insuficiencia mitral secundaria
La IM secundaria se caracteriza por ser dinámica y puede variar en el tiempo según las situaciones hemodinámicas, dependiendo del balance de las fuerzas de estiramiento y cierre que a su vez son dependientes de las condiciones fisiológicas y farmacológicas56-58.
Una IM leve a moderada puede transformarse en severa durante el ejercicio. Lancellotti demostró que un aumento significativo de la insuficiencia con el ejercicio se correlaciona con mayor mortalidad, aumento del número de readmisiones y agravamiento de la IC42,44,59.
Cuando se procede a la cirugía cardíaca, si se va a actuar sobre la válvula mitral, no se debe determinar el grado de IM en el perioperatorio, ya que la anestesia disminuye la precarga y el volumen de regurgitación.
3.3. Diagnóstico
La IM secundaria puede presentarse en forma asintomática o con síntomas muy incapacitantes, lo que depende de la magnitud de la regurgitación, del tiempo de evolución y de la sensibilidad individual.
La auscultación depende parcialmente de los gradientes de presión entre aurícula y ventrículo, por lo cual puede variar según la situación hemodinámica.
El análisis ecocardiográfico de las características anatómicas y funcionales de las diferentes estructuras valvulares y las características del jet regurgitante por Doppler color ayudan a interpretar el mecanismo fisiopatológico de la insuficiencia, la gravedad de la misma y a evaluar la posibilidad de su reparación quirúrgica.
Los parámetros ecocardiográficos que permiten definir una IM como moderadamente severa (grado 3) o severa (grado 4) son: a) vena contracta ³7 mm; b) área de chorro regurgitante en relación con el área de la aurícula izquierda >40% (si el flujo es central, ya que con flujo sobre la pared esta relación puede ser menor); c) patrón circular de flujo intraauricular; d) orificio regurgitante efectivo (ORE) ³40 mm2; e) fracción regurgitante >50%60.
En la última década se había propuesto considerar un umbral inferior para el diagnóstico de severidad en la IM secundaria basándose en el peor pronóstico de los pacientes con un ORE >20 mm2. Las guías de la ACC/AHA publicadas en 2014 recogieron este concepto aceptando el punto de corte de 20 mm2 para severidad en la IM secundaria a diferencia de los 40 mm2 requeridos en la IM primaria61.
Existe alguna controversia en este aspecto considerando que el ORE en estos pacientes suele ser elíptico y difícil de evaluar, con un componente dinámico importante y que, además, no está claro si el valor pronóstico está dado por dicho valor exclusivamente o se deba a la severa disfunción del VI o al grado de cicatrización miocárdica irreversible62.
Dado que no hay evidencia fuerte de que la corrección quirúrgica de la IM secundaria mejore el pronóstico, existe la preocupación de que un umbral menor en la definición de severidad pueda llevar a intervenciones innecesarias. De hecho, recientes datos han demostrado que la reparación mitral en pacientes con IM secundaria, con ORE de 20-39 mm2, no mejoró los resultados y se asoció con un mayor riesgo de eventos neurológicos y arritmias supraventriculares62), (63.
Las guías conjuntas de las sociedades americanas de ecocardiografía y resonancia magnética publicadas en abril de 2017 consideran que el diagnóstico de IM secundaria, empleando el ORE como único parámetro, se debe realizar utilizando el punto de corte de 40 mm2. En pacientes con ORE entre 20-30 mm2 se deben utilizar todos los criterios ecocardiográficos para definir severidad y no solo el ORE62.
3.4. Indicaciones quirúrgicas en la insuficiencia mitral secundaria
No existen criterios unánimes para la indicación de cirugía en la IM secundaria crónica. En la (Tabla 1) se establecen las recomendaciones que la AHA publicó en 201461.
Aquellos pacientes que van a ser sometidos a CRM y presentan una IM secundaria severa deben recibir cirugía mitral asociada a la revascularización. En cambio, en los pacientes que presentan una falla mitral episódica vinculada a la isquemia, en general no debe asociarse la cirugía mitral, pues la regurgitación tiende a mejorar con la revascularización.
En los casos de IM con disfunción localizada en cara inferior por afección del aparato subvalvular inferior y oclusión o estenosis crítica de un vaso no revascularizable por malos lechos se debe asociar tratamiento valvar.
La situación de la IM moderada es controvertida, habiendo extensa bibliografía en uno y otro sentido. Se debe sopesar el riesgo del procedimiento combinado, que globalmente duplica la mortalidad operatoria y el riesgo de evolución a IM severa y falla cardíaca. Se puede afirmar que los pacientes que no son operados tienen una incidencia significativamente mayor de síntomas, un índice menor de sobrevida libre de eventos cardíacos y 30% evoluciona a IM grado 3 o 464,65.
Esta situación clínica ha sido analizada en un estudio cooperativo de los principales centros de cardiocirugía de Estados Unidos. Un total de 301 pacientes con IM isquémica moderada, que iban a ser sometidos a CRM, fueron randomizados a CRM aislada o con plastia de válvula mitral. A un año de seguimiento no hubo diferencias en cuanto a mortalidad, eventos cardiovasculares, clase funcional, reingresos, calidad de vida ni remodelación inversa. Los que recibieron CRM aislada tuvieron menor tiempo de circulación extracorpórea, menor estadía intraoperatoria y menor índice de eventos intraoperatorios. Recientemente se publicaron los datos de la misma serie a dos años con resultados equivalentes63,66.
Se debe definir la mejor alternativa para cada paciente y la ecocardiografía de ejercicio tiene un rol importante para discriminar IM severas encubiertas.
3.5. Opciones quirúrgicas
Los malos resultados de la sustitución mitral en décadas previas pueden explicarse por el desconocimiento de la importancia de la interdependencia de la función ventricular y la continuidad anulo-papilar, soslayando el hecho de que la IM provee al VI disfuncionante una cámara de baja presión de descarga. La sustitución mitral con exéresis de todo el aparato subvalvular era responsable de la caída de la función ventricular.
3.5.1. Sustitución valvular mitral
La sustitución valvular mitral con conservación del aparato subvalvular es una opción quirúrgica posible y deseable dado que en estos pacientes la válvula es normal, así como las cuerdas tendíneas; se preserva la funcionalidad con mejoría de la performance del VI.
Se ha demostrado que la conservación de ambas valvas confiere una significativa ventaja si se compara con la conservación cordal parcial (solo valva menor), debido a una reducción del tamaño del VI y de la poscarga sistólica. Inclusive, la función ventricular sigue mejorando con el tiempo, debido probablemente a una remodelación ventricular más favorable, elemento que no ocurre con la preservación cordal posterior67), (68.
A pesar de que el tratamiento de elección en esta patología es la anuloplastia, se debe considerar la sustitución valvular en: a) pacientes con severas comorbilidades; b) presencia de jets regurgitantes complejos (no centrales); c) tethering severo de ambas valvas68), (69.
Gillinov refiere que la incidencia de fallo de la anuloplastia a los seis meses es de 55% cuando el diámetro del anillo es >3,7 cm o el área de tenting es >1,6 cm2, debiéndose considerar la sustitución o técnicas reparativas complejas en esas situaciones. Calafiore, por su parte, recomienda la sustitución en pacientes que presentan una distancia entre el punto de coaptación de las valvas >10 mm68), (69.
En la (Figura 5), tomada de los trabajos de Calafiore, se puede observar la técnica de preservación de todo el aparato subvalvular empleada habitualmente68.
3.5.2. Anuloplastia
Dados los magros resultados iniciales obtenidos con la sustitución valvular mitral, Bolling y colaboradores propusieron la denominada anuloplastia restrictiva que consiste en una reparación mitral con anuloplastia. El objetivo es lograr una adecuada coaptación de las valvas, que se encuentra alterada por dilatación anular secundaria a la dilatación y esfericidad ventriculares. Implica la colocación de un anillo, dos medidas menor que la distancia intertrigonal; es decir, si el probador mide una distancia, por ejemplo, de 32 mm, se utiliza un anillo de 28 mm (van de dos en dos), logrando de esa forma la aposición valvar con la consiguiente suficiencia de la válvula70).
En un estudio se aplicó la anuloplastia restrictiva a 125 pacientes con CMI en estadio D, con IM secundaria severa, en clase funcional III o IV de la NYHA, FEVI <25%, con promedio de 14%. La mortalidad operatoria fue de 5%, con sobrevida a uno y dos años de 80% y 70% respectivamente, clase funcional I y II, y FEVI promedio de 25%. La técnica demostró una aceptable morbimortalidad y fue aceptada como la técnica de preferencia70. Luego fue extendida a pacientes con cardiomiopatía dilatada isquémica y no isquémica, acompañada de CRM en los primeros, registrándose un alto índice de remodelación inversa en los ventrículos no severamente dilatados. Por otra parte, es una técnica reproducible, con baja morbimortalidad y que evita la “enfermedad protésica”.
De todas formas, es una técnica que globalmente se asocia a altas tasas de recidiva y en los pacientes con severa dilatación se obtienen malos niveles de sobrevida a cinco años (50%). Parece claro que el procedimiento mitral asociado reduce la clase funcional y el ingreso por IC, pero quedan muchos aspectos a discutir.
Un estudio de seguimiento a 17 años de la Cleveland Clinic mostró un índice de recurrencia de IM, al menos moderada, luego de anuloplastia, de 28% en seis meses68).
Los factores de riesgo asociados a falla de la cirugía son: a) severa disfunción ventricular izquierda; b) grado mayor de IM; c) dirección del jet diferente a posterior; d) anillo dilatado (más de 3,7 cm); e) área de tenting >1,6 cm2; d) empleo de bandas de pericardio en la plastia.
Como alternativas se han desarrollado anillos semirrígidos y rígidos completos, además de algunos anatómicos como el Geoform®, y también se han diseñado técnicas complementarias como corte de cuerdas tendíneas secundarias y la plastia de Alfieri.
Un seguimiento evolutivo de 100 anuloplastias mostró que los mejores predictores pronósticos fueron los diámetros finales diastólicos (DDF) y sistólicos (DSF) del VI. Los pacientes con DDFVI <65 mm y DSFVI <50 mm presentaron una menor mortalidad perioperatoria y una significativa mayor sobrevida a largo plazo71).
En 2016 se publicó un estudio aleatorizado doble ciego en el que se incluyeron 251 pacientes y se comparó la sustitución valvular mitral con conservación total del aparato subvalvular y la anuloplastia reductora con anillo rígido o semirrígido. A dos años no hubo diferencias significativas en mortalidad; el grupo de reparación tuvo mayor incidencia de IM moderada o severa, y también más efectos adversos mayores vinculados a falla cardíaca y reingreso por causa cardiovascular que el grupo sometido a sustitución valvular72).
Se podría resumir, entonces, que en pacientes con IM secundaria severa con ventrículos no muy dilatados, la anuloplastia restrictiva sigue siendo la técnica de elección, no obteniéndose buenos resultados con la mayoría de las técnicas en pacientes con VI muy dilatados; en estos no se recomienda la anuloplastia y es preferible la sustitución con conservación de todo el aparato subvalvular mitral.
Resumen conceptual
- Se denomina cirugía de la insuficiencia cardíaca a la cirugía convencional en pacientes de alto riesgo con disfunción severa del ventrículo izquierdo.
- El objetivo del abordaje quirúrgico en la falla cardíaca severa es mejorar los síntomas, prevenir nuevos eventos cardiovasculares y aumentar la sobrevida.
- La cirugía de revascularización miocárdica en pacientes con severa disfunción ventricular y coronariopatía grave es particularmente beneficiosa en relación con otras terapéuticas a los cinco años y resulta más evidente a los diez años.
- La ausencia de correlación entre el estado de viabilidad miocárdica y la revascularización determina que no debe ser el único factor a considerar. Los criterios primordiales son: gran extensión de miocardio en riesgo, lesiones coronarias críticas proximales y buenos lechos para revascularizar.
- La cirugía de remodelación ventricular está indicada en la cardiomiopatía isquémica con grandes cicatrices y áreas disquinéticas. Fuera de esta situación se debe definir la conducta en cada paciente, considerando que puede ser más beneficiosa en ventrículos no muy dilatados.
- La anuloplastia restrictiva continúa siendo la técnica de elección en insuficiencia mitral secundaria severa con ventrículo no muy dilatado. No se recomienda en ventrículos con gran dilatación y es preferible la sustitución mitral con conservación del aparato subvalvular.