1. Introducción
En los últimos 40 años la evolución en la comprensión de la fisiopatología y, por ende, en el tratamiento de la insuficiencia cardíaca (IC) vinculada a disfunción sistólica ha sido sencillamente impresionante. Esto ha tenido fuerte impacto en la calidad de vida (mejoría de los síntomas) y en la cantidad de vida (disminución drástica de la mortalidad). Además de los fármacos, los dispositivos implantables han contribuido de forma fundamental en estos logros.
Este capítulo analiza el rol de los dispositivos en mejorar los síntomas y en la prevención primaria de la muerte súbita (MS) cardíaca de los pacientes con IC. El lugar del cardiodesfibrilador implantable (CDI) en la prevención secundaria de la MS cardíaca, es decir, en el paciente que ya ha tenido un evento arrítmico mayor (fibrilación ventricular o taquicardia ventricular), constituye una situación particular que merece un análisis específico que está fuera del alcance del presente artículo.
2. Cardiodesfibrilador implantable para prevención primaria de muerte súbita en la insuficiencia cardíaca
La MS representa aproximadamente la mitad de la mortalidad total de los pacientes con insuficiencia cardíaca con fracción de eyección reducida (ICFEr). Su valor relativo es mayor en etapas tempranas de la IC y su valor absoluto es más importante en estadios avanzados1.
Las arritmias ventriculares malignas son la causa de la gran mayoría de estas MS. Numerosos ensayos clínicos randomizados, que se comentarán más adelante, han demostrado que el CDI es la terapéutica más eficaz para reducir la MS dado que es capaz de detectar y terminar con las arritmias ventriculares. Inicialmente se estableció su beneficio, en términos de sobrevida, para pacientes que experimentaron y sobrevivieron a una arritmia ventricular sintomática o a un paro cardiorrespiratorio (prevención secundaria)2), (3), (4. En los últimos 15 años se ha demostrado, además, que este beneficio se extiende a la prevención primaria, es decir, a tratar el primer evento potencialmente fatal (Figura 1). Numerosos estudios avalan la indicación de implante profiláctico de CDI para subgrupos de alto riesgo de presentar arritmias ventriculares malignas. Es muy importante estratificar correctamente el riesgo y sopesarlo con el de infección, choques inapropiados, calidad de vida, mortalidad asociada al dispositivo, así como también costos y comorbilidades para poder determinar la población en que el implante de CDI tendrá impacto en la disminución de la mortalidad total y no solo arrítmica. El mayor conocimiento de la historia natural de la enfermedad, de sus mecanismos fisiopatológicos, así como de los resultados de estudios recientemente publicados determinan que sea necesario analizar por separado el rol del CDI en prevención primaria en la cardiomiopatía isquémica (CMI) y en la cardiomiopatía no isquémica (CMNI).
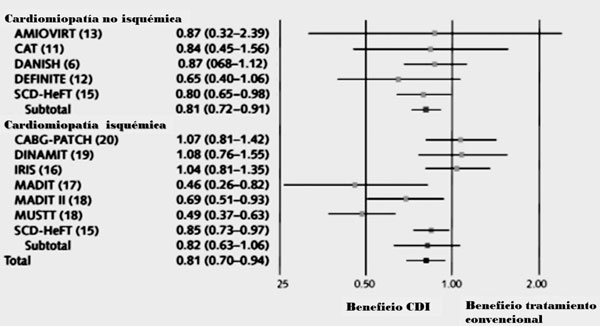
Figura 1: Hazard ratios (HR) para mortalidad total: cardiodesfibrilador implantable versus tratamiento convencional en los principales estudios de prevención primaria en cardiomiopatía isquémica y no isquémica. Modificado de referencia 5.
2.1. CDI en la prevención primaria de muerte súbita en cardiomiopatía isquémica
Los primeros estudios del tema investigaron el beneficio del CDI en pacientes con CMI y alto riesgo, en base fundamentalmente a la estratificación por el estudio electrofisiológico (EEF).
En el año 1996 se publicó el estudio MADIT I6 que evaluó el implante de CDI versus el tratamiento convencional en pacientes con CMI, fracción de eyección del ventrículo izquierdo (FEVI) <35%, taquicardia ventricular (TV) no sostenida en el Holter y TV inducible en el EEF no suprimible por drogas antiarrítmicas. Demostró una reducción relativa de la mortalidad de 54% con el implante de CDI. Este efecto tan importante, que llevó incluso a la finalización prematura del estudio, fue en parte cuestionado dado que el grupo control recibía tratamiento médico subóptimo, incluyendo drogas antiarrítmicas de clase I, que, como se sabe, incrementan la mortalidad en estos pacientes.
Posteriormente se publica el estudio MUSTT7, que evaluó pacientes con CMI, FEVI <40% y TV no sostenida asintomática. Aquellos con TV inducible en el EEF eran randomizados a CDI o fármacos antiarrítmicos y a los que no inducían TV se los mantenía con tratamiento médico. A los cinco años se demostró una reducción de la mortalidad de 31% en el grupo de pacientes con CDI en comparación con los que recibían drogas antiarrítmicas y de 24% en comparación con el grupo sin tratamiento antiarrítmico.
En el año 2002 se publica el ensayo MADIT II8, que incluyó un grupo más amplio de pacientes en riesgo de MS. Presentaban antecedente de infarto agudo de miocardio (IAM) de al menos un mes de antigüedad y FEVI 30%, y fueron randomizados a CDI o tratamiento convencional. No se utilizó la estratificación por medio del EEF, sino únicamente por la FEVI. Luego de un seguimiento promedio de 20 meses se demostró una reducción de 31% de la mortalidad con el CDI. En 2010 se publicó el seguimiento de los pacientes del MADIT II extendido a ocho años que mostró la persistencia del beneficio del CDI en la mortalidad total9) .
El SCD-HeFT10 fue un ensayo clínico de grandes dimensiones (más de 2.500 pacientes) publicado en el año 2005 que randomizó pacientes con IC clase funcional (CF) II-III (CMI y CMNI) y FEVI =35% a tres ramas de tratamiento: CDI, amiodarona o placebo. Luego de una media de seguimiento de 45 meses, el grupo con CDI mostró reducción de 23% de la mortalidad respecto del grupo placebo. La amiodarona no mostró beneficio e incluso tendió a ser perjudicial. Si bien la mortalidad fue mayor en el grupo de CMI que en el de CMNI, el beneficio relativo fue similar en ambos. En el análisis según CF, el beneficio del CDI se limitó a los pacientes en CF II.
No todos los estudios sobre CDI y CMI tuvieron resultados positivos. El estudio DINAMIT11 analizó qué efecto tiene el implante profiláctico de CDI en la fase precoz pos IAM. Se randomizaron pacientes entre 5 y 40 días pos IAM, FEVI <35% y variabilidad de la frecuencia cardíaca disminuida, a tratamiento convencional con o sin implantación de un CDI. No se demostró beneficio del implante de CDI en términos de mortalidad.
En la misma línea se encuentra el estudio CABG Patch(12), que incluyó y randomizó pacientes con CMI e indicación de cirugía de revascularización miocárdica (CRM), FEVI <35% y un electrocardiograma (ECG) con promediación de señales anormal, a CRM y CDI o solo CRM. Luego de un seguimiento de 36 meses, no se observó beneficio del implante de CDI. Esto podría estar asociado a la reducción del riesgo arrítmico vinculado a la revascularización per se.
En suma, existe evidencia contundente derivada de estudios de grandes dimensiones que sustentan la indicación clase I del implante profiláctico de CDI en pacientes con CMI luego de la fase aguda posinfarto, estratificados básicamente por la FEVI y la clase funcional (FEVI 35% y CF II-III (Tabla 1)13.
2.2. CDI en la prevención primaria de muerte súbita en cardiomiopatía no isquémica
En contraste con la extensa evidencia que se ha presentado para la CMI, la evidencia para la CMNI es menos robusta. Las guías actuales (Tabla 1) recomiendan el implante de CDI en cierto grupo de pacientes con CMNI, basadas en un metaanálisis publicado en 2004 que reúne los resultados positivos derivados de los estudios SCD-HeFTl (cuyos datos fueron presentados en sesión científica de marzo de 2004, previo a su publicación)10 y del COMPANION14, y los negativos derivados de los estudios CAT15, AMIOVIRIT16 y DEFINITE17. El metaanálisis muestra una reducción de 31% de la mortalidad con CDI vesus tratamiento convencional18.
Recientemente se ha publicado el estudio DANISH(19, que randomizó 1.116 pacientes con CMNI con tratamiento óptimo a CDI o no CDI. La mitad de los pacientes, aproximadamente, estaba tratada con terapia de resincronización cardíaca (TRC). Aunque el CDI disminuyó la MS cardíaca, no hubo diferencia estadísticamente significativa en el punto final primario de mortalidad total de cualquier causa. La mortalidad total global fue baja. Muchos atribuyen en parte el resultado negativo a la elevada proporción de pacientes que recibieron TRC (58%), así como también a la presencia de importantes comorbilidades que pueden marcar un pronóstico adverso independientemente del riesgo arrítmico.
En el análisis por subgrupos se demostró que sí existía beneficio en pacientes jóvenes, menores de 59 años. Cuando se analiza el tipo de muerte (súbita versus no súbita) se observa que los pacientes mayores de 70 años tienen una elevada proporción de muertes no súbitas y en su mayoría de causa no cardíaca, proporción mucho mayor que en el subgrupo de pacientes menores de 70 años.
Dado el impacto potencial que puede tener el resultado negativo del DANISH, se han realizado nuevamente varios metaanálisis que evalúan el efecto del CDI en prevención primaria en estos pacientes, con la inclusión de los estudios clásicos y también de este último. Todos muestran un beneficio en mortalidad total estadísticamente significativo del CDI versus tratamiento médico óptimo, pero no así en pacientes a quienes se les asoció TRC20), (21) .
Si bien hoy día el implante de CDI en prevención primaria continúa siendo una indicación clase I en las guías para pacientes con CMNI, FEVI ?35% y CF II-III (Tabla 1), es probable que a la luz de los últimos estudios analizados se reduzca la indicación en esta subpoblación.
Finalmente debe destacarse que se han desarrollado scores tanto para pacientes con CMI como CMNI que establecen quiénes se benefician menos en la reducción de la mortalidad total con CDI (MADIT II, SOCKED, FADES, PACE)22. Estos incluyen edad y enfermedades comórbidas como diabetes, fibrilación auricular (FA), enfermedad pulmonar obstructiva crónica (EPOC) e insuficiencia renal. De acuerdo a la información actual y al igual que en otros tratamientos en la esfera cardiovascular con efecto a largo plazo, los pacientes más jóvenes, con menos comorbilidades, con mayor expectativa de vida, son los de mayor tasa de MS arrítmica y, por tanto, los que más se benefician del implante de CDI.
3. Terapia de resincronización en la insuficiencia cardíaca con fracción de eyección reducida
La TRC se ha constituido en uno de los pilares en el tratamiento de la ICFEr.
En pacientes seleccionados, determina disminución de los síntomas y de la mortalidad. Después de los inhibidores de la enzima convertidora de angiotensina y de los betabloqueantes constituye uno de los pocos tratamientos con estos dos efectos fundamentales sobre el curso natural de esta patología crónica.
Los trastornos de la conducción intraventricular, especialmente el bloqueo completo de rama izquierda (BCRI), determinan disincronía interventricular e intraventricular con activación tardía de la pared lateral del ventrículo izquierdo (VI), agravando la disfunción sistólica, disminuyendo la eficiencia en la contracción y causando remodelado ventricular.
La TRC intenta corregir todos estos hechos además de mejorar también la sincronía auriculoventricular (AV): optimiza el retardo AV, restablece la sincronía ventricular mejorando la performance del VI (remodelado reverso), disminuyendo la insuficiencia mitral y también mejorando la función diastólica. Permite, además, optimizar las dosis de fármacos beneficiosos para la ICFEr.
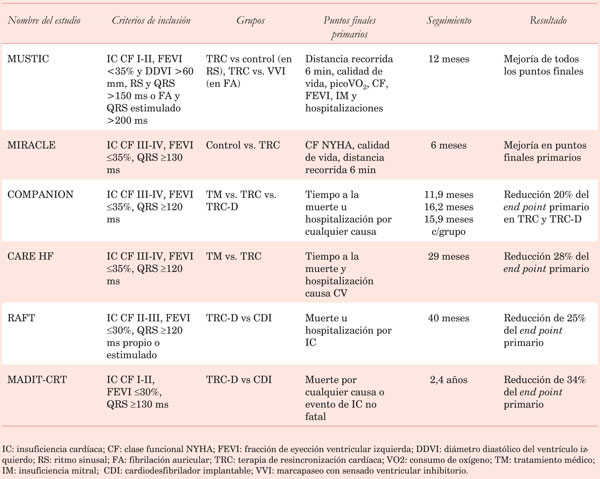
La TRC se aplica clínicamente desde hace más de 20 años. Ha sido demostrada su eficacia en múltiples estudios randomizados y multicéntricos en pacientes con IC CF II-IV, FEVI <35% y BCRI. El primer estudio con estas características fue el MUSTIC23 publicado en 2001. Le siguió el estudio MIRACLE24, con una mayor cantidad de pacientes. En ambos se demostró una mejoría significativa en los síntomas, pero no disminución de la mortalidad total.
El estudio COMPANION14 fue el primero que agregó la terapia de desfibrilación a la TRC, demostrando beneficio en la disminución de la mortalidad con la TRC más el CDI (TRC-D)24. Sin embargo, fue el estudio CARE-HF el que demostró una consistente reducción de la mortalidad de la TRC en ausencia de desfibrilador (TRC-P) (Figura 2)25.
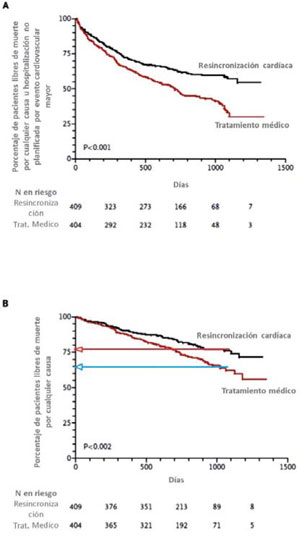
Figura 2: Curvas de Kaplan-Meier del estudio CARE-HF para tiempo al end point primario (A) y secundario (B). Modificado de referencia 24.
El estudio RAFT26 fue de los pocos que comparó TRC-D con terapia con CDI solo en pacientes con FEVI <30%, CF II-III y duración del QRS >120 ms. Mostró una disminución absoluta de 7% de la mortalidad total u hospitalización por IC con TRC-D.
El estudio MADIT-CRT27 randomizó pacientes con IC CF I-II, FEVI <30% y duración del QRS >130 ms a TRC-D y a desfibrilador solo. Mostró una reducción del punto final combinado de mortalidad y descompensación de IC, sugiriendo que los pacientes en estadios precoces de IC también se benefician de la TRC. Este concepto fue reafirmado en el estudio REVERSE28, que mostró beneficio en los síntomas con la TRC en pacientes con IC CF I-II.
La (Tabla 2) muestra las características de los estudios más importantes, los criterios de inclusión, los puntos finales y sus resultados.
3.1. Guías de tratamiento de la TRC
Basándose en los estudios antes mencionados y en otros de menor entidad se han publicado guías de TRC por parte de las sociedades científicas y agencias sanitarias más importantes del mundo.
Tanto las guías europeas de ESC/EHRA13 como las estadounidenses de ACC/AHA/HRS29 tienen como indicación clase I la TRC-D en pacientes con IC CF II-III y IV ambulatoria, FEVI <35%, ritmo sinusal y BCRI con duración del QRS ³130 ms. Esta y otras recomendaciones de TRC se detallan en la (Tabla 3).
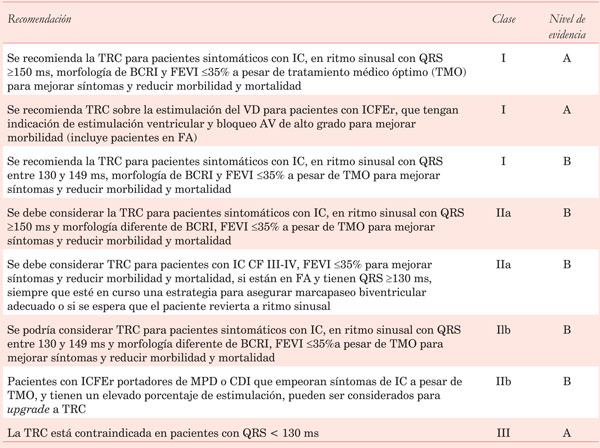
Tabla 3:Recomendaciones para el implante de resincronizador en pacientes con insuficiencia cardíaca (Guía europea de Insuficiencia cardíaca, 2016)28.
3.2. Terapia de resincronización en situaciones específicas
3.2.1. Fibrilación auricular
La prevalencia de FA en pacientes con IC y disfunción sistólica depende del grado de severidad de la cardiopatía, pero es siempre importante: cerca de 10% en la CF I, hasta 50% en CF IV. Hay dos escenarios diferentes que se intrincan cuando se analiza la TRC en pacientes con FA e ICFEr:
-- Pacientes con FA y bloqueo AV estructural o producido por ablación del nodo AV en los que se plantea implante de marcapasos.
- Pacientes con FA, disfunción sistólica y BCRI en los que se plantea TRC.
En el primer escenario se pretende evitar el efecto deletéreo del marcapaseo en el ventrículo derecho (VD). Los efectos beneficiosos de la TRC fueron demostrados en el estudio PAVE30, que incluyó a pacientes con FA en quienes se realizó ablación del nodo AV, y en el estudio BLOCK HF31, que incluyó a pacientes con indicación de marcapasos por bloqueo AV, FEVI <50% e IC CF I-III. En esta población aproximadamente la mitad tenía FA.
Respecto a la segunda situación varios subestudios de los grandes ensayos clínicos han mostrado consistentemente la menor tasa de respuesta a la TRC cuando el paciente presenta FA. Por tanto, en este grupo de pacientes debe hacerse una cuidadosa selección en base a los demás criterios (ancho del QRS, BCRI, FEVI, CF) para obtener los mejores resultados.
En la medida en que está bien demostrada que la eficacia de la TRC depende también del porcentaje de estimulación biventricular logrado, la FA puede interferir en este sentido dada su tendencia a conducir rápida e irregularmente hacia los ventrículos. Por tanto, agregar ablación del nodo AV a estos pacientes parece muy razonable, dado que así se puede garantizar el 100% de estimulación biventricular.
Un estudio observacional ha mostrado el beneficio de la estrategia de ablación del nodo AV32. También cabe la posibilidad de que estos pacientes sean tratados mediante ablación de la FA para restablecer el ritmo sinusal, hecho que también ha demostrado beneficios en la ICFEr en el estudio CASTLE AF33, estudio randomizado presentado en agosto de 2017. En todo caso, se necesita más información que provenga de estudios randomizados para definir cuál es la terapia más adecuada para este grupo de pacientes.
Debe destacarse que la TRC no ha demostrado disminuir la incidencia de nueva FA a pesar de determinar efectos fisiopatológicos beneficiosos, como disminuir el tamaño auricular, la insuficiencia mitral y la activación neurohormonal de la IC.
3.2.2. Trastornos de la conducción intraventricular diferente a bloqueo de rama izquierda
Varios estudios han incluido a pacientes con QRS ancho, pero sin BCRI, principalmente con bloqueo de rama derecha; sin embargo, no se ha demostrado beneficio neto con TRC en estos pacientes. Un metaanálisis ha evidenciado que el ancho del QRS es el predictor más fuerte de respuesta a la TRC independientemente del tipo de bloqueo de rama34. Por tanto, en casos muy seleccionados puede intentarse TRC sabiendo que la tasa de respuesta favorable es baja. Se está investigando estimular a estos pacientes en la zona de mayor retraso eléctrico mecánico, o ambos, en el VI determinado por ecocardiografía (speckle tracking), SPECT o mapeo electroanatómico.
3.2.3. Diferente duración del complejo QRS
Una vez conocido el beneficio de la TRC en pacientes con QRS >130 ms, se estudió el potencial beneficio de esta terapia en pacientes con QRS normal o <130 ms que cumplieran criterios de disincronía por otros métodos, como el ecocardiograma Doppler y tisular. Los estudios RethinQ35 y ECHO-CRT36 fueron los más importantes y arrojaron resultados negativos en este sentido. Incluso el beneficio de la TRC es menor cuando el QRS es >130 ms, pero <150 ms.
Otros estudios sugieren que el beneficio de la TRC disminuye francamente y la mortalidad es más elevada cuando el ancho del QRS es >200 ms, traduciendo probablemente una miocardiopatía muy avanzada37.
El BCRI y la duración del QRS >150 ms (y <200 ms), parámetros electrocardiográficos de fácil obtención, siguen siendo los predictores más importantes de respuesta favorable a la TRC.
3.2.4. Pacientes en clase funcional I de la NYHA
Los estudios MADIT-CRT27 y REVERSE28 incluyeron a pacientes en CF I, la proporción fue baja (menor a 20%). Si bien los subanálisis en esta población sugieren mejoría de parámetros ecocardiográficos y retraso en la aparición de síntomas, no se comprobó beneficio en los puntos finales primarios en este subgrupo. La información disponible es entonces insuficiente para indicar TRC en pacientes con CF I.
3.2.5. Pacientes dependientes de marcapasos
Como es sabido, el marcapaseo en el VD determina una situación similar al BCRI: disincronía intra e interventricular. Esto cobra mayor importancia en pacientes con FEVI disminuida. Aunque el estudio BLOCK-HF31 mostró los beneficios de la TRC en pacientes con FEVI <50%, el concepto más aceptado es usar la TRC en pacientes dependientes de marcapasos y FEVI severamente disminuida (<35%).
3.2.6. Pacientes con insuficiencia mitral
Los grandes estudios han mostrado disminución de la insuficiencia mitral (IM) por TRC. Sin embargo, los pacientes con IM muestran tasas más bajas de respuesta clínica a la TRC. Además, en la IM isquémica la TRC no se asocia a mejoría clínica significativa, lo que puede estar vinculado a la incapacidad de estimular la pared lateral del VI por presencia de cicatriz extensa a ese nivel38.
3.3 Mejorando la respuesta a la resincronización cardíaca
Uno de los grandes problemas de la TRC es la tasa de no respondedores, la cual es aproximadamente de 30%. De hecho, pacientes que responden inicialmente pueden volverse no respondedores. Para minimizar la no respuesta a la TRC se han estudiado diferentes aspectos que se analizarán.
3.3.1. Electrodo de estimulación. Ubicación y nuevas tecnologías
El implante percutáneo a nivel epicárdico a través del seno coronario es la técnica de elección. Se ubica el electrodo en la vena lateral o posterolateral tributaria del seno coronario. La exacta ubicación del electrodo es dependiente de la anatomía del seno coronario y sus venas tributarias, hecho que es muy variable de un paciente a otro. La alternativa en casos de imposibilidad es el implante quirúrgico epicárdico del electrodo del VI (toracotomía y sutura directa en el epicardio), de mayor riesgo por tratarse de un abordaje quirúrgico.
La ubicación del electrodo en la pared anterior y en la zona apical del VI es la que conlleva la peor respuesta a la TRC39(Figura 3).
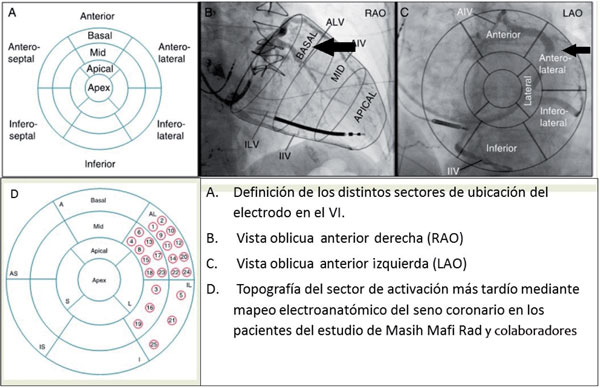
Figura 3: Definición de los distintos sectores de ubicación del electrodo en el VI y su visualización según los enfoques (A, B, C) y resultados del mapeo en pacientes del estudio de Masih Mafi Rad (D). Modificado de referencia 39.
Recientemente se han publicado estudios utilizando la alternativa de la estimulación del VI por vía endocárdica, lo que puede realizarse por diferentes técnicas40), (41(Figura 4). Incluso se ha logrado la estimulación endocárdica sin electrodo (leadless) a través de un dispositivo que se implanta a nivel endocárdico del VI y estimula mediante ultrasonido transmitido desde un dispositivo subcutáneo enfrentado42.
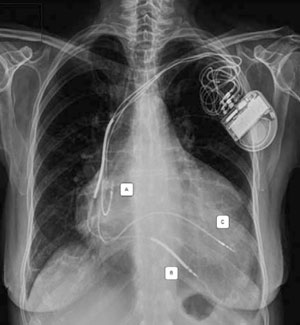
Figura 4: Radiografía de tórax de un paciente a quien se le implantó un TRC-D por vía endocárdica transeptal usando la técnica Jurdham. A. Electrodo auricular. B. Electrodo ventricular con doble bobina de desfibrilación. C. Electrodo endocárdico en pared lateral del VI a través de septum interauricular. Gentileza del Dr. Benjamin Elencwajg.
La estimulación endocárdica tiene la ventaja de que la conducción desde el endocardio al epicardio (endo-epi) es más rápida que la inversa (epi-endo), por lo que se logran complejos QRS más finos y resincronización más fisiológica. Además, se puede elegir el sitio de estimulación con mayor precisión. La desventaja es la alta tasa de stroke y, por tanto, el paciente debe quedar anticoagulado con warfarina con objetivos similares a los usados para las válvulas mecánicas.
En este último año se ha desarrollado el marcapaseo del haz de His (MHH). Si bien es una forma de estimulación ya conocida desde hace tiempo, el advenimiento de tecnología nueva en electrodos y vainas y estudios en este sentido han logrado establecerla como una de las alternativas más fisiológicas en el “mundo” de la estimulación cardíaca43), (44.
Estudios fisiopatológicos de los albores de la electrofisiología básica han sentado la base para la posibilidad de lograr el afinamiento del complejo QRS mediante MHH en pacientes con BCRI. De alguna forma, la mayoría de los pacientes con BCRI presentan un trastorno en la conducción que es longitudinal, por lo que la estimulación del haz de His puede lograr el restablecimiento de la conducción fisiológica por ambas ramas y por tanto un QRS estrecho normal o casi normal, demostrado en series de casos.
Ya han comenzado estudios que comparan MHH y TRC clásica vía seno coronario en pacientes con las indicaciones clásicas de TRC, lo que ha determinado un gran entusiasmo ante la posibilidad de lograr la resincronización en pacientes con indicación de TRC sin necesidad de ubicar un electrodo en el VI y con un procedimiento mucho más sencillo que el de TRC clásico (Figura 5) (Figura 6).
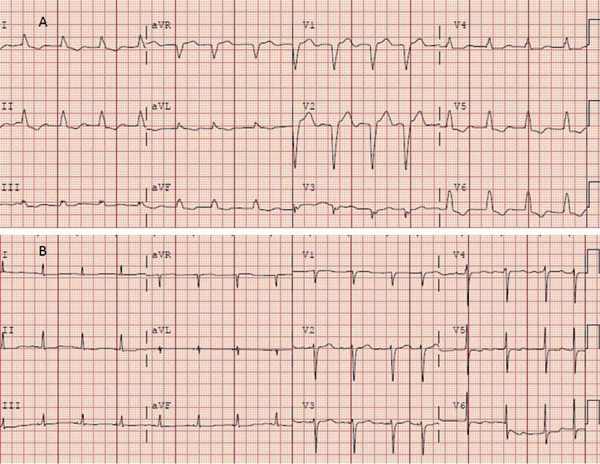
Figura 5: ECG previo (A) a la estimulación hisiana (BCRI) y posterior (B) (QRS fino). Gentileza del Dr. John Mandrola.
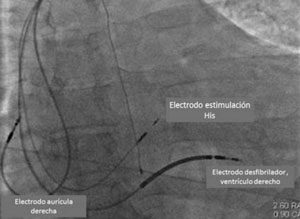
Figura 6: Imagen radioscópica de un paciente en el que se realizó implante de CDI bicameral con marcapaseo de His. Modificado de referencia 43.
Se ha evaluado la utilidad de los estudios de medicina nuclear (análisis de fase en el SPECT), ecocardiográficos (speckle tracking) y con sistema de mapeo tridimensional para ubicar el sitio de activación más tardía para decidir la implantación del electrodo del VI. Si bien hay algunos resultados alentadores, todavía no han logrado relevancia clínica, por lo que se necesitan estudios randomizados de mayor porte para generalizar su uso39.
Nuevas tecnologías de los electrodos para el VI han determinado mejoras sustantivas en la tasa de éxito de los implantes y en la capacidad de respuesta. Es el caso de los electrodos cuadripolares para implante en las venas tributarias del seno coronario. Además, permite la estimulación multipunto del VI (estimulación simultánea desde varios electrodos del catéter en el VI), lo que en estudios preliminares ha determinado una reducción adicional de los no respondedores y una mejor respuesta a la TRC. En este sentido existen varios estudios en marcha para definir el exacto rol de esta tecnología promisoria (45.
3.3.2. Programación de la resincronización. Optimización de los intervalos
Existen varios métodos para optimizar los intervalos AV e interventricular (VV) en la TRC que se pueden programar luego del implante: ecocardiográficos, electrocardiográficos y electrofisiológicos. No se ha demostrado el beneficio de estos cambios de programación. Sin embargo, en casos seleccionados puede lograrse un importante impacto clínico. Por tanto, la recomendación es limitar la optimización de este intervalo a los no respondedores46.
Como fue dicho, la programación de la TRC es importante para lograr el mayor porcentaje posible de estimulación biventricular. La respuesta positiva a la TRC se ha observado en estimulación biventricular >90% y es óptima cuando alcanza el 98% o más. La presencia de arritmias ventriculares (extrasístoles, TV no sostenida) o supraventriculares (principalmente FA) son causas de disminución del porcentaje de estimulación biventricular, por lo que deben ser tratadas enérgicamente con fármacos o ablación.
3.4. Respuesta a la resincronización. Caracterización y predictores
La mejoría de los síntomas debida a la TRC ocurre precozmente en las horas y días consecutivos al implante, aunque algunos estudios sugieren que es óptima luego de un mes posimplante.
Las posibles características de respuesta a la TRC son:
- Respondedor: mejoría significativa de la clase funcional y ligero aumento de la FEVI. Corresponde aproximadamente al 60% de los casos.
- Superrespondedor: mejoría en 2 puntos o más de la clase funcional y normalización o casi normalización de la FEVI. Cerca de 10% de los pacientes logran este resultado.
- No respondedor: no mejoría de ninguno de los parámetros clínicos ni ecocardiográficos, aproximadamente 30% de los casos.
- Respondedor negativo: agravación de los síntomas con la TRC. Corresponde a cerca de 5% de los casos y se vincula casi exclusivamente con la ubicación del electrodo en el VI en lugares no adecuados, por lo que debería ser evitable.
La experiencia acumulada en años de aplicación de la TRC ha logrado establecer predictores de buena y mala respuesta a este tratamiento.
La ecocardiografía Doppler y tisular no ha logrado definir cuáles son los parámetros preimplante que garantizan una respuesta positiva a la TRC.
La cardiorresonancia en pacientes con CMI ha mostrado que la presencia de cicatriz en menos del 15% del miocardio y la ausencia de cicatriz posterolateral son elementos predictores de respuesta positiva a la TRC.
3.5. Beneficios de agregar cardiodesfibrilador a la TRC
Los pacientes que se benefician de TRC cumplen con los parámetros establecidos en las guías y derivados de los grandes estudios (MADIT I y II, SCD-HeFT, entre otros) de indicación de CDI para prevención primaria de MS cardíaca. Por tanto, los candidatos a TRC deberían ser implantados con un dispositivo con capacidad para TRC-D5,14,27.
La evidencia sobre el beneficio de agregar CDI a la TRC surge del estudio COMPANION y de otros de menor porte. Sin embargo, debe tenerse en cuenta que la TRC por sí misma determina disminución de la mortalidad total y que muchos pacientes mejoran significativamente la FEVI, llegando a valores >35% en los que la prevención primaria de MS con CDI no está demostrada21.
Existen descripciones de casos en que al momento de cambio del generador por agotamiento de la batería se realizó sustitución del TRC-D por un TRC-P con buena evolución. Al menos la discusión debe plantearse47.
Ya fue analizado el menor impacto en el beneficio de la prevención primaria de MS con CDI en la CMNI comparado con la isquémica. El estudio SCD HeFT no tuvo en cuenta la TRC10.
Como fue analizado más arriba, el estudio DANISH19 intentó dar respuesta a este tema, en el cual el 58% de los pacientes recibieron TRC concomitante. Si bien no hubo beneficios del implante de CDI en el punto final primario de mortalidad total, sí mostró que el beneficio sobre la mortalidad total con CDI es a largo plazo y más evidente en poblaciones más jóvenes. Por tanto, en nuestra opinión, debe individualizarse el agregado de CDI a la TRC (TRC-D) especialmente en pacientes con miocardiopatía dilatada no isquémica donde la edad, la expectativa de vida y las enfermedades comórbidas pueden jugar un rol para definir la conducta.
3.6. Complicaciones de la TRC
Todo procedimiento de implante de dispositivo tiene complicaciones periprocedimiento y estas parecen ser mayores en el implante de TRC. Se ha objetivado una tasa de complicaciones intraoperatorias cercana a 10%. La incapacidad de ubicar el electrodo en el seno coronario es la más frecuente. Otras incluyen: taponamiento cardíaco, disección del seno coronario, neumotórax y descompensación de IC.
Las complicaciones posprocedimiento son también cercanas a 10% e incluyen: desplazamiento del electrodo del VI que requiere reposicionamiento en 4% de los casos, estimulación frénica, infección o hematoma del bolsillo.
3.7. Costo/eficacia de la TRC
La TRC disminuye el costo asociado a las rehospitalizaciones por IC, lo que determina un beneficio en el balance costo/eficacia a pesar del alto costo inicial y las complicaciones, siendo comparable y hasta mejor que otros tratamientos médicos de alto costo, aceptados y financiados por los sistemas de salud. Dado el mayor costo de la TRC-D, su relación costo/eficacia es menor que en la TRC aislada (TRC-P)48).
Resumen conceptual
- El implante de CDI disminuye significativamente la mortalidad total (prevención primaria) en pacientes con disfunción sistólica, aunque el impacto es menor en etiología no isquémica que en isquémica.
- La TRC disminuye la mortalidad, mejora los síntomas y disminuye las rehospitalizaciones en pacientes con IC CF II-III y IV ambulatoria, ritmo sinusal y BCRI.
- El agregado del desfibrilador a la TRC (TRC-D) disminuye adicionalmente la mortalidad total, aunque el impacto es marginal en pacientes con cardiomiopatía no isquémica mayores de 60 años.
- La tasa de no respondedores a la TRC es cercana a 30%.
- Son predictores de mejor respuesta a la TRC: CMNI, ritmo sinusal, QRS ³150 ms y sexo femenino.
- No se ha logrado demostrar beneficio de la TRC en pacientes con QRS ancho y bloqueo de rama diferente del de izquierda, con QRS angosto, ni asintomáticos.
- Para lograr la respuesta óptima a la TRC debe lograrse una estimulación biventricular durante un período mayor a 95% del tiempo.
- El lugar de ubicación del electrodo puede influir en el resultado de la TRC, siendo los sectores lateral y posterolateral basal los más eficaces.
- Diferentes aspectos técnicos de implante del electrodo en el VI pueden mejorar los resultados de la TRC, como la utilización de electrodos cuadripolares, la estimulación multipunto, el marcapaseo endocárdico del VI y más recientemente el promisorio marcapaseo del haz de His.
- La TRC aislada es costo/eficacia superior a varios tratamientos usados en cardiología. La relación costo/eficacia es menor en la TRC-D debido al mayor costo del dispositivo.