1. Introducción
Desde la introducción del tema por Feinstein, han habido muchas definiciones de comorbilidad; quizá la más aceptada actualmente es la presencia de dos o más enfermedades en el mismo individuo con el diagnóstico de cada una de ellas basado en criterios establecidos y no relacionadas causalmente con el diagnóstico primario1.
En general la investigación clínica se centra en la prevención, diagnóstico y tratamiento de una sola enfermedad y eso se ve reflejado en la mayoría de los ensayos clínicos controlados, los que excluyen sistemáticamente a pacientes con comorbilidades. Dado que las guías de práctica clínica basan sus recomendaciones en los resultados de dichos estudios, estas pueden resultar de difícil aplicación en la vida real2.
La insuficiencia cardíaca (IC), enfermedad prevalente en edades avanzadas, se ve frecuentemente acompañada por comorbilidades que complican el cuidado de los pacientes llevando a la polifarmacia con riesgo de interacciones farmacológicas, de no adherencia al tratamiento y aumento de la tasa de internaciones3.
Datos aún no publicados de la cohorte perteneciente a la Unidad Multidisciplinaria de Insuficiencia Cardíaca del Hospital de Clínicas (UMIC) muestran que el 45% de los pacientes mayores de 65 años presenta dos o más comorbilidades (Figura 1). Dentro de estas la insuficiencia renal, la anemia y la depresión son las más frecuentes4), (5.
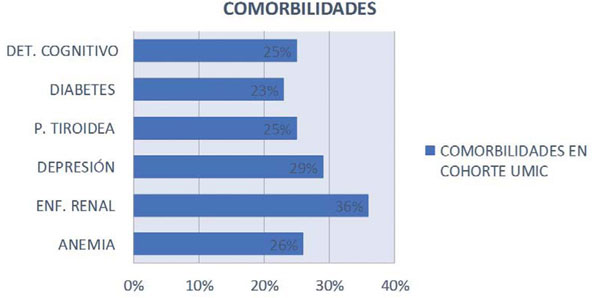
Figura 1: Comorbilidades en la Unidad Multidisciplinaria de Insuficiencia Cardíaca del Hospital de Clínicas (UMIC).
Según el registro del sistema Medicare estadounidense, dentro de las enfermedades crónicas no transmisibles, la IC es la que más se asocia a comorbilidades (Figura 2)6.
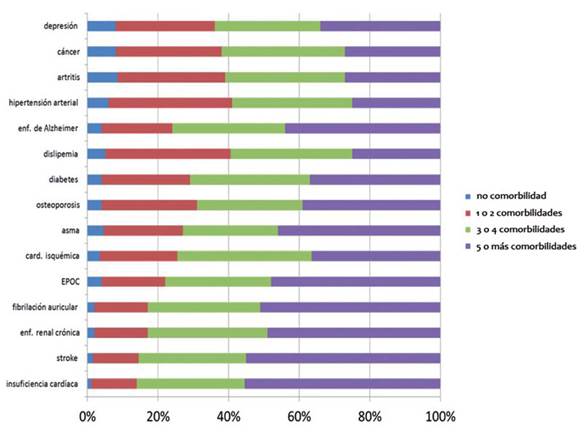
Figura 2: Comorbilidades en enfermedades crónicas en beneficiarios de Medicare 2010. Tomado de referencia 6.EPOC: enfermedad pulmonar obstructiva crónica
Considerando estos aspectos las guías para el manejo de la IC de la Sociedad Europea de Cardiología (ESC) y de la Asociación Americana del Corazón (AHA) han ido abordando, en forma progresiva, las patologías que acompañan a esta enfermedad7), (8), (9.
El objetivo de este artículo es considerar los aspectos prácticos que deben tener en cuenta los médicos y, en especial, los cardiólogos cuando se aborda el control clínico de un paciente con IC y comorbilidades.
A efectos didácticos se dividirán las distintas comorbilidades en cardiovasculares y no cardiovasculares.
2. Comorbilidades cardiovasculares
2.1. Enfermedad coronaria
Si bien la enfermedad coronaria es la etiología más frecuente de IC con fracción de eyección reducida (ICFEr), también puede presentarse como una patología satélite en pacientes con IC de otra causa determinando distintas conductas terapéuticas y evaluaciones pronósticas10.
Felker ha propuesto una definición de cardiomiopatía isquémica que sigue siendo aceptada hasta el momento actual y que implica disfunción sistólica y presencia de alguno de estos criterios: historia de infarto de miocardio o revascularización (quirúrgica o percutánea); estenosis ³75% en el tronco izquierdo o arteria descendente anterior; estenosis ³75% en dos o más vasos epicárdicos11.
Considerando la propuesta de Felker, la enfermedad coronaria sin las características descritas no debería aceptarse como etiología de disfunción sistólica sino como una comorbilidad con todas sus implicancias.
En estos pacientes, además de los fármacos aceptados para el manejo de la IC, deben considerarse los que tratan síntomas como la angina. En tal sentido los betabloqueantes (BB) siguen siendo la primera elección con beneficio demostrado12.
La ivabradina en pacientes en ritmo sinusal y con disfunción sistólica, ya sea asociada a BB o como alternativa en los pacientes que tienen contraindicación para los mismos, ha resultado beneficiosa y debe tenerse en cuenta13.
La trimetazidina ha demostrado ser efectiva y segura en pacientes con IC y angina14.
Mientras que los nitratos siguen siendo una droga segura en los pacientes con ICFEr, los calcioantagonistas, con la excepción de amlodipina y felodipina, no deben utilizarse15.
En cuanto a la revascularización miocárdica, si bien hay acuerdo general en su realización en pacientes con angina persistente bajo tratamiento médico, no es clara la conducta más adecuada en otras situaciones8. En otro capítulo de este suplemento especial se realiza un análisis pormenorizado del tema.
El método de revascularización debe ser decidido por el equipo cardiológico teniendo en cuenta la situación clínica y la anatomía coronaria, atendiendo a la presencia de valvulopatías, aneurismas y otras comorbilidades.
La cardiopatía isquémica debe ser considerada también a la hora de definir la colocación de dispositivos para prevención de muerte súbita, como los cardiodesfibriladores implantables (CDI), o para mejorar la situación funcional, como la terapia de resincronización (TRC).
El beneficio de la prevención primaria de muerte súbita con CDI es mayor en los pacientes con miocardiopatía isquémica frente a la miocardiopatía dilatada no isquémica y, por otra parte, no está indicado colocar un CDI en el paciente que ha sufrido un infarto de miocardio en los 40 días previos16), (17.
La etiología isquémica es un factor negativo a la hora de evaluar una eventual respuesta a TRC18.
2.2. Hipertensión arterial
La hipertensión arterial (HTA) y la IC son patologías altamente prevalentes y, a su vez, la IC es una complicación de la HTA casi tan frecuente como el accidente cerebrovascular (ACV)19.
Es común el antecedente de HTA en pacientes con IC; sin embargo, los valores elevados de presión arterial suelen descender cuando la IC se establece.
No hay estudios controlados que aborden el control de la presión arterial en pacientes con IC, pero todos los datos parecen indicar que un adecuado control de la misma disminuiría los eventos cardiovasculares pudiendo plantearse, como valor objetivo, una presión arterial sistólica ?130 mmHg7,20.
El beneficio de los inhibidores de la enzima convertidora de angiotensina (IECA), BB, antagonistas de receptores de la angiotensina II (ARAII) y antagonistas de los receptores mineralocorticoides (ARM) en los pacientes con ICFEr se atribuye a su efecto sobre el sistema renina angiotensina (SRA) y sobre el sistema simpático (SS), más que por su efecto sobre la presión arterial.
2.3. Fibrilación auricular
La fibrilación auricular (FA) es la arritmia más frecuente en la IC y tiene vínculos etiopatogénicos, ya que puede generar disfunción sistólica mientras que las alteraciones estructurales de las miocardiopatías favorecen su aparición21.
Se relaciona con aumento de riesgo de ACV, deterioro de la función ventricular y deterioro sintomático22.
En todo paciente portador de IC que presenta FA debe analizarse:
- Posibles causas o factores precipitantes: distiroidismos, disionía, HTA no controlada, isquemia miocárdica, ingesta de alcohol, y cuadro respiratorio intercurrente (bronquitis, neumonía, enfermedad pulmonar obstructiva crónica (EPOC) descompensada o asma no controlado).
- El riesgo embólico del paciente, calculado mediante el uso de scores validados, casi siempre es elevado y determina la recomendación de anticoagular.
- La frecuencia cardíaca para su adecuado control.
- La repercusión sintomática para un manejo adecuado.
Finalmente, la presencia de FA en los pacientes con IC limita el uso de terapias cuyo beneficio se restringe a pacientes en ritmo sinusal (ivabradina, resincronización biventricular), de ahí la importancia de recuperar y mantener el ritmo sinusal.
Un análisis más profundo de sus implicancias y manejo es abordado en otro capítulo de este suplemento especial.
3. Comorbilidades no cardiovasculares
3.1. Dislipemia
Los pacientes con ICFEr suelen tener valores bajos de LDL y esto se ha asociado a mal pronóstico. No se recomienda la indicación rutinaria de estatinas en los pacientes con IC porque no demostraron disminuir morbilidad y mortalidad combinadas23.
De todas maneras vale decir que independientemente de la escasez de evidencia, la presencia de una dislipemia con valores elevados de colesterol LDL o triglicéridos y factores de riesgo cardiovascular debe abordarse como en la población general24.
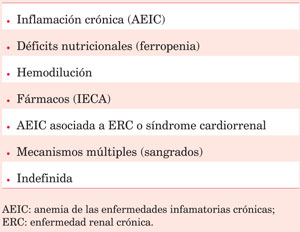
3.2. Anemia y déficit de hierro
La anemia es frecuente en los pacientes con IC determinando mala tolerancia al ejercicio, mayor sintomatología y peor pronóstico, pudiendo actuar como causa de descompensación y hospitalización25. Su incidencia es variable (15%-61%) teniendo una relación directa con la clase funcional26.
En la UMIC la prevalencia de anemia es de 34% (datos no publicados).
Los mecanismos fisiopatológicos son múltiples, complejos y no siempre bien comprendidos, debiéndose investigar causas tratables27. Las causas más frecuentes se resumen en la (Tabla 1).
La utilización de estimulantes de la eritropoyesis no ha demostrado resultados beneficiosos en los pacientes con anemia sin causa demostrada28.
Actualmente se ha centrado la atención en la alta incidencia de déficit de hierro con o sin anemia en pacientes con ICFEr. La prevalencia de ferropenia ronda en 40% y se vincula con el agravamiento de la disnea y mayor intolerancia al ejercicio29.
Más allá de su papel en la eritropoyesis, el hierro interviene en la formación de la mioglobina y es cofactor de enzimas involucradas en la fosforilación oxidativa y formación de ATP, por lo que su déficit afecta el metabolismo oxidativo y la energética celular.
Es aconsejable realizar hemograma y estudio del metabolismo férrico anualmente o cuando haya cambios en la clase funcional, aumento de péptidos natriuréticos o deterioro de la fracción de eyección del ventrículo izquierdo (FEVI)30.
La ferritina puede estar aumentada como reactante de fase aguda, por lo cual diagnosticar el déficit de hierro requiere un índice de saturación de transferrina (IST) <20% o la dosificación de receptor soluble de transferrina, este último no siempre disponible. Se define ferropenia cuando se comprueban valores de ferritina <100 g/l, o entre 100 y 300 g/l junto con un IST <20%29), (30.
Estudios clínicos aleatorizados han valorado el tratamiento con carboximaltosa férrica intravenosa en la ICFEr y déficit de hierro con o sin anemia, mostrando beneficios en la calidad de vida y la capacidad funcional con disminución del número de hospitalizaciones, aunque no de la mortalidad31.
Es recomendable tratar la ferropenia con o sin anemia en IC con preparados de hierro endovenosos (no se han visto beneficios con la vía enteral) siempre que la hemoglobina sea <15 g/l.
3.3. Enfermedad pulmonar obstructiva crónica
Por varios motivos (envejecimiento de la población, compartir los mismos factores de riesgo, mejora en técnicas diagnósticas, sospecha clínica elevada) la prevalencia de la EPOC en la IC ha ido en aumento en la última década. Diferentes registros poblacionales mencionan una prevalencia de 10% a 50%. La asociación de ambas patologías confiere un peor pronóstico con mayor hospitalización y mortalidad32.
El diagnóstico de IC es más dificultoso en pacientes con EPOC por su sintomatología similar, con hallazgos radiológicos que alteran los patrones típicos, ventanas dificultosas para el ecocardiograma y péptidos natriuréticos que pueden aumentar en ambas patologías.
Respecto a la espirometría, si bien es característico el patrón obstructivo de la EPOC frente al patrón restrictivo de la IC, la hipervolemia puede generar hiperreactividad bronquial y un patrón obstructivo que determine confusión, por lo que es importante que el paciente se encuentre estable y euvolémico por lo menos tres meses previos al estudio33), (34.
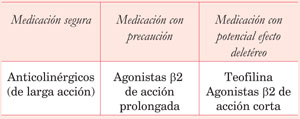
Respecto a la terapéutica, los agonistas 2 adrenérgicos pueden producir taquicardia y aumento del consumo de oxígeno, originando efectos negativos en la evolución clínica de los pacientes con IC. Diversos estudios han demostrado un incremento de la mortalidad y de los reingresos por IC en los pacientes con EPOC e ICFEr tratados con agonistas de corta duración y se aboga por el uso de agonistas de larga duración en caso de ser necesarios35.
Mientras los anticolinérgicos de acción corta, como el bromuro de ipratropio, se asociaron a una mayor frecuencia de eventos cardiovasculares, los de acción prolongada, como el tiotropio, han mostrado, respecto al placebo, una reducción de la mortalidad cardiovascular en pacientes con EPOC y son seguros en pacientes con IC36.
Los corticoides inducen retención hidrosalina, por lo que su utilización a altas dosis puede aumentar el número de descompensaciones. En caso de usarlos, es preferible emplear la vía inhalatoria que puede ser una alternativa eficaz con menos efectos secundarios37.
Las teofilinas, cada vez menos empleadas, no se recomiendan por su elevado riesgo de arritmias38.
En la (Tabla 2) se resume lo comentado.
Existe evidencia que respalda el uso del betabloqueo cardioselectivo (nebivolol o bisoprolol) en pacientes con ICFEr y EPOC, recomendándose siempre una adecuada titulación de las dosis8), (39.
Con respecto a los diuréticos de asa, fármacos muy utilizados en IC, las dosis elevadas pueden producir alcalosis metabólica e hipoventilación compensadora, agravando una posible hipercapnia, por lo que a dosis altas deben usarse con precaución40.
3.4. Enfermedad renal crónica
La enfermedad renal crónica (ERC) es una comorbilidad muy frecuente y puede estar presente en 40% a 50% de los pacientes en estadios avanzados de IC. A mayor clase funcional o mayor deterioro de la FEVI, mayor es la prevalencia41. En la UMIC la prevalencia de ERC es de 34%4.
La ERC es un factor independiente de mal pronóstico porque aumenta la morbilidad, las hospitalizaciones y la mortalidad. Además, dificulta en muchos casos la optimización del tratamiento limitando, sobre todo el uso de ARA II, IECA y ARM42) (43) (44.
Múltiples son los mecanismos de interacción renal y cardíaca en la IC y se pueden agrupar en tres categorías fisiopatológicas: alteraciones hemodinámicas debidas tanto al bajo gasto como a la congestión venosa; activación neurohormonal sostenida del SRA y del SS; factores aceleradores del deterioro cardíaco y renal como la inflamación, las alteraciones celulares inmunomediadas y las metabólicas45.
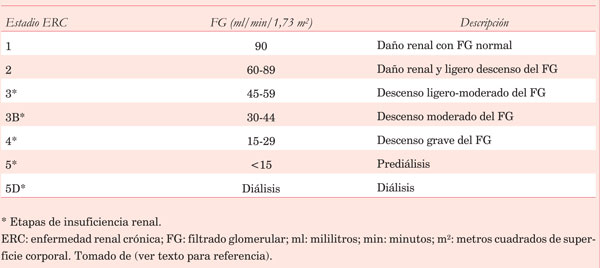
El concepto de insuficiencia renal crónica (IRC), que es diferente al de ERC, implica un deterioro progresivo e irreversible (durante más de tres meses) de la función renal determinada por el filtrado glomerular (FG) <60 ml/min/1,73 m2. Según esta evolución se establecen distintos estadios (Tabla 3)46.
Clásicamente se ha utilizado la concentración sérica de creatinina para evaluar la función renal, pero se ha observado que incluso cifras dentro de los valores de referencia pueden corresponder a FG <60 ml/min/1,73 m2, por lo que no debería utilizarse como única prueba para el estudio de la función renal. El FG es la mejor herramienta, pero su estudio por depuración de la creatinina presenta una serie de inconvenientes.
Las guías K-DOQI y KDIGO, entre otras, recomiendan la estimación del FG mediante ecuaciones obtenidas a partir de la medida de la concentración de creatinina sérica, la edad, el sexo y la raza. Estas ecuaciones son más exactas que la medida de la creatinina sérica aislada47), (48.
El grupo Cronic Kidney Disease-Epidemiology Collaboration (CKD-EPI) publicó una ecuación conocida como CKD-EPI y que es recomendada por las guías KDIGO 2012, utilizando como variables para su cálculo: edad, sexo, raza y creatinina (no considera el peso), pudiéndose acceder a ella a través de la web49.
A continuación se realizará un punteo de aspectos prácticos que el clínico deberá tener en cuenta en los pacientes con IC y ERC al momento de definir la terapéutica:
- La presencia de ERC moderada no es contraindicación para el uso de IECA, ARA II o ARM, incluso los datos sobre sacubitril/valsartán permiten sustentar el mismo concepto para este fármaco. En estadios más avanzados se debe individualizar el tratamiento8), (45), (50.
- Es esperable una agravación de la función renal hasta en 30% cuando se inicia el tratamiento con IECA, lo que no es indicación de suspensión de los mismos.
- La ERC no es una contraindicación para la prescripción de BB.
- Los diuréticos de asa son de elección para el tratamiento de los síntomas congestivos. Ante la presencia de resistencia diurética es necesario definir la causa de la misma (transgresión dietética, ingesta de antiinflamatorios no esteroideos (AINE), etcétera) y aumentar la dosis de diuréticos para lograr el efecto deseado51.
- En casos de hipervolemia en que se deteriora la función renal, la congestión es el factor fundamental y no se deben suspender los diuréticos, siendo a veces necesario aumentarlos.
- Las tiazidas son menos eficaces con FG <30 ml/min y no se deberían indicar; sin embargo, pueden ser útiles en casos de resistencia a diuréticos de asa potenciando sus efectos51.
- La digoxina, por su estrecho margen terapéutico, se debe utilizar con precaución en pacientes con ERC52.
- La amiodarona no requiere ajuste de dosis.
- La ivabradina se debe utilizar con precaución si el FG es <15 ml/min, dado que no está estudiada en esta población.
- La warfarina no requiere ajuste de dosis.
- Los anticoagulantes directos en general requieren ajuste de dosis según la función renal22.
- Estatinas: la atorvastatina es de elección en los pacientes con ERC53.
3.4.1. Síndrome cardiorrenal
Debido a la directa relación entre la disfunción renal y la IC, en la última década se ha venido manejando el concepto de síndrome cardiorrenal o renocardíaco como una entidad con características propias diferentes a la falla renal o cardíaca aisladas. La misma será abordada en otro capítulo de este suplemento especial, por lo cual nos limitamos simplemente a enunciarla54.
3.5. Diabetes mellitus
La diabetes mellitus (DM) también es una comorbilidad frecuente con una prevalencia que oscila entre 25% a 45% en los diferentes registros42. En la UMIC la prevalencia de DM es 20% (datos sin publicar).
La incidencia de IC es mayor en pacientes diabéticos; el estudio UKPDS mostró que la incidencia se modificaba con el valor de hemoglobina glicosilada (HbA1c), siendo 2% al año en los diabéticos con HbA1c <6% y 12% al año con HbA1c >10%55.
Los pacientes que asocian DM presentan peor clase funcional, mayor número de ingresos por IC y mayor mortalidad que los no diabéticos56-58.
Al abordar los aspectos terapéuticos se debe considerar la seguridad, efectividad y posibles interacciones de los fármacos prescriptos para ambas patologías.
A los BB se les atribuye la posibilidad de enmascarar los síntomas de hipoglucemia, aumentar el riesgo de dislipemia y disminuir la sensibilidad a la insulina, y ello podría explicar su reducida indicación en varios registros; sin embargo, los beneficios cardiovasculares superan ampliamente a estos posibles inconvenientes y debe promoverse su indicación en los pacientes con ICFEr59.
El carvedilol, por su acción alfabloqueante, disminuiría la resistencia a la insulina a diferencia de los B1 selectivos, lo cual podría ser un argumento para su elección. Si bien en el estudio COMET el carvedilol redujo 22% la incidencia de nueva diabetes respecto del metoprolol en un seguimiento a casi cinco años, sea cual sea el BB indicado, es claro el beneficio de los mismos8), (60), (61.
En cuanto a los IECA, los ARAII y los ARM no se han comprobado diferencias entre pacientes diabéticos y no diabéticos, por lo cual su indicación se mantiene más allá de esta comorbilidad8.
Dentro de los diuréticos, si bien los tiazídicos pueden producir hiperglucemia, no se deben contraindicar pero sí realizar controles metabólicos frecuentes62.
Elementos a considerar sobre el tratamiento de la DM en pacientes con IC:
- No existe evidencia a favor de realizar control estricto de la glicemia en la IC, sí un control gradual y progresivo de la misma8), (63.
- Metformina: a pesar de que su uso se ha asociado con acidosis láctica, esta es infrecuente. Es el único fármaco que ha demostrado reducir la mortalidad por cualquier causa en pacientes con IC, por lo que es considerada de primera elección64.
- Sulfonilureas: el estudio UGDP mostró que su uso se asociaba a una mayor frecuencia de eventos cardiovasculares, pero estudios posteriores no lo pudieron confirmar, de manera que en la actualidad aún persiste controversia sobre su seguridad y no son de primera elección65.
- Glitazonas: su uso se ha relacionado con una mayor retención de líquidos y están contraindicadas en pacientes con IC, independientemente de su clase funcional66.
- Acarbosa: los datos disponibles son limitados y no permiten formular recomendaciones67.
- Inhibidores de la dipeptidil peptidasa 4 (IDPP4): sitagliptina, vildagliptina y saxagliptina. Se han publicado varios estudios randomizados, doble ciego, controlados con placebo, que han evaluado end points cardiovasculares duros. En el estudio SAVOR se vio que la saxagliptina alcanzó el criterio de no inferioridad, pero se observó un inesperado incremento en la incidencia de hospitalización por IC. Sin embargo, en los estudios llevados a cabo con otros agentes no se observaron diferencias significativas en las tasas de hospitalización por IC comparado con placebo. Sería posible concluir que el riesgo en IC es bajo y se asocia principalmente con el uso de saxagliptina68), (69), (70.
- Agonistas del receptor del péptido de tipo glucagón 1 (ARGLP-1): exenatide, liraglutide, lixisenatide. No existe suficiente experiencia en pacientes con IC. Yu y colaboradores, en un estudio observacional en 57.737 pacientes, analizaron de forma conjunta los IDPP 4 y los ARGLP-1 sin encontrar relación entre su uso y la incidencia de IC71.
- Inhibidores de cotransportadores del Na-glucosa 2 (SGLT2): empagliflozina, dapaglifozina. La empaglifozina ha demostrado reducir las tasas de hospitalización y muerte por IC en pacientes con alto riesgo cardiovascular, por lo que este grupo de fármacos se presenta como muy auspicioso en los diabéticos con IC72.
- Insulina: la evidencia no es concluyente en cuanto al riesgo o beneficio de su uso. Por ser una hormona que retiene sodio, podría exacerbar la retención hídrica y agravar la IC. Al igual que con las sulfonilureas existe controversia en cuanto a mortalidad y hospitalización. Las indicaciones de insulinizar son iguales a los pacientes sin IC73.
- Cuando un paciente ingresa por una descompensación de su IC es recomendable retirar todos los hipoglucemiantes orales y pasar a una insulinización transitoria74.
3.6. Distiroidismo
La disfunción tiroidea (hipertiroidismo/hipotiroidismo) se presenta con mayor frecuencia en los pacientes con IC respecto a la población general con una prevalencia aproximada de 15% a 30%75.
En la UMIC, la prevalencia es 5% de hipertiroidismo y 10% de hipotiroidismo (datos sin publicar).
La disfunción tiroidea se puede presentar como comorbilidad de la IC, o ser la causa de la misma; en este capítulo solo se abordará la primera de estas situaciones.
3.6.1. Hipertiroidismo
La presencia de hipertiroidismo conlleva un peor pronóstico dado el aumento del catabolismo y del consumo energético además del incremento en la incidencia de FA hasta en 20%75.
Las etiologías del hipertiroidismo en pacientes con IC son similares a la población general y el tratamiento, cuando no es causado por amiodarona, no difiere del de los pacientes sin IC, siendo el radioyodo el tratamiento de primera línea. Se reserva el tratamiento farmacológico (antitiroideos de síntesis) cuando está contraindicado el radioyodo, o como terapia puente al mismo.
3.6.2. Hipotiroidismo
El hipotiroidismo rara vez es causa primaria de IC, pero su concomitancia se asocia a un peor pronóstico pudiendo actuar como causa de descompensación, por lo que siempre que se halle un hipotiroidismo clínico (TSH elevada y T4-T3 descendidas) debe realizarse terapia de sustitución hormonal.
El hipotiroidismo subclínico (TSH elevada y T4-T3 normales) es una situación frecuente y tiene las mismas connotaciones que el hipotiroidismo manifiesto, por lo que su pesquisa debe ser sistemática y debe ser tratado si la TSH >10 mU/l. No está indicado el tratamiento con TSH <7mU/l, quedando una “zona gris” entre 7-10 mU/ l en la que la evidencia es discutida y no existe fuerte recomendación al respecto76.
3.6.3. Distiroidismos por amiodarona
La amiodarona es un fármaco frecuentemente utilizado en pacientes con IC, ya sea para prevención de recurrencia de FA o prevención de arritmias ventriculares.
Existe una semejanza estructural entre la amiodarona y su metabolito desetilamiodarona con las hormonas tiroideas. Como posee, además, un alto contenido en yodo (37% de su peso molecular) puede llevar al desarrollo de distiroidismos77.
Se sugiere dosificación de TSH previo al inicio del tratamiento con amiodarona y luego en forma periódica cada tres a seis meses hasta por lo menos un año luego de suspendido el fármaco.
Prácticamente todos los pacientes en tratamiento con amiodarona pueden tener un ascenso de la TSH con un leve aumento de T4 y T3 durante los primeros meses, lo que se consideran variaciones aceptables.
El hipotiroidismo inducido por amiodarona se puede observar hasta en 20% de los casos y el hipertiroidismo hasta en 10%.
Mientras que en el hipertiroidismo se debe suspender el fármaco y realizar tratamiento en acuerdo con endocrinólogo, en el hipotiroidismo puede mantenerse la amiodarona, si es imprescindible, instaurándose la sustitución hormonal78.
3.7. Disfunción eréctil
La presencia de disfunción eréctil (DE) puede ser un componente negativo en la calidad de vida del paciente, quien, habitualmente, no relata este problema por vergüenza, por lo que es importante considerarlo en el interrogatorio79.
Se deben tener en cuenta comorbilidades favorecedoras como la diabetes o arteriopatías y tener presente que múltiples drogas utilizadas para el tratamiento de la IC pueden aumentar la DE, como los diuréticos tiazídicos, los BB o la espironolactona. Es importante pesquisar síntomas de ansiedad y depresión acompañantes.
El clínico debe intentar, por el interrogatorio, determinar si el componente predominante en la génesis de la DE es orgánico o psicógeno y considerar la consulta con un especialista en medicina sexual.
En el tratamiento de la DE predominantemente orgánica, los inhibidores de la 5 fosfodiesterasa han demostrado su utilidad con un perfil hemodinámico favorable en pacientes con ICFEr. Estos fármacos están contraindicados en pacientes que reciben nitritos80.
3.8. Trastornos ventilo-respiratorios durante el sueño
Los trastornos ventilo- respiratorios durante el sueño son muy frecuentes en la IC con una prevalencia que puede llegar a más de 60%. Se asocian a aumento de la morbimortalidad por IC y su tratamiento puede mejorar el pronóstico y la calidad de vida81.
Las dos formas más comunes son la apnea obstructiva del sueño (AOS) y la apnea central del sueño (ACS), siendo importante su diferenciación pues tienen distintas implicancias pronósticas y terapéuticas82.
El juicio clínico y el alto valor de sospecha son fundamentales para un correcto diagnóstico, disponiéndose de cuestionarios para el screening rápido83.
Si bien existen actualmente equipos que simplifican su diagnóstico, sigue siendo la polisomnografía el instrumento para su confirmación.
En cuanto a la terapéutica, optimizar el tratamiento de la IC es la principal estrategia. Para pacientes que persisten sintomáticos a pesar del manejo óptimo de la IC, la ventilación no invasiva (VNI) con el uso del dispositivo de presión positiva en la vía aérea (PAP) mejora los parámetros de la IC y del trastorno ventilatorio84.
La VNI se debe indicar fundamentalmente durante la noche. El beneficio se observa en reducción del índice apnea/hipopnea, mejoría en el volumen espiratorio forzado en 1 s, en el test de la marcha y en la oxigenación nocturna85.
Respecto al tratamiento de la AOS, la reducción del sobrepeso y la obesidad, junto con VNI-PAP, han mostrado buenos resultados, promoviéndose el uso de esta última para mejorar la calidad de vida de los pacientes86.
No se recomienda el uso de adapto servo-ventilación (ASV) en ICFEr, ya que se demostró aumento de mortalidad cardiovascular y por otras causas86), (87.
3.9. Fragilidad y deterioro cognitivo
Dada la alta prevalencia de la IC en los adultos mayores, la fragilidad y el deterioro cognitivo son frecuentes asociaciones que dificultan el manejo de la misma.
Existen sistemas de puntuación de fragilidad que permiten objetivación y seguimiento de esta problemática. Los ancianos frágiles que ingresan por IC tienen peor evolución, mayor mortalidad y requieren seguimiento estrecho con estrategias especiales de cuidado88.
El deterioro cognitivo es común en los pacientes con IC con una prevalencia que varía ampliamente (30% a 80%). Tiene un origen multifactorial, impacta negativamente en la capacidad de autocuidado y está asociado a mayor morbimortalidad. Existen instrumentos de evaluación rápida para su detección como el Mini Mental State Examination o la evaluación cognitiva Montreal89.
3.10. Depresión
La depresión está presente entre el 17% y 37% de los pacientes con IC y tiene impacto negativo en el pronóstico. En un estudio transversal descriptivo de 151 pacientes de UMIC se detectó depresión mayor en el 29,8% de los mismos5), (90.
Es importante su pesquisa y para ello existen cuestionarios breves, sencillos y validados91.
Los inhibidores selectivos de la recaptación de serotonina son considerados seguros para el tratamiento en pacientes con cardiopatía debiendo evitarse el uso de antidepresivos tricíclicos. Las intervenciones psicosociales, las terapias cognitivo-conductuales y el entrenamiento físico han mostrado efectos beneficiosos en la calidad de vida.
3.11. Obesidad
La obesidad se ha convertido en una de las mayores preocupaciones sanitarias en el mundo por su creciente aumento en la población general.
Cuando se encuentra asociada a la IC puede dificultar el diagnóstico por síntomas similares como disnea, intolerancia al ejercicio, edemas maleolares, con malas ventanas para evaluación ecocardiográfica y valores de péptidos natriuréticos falsamente bajos93), (94.
Se ha observado que los pacientes obesos con ICFEr tienen una mortalidad cardíaca menor que el resto de los pacientes, lo que se ha denominado “paradoja de la obesidad”95.
Existen dos posibles hipótesis para explicar este fenómeno: una plantea que los obesos tienen una mayor reserva de masa corporal para enfrentar el efecto catabólico de la enfermedad; la otra hipótesis se vincula con los procesos inflamatorios: las personas con sobrepeso tienen algunos factores que los protegen de la inflamación (lipoproteínas que neutralizan las toxinas liberadas por ciertas bacterias intestinales; un mayor número de receptores para el factor de necrosis tumoral (TNF), lo que inhibe el TNF circulante, y una respuesta disminuida del sistema neurohumoral).
No existen estudios prospectivos que demuestren que sea seguro o beneficioso bajar de peso para los pacientes con ICFEr. Por el contrario, está documentado que la pérdida de peso se asocia con alta morbimortalidad, peor clase funcional y mala calidad de vida96. Sin embargo, en los pacientes con IC con índice de masa corporal entre 35 y 45, el descenso de peso resulta beneficioso para mejorar los síntomas y la capacidad de ejercicio8.
3.12. Cáncer
El abordaje de la relación entre cáncer e IC ha tomado relevancia en los últimos años ya que, por un lado, el aumento de la sobrevida de los pacientes con IC ha permitido comprobar una mayor incidencia de cáncer en relación con la población general y, por otro lado, la mayor efectividad de los tratamientos oncológicos ha permitido observar las consecuencias cardiotóxicas de los mismos97.
De los fármacos utilizados en las patologías neoplásicas, los que más comúnmente causan cardiotoxicidad son las antraciclinas (doxorubicina), el trastuzumab y los inhibidores de la tirosincinasa98.
Es importante el papel de un trabajo cardiooncológico conjunto para definir los pacientes con mayor riesgo de desarrollar cardiotoxicidad y el adecuado manejo farmacológico de los que la desarrollan99.
3.13. Gota y artritis
La artritis reumatoide es una patología muy frecuente y es muy común la indicación de AINE para el tratamiento sintomático.
Los AINE se desaconsejan en pacientes portadores de IC, ya que es bien conocido su efecto adverso sobre la función renal, la posibilidad de descompensar la IC y su interacción negativa con los IECA y ARA II. Esto limita seriamente el tratamiento del dolor, que incluiría solo paracetamol o derivados opiáceos100.
En cuanto a los fármacos modificadores de la enfermedad reumatoide y su seguridad en la IC, no hay suficiente evidencia para determinar conductas.
La hiperuricemia y la gota pueden ser exacerbadas por el tratamiento diurético. Si bien no está probada la seguridad de allopurinol o de oxipurinol en pacientes con ICFEr, se recomienda su indicación cuando los síntomas son intensos y recurrentes para mantener los niveles de uratos por debajo de 6 mg/dl. Para la crisis gotosa se recomienda el uso de butacolchicina101.
Resumen conceptual
Las comorbilidades son muy frecuentes en la insuficiencia cardíaca y su consideración y abordaje forman parte del tratamiento holístico de esta patología. Su conocimiento y pesquisa sistemáticas pueden redundar en un mejor pronóstico, mejor calidad de vida y eventual mayor sobrevida.