Principales aportes
En Uruguay existe importante retraso en el acceso a la ATC primaria en pacientes con IAMCEST.Del tiempo isquémico total, un 45,3% corresponde al tiempo dolor-PCM y el resto a demoras del sistema de salud.
El traslado directo desde domicilio a centro con hemodinamia disminuye el tiempo PCM-balón en 58% y el tiempo isquémico total en 43%.
Los pacientes con traslado directo presentaron tiempos PCM-balón en los rangos exigidos por las recomendaciones actuales.
Aquellos que sufrieron ECAM presentaron mayor score de contractilidad inicial y menor FEVI inicial y al mes.
Antecedentes
El tiempo de retraso en la reperfusión es un determinante pronóstico mayor de la evolución clínica y ecocardiográfica en los pacientes con IAMCST1-3. Durante las primeras semanas que siguen a la reperfusión existe una mejoría de la contractilidad en las zonas de miocardio atontado4,5. La ATC primaria se ha impuesto como la opción de reperfusión de elección siempre que se acceda a la misma de forma precoz, recomendándose por sobre los agentes fibrinolíticos cuando el tiempo PCM-balón no supera los 120 minutos6-10.
Existen importantes experiencias a nivel internacional que han demostrado ser eficaces en disminuir el tiempo PCM-balón en el IAMCST11-15. En Uruguay, la ATC primaria es una estrategia de reperfusión del IAMCST eficaz y segura, con mortalidad inicial y alejada que se asimila a lo reportado internacionalmente16. El registro RENATIA evidenció una demora de 255 minutos desde el inicio de los síntomas hasta la reperfusión con ATC primaria; en el 50% de estos pacientes se requería el traslado desde otro centro asistencial a un centro con servicio de hemodinamia17. Estos hallazgos locales subrayan la importancia de la organización de los sistemas de respuesta al IAMCST para disminuir el tiempo isquémico.
Objetivo
Analizar el impacto del traslado directo desde domicilio a un centro con hemodinamia sobre los tiempos de reperfusión y la evolución clínica y ecocardiográfica del IAMCST.
Material y método
Se realizó un estudio prospectivo observacional que incluyó a todos los pacientes con IAMCST de menos de 24 horas de evolución recibidos en el centro INCI para ATC primaria desde el 1° de febrero de 2016 al 30 de setiembre de 2016. Se excluyeron los pacientes con antecedente de IAM o revascularización previa y los portadores de valvulopatía mitral o aórtica severas. Se volcaron los datos en una base que incluyó los tiempos de reperfusión, variables clínicas y angiográficas (topografía del infarto, clasificación de Killip y Kimball, aspiración trombótica endovascular, tipo de stent implantado, score de flujo TIMI) así como ecocardiográficas. Los pacientes se clasificaron en dos grupos: 1) pacientes que recibieron traslado directo desde el domicilio a un centro con servicio de hemodinamia a través de una unidad de emergencia móvil (UEM) y los que consultaron directamente por sus propios medios en la emergencia de un centro con hemodinamia, y 2) pacientes valorados inicialmente en domicilo por UEM que fueron trasladados a un centro sin hemodinamia o que consultaron en emergencia de un centro sin hemodinamia, para desde allí ser trasladados a otro centro con hemodinamia. Se evaluaron los tiempos: isquémico total (desde el inicio de los síntomas hasta la reperfusión), dolor-PCM, PCM-balón y puerta-balón. Se analizaron las características clínicas de los pacientes al momento de la presentación, durante la evolución hospitalaria y al mes. Se registraron los ECAM (muerte, reinfarto, necesidad de nueva revascularización urgente y ACV) en la internación y mediante un control ambulatorio en policlínica al mes. Aquellos que no concurrieron al control clínico mensual fueron contactados telefónicamente. Se realizó ecocardiograma transtorácico (ETT) entre las 24 y 48 horas del cuadro inicial y al mes del procedimiento. Los ecocardiogramas fueron realizados con las vistas estándar (paraesternal ejes largo y corto, apical 4, 3 y 2 cámaras). Las imágenes fueron capturadas para su posterior análisis por dos operadores independientes que no tenían acceso a la historia clínica ni a los resultados del ETT previo. Se calculó la FEVI a partir de los volúmenes de fin de diástole y fin de sístole obtenidos por método biplano de discos (Simpson modificado). La motilidad segmentaria se analizó utilizando un modelo de 16 segmentos, asignando 4 grados de score de contractilidad a cada segmento (donde 1=contractilidad normal, 2=hipoquinesia, 3=aquinesia, 4=disquinesia). Posteriormente se calculó el score de contractilidad segmentaria del VI mediante el cociente entre la suma del score de cada segmento y el número de segmentos.
Análisis estadístico
Las variables continuas se compararon mediante la prueba U de Mann Whitney entre grupos ya que en ningún caso las distribuciones son normales (test de Kolgomorov-Smirnov con corrección de Lilliefors, p=0,000 para todas las variables consideradas) y test de Wilcoxon de los rangos de los signos entre valores ecocardiográficos iniciales y finales en cada grupo. Las variables categóricas se compararon mediante test exacto de Fisher. En los análisis se consideró como nivel de significación un valor de p<0,05 (dos colas).
Resultados
Se incluyeron 124 pacientes, 38 (31%) mujeres. La edad media±DE fue de 63,2±13,5 años. Las características de la población de estudio se muestran en la Tabla 1.
Tabla 1 Características generales de la población.
| Población total | Grupo 1 | Grupo 2 | ||
| N | 124 (100%) | 51(41%) | 73 (59%) | |
| Edad (años) | 63,2 ±1 3,5 | 62,9±12,3 | 63,5±14,7 | ns |
| Sexo F | 38 (31%) | 14 (27%) | 24 (33%) | ns |
| HTA | 72 (58%) | 29 (57%) | 43 (59%) | ns |
| DM | 31 (25%) | 13 (25%) | 18 (25%) | ns |
| Dislipemia | 31(25%) | 13 (25%) | 18 (25%) | ns |
| Tabaquismo | 70 (56%) | 29 (57%) | 41 (56%) | ns |
| Obesidad | 34 (27%) | 15 (29%) | 19 (26%) | ns |
| IR | 16 (13%) | 6 (12%) | 10 (14%) | ns |
| Topografía | ||||
| Anterior | 45 (36%) | 17 (33%) | 28 (38%) | ns |
| Inferior | 74 (60%) | 32(63%) | 42 (58%) | ns |
| Lateral | 5 (4%) | 2 (4%) | 3 (4%) | ns |
| KK | ||||
| I | 95 (77%) | 44 (86%) | 51 (70%) | ns |
| II | 18 (15%) | 3 (6%) | 15 (20%) | p =0,037 |
| III | 3 (2%) | 1 (2%) | 2 (3%) | ns |
| IV | 8 (6%) | 3 (6%) | 5 (7%) | ns |
| Tromboaspiración | 37 (30%) | 17 (33%) | 20 (27%) | ns |
| BMS | 82 (66%) | 31 (61%) | 51 (70%) | ns |
| DES | 42 (34%) | 20 (39%) | 22 (30%) | ns |
| TIMI | ||||
| 0 | 4 (3%) | 2 (4%) | 2 (3%) | ns |
| 1 | 3 (2%) | 2 (4%) | 1 (1%) | ns |
| 2 | 8 (6%) | 3 (6%) | 5 (7%) | ns |
| 3 | 109 (88%) | 44 (86%) | 65 (89%) | ns |
HTA: hipertensión arterial; DM: diabetes mellitus; IR: insuficiencia renal; KK: clasificación Killip y Kimball; BMS: bare metal stent; DES: drug eluting stent; ns: no significativo.
Análisis del tiempo isquémico
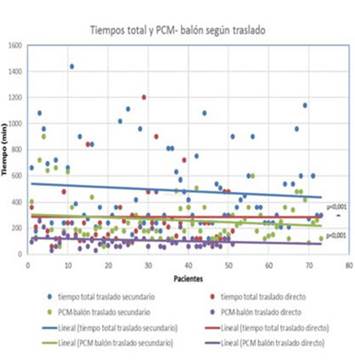
La media ± DE del tiempo isquémico total fue 410±301 min, con una mediana de 300 min (60-1.440 min). El tiempo dolor-PCM tuvo una media ± DE de 209±241 min y una mediana de 120 min (15-1.080 min). El tiempo dolor-PCM corresponde a 45,3% del tiempo isquémico total, valor obtenido promediando el porcentaje al que corresponde este tiempo para cada paciente. El tiempo medio±DE PCM-balón fue 201±161 min, con una mediana de 150 min (30-900 min), lo que corresponde a 54,7% del tiempo total. El tiempo medio puerta de centro con servicio de hemodinamia-balón fue 53±50, con una mediana de 45 min (15-480 min), lo que constituye el 18,4% del tiempo isquémico total. En la Tabla 2 y la Figura 1 se caracterizan los tiempos en toda la población de estudio y en ambos grupos.
Tabla 2 Comparación de tiempos en minutos.
| Población total | Grupo 1 | Grupo 2 | |
| Tiempo isquémico total | |||
| Media±DE | 410 ±301 | 284 ±241 | 498 ±309 |
| Mediana (mínimo-máximo) | 300 (60-1440) | 240 (60-1200) | 375 (90-1440) |
| Tiempo dolor-PCM | |||
| Media | 209 ±241 | 172 ±219 | 234 ±254 |
| Mediana | 120 (15-1080) | 85(15-1080) | 120 (15-1080) |
| Tiempo PCM-balón | |||
| Media | 201 ± 161 | 111±76 | 263 ±175 |
| Mediana | 150 (30-900) | 92 (30-480) | 192 (60-900) |
| Tiempo puerta-balón | |||
| Media | 53 ± 50 | 44 ±32 | 59 ±58 |
| Mediana | 45 (15-480) | 30 (15-210) | 47 (15-480) |
PCM: primer contacto médico. Grupo 1: con traslado directo a hemodinamia. Grupo 2: con traslado secundario.
Traslados en ambos grupos
Provenían de domicilio (grupo 1): 51 pacientes (41%) y de otro centro asistencial (grupo 2): 73 pacientes (59%). Cinco pacientes del grupo 1 (9,8%) consultaron por sus medios en la emergencia de un centro con servicio de hemodinamia, mientras que 46 (90,2%) fueron trasladados desde su domicilio por la UEM. Veinte pacientes del grupo 2 (27,4%) consultaron por sus medios en emergencia de centro sin hemodinamia y 53 (72,6%) fueron trasladados por UEM desde su domicilio a un centro sin hemodinamia, para luego requerir un segundo traslado hacia el centro con hemodinamia.
Análisis temporal según grupos (Figura 2,Tabla 2)
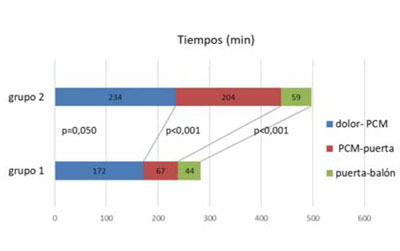
Figura 2 Se muestra la reducción de cada uno de los tiempos analizados, que determina una disminución del tiempo isquémico total para el grupo 1 (con traslado directo) respecto al grupo 2 (traslado secundario). PCM: primer contacto médico.
La media ± DE de tiempo de reperfusión del grupo 1 fue 284±241 min, con una mediana de 240 min (60-1200), mientras que en el grupo 2 fue de 498±309 min, con una mediana de 375 min (90-1.440 min) (p<0,001). El tiempo PCM-balón del grupo 1 fue 111±76 min, mediana=92 (30-480 min); para el grupo 2 la media (DE) fue 263 min±175 min y la mediana fue de 192 min (60-900 min) (p<0,001).
Evaluación ecocardiográfica
Se realizó ETT inicial en 116 pacientes, ya que de los 124 pacientes incluidos, 8 fallecieron previo a la realización del mismo, lo cual arroja una mortalidad hospitalaria de 6,5%. El tiempo de seguimiento fue de un mes, con una mortalidad total de 9,7% (n=12). De los 112 pacientes vivos al mes, todos se contactaron para control clínico, 16 controles fueron telefónicos y 96 en consultorio. De estos 96 controles clínicos presenciales se excluyeron 11 pacientes del análisis ecocardiográfico por haber recibido nueva revascularización con ATC o cirugía, por lo que fueron analizados 85 ecocardiogramas al mes del IAMCST.
La FEVI inicial fue de 49,5±9,33% en el grupo 1 y de 46,5±9,7% en el grupo 2 (p=0,114). La FEVI al mes fue de 53±8,5% en el grupo 1 y de 50,2±10,5% en el grupo 2 (p=0,309). El score de contractilidad inicial fue de 1,37±-0,39 en el grupo 1 y 1,46±0,31 en el grupo 2, (p=0,029). El score de contractilidad obtenido al mes fue de 1,23±0,26 para el grupo 1 y 1,34±0,32 para el grupo 2 (p=0,124), lo que se representa en la Figura 3.
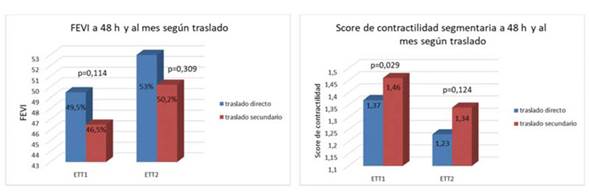
Figura 3 Análisis ecocardiográfico de la FEVI y score de contractilidad inicial y al mes por grupos. ETT 1: ecocardiograma transtorácico a las 48 horas. ETT 2: ecocardiograma transtorácico al mes.
En toda la población hubo mejoría significativa de la FEVI al mes: 3,21±6,22%, mediana de 2% (p<0,001) y del score de contractilidad: mediana de -0,0625 (p<0,001). No hubo diferencias significativas en la mejoría de FEVI ni en el score de contractilidad entre ambos grupos
Tasa de eventos y variables ecocardiográficas
La mortalidad al mes fue de 7,8% (n=7) en el grupo 1 y 10,9% (n=8) en el grupo 2 (NS). Once pacientes sufrieron ECAM al mes en el grupo 1 (21,6%) y 12 en el grupo 2 (16,4%), sin diferencias significativas. En la Figura 4 se analiza la tasa de eventos al mes en cada grupo.
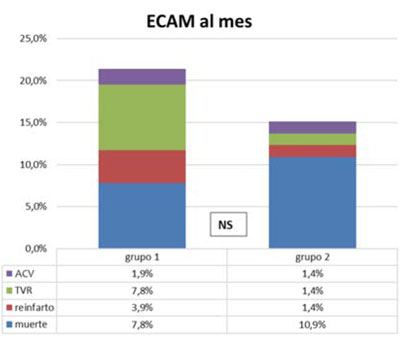
Figura 4 Tabla de ECAM al mes sin diferencias entre grupos con su gráfico correspondiente. Grupo 1 con traslado directo. Grupo 2: con traslado secundario. ECAM: eventos cardíacos adversos mayores. TVR: revascularización del vaso tratado.
Si evaluamos los pacientes con ECAM se observa que tuvieron una FEVI inicial de 40,6±7,7% en comparación con 48,4±9,6% en los pacientes libres de eventos (p=0,008). Asimismo, se registró una diferencia significativa (p=0,012) en el score de contractilidad inicial, con un valor de 1,67±0,34 en los pacientes que presentaron ECAM y de 1,40±0,34 para los pacientes libres de eventos. Al mes, la FEVI fue de 42,3±6,3% en los que tuvieron ECAM y de 51,8±9,7% en los libres de eventos (p=0,031). El score de contractilidad al mes fue de 1,55±0,29 y 1,28±0,29 respectivamente (p=0,065).
Discusión
El presente artículo evidencia que aún existe una importante demora en el acceso a la reperfusión del IAMCST, con una mediana de 300 min. El registro uruguayo RENATIA (2006)17 reportó una mediana de 250 min, aunque solo incluyó a pacientes de hasta 12 horas de evolución.
Estos tiempos prolongados concuerdan con datos del US National Cardiovascular Registry de Chakrabarti obtenidos durante 2005 y 200618, en que solo 9,9 % de los IAMCST cumplían con los tiempos recomendados por las guías.
Analizando los tiempos observamos que 45,3% del retardo corresponde al tiempo desde el inicio del dolor al PCM. Esto podría explicarse por una demora del paciente en consultar o por una dificultad en el acceso al sistema de salud, lo que podría corregirse con políticas educativas y mejoras del sistema que faciliten el acceso a la consulta inicial. Por otro lado, el 54,7% del tiempo de demora restante corresponde a demoras propias del sistema de salud, es decir, del tiempo PCM-puerta sumado al tiempo puerta-balón. En nuestro grupo de pacientes, el traslado directo desde domicilio a un centro con hemodinamia se asoció con una disminución significativa del tiempo isquémico en 43% y del tiempo PCM-balón en 58% (disminuyendo así el tiempo PCM-puerta y el tiempo puerta-balón).
Existe amplia bibliografía en relación con la disminución del tiempo de reperfusión asociada al traslado directo desde domicilio en el IAMCST. Los estudios de Dorsch y colaboradores15, con 387 pacientes en el Reino Unido; Le May y colaboradores19, con 344 pacientes en Ottawa; Pedersen y colaboradores20, con 1.334 pacientes en Dinamarca; Dieker21, con 581 pacientes en Holanda, y Estévez Loureiro y colaboradores(22), con 1.194 pacientes en España, demostraron todos una disminución de la media del tiempo puerta-balón y tiempo isquémico total en los pacientes con traslado directo a sala de hemodinamia.
Encontramos una disminución del tiempo desde el inicio del dolor al PCM en el grupo de traslado directo, al igual que en el trabajo presentado en 2002 por Canto y colaboradores23. Es posible que esta diferencia esté vinculada a que los pacientes con traslado directo se hayan presentado con síntomas más típicos, que motiven una consulta temprana y una rápida respuesta de los servicios de emergencia móvil, aspectos que no fueron analizados en nuestro trabajo.
En nuestra experiencia, los pacientes que fueron trasladados directamente desde domicilio a centro con hemodinamia fueron los únicos que presentaron una media de PCM-balón por debajo de los 120 minutos exigidos por las guías de práctica clínica, a diferencia de aquellos que consultaron por sus medios o fueron inicialmente trasladados hacia centros sin hemodinamia.
Los estudios de Bradley y colaboradores24) en 2005 y de Krumholz y colaboradores25 en 2008 evaluaron que la realización de un electrocardiograma prehospitalario permitía la inmediata activación del laboratorio y el equipo de hemodinamia, con una disminución del tiempo puerta-balón y un mejor cumplimiento de lo estipulado en las guías.
Los resultados de nuestro estudio, que concuerdan con datos internacionales, nos llevan a considerar que la implementación de medidas específicas como la activación prehospitalaria de los equipos de hemodinamia y el traslado directo del paciente a centros con sala de intervencionismo, evitando el pasaje por servicios de emergencia, contribuyen a reducir los tiempos de reperfusión.
Existe evidencia consistente sobre la relación entre el tiempo de reperfusión (farmacológica o intervencionista) y la mortalidad en el IAMCST. El Fibrinolitic Therapy Trialist (FTT)26, que analizó los estudios que utilizaron fibrinolíticos versus placebo en más de 1.000 pacientes con IAMCST, demostró la asociación entre el tiempo de demora en el tratamiento y la mortalidad. Resultados similares muestran Boersma y colaboradores27 en un metaanálisis publicado en 1996. Terkelsen y colaboradores28) demostraron en 2010 un aumento en la mortalidad vinculado a la demora del sistema en lograr la reperfusión. Por otro lado, De Luca y colaboradores29 concluyen que por cada 30 minutos de retardo en la ATC existe un aumento de 7,5% en la mortalidad del IAMcST. Vinculado al tiempo de demora del sistema, Steg y colaboradores30, al igual que Pedersen y colaboradores20, demostraron que el pasaje del paciente por la emergencia se asocia a un peor pronóstico. Estévez-Loureiro y colaboradores22 demuestran, mediante un análisis multivariado, que la aplicación sistemática del traslado directo fue un predictor pronóstico independiente. De igual modo, en el trabajo de Le May y colaboradores19, la mortalidad a 180 días fue más del doble (11% vs 5% ) para los que tuvieron traslado a un centro sin hemodinamia.
Si bien en nuestro trabajo se observa una disminución de los tiempos vinculada al traslado directo desde domicilio a sala de hemodinamia, no se alcanza una diferencia estadísticamente significativa de la mortalidad ni otros eventos clínicos, lo que podría estar vinculado al bajo número de pacientes incluidos.
Respecto al análisis ecocardiográfico, observamos que si bien el estudio no tuvo la potencia suficiente para demostrar diferencias significativas de la FEVI entre ambos grupos, sí evidenció un score de contractilidad significativamente mejor en el ETT inicial en el grupo con traslado directo. Un análisis post-hoc del estudio de Van’t Hof31 evidenció que los pacientes con traslado directo a sala de hemodinamia tenían menos disfunción sistólica en comparación con los que eran valorados en emergencia. Nuestros hallazgos confirman que aquellos que tuvieron ECAM tenían peor score de contractilidad inicial y peor FEVI inicial y al mes.
La iniciativa Stent for Life (SFL) es un proyecto europeo iniciado en 2008 con el objetivo de conseguir que la mayoría de los pacientes con IAMCST tengan un rápido acceso a la intervención coronaria percutánea primaria, en un intento por disminuir la morbilidad y la mortalidad. La European Association for Percutaneous Cardiovascular Interventions (EAPCI) realizó una encuesta para analizar el uso de tratamientos de reperfusión en Europa, sugiriendo que el traslado primario de los pacientes con IAMCST debe evitar el paso por el hospital más próximo sin hemodinamia, así como por el servicio de urgencias o la unidad de cuidados intensivos del centro de hemodinamia. En consonancia, el paciente debe ser coordinado y trasladado directamente al laboratorio de hemodinamia, indicando el momento aproximado previsto para su llegada. Esta estrategia permite disminuir los plazos al mínimo, pudiendo alcanzarse el límite recomendado en las guías (<90 min) en la inmensa mayoría de los casos.
En el año 2010 se publicó en la Revista Uruguaya de Cardiología el Programa de infarto agudo de miocardio (PIAM), una iniciativa en vías de reformulación que aún no se ha puesto en práctica. Este programa tiene como objetivo asegurar el acceso de la terapia de reperfusión a todos los pacientes con IAMCST, reducir los tiempos de implementación de la misma y disponer tratamientos individualizados de óptima calidad. Se plantea un algoritmo de manejo en donde el PCM es la base para el éxito de la estrategia de reperfusión. Desde ese momento se debe proceder para asegurar el menor tiempo de acceso a la terapéutica de reperfusión. Algunas de las medidas propuestas consisten en la educación acerca del IAMCST y su manejo terapéutico, el apoyo en la implementación de la trombolisis y la puesta en marcha de un sistema de coordinación regional y un centro de apoyo telefónico para los médicos que se enfrentan al PCM. El PIAM también establece que en los pacientes valorados inicialmente por la UEM se proceda de inmediato al traslado directo a la sala de hemodinamia, siempre que el acceso a la misma cumpla con los tiempos estipulados por las guías, de lo contrario se deberá proceder al tratamiento trombolítico.
Limitaciones
Se realizó un estudio unicéntrico con un número pequeño de pacientes, lo que no permitió demostrar diferencias significativas en los ECAM y algunas variables ecocardiográficas asociadas al traslado directo desde domicilio. En el seguimiento, al mes hubo 16 pacientes que no concurrieron al control clínico y el mismo debió realizarse telefónicamente.