Introducción
La miocardiopatía hipertrófica (MCH) es una enfermedad cardíaca con base genética, de expresión fenotípica heterogénea y elevado riesgo de muerte súbita (MS) cardíaca, principalmente en sujetos jóvenes1-4. Está causada por mutaciones en genes que codifican proteínas sarcoméricas y se transmiten siguiendo un modelo autosómico dominante. Su rasgo estructural distintivo es un aumento del grosor parietal ventricular que no se explica únicamente por condiciones de sobrecarga, lo que en la práctica obliga a descartar diagnósticos diferenciales con la cardiopatía hipertensiva o valvular, por ejemplo. Para definir el diagnóstico en adultos se requiere demostrar, mediante cualquier técnica de imagen, un aumento del grosor parietal ventricular ≥ 15 mm en al menos un segmento miocárdico5.
A menudo la sospecha de MCH surge a partir de una o más anormalidades del electrocardiograma (ECG) de superficie; el número y la severidad de estas alteraciones se relaciona directamente con su expresión fenotípica6,7. El espectro de los cambios ECG es amplio e incluye signos de hipertrofia ventricular izquierda (HVI), trastornos diversos en la repolarización ventricular, ondas Q anormales, alteraciones de la conducción ventricular o auriculoventricular, auriculomegalia izquierda, desviación del eje eléctrico frontal y arritmias6-10. Por desgracia, todos estos hallazgos han demostrado tener baja especificidad6-8,11.
La expansión progresiva en las indicaciones y las mejoras en las técnicas de imagen, como la ecocardiografía Doppler (ECO), la tomografía computada multicorte y la resonancia nuclear magnética cardíaca (RNMC) han permitido caracterizar más exactamente los diferentes fenotipos de MCH y, a la vez, comprender mejor su traducción electrocardiográfica. Sin embargo, estas alteraciones han sido escasamente descritas a nivel regional y local11-13.
El presente trabajo se orientó a caracterizar las modificaciones ECG en una cohorte local de pacientes portadores de MCH, correlacionándolas con hallazgos clínicos y estructurales.
Método
Población de estudio
Se incluyeron los pacientes con MCH que al momento del presente análisis estaban en seguimiento en la policlínica especializada del Departamento de Cardiología (Centro Cardiovascular Universitario, Hospital de Clínicas, Montevideo). Los hallazgos ECG se correlacionaron con los resultados obtenidos por los estudios de imagen (ECO en todos los pacientes y RNMC en 13 de ellos). El diagnóstico se realizó de acuerdo con la última guía sobre diagnóstico y manejo terapéutico de la MCH de la Sociedad Europea de Cardiología5, según la cual se requiere un grosor parietal ventricular ≥ 15 mm o ≥ 13 mm en pacientes con familiares de primer grado con diagnóstico inequívoco de MCH, en ausencia de condiciones de carga anómala que expliquen dicho hallazgo. Se excluyeron los pacientes portadores de MCH de variante fenotípica apical y parietal concéntrica simétrica y aquellos que fueron sometidos a miectomía ventricular. En el caso de los sujetos hipertensos solo se incluyeron aquellos en los que el grado de hipertrofia era estructuralmente desproporcionado y no guardaba correlación con la presentación clínica. Se registraron los síntomas al ingreso a la cohorte (ángor, disnea, síncope), implante de cardiodesfibrilador automático y arritmias ventriculares en el registro Holter ambulatorio.
Registro e interpretación ECG
Se registró el ECG de 12 derivaciones en posición supina mediante un equipo Fukuda Denshi Tokyo, modelo Cardimax FX 7102, utilizando un rango de filtros de 0,05-150 Hz (AC filter off, muscle filter off, drift filter 0,5 Hz), a una velocidad de registro del papel de 25 mm/s y una ganancia de 10 mm/mV. Se registró la frecuencia ventricular promedio (cpm) y el ritmo cardíaco. Los pacientes con bloqueo completo de rama izquierda (BCRI) o estimulación ventricular permanente por marcapasos (MP) al momento del registro se excluyeron del análisis. Se definió ECG “anormal” por la presencia de uno o más de los siguientes hallazgos.
1. Alteraciones de la repolarización ventricular:
Patrón de sobrecarga sistólica del VI: elevación del segmento ST ≥ 0,1mV con concavidad superior y ángulo QRS-T > 100° en las derivaciones con QRS negativos, o alteraciones en precordiales izquierdas (V5-V6) dadas por descenso del punto J, infradesnivel ST descendente supraconvexo y onda T negativa/bifásica asimétrica, con rama descendente inicial de menor velocidad de deflexión que la rama ascendente.
Supradesnivel ST inespecífico: supradesnivel ST de al menos 0,1 mV en dos o más derivaciones contiguas.
Infradesnivel ST: infradesnivel del segmento ST de al menos 0,1 mV en dos o más derivaciones con tiguas.
Inversión inespecífica de la onda T: inversión de onda T de al menos 0,1 mV de profundidad en dos o más derivaciones contiguas.
Ondas T gigantes: inversión simétrica de onda T que alcanza 1 mV en dos o más derivaciones contiguas.
Patrón de repolarización precoz: muesca o nudo (notch) al final del complejo QRS y al inicio del segmento ST, asociado a elevación del punto J ≥ 0,1 mV en dos o más derivaciones contiguas.
2. Signos de hipertrofia ventricular izquierda. Para definir la presencia de HVI se utilizó el sistema de puntuación de Romhilt-Estes (HVI definida: puntaje ≥ 5)14 o el índice de Sokolow-Lyon (≥3,5 mV)15.
3. Ondas Q patológicas: aquellas que abarcan 25% de la amplitud de la siguiente onda, duran al menos 40 mseg o miden al menos 3 mm (0,3 mV) en dos derivaciones contiguas, con excepción de aVR.
4. Fraccionamiento del complejo QRS: presencia de muesca (notch) en la onda R u onda S del QRS, o complejos de morfología RSR’ y duración menor a 120 mseg al menos en una derivación.
5. Sobrecarga auricular izquierda: componente negativo de la onda P en derivación V1 ≥ 40 mseg de duración o voltaje ≥ 0,1mV (en ritmo sinusal).
6. Trastornos de la conducción intraventricular:
Bloqueo fascicular (hemibloqueo) anterior izquierdo de la rama izquierda de His: eje eléctrico frontal superior (-30o a -90o) con onda Q inicial en DI y onda R inicial en DIII.
Bloqueo fascicular (hemibloqueo) posterior izquierdo: desviación del eje inferior (≥ 120o), onda R en DI y onda Q en DIII, en ausencia de hallazgos ECG que sugieran hipertrofia ventricular derecha.
Bloqueo completo de rama derecha (BCRD) de acuerdo a los criterios diagnósticos de la American Heart Association16.
Ecocardiograma Doppler
Para la adquisición, procesamiento e interpretación de las imágenes de ultrasonido Doppler se utilizó un equipo Siemens Acuson Sequoia 256®. Se obtuvieron secuencias habituales en los enfoques paraesternal eje largo, paraesternal eje corto, apical de 4 y 5 cámaras y subcostal. Se midió el espesor del septum y la pared posterior en enfoque paraesternal eje largo, así como el máximo espesor parietal en las regiones anterior y anterolateral del VI en enfoque paraesternal en eje corto. El área auricular izquierda se midió en el eje apical de 4 cámaras. La obstrucción en el tracto de salida del VI (OTSVI) se definió por la presencia de un gradiente sistólico en el tracto de salida del VI (basal o provocado) ≥ 30 mmHg. Cuando correspondía, se cuantificó el grado de insuficiencia mitral en leve/moderada/severa. Para la estimación de la fracción de eyección del VI (FEVI) se utilizó el método elipsoide.
Resonancia nuclear magnética cardíaca
Todos los estudios se realizaron en un equipo Siemens® de 1,5 T con el empleo de una antena cardíaca de ocho canales, sincronización electrocardiográfica y apneas de 12-16 segundos en función del tipo de secuencia y la frecuencia cardíaca. En todos los casos se realizó un estudio funcional mediante secuencias de eco de gradiente en eje corto con los siguientes parámetros: tiempo de eco/tiempo de repetición 1.3-1.7 / 3-3.8 ms, ángulo de 45º, 16-18 vistas por segmento y 20 fases. Se estudiaron las secuencias de perfusión de primer paso en reposo con apnea en tres niveles del eje corto (basal, medio y apical) luego de la administración de una dosis de gadolinio de 0,1 mmol/kg. Se realizaron secuencias de realce tardío 2D inversión-recuperación tras completar una dosis de gadolinio de 0,2 mmol/kg, definiendo la extensión e intensidad del realce tardío de gadolinio (RTG). El tiempo de inversión se determinó al observar anulación del miocardio sano. La secuencia se adquirió 10-15 minutos luego de la administración de gadolinio, en eje corto, 2 y 4 cámaras.
Análisis estadístico
Las variables discretas binarias o categóricas se expresaron en frecuencias absolutas y relativas y las variables continuas en medias + desvío estándar (DE). Para la comparación de subgrupos en las variables categóricas se construyeron tablas de contingencia 2x2 en las que la variable independiente era el hallazgo ECG y la dependiente era el resultado en las técnicas de imagen, aplicando el test exacto de Fisher. Para comparar las variables continuas se aplicó el test no paramétrico de Mann-Whitney. En todos los análisis se consideró como nivel de significación un valor de p < 0,05 (2 colas), utilizando el software Graph Pad Prism 6.0®.
Resultados
Características de la población de estudio
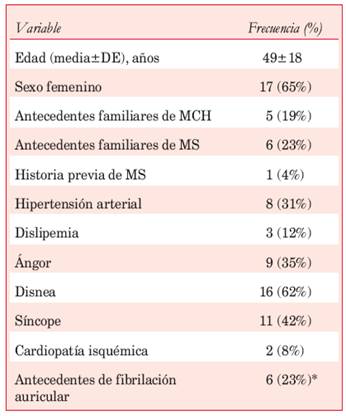
Un total de 26 pacientes fueron incluidos en el análisis, con una media de edad de 49 años (19-75 años). El 46% de ellos presentaba al menos un familiar de primer grado con MCH, o bien antecedentes familiares de MS o MS abortada. La mayoría de los sujetos de la serie (85%) se encontraban sintomáticos; los síntomas más frecuentes fueron disnea de esfuerzo, ángor y síncope (Tabla 1); ocho pacientes (31%) asociaron disnea y ángor. Por indicación y oportunidad consensuada con el equipo de electrofisiólogos, siete pacientes tenían implantado un cardiodesfibrilador automático. En uno de los interrogatorios telemétricos de rutina se detectó una descarga apropiada del dispositivo en respuesta a un episodio de taquiarritmia ventricular. Los registros Holter, obtenidos en todos los sujetos de la serie, detectaron taquicardia ventricular monomorfa sostenida en siete casos (27%). Un paciente portador de MP exhibió ritmo propio en el ECG basal.
Evaluación estructural
Los pacientes de la serie presentaban máxima hipertrofia predominantemente a nivel anteroseptal (basal o media) en 17 casos e inferoseptal basal en cinco casos. Un paciente presentó, además, hipertrofia en la región anterior y ápex. El grosor septal medio fue de 22,0 + 5,3 mm. Las características estructurales de la población de estudio se resumen en la Tabla 2. Doce de los trece pacientes estudiados con RNMC (92%) exhibieron RTG. En seis de estos pacientes se detectaron pequeñas zonas de RTG focal y en cuatro se observó RTG extenso. En dos sujetos la RNMC informó la presencia de RTG sin especificar su magnitud. Solo un paciente presentó disfunción sistólica (FEVI = 35%).
Tabla 2: Características estructurales y fisiológicas de la población.
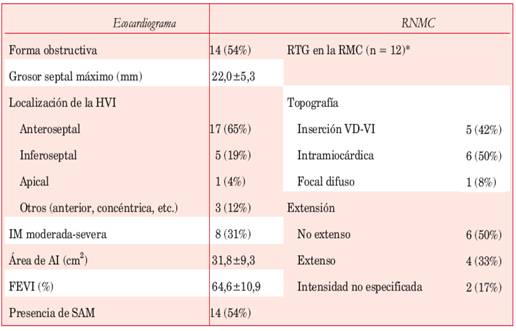
*12 de 13 pacientes estudiados con RNMC presentaron RTG. AI: aurícula izquierda; FEVI: fracción de eyección ventricular izquierda; HVI: hipertrofia ventricular izquierda; IM: insuficiencia mitral; RTG: realce tardío con gadolinio; SAM: movimiento anterior sistólico de la valva mitral anterior; VD: ventrículo derecho; ventrículo izquierdo.
Análisis electrocardiográfico
Únicamente dos pacientes de la serie presentaron un trazado ECG normal (8%). El resto exhibió al menos una alteración ECG, lo que define una sensibilidad global de 92% para el diagnóstico de MCH. La distribución de los hallazgos ECG por derivaciones se resume en la Tabla 3.
Tabla 3: Distribución de los hallazgos ECG en las derivaciones de superficie.
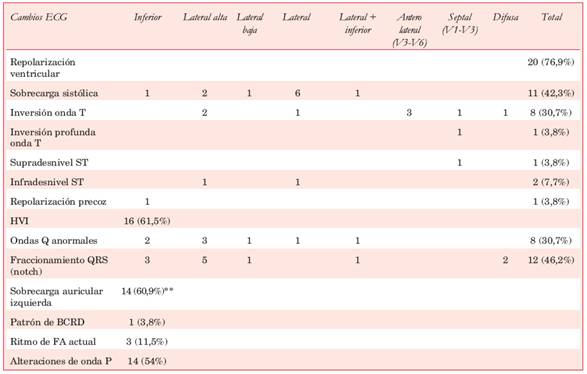
*Un paciente presentó inversión de ondas T en proyección lateral alta no atribuible a sobrecarga sistólica e inversión profunda de onda T en V2-V3. **Sobre el total de pacientes en ritmo sinusal (n=23). BCRD: bloqueo completo de rama derecha; fibrilación auricular; HVI; hipertrofia ventricular izquierda.
Repolarización ventricular
Se detectaron alteraciones de la repolarización ventricular en la mayoría de los pacientes (20/26, 76,9%). Dentro de estos cambios predominó el patrón de sobrecarga sistólica del VI (42,3%), mayoritariamente asociado a signos de HVI. Estas alteraciones se observaron más frecuentemente en la proyección de las caras lateral e inferior (ver Tabla 3). A estos cambios le siguió, en frecuencia, la inversión de la onda T en ocho pacientes (30,7%), un hallazgo que también predominó en las derivaciones que enfrentan la cara lateral. Menos frecuentemente se registró infradesnivel ST y patrón de repolarización precoz. El único caso que presentó ondas T gigantes exhibía un grosor septal máximo de 27,8 mm y presentaba un fenotipo caracterizado por hiper trofia difusa con compromiso septal y ante rior, respe tando la región apical.
Signos de hipertrofia ventricular izquierda
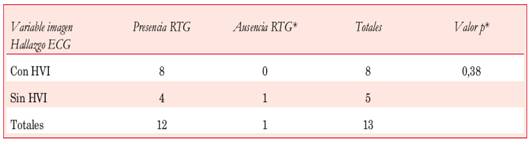
Constituyeron el segundo hallazgo ECG patológico más frecuente en nuestra serie (61,5%); de los 26 pacientes del estudio, 16 tenían uno o más signos de HVI. De éstos, 11 asociaron patrón de sobrecarga sistólica del VI (Tabla 3). No hubo correlación entre la presencia de signos ECG de HVI y el espesor parietal septal medido por ECO (23,18 ± 5,46 mm vs 20,20 ± 4,59 mm; p=0,16). El 75% de los pacientes con signos de HVI en el ECG presentaba uno o más síntomas (12 de 16). Del total de pacientes con HVI, dos presentaron los tres síntomas (ángor, disnea, síncope), otros seis tuvieron dos síntomas y cuatro pacientes tuvieron un solo síntoma, mientras que cuatro fueron asintomáticos. De los pacientes sin HVI electrocardiográfica, 9 de 10 presentaron síntomas (90%), dos tuvieron los tres síntomas, uno tuvo dos síntomas, seis tuvieron un síntoma y uno estaba asintomático. No hubo diferencias significativas asociadas a la presencia de síntomas en los pacientes con y sin HVI (p=0,61, test exacto de Fischer). Tampoco encontramos asociación estadística entre los signos electrocardiográficos de HVI y la presencia de OTSVI o RTG en la RNMC (Tablas 4 y Tabla 5). El doble de pacientes con HVI en el ECG presentó RTG en comparación con los que no presentaban HVI, aunque esta asociación no alcanzó significación estadística. Cabe destacar que dos de los cuatro pacientes con áreas de RTG extenso en la RNMC tenían un espesor septal ≥ 29 mm.
Tabla 4: Correlación entre los signos electrocardiográficos de HIV y la obstrucción al TSVI detectada por ECO.
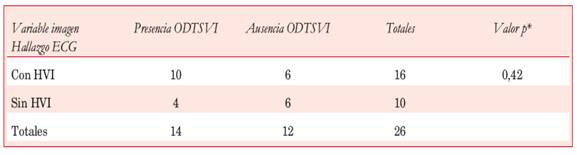
*Test exacto de Fisher. ODTSVI: obstrucción dinámica al tracto de salida del VI.
Ondas Q patológicas
Se detectaron ondas Q anormales en ocho pacientes (30,7%), más frecuentemente en la proyección de la cara lateral (seis casos) que en la cara inferior (dos casos). No hubo diferencias significativas en el espesor anteroseptal en comparación con el grupo de pacientes sin ondas Q. Cuatro de los 12 pacientes con RTG presentaron ondas Q anormales, mientras que el paciente sin RTG exhibía ausencia de onda Q patológica en el ECG (p=1,00). La Figura 1 ilustra el caso de un paciente que presentaba ondas Q anor males en cara inferior y V2-V3.
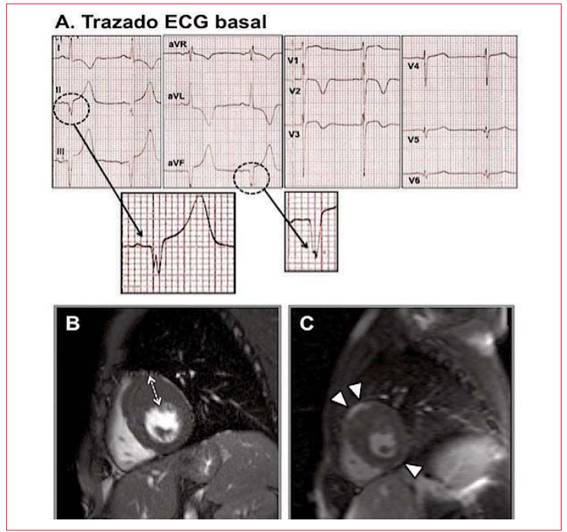
Ritmo sinusal a 60cpm, score de Romhilt-Estes=8, fragmentación del QRS en DII-aVF (círculos punteados). Hay bloqueo fascicular anterior izquierdo, patrón de repolarización precoz inferior e inversión profunda de ondas T en DI, aVL, V2 y V3. QTc (Bazzet) = 420ms. Marcada hipertrofia de distribución septal anterior (segmentos medio y basal) con espesor parietal máximo de 27,6 mm (flechas blancas punteadas). RTG difuso en el área de hipertrofia que predomina en la zona de inserción de ambos ventrículos a nivel septal anterior (puntas de flechas blancas).
Figura 1: Trazado ECG basal (A) y RNMC (B y C) en uno de los casos de la serie.
Fraccionamiento del complejo QRS
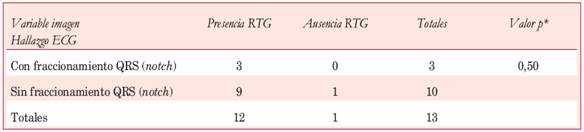
En 12 pacientes (46,2%) se registró fraccionamiento del QRS en al menos una derivación como manifestación de retraso localizado en la conducción ventricular. La Figura 2 ilustra un caso clínico que exhibió fraccionamiento del QRS asociado a fibrosis intramiocárdica en la RNMC. Como se observa en la Tabla 2, la mayoría de los pacientes estudiados con RNMC exhibieron fibrosis intramiocárdica. No se encontró correlación entre la presencia de fraccionamiento del QRS y el espesor septal medido por ECO (espesor septal 22,30 ± 4,78 vs 21,62 ± 5,00, p=0,67, test de Mann-Whitney) ni con la presencia de RTG en la RNMC (p=0,50, Tabla 6).
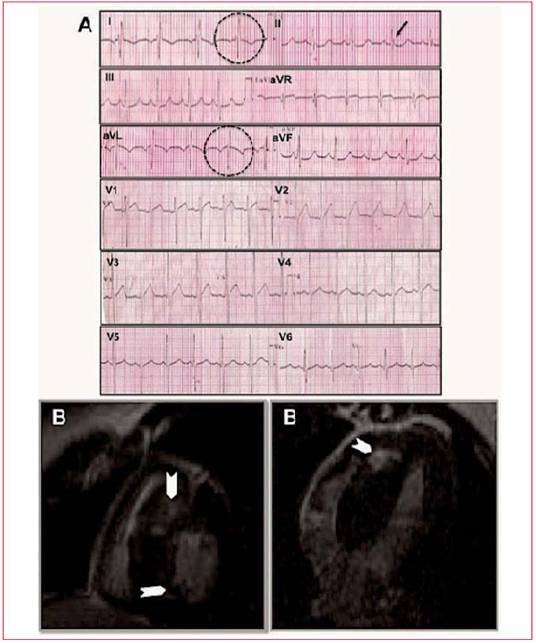
A) Sobrecarga auricular izquierda, signos de HVI, morfología RSR'en DI-aVL (círculos negros punteados), QRS fragmentado en DII (flecha negra). B) RTG intramiocárdico “parcheado” (puntas de flecha blancas). El ECO en este paciente mostraba HVI severa a predominio septal medio y basal (34 mm), movimiento anterior sistólico de la valva mitral anterior en ausencia de gradientes transvalvulares, área auricular izquierda de 16 cm2 y FEVI de 65%.
Figura 2: Fragmentación del QRS en un hombre de 18 años, asintomático, deportista amateur.
Cambios en la onda P
Un total de 14 pacientes (54%) cumplieron criterios electrocardiográficos de sobrecarga auricular izquierda. Sin embargo, en ningún caso esto constituyó un hallazgo ECG único, observándose que en más de la mitad de los pacientes estaba asociado a signos de HVI. Cuando se correlacionó este hallazgo con la presencia de dilatación auricular izquierda definida por técnicas de imagen, solo uno de los 12 pacientes tenía aurícula izquierda de dimensiones normales.
Discusión
Nuestros resultados confirman que el ECG constituye una herramienta valiosa para sospechar la MCH, dada la alta prevalencia y diversidad de las alteraciones. En efecto, solo 8% de los pacientes presentaba ECG normal. Esta incidencia es similar a la reportada en las series más extensas6-9. Debido a que se incluyeron solo los pacientes con diagnóstico confirmado de MCH, la especificidad de cada uno de los hallazgos ECG no pudo definirse.
Los cambios en la repolarización ventricular representan las alteraciones ECG más frecuentes en la MCH17. En nuestra serie se observó, en casi 77% de los casos, una frecuencia menor al 91% reportado en el Registro Uruguayo de Miocardiopatía Hipertrófica (RUMHI)13. Fue muy frecuente el patrón de sobrecarga sistólica del VI, asociado o no a signos de HVI, seguido de la inversión de la onda T. Ambas alteraciones se observaron principalmente en derivaciones laterales, sobre todo en DI-aVL (Tabla 6). Estos hallazgos también coinciden con las series más extensas. En un estudio observacional que analizó los ECG de 128 sujetos con MCH, el patrón de sobrecarga sistólica y la inversión inespecífica de la onda T fueron las alteraciones de la repolarización más frecuentes, predominando también en la cara lateral19. En nuestra serie, la desviación del segmento ST no atribuible a sobrecarga sistólica y la inversión profunda de la onda T (> 10 mm) fueron infrecuentes (7,7% y 3,8%, respectivamente). La inversión de la onda T es más común en la MCH de variante septal asimétrica y podría estar asociada al grosor parietal anterior basal y anteroseptal19. En contraste, otros estudios indican que esta alteración ECG es aún más frecuente en la variante apical (sobre todo la inversión profunda de la onda T) y que podrían responder al aumento del grosor septo-apical y un mayor gradiente de espesor desde el ápex a las regiones basales ventriculares10,20-23. La prevalencia de ondas T gigantes en la MCH de variante apical parece ser mayor en la población asiática24. Los grandes estudios observacionales sugieren que las ondas T observadas en la MCH tienden a disminuir de voltaje con el transcurso de los años, sobre todo cuando hay hipoquinesia o aneurisma apical(25,26). Utilizando criterios diagnósticos de elevada sensibilidad, como el sistema de puntuación de Romhilt-Esthes, un score que combina signos de sobrecarga auricular izquierda, posición del eje eléctrico frontal, amplitud de voltajes, patrón de sobrecarga sistólica y prolongación del tiempo de deflexión intrinsecoide del QRS, se observó HVI en 61,5% de los pacientes. Esta cifra se asemeja a las reportadas por diferentes series6,8,17,18. El puntaje de Romhilt-Estes no se correlacionó con el grosor parietal medido por ECO, con los síntomas ni con la presencia de OTSVI; resultados que también coinciden con las grandes series internacionales. En una población de 448 pacientes, Montgomery y colaboradores encontraron que el máximo grosor parietal tuvo una correlación significativa pero débil con los voltajes de la onda R27. Así, de 55 pacientes con hipertrofia masiva (definida como un espesor septal > 30 mm), solo 44% mostraba signos de HVI severa en el ECG. La misma conclusión se obtuvo al comparar los pacientes con OTSVI (definida en esta cohorte como un gradiente ³ 30 mmHg) con los voltajes de superficie. Por otra parte, algunos datos sugieren que los criterios electrocardiográficos de HVI podrían estar más relacionados con la extensión de la afectación miocárdica que con la magnitud del espesor parietal. En una serie de 154 pacientes analizada por Maron y colaboradores6, el 74% de los pacientes que tenían mayor cantidad de segmentos hiper tróficos mostraba criterios de HVI en el ECG, en contraste con el 25% en los pacientes con hipertrofia localizada. Debido a que la magnitud de los voltajes depende de otras variables como la posición geométrica del corazón en el tórax, la cercanía del VI a la pared torácica o el volumen de fin de sístole, por ejemplo, el valor diagnóstico independiente de los signos ECG de HVI podría estar limitado26).
La presencia de RTG en la RNMC (92,0%) es mayor a la reportada en las grandes series internacionales (33%-86%)29. Esto podría explicarse por los estrictos criterios diagnósticos de nuestra cohorte. La topografía más frecuente del RTG fue intramiocárdica en las zonas de mayor hipertrofia (regiones septales basales y medias), seguida de los puntos de inserción del ventrículo derecho a nivel septal anterior y posterior (Tabla 2). Esta última distribución del RTG es típica pero no específica29. Un estudio de 66 pacientes con MCH asimétrica30 encontró esta distribución en el 73% de los casos, y en comparación con la forma apical, la cantidad de RTG fue mayor y más difusa. Investigaciones más recientes demuestran que la presencia de fibrosis mio cárdica suele traducirse en el ECG de superficie mediante complejos QRS de morfología fraccionada (con notch), e incluso que este hallazgo tendría valor topográfico, dependiendo de las derivaciones comprometidas21,31-33. Kawasaki y colaboradores demostraron que la cantidad de derivaciones con fraccionamiento del complejo QRS se relacionaba estrechamente con el volumen y la localización del RTG en la RNMC33. Así, cuando el notch estaba presente en DII-DIII-aVF, el RTG era más frecuente en la cara inferior y en el septum, mientras que su presencia en las derivaciones precordiales se correspondía con afectación fibrosa de la cara anterior y el ápice. El autor encontró que la presencia de notch con un componente negativo de al menos 0,05 mV en dos derivaciones contiguas tenía una sensibilidad y especificidad para detectar fibrosis miocárdica de 70% y 81%, respectivamente, con un valor predictivo positivo de 70% y un valor predictivo negativo de 80%. En otra cohorte de 108 pacientes31, la cantidad de derivaciones con notch se relacionó con la extensión del RTG con una sensibilidad y especificidad de 40% y 80%, respectivamente. En nuestra serie todos los pacientes con notch tuvieron RTG (3 en 3). Sin embargo, de los 10 pacientes que no presentaron notch, la mayoría 9 tenían RTG, no habiendo correlación significativa del RTG con el fraccionamiento del QRS, ni tampoco con el espesor miocárdico medido por ECO. A este respecto hay que subrayar que solo se dispuso de RNMC en 13 pacientes, y que solamente en uno de ellos existía ausencia de RTG. No obstante, tres de los pacientes con mayor grosor parietal exhibían extensas áreas de RTG. Si bien este hallazgo no alcanzó significancia estadística, las evidencias obtenidas a nivel internacional sustentarían dicha relación21-34. Esta hipótesis debe reevaluarse ampliando la muestra.
Las ondas Q angostas y profundas son un hallazgo bastante frecuente en la MCH17. En efecto, más de 30% de los individuos de nuestra serie presentaban ondas Q anormales, que predominaron en la cara lateral. Su presencia debe despertar la sospecha de la enfermedad, sobre todo cuando se acompaña de ondas T positivas, lo que las diferencia de las ondas Q de etiología isquémica35. Hace pocas décadas se postulaba que este hallazgo sugería la presencia de fibrosis miocárdica. Posteriormente se demostró que, en realidad, las ondas Q traducían la falta de oposición del vector de despolarización correspondiente al miocardio más hipertrofiado en los segmentos miocárdicos anteroseptales, en contraposición con la masa miocárdica de la cara posterior y el ventrículo derecho36. En nuestra serie no encontramos correlación entre el espesor parietal anteroseptal y la presencia de ondas Q, así como tampoco con la presencia de fibrosis intramiocárdica. Estos resultados también coinciden con la mayoría de los reportes internacionales, que no evidenciaron una correlación potente entre las ondas Q y la presencia, magnitud y topografía de la fibrosis miocárdica21,26,31,32. Solo en una cohorte descrita por Dumont y colaboradores (n=102), la duración de la onda Q se correlacionó significativamente con la presencia de RTG en la RNMC37.
La mayoría de los sujetos de nuestra serie (60,9%) exhibía agrandamiento auricular izquierdo, con un área auricular izquierda promedio de 31,8 cm2. Sin embargo, estas alteraciones del ECG nunca constituyeron un hallazgo patológico único, asociándose siempre con otras anomalías. Las grandes series internacionales describen resultados similares8.
Las limitantes mayores de nuestro reporte se derivan del bajo número de pacientes y la disponibilidad parcial de RNMC. Además, solo se incluyeron sujetos portadores de MCH con fenotipia septal asimétrica, por lo que los resultados obtenidos no pueden ser extrapolados a otras variantes anatómicas. Finalmente, por ser pacientes derivados a una policlínica multidisciplinaria de carácter universitario, actuando en un nivel de atención terciario, el análisis no incluyó casos-control, esto es, individuos con hallazgos ECG similares que no fueran portadores de MCH. Esto impidió definir la especificidad y el valor predictivo negativo de cada uno de los hallazgos ECG. A pesar de estas debilidades, creemos que nuestra experiencia aporta datos valiosos sobre la expresión electrocardiográfica de la MCH en el ámbito local, incluso replicando algunos resultados obtenidos en las series internacionales más extensas.
Conclusión
En la cohorte de pacientes asistidos en el Centro Cardiovascular Universitario, la MCH septal asimétrica se caracteriza por alteraciones ECG muy frecuentes y floridas, lo que confirma la utilidad de la técnica como herramienta de tamizaje. Sin embargo, ninguno de estos hallazgos se correlacionó con los síntomas, la magnitud del espesor septal ni la presencia de fibrosis intramiocárdica. Ampliando esta serie podrían evaluarse los aportes diagnósticos de las combinaciones de signos ECG y su potencial valor pronóstico como marcadores de riesgo de MS en diferentes variantes fenotípicas de MCH.