Services on Demand
Journal
Article
Related links
Share
Revista Uruguaya de Cardiología
Print version ISSN 0797-0048On-line version ISSN 1688-0420
Rev.Urug.Cardiol. vol.31 no.3 Montevideo Dec. 2016
Especial Diabetes Revisión
Actualización en medicamentos antidiabéticos y riesgo cardiovascular
Dra. María del Pilar Serra Sansone1
1 Profesora Agregada. Clínica de Endocrinología, Facultad de Medicina. Universidad de
Corre
Resumen
Diferentes clases de medicamentos con variados mecanismos de acción para el tratamiento de la hiperglicemia han sido investigados y se han desarrollado en las últimas dos décadas. Concomitantemente, algunas instituciones reguladoras, como
Palabras clave:
DIABETES MELLITUS
AGENTES HIPOGLUCEMIANTES
ANTIHIPERGLUCEMIANTES
CARDIOPATÍA ISQUÉMICA
ISQUEMIA ENCEFÁLICA
ENFERMEDAD ARTERIAL PERIFÉRICA
Importancia del tema
El estudio de Prevención de Diabetes y Estilo de Vida de Da Qing, con un seguimiento de 23 años de personas que inicialmente presentaban intolerancia a la glucosa (ITG) –condición que conlleva aumento del riesgo CV– evidenció que la incidencia de ECV se duplicó (15 vs 28/1000 personas/año) en el grupo que evolucionó hacia la diabetes(3). El desarrollo de diabetes fue el factor de riesgo CV más importante en comparación con otros factores como edad, sexo, cifras de presión arterial sistólica (PAS), cifras de colesterol total (CT), tabaquismo y antecedentes de ECV.
El nexo entre diabetes y ECV ha sido reconocido desde hace más de ocho décadas(4,5). Ha sido y es motivo de estudio la variabilidad del riesgo CV con el uso de medicamentos para patologías asociadas a la diabetes (por ejemplo, dislipemia e hipertensión arterial) y también el que pueden determinar los medicamentos para tratar la hiperglucemia.
Relación entre grado de hiperglucemia y eventos cardiovasculares
Un aumento de 1% del valor de la hemoglobina glucosilada (HbA1c), luego de ajustar para otros factores de riesgo, se ha asociado a un incremento estadísticamente significativo del riesgo de eventos CV de 18%(9) y de 12% a 14% de aumento de mortalidad por cualquier causa(10,11).
La correlación entre hiperglucemia y enfermedad microvascular es mucho más estrecha que para la enfermedad macrovascular, presentando un aumento de 37% en el riesgo de retinopatía o enfermedad renal terminal (ERT) asociada a un aumento similar de HbA1c(12).
Descenso de glucosa en sangre y beneficio cardiovascular
La primera evidencia científica que brindó certeza sobre el beneficio del buen control metabólico en relación con el desarrollo de complicaciones micro y macrovasculares fue el Diabetes Control and Complication Trial (DCCT) y su seguimiento posterior, el estudio Epidemiology of Diabetes Interventions and Complications (EDIC)(13,14). Estos estudios realizados en población diabética tipo 1 hallaron que una disminución de 2% en el valor de
El estudio pionero en DM2 fue el United Kingdom Prospective Diabetes Study (UKPDS)(15), en el que pacientes con DM2 de reciente diagnóstico se dividieron en dos grupos: uno de tratamiento intensivo (objetivo de glucemias <110 mg/dl con tratamiento con sulfonilureas (glibenclamida; clorpropamida y glipizida o insulina) versus un grupo convencional (objetivo de glucemias
El tratamiento intenso con metformina también redujo el riesgo de IAM. El efecto beneficioso del control metabólico glucémico temprano dejó su impronta a largo plazo, según lo demostrado en el seguimiento de los pacientes diez años después(16).
Otro estudio destacado en relación con el control metabólico intenso y riesgo de ECV fue el Prospective Pioglitazone Clinical Trial in Macrovascular Events (PROACTIVE), el cual encontró que la pioglitazona redujo uno de los puntos finales secundarios compuestos: muerte e IAM no fatal o stroke ([HR] = 0,84; IC95%, 0,72-0,98); p = 0,027), mientras que una leve reducción de puntos finales primarios, incluyendo amputaciones de miembros inferiores (MMII) y revascularizaciones, no logró significación estadística(17).
Hasta ese momento se podía concluir que existía un impacto positivo en
A pesar de ello, el metaanálisis de Ray y colaboradores, publicado en 2009, analizó los cinco estudios mayores disponibles sobre el efecto del control estricto de glucemia en
Es de resaltar que los beneficios de los primeros estudios se vieron contrapuestos con los hallazgos neutrales y en algunos aspectos negativos de los estudios posteriores, determinando controversias en el ambiente científico.
Varias han sido las hipótesis para dar una explicación de este hecho. Entre ellas, la observación de que existió una diferencia importante entre el UKPDS y estudios subsiguientes determinada por la falta de disponibilidad de drogas hipolipemiantes y antihipertensivas efectivas en la época en que se realizó el estudio. En los estudios siguientes, que analizaron el control de glucemia y su relación con ECV, se usaron medicamentos eficientes para hiperlipemia e hipertensión arterial, lo que probablemente hizo que los resultados del efecto hipoglucemiante sobre el desarrollo de ECV fueran menos aparentes. Otra de las hipótesis planteadas es la relacionada con efectos adversos de las drogas antidiabéticas, las que han sido usadas en altas dosis, solas o en combinaciones variadas, u otros factores aislados o asociados tales como: cortos períodos de seguimiento; falta de revisión de los puntos finales y poder insuficiente de los marcadores surrogados; estudios de poblaciones que ya presentaban daño CV; pocas comparaciones head to head con drogas disponibles; estudios impulsados por el mercado más que por la investigación académica, etcétera(22,23).
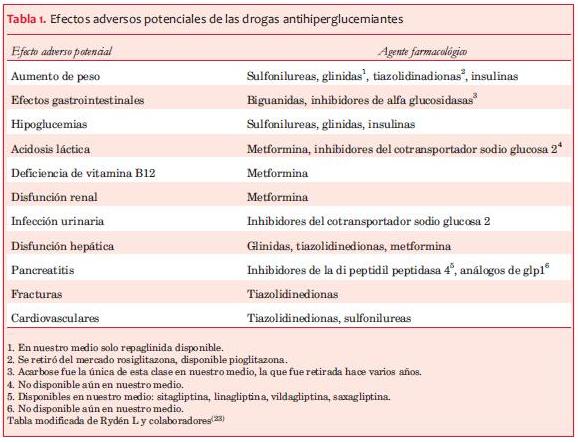
En la tabla 1 se pueden observar los potenciales efectos adversos de los medicamentos antihiperglucémicos.
Seguridad cardiovascular de las drogas hipoglucemiantes
El tema de la seguridad de las drogas usadas para el tratamiento de la hiperglucemia surgió posteriormente a la publicación de Nissen y Wolski sobre el metaanálisis de rosiglitazona y eventos cardiovasculares(24). Este reporte refirió un aumento del riesgo de IAM de 43% y de muerte de causa CV de 64% al comparar el uso de rosiglitazona versus otros hipoglucemiantes que incluían: metformina, SU e insulina, generando múltiples debates y preocupación. En 2008,
Las drogas antidiabéticas y riesgo cardiovascular: evidencias y conceptos actuales
1. Metformina
La metformina tiene más de 50 años de uso en el mundo y más de 20 en nuestro país, algunos años antes de que se lanzara al mercado en Estados Unidos. Es la droga más prescripta y recomendada como de primera línea de tratamiento por
Como ya fue mencionado en el UKPDS, la metformina redujo la incidencia de IAM, muerte coronaria y por cualquier causa en pacientes con DM2 recién diagnosticada con bajo riesgo CV, cuyo peso corporal se encontraba en un promedio de 120% por encima del peso ideal(30). En el análisis que se llevó a cabo diez años después de finalizado este estudio, se mantuvo una reducción de 33% de IAM y muerte por cualquier causa. El número necesario a tratar (NNT) para prevenir una muerte fue de 14 pacientes por diez años(16).
Hubo un segundo estudio con resultados claramente beneficiosos con el uso de metformina: el estudio SPREAD-DIDMCAD, el cual comparó el tratamiento por cinco años de metformina con glipizida en DM2 con ECV, encontrando una reducción de eventos CV del 10,1%(31). En este caso, el NNT para evitar una muerte o IAM no fatal, ACV no fatal o revascularización arterial, fue de 10 pacientes por cinco años, sin demostrar una reducción independiente de mortalidad por cualquier causa como en el UKPDS.
Sin embargo, el metaanálisis de estudios controlados y randomizados con metformina versus dieta, placebo o no tratamiento, no encontró beneficio CV con el uso de esta droga(32). Es de destacar que este metaanálisis no incluyó el estudio SPREAD- DIDMCAD.
Si bien existen muchos trabajos retrospectivos de grandes bases de datos que concluyeron que la metformina reduce eventos CV, en la mayoría de ellos fue comparada con diferentes sulfonilureas (SUs)(33-38). Según el juicio de Ralph de Fronzo y E. Ferranini, no es posible discernir si las SUs aumentan o la metformina desciende el riesgo de eventos CV(39).
Existen dos estudios retrospectivos de pacientes con enfermedad arterial coronaria (EAC) con y sin insuficiencia cardíaca que han concluido que la metformina mejora la sobrevida, independientemente del control glucémico(40,41).
Varios estudios han sido diseñados para evaluar la asociación de metformina con injuria miocárdica. El estudio MetCABG, recientemente publicado, ha investigado si su uso en individuos no diabéticos, pretratamiento quirúrgico y por breve tiempo, limita la injuria miocárdica reflejada por las concentraciones de troponina y de puntos finales secundarios como la aparición de arritmias, requerimiento de inotrópicos y tiempo de desintubación. No se encontraron diferencias en ninguno de los puntos analizados, concluyendo los autores que aunque el uso de metformina fue seguro, no es una estrategia efectiva para reducir la injuria miocárdica periprocedimiento de revascularización coronaria(42).
Otro de estos estudios evaluó el efecto de metformina sobre subfracciones de lípidos circulantes e injuria isquémica miocárdica en 371 pacientes tratados por cuatro meses posteriores a la elevación del ST, denominado Glycometabolic Intervention as Adjunct to Primary Percutaneous Intervention in ST Elevation Myocardial Infarction Trial, GIPS-III. Al finalizar el período de cuatro meses encontraron una disminución de LDL colesterol y de las partículas grandes de LDL, las cuales se vieron afectadas precozmente desde el inicio de la intervención con metformina. El aumento precoz de HDL colesterol y de partículas medianas de VLDL se asoció a mejor función ventricular izquierda y a reducción de la injuria miocárdica(43).
Actualmente se está llevando a cabo un estudio randomizado y controlado en el Reino Unido (Glucose-Lowering in Non-diabetic Hyperglycaemia trial– GLINT)(44) que analizará a 12.000 individuos con prediabetes (disglucemia en rangos inferiores a diabetes) tratados por cinco años con metformina para establecer la efectividad y relación costo/efectividad de la metformina para prevenir eventos cardiovasculares.
Varios también son los estudios ya publicados y otros que proyectan estudiar el efecto de la metformina sobre la íntima media carotídea (IMC). Tres de ellos encontraron efectos positivos(45-47) y de significancia estadística, mientras que otro presentó resultados neutros. Sin embargo, este último se realizó en sujetos que estaban bajo tratamiento con estatinas, por lo que esta podría haber solapado los beneficios de la metformina(48).
En este año se publicó un adelanto del estudio Copenhagen Insulin and Metformin Therapy Trial en más de 400 pacientes con DM2 que fueron asignados en forma aleatoria a insulina más placebo o metformina por 18 meses(49). Encontraron que el cambio en el grosor de
El estudio en curso sobre los efectos de la metformina en el grosor de
Finalmente, en esta revisión de estudios sobre metformina, citamos el metaanálisis y revisión sistematizada recientemente publicado de Marathur NM y colaboradores(51), quienes analizaron más de 200 estudios en los que compararon el efecto y la seguridad de metformina en monoterapia o en combinación con otras drogas para diabetes (SUs; tiazolidinedionas [TZD]; -DPP4; -SGLT2; aGLP1). Concluyeron que la metformina presenta efectos beneficiosos sobre HbA1c, peso, y mortalidad cardiovascular comparada con SUs, lo que avala la indicación de esta droga como de elección o primera línea en el tratamiento de
Según los conceptos de la reciente revisión de los Profs. Ferranini y DeFronzo, varios son los mecanismos de acción de la metformina para ejercer sus efectos beneficiosos: mejora el control metabólico; reduce los niveles de metilglioxal; disminuye los niveles de VLDL, TG y lipemia posprandial; mejora la disfunción endotelial; reduce el PAI-1; desciende aunque modestamente el peso (por efecto anorexígeno, diarrea, disconfort abdominal y flatulencia). Los niveles de LDL y HDL colesterol pueden descender de forma mínima o tener un efecto neutro(39).
En cuanto al concepto de que la metformina es un insulino sensibilizador, recientes revisiones sistematizadas de estudios realizados con clamp euglucémico no soportan este concepto(52,53). Actualmente se considera que sus efectos se restringen a su acción en el hígado y tubo digestivo.
En suma, basándonos en evidencias científicas sobre metformina podemos aseverar que:
· No presenta efectos adversos cardiovasculares en DM2.
· Determina beneficios de varios factores de riesgo CV: disminución leve de peso o efecto neutro; disminución leve de lípidos aterogénicos; reduce marcadores inflamatorios vinculados con ECV.
· No produce hipoglucemias usadas en monodroga.
2. Sulfonilureas (SUs)
Las SUs han sido usadas por más de seis décadas. Son drogas muy baratas comparadas con todo el arsenal terapéutico disponible hoy día y son accesibles en todos los niveles asistenciales.
El mecanismo de acción principal es aumentar la secreción de insulina por las células beta pancreáticas. La hiperinsulinemia resultante vence, al menos en parte, la insulinorresistencia hepática y muscular disminuyendo la hiperglucemia. Hay estudios que avalan el concepto de que las SUs aceleran la falla de la célula beta(54-56); no tienen efecto sobre los factores de riesgo CV; determinan aumento de peso corporal e hipoglucemias, estando estos dos últimos factores asociados a mayor riesgo de ECV(57-59).
Las primeras sospechas sobre la asociación de SUs y mayor riesgo cardiovascular surgieron en la década de 1970 con el controvertido estudio University Group Diabetes Program UGDP(60), a partir de cuya publicación
Dentro de este grupo de drogas la que más se ha encontrado asociada a eventos cardiovasculares ha sido la glibenclamida(63-68). Sin embargo, existen otros trabajos que no han encontrado asociación de este grupo de drogas con mayor morbimortalidad(6,15,68,69). Metaanálisis recientes, diseñados para evaluar mortalidad(62,70,71), dieron resultados conflictivos; mientras que el estudio de Monami(61) reportó un aumento de mortalidad de causa CV, pero no de otros eventos. La asociación de metformina con SUs ha sido reportada en varios estudios como determinante de mayor riesgo CV(30,73). El estudio en curso Cardiovascular Outcome Study of Linagliptin vs Glimepiride in Patients with Type 2 Diabetes (CAROLINA)(74), quizá pueda aclarar más estos conceptos.
Los Profs. Ferranini y De Fronzo, en su revisión del tema sobre las SUs, concluyen que dadas las evidencias de que la glibenclamida interfiere con el preacondicionamiento isquémico coronario(75,76), determina más hipoglucemias(77) y puede estar asociada a aumento del riesgo CV comparada con otras sulfonilureas(63-69), es recomendable elegir otra de su clase(39).
Desde hace varias décadas hay estudios que postulan el nexo entre SUs y riesgo CV, pero no hay unanimidad de resultados en estudios poblacionales. Si nos preguntamos cuál es el lugar de las SUs en el algoritmo terapéutico del paciente diabético, hay guías, como la de
Las diferencias en las recomendaciones medicamentosas para el manejo del paciente diabético 2 en las guías de práctica clínica internacionales demuestran que los criterios que fundamentan el lugar que ocupan este tipo de drogas en el algoritmo terapéutico no han sido unánimes. Por otra parte, existen fundamentos de variada índole: costos de los medicamentos, accesibilidad, experiencia de uso en años, forma de administración, efectos adversos, comodidad y adherencia del paciente, etcétera, para recomendar una u otra estrategia terapéutica medicamentosa.
Parece razonable que al elaborar guías de práctica clínica en países diferentes del origen de las guías anteriormente mencionadas, y al momento de la toma de decisiones del profesional sobre la estrategia frente a cada paciente en particular, es necesario pensar en los pros y los contras de cada uno de los medicamentos según el país, medio y circunstancias en que se encuentre el binomio médico-paciente diabético. Lo que no podemos olvidar en cualquiera de las circunstancias es que los mayores costos en diabetes son los determinados por la aparición de las complicaciones parenquimatosas asociadas a esta enfermedad.
Las evidencias demuestran que las SUs tienen las siguientes características:
· Son las drogas orales con más uso en la historia de la diabetes.
· Son las más baratas.
· Determinan aumento de peso.
· No aportan beneficios adicionales sobre los factores de riesgo de ECV aparte de la que determina la disminución de la hiperglucemia.
· Pueden inducir la claudicación anticipada de la masa de células beta pancreáticas.
· Determinan como efecto adverso principal mayor riesgo de hipoglucemias, por lo que se pueden asociar a mayor riesgo de ECV.
3. Glinidas
En el mundo se comercializan dos de esta clase de drogas: repaglinida y nateglinida. Esta última nunca fue comercializada en nuestro país. Son secretaggos de insulina de corta acción que se unen al receptor de sulfonilurea y además en otro sector diferente de la célula beta pancreática. Este hecho le confiere un perfil farmacocinético diferente. Deben administrarse antes de las comidas principales.
A diferencia de las SUs, cuyo efecto más importante es descender la glucemia de ayuno, las glinidas disminuyen las excursiones glucémicas posprandiales(81). Debido a su corta acción, determinan menor riesgo de hipoglucemias y menor aumento de peso corporal(82,83).
No determinan beneficios sobre los FRCV clásicos. Existe un reporte relacionado con disminución de Lp(a) con repaglinida(84).
En cuanto a seguridad CV, se ha publicado un estudio en 740 pacientes DM2 tratados con repaglinida que ingresaron por enfermedad cardíaca isquémica y en un seguimiento a 30 días no se encontró mayor mortalidad CV en comparación con glibenclamida o gliclazida(85).
Podemos concluir que la repaglinida determina:
· Menor aumento de peso que SUs.
· Menor riesgo de hipoglucemias que SUs.
· No determina mayor mortalidad en pacientes con isquemia miocárdica que las SUs.
4. Tiazolidinedionas (TZD)
Estas drogas activan los receptores proliferadores de peroxisomas nucleares. Son verdaderos insulino sensibilizadores, actuando sobre el músculo esquelético y miocárdico, hígado y tejido adiposo. Actúan también sobre la célula beta aumentando la secreción de insulina y preservando su función(86-89).
En nuestro país solo se dispone de pioglitazona.
Tanto la rosiglitazona como la pioglitazona aumentan la reabsorción renal de agua y sodio, por lo que pueden determinar insuficiencia cardíaca (IC) –más frecuente con rosi que con pioglitazona–, especialmente en individuos con disfunción diastólica miocárdica(91). Sin embargo, existen evidencias de que la pioglitazona mejora la disfunción diastólica; aumenta la sensibilidad insulínica miocárdica y sería neutral en la función del ventrículo izquierdo(39,92).
Del estudio PROACTIVE, que ya fue mencionado, se destaca que la pioglitazona se asoció con un aumento de la incidencia de IC severa, sin aumento de la mortalidad CV por cualquier causa. En un subestudio del PROACTIVE se encontró que la pioglitazona redujo la incidencia de IAM subsecuente en 16% y en 47% la recurrencia de ACV(93,94).
Existen evidencias de que pioglitazona reduce la aterosclerosis en
Hay publicados dos estudios poblacionales en DM2 con grandes números: el primero, llamado General Practice Database del Reino Unido, el cual tuvo un seguimiento de siete años. La pioglitazona comparada con metformina se asoció a una reducción del riesgo de mortalidad por cualquier causa del 39% al 31% (p=0,02; p<0,001); mientras que con SUs se constató un aumento de la mortalidad(98). El otro estudio, de Morgan y colaboradores, encontró que el uso de pioglitazona asociada a metformina determinó un HR de 0,70 para mortalidad por cualquier causa y HR de 0,75 para la asociación de end points que comprendieron eventos cardiovasculares mayores (MACE)(99).
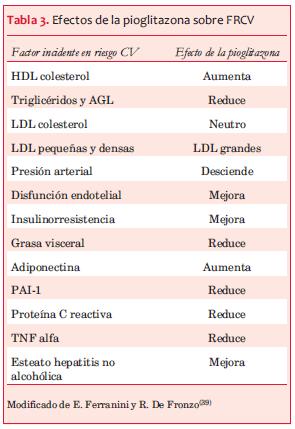
La evidencia demuestra que la piolitazona:
· Tiene efectos beneficiosos sobre algunos FRCV: reduce la grasa visceral; efecto beneficioso en las fracciones de lípidos, mejoría en la función endotelial, descenso leve de la presión arterial.
· Reduce marcadores inflamatorios asociados a ECV.
· Puede disminuir la progresión de la aterogénesis.
· Puede disminuir la incidencia de ECV y mortalidad.
· Aumenta el riesgo para el desarrollo de IC.
5. Inhibidores de la dipeptidil peptidasa 4 (-DPP4)
Los inhibidores de la enzima dipeptidil peptidasa tipo 4 bloquean la degradación de incretinas: GLP1 y GIP, y, además, una variedad de otros péptidos que incluyen el péptido natriurético cerebral(100). A través del efecto incretinas determinan una estimulación de la secreción de insulina por parte de las células beta pancreáticas y una disminución de la secreción de glucagón (tabla 4).
Los -DPP4 tienen un efecto moderado en la reducción de
Se ha evidenciado que la sitagliptina desciende PCR y mejora la disfunción endotelial al igual que la vildagliptina(108-110).
En estudios animales disminuyen el área de isquemia-reperfusión miocárdica(111). En estudios retrospectivos en humanos, que no fueron diseñados para analizar la incidencia de ECV, se encontró una reducción significativa de eventos CV y de ECV(112-119).
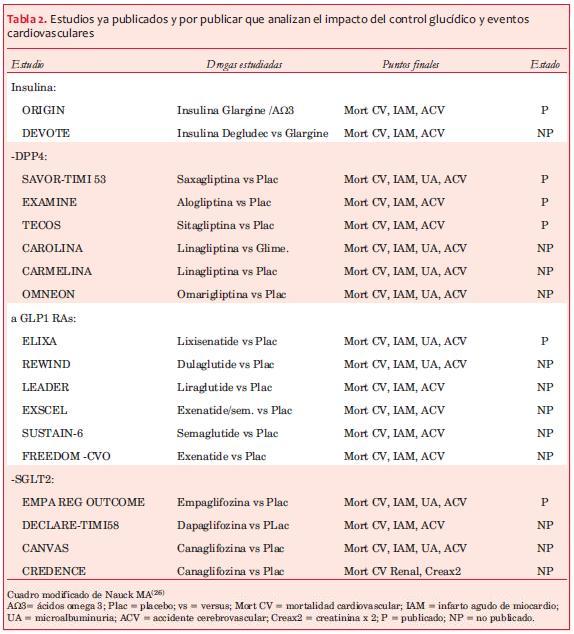
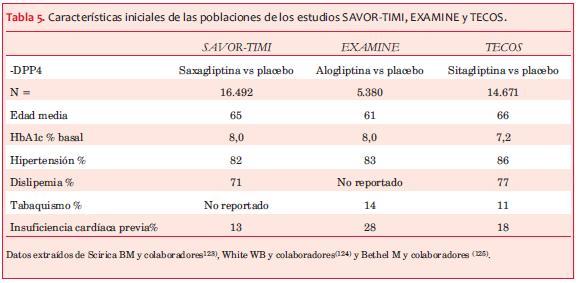
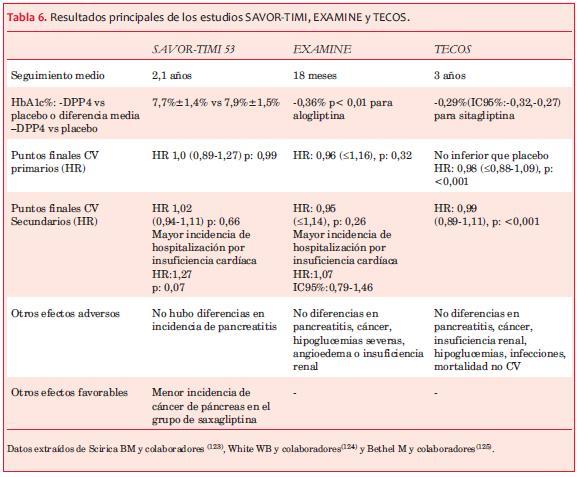
Recientemente han sido publicados tres estudios prospectivos, randomizados, diseñados para evaluar el impacto de drogas de esta clase sobre ECV: 1. Saxagliptin Assessment of Vascular Outcomes Recorded in patients with diabetes mellitus-Thrombolysys In Miocardial Infarction (SAVOR-TIMI 53)(120). 2. EXAMINation of cardiovascular outcomes with alogliptin versus standard of carE (EXAMINE)(121). 3. El Trial Evaluating Cardiovascular Outcomes with Sitagliptin (TECOS)(122) (tablas 5 y 6).
El estudio SAVOR TIMI 53 tuvo como hallazgo inesperado una mayor incidencia de hospitalización por IC, hecho que no se asoció con aumento de mortalidad(121). La causa de este hallazgo no está clara. En el estudio EXAMINE también se observó, aunque en menor incidencia, este hecho(121,123), mientras que en el estudio TECOS no se observaron diferencias entre los dos grupos (sitagliptina vs placebo)(122).
A diferencia de los estudios retrospectivos, en estos no se evidenció una disminución de los ECV. Obsérvese, sin embargo, que los tres estudios, a pesar de ser diseñados para evaluar incidencia de ECV, tuvieron un tiempo de seguimiento muy corto, por lo que posiblemente no hubo tiempo suficiente para el desarrollo de ECV.
Otro hecho destacable es que la diferencia entre las incretinas estudiadas vs placebo fue pequeña (0,3%-0,4%), y que la mayoría de los pacientes estaban bajo tratamiento con estatinas, antiplaquetarios y antihipertensores, lo que puede haber atenuado las diferencias, según la opinión de los Profs. Ferranini y De Fronzo(39). Es posible concluir que los tres estudios muestran concluyentemente la no inferioridad frente a placebo de esta clase de medicamentos para determinar eventos cardiovasculares mayores (mortalidad CV; IAM y ACV no fatales).
Si bien no existe un aumento del riesgo CV, no se han comprobado resultados unánimes sobre beneficios asociados a su uso.
Los estudios CAROLINA(124), CARMELINA(125) serán finalizados en 2018 y el estudio OMNEON en 2020(126). Habrá que esperar si los resultados de linagliptina versus SUs en el primero, y con placebo en los siguientes, arrojan luz sobre los potenciales beneficios cardiovasculares de esta droga perteneciente al grupo de las incretinas.
De acuerdo con las evidencias actuales los -DPP4:
· No aumentan el riesgo de hipoglucemia.
· Tienen efecto neutro en el peso del paciente.
· Poseen leve efecto beneficioso sobre FRCV: lipemia posprandial.
· Mejoran disfunción endotelial.
· No son inferiores que placebo en relación a eventos CV y ECV en general.
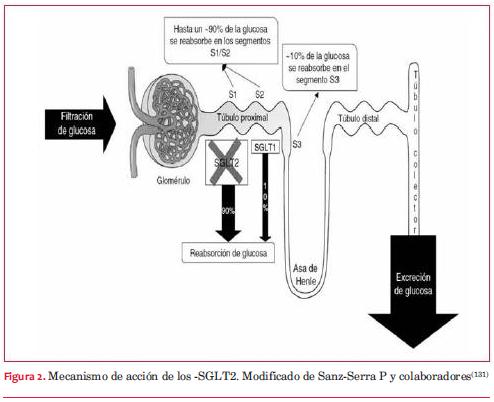
6. Inhibidores del cotransportador renal de Na/glucosa tipo 2 (-SGLT2)
Representan la clase más nueva de agentes orales aprobados para el tratamiento de
La disminución de la glucosa circulante disminuye la gluco toxicidad, resultando en mejoría de la función de la célula beta pancreática y disminución de la insulinorresistencia(131-134). Logran una disminución de HbA1c similar a metformina, que es del rango de 0,8% a 1,0%, si partimos de un valor de 8% durante dos años de tratamiento(135-138). Pueden ser asociados a cualquiera de las drogas orales e insulinas debido a su diferente mecanismo de acción. Los -SGLT2 se asocian a un bajo riesgo de hipoglucemias, similar a metformina, y al igual que con esta, aumenta el riesgo con el uso simultáneo de secretagogos de insulino secretores o insulina.
Además de disminuir la insulinorresistencia determinan otros efectos favorables sobre FRCV. Al inhibir la reabsorción de sodio del túbulo contorneado proximal (TCP), determinan una leve depleción del volumen intravascular, y por ello, una disminución de la presión arterial de aproximadamente 4-6/1-2 mmHg(128,129). Disminuyen el peso en los seis a doce meses posteriores a su inicio, en el orden de
En el metaanálisis de Ptaszynska y colaboradores de estudios clínicos en fase III/IV con dapaglifozina, que incluyó a más de 5.000 pacientes, y de ellos, más de 3.000 tratados con la droga, el HR de puntos finales compuestos de MACE más hospitalización por angina inestable fue de 0,82 favorable a dapaglifozina(140).
Recientemente se publicó el estudio EMPA- REG-OUTCOME(141), el cual encontró resultados cardiovasculares muy beneficiosos, siendo hasta el momento el más destacado en este tema. Fue un estudio doble ciego, controlado y randomizado que analizó los efectos de la droga sobre la morbimortalidad en DM2 con alto riesgo de ECV que recibían tratamiento estándar. El grupo tratado con empaglifozina redujo el riesgo de muerte de causa CV (HR=0,62 [0,49-0,77] p: < 0,001); de muerte por cualquier causa (HR=0,68 [0,57-0,82] p: < 0,001) y de hospitalizaciones por IC (HR=0,65 [0,50-0,85] p: < 0,002). Para prevenir un evento CV, el NNT fue de 46 pacientes por tres años. El riesgo de ACV no tuvo diferencias significativas, pero tendió a dirigirse en la dirección opuesta. Un hallazgo adicional del estudio fue la importante reducción de la progresión de enfermedad renal. Los efectos CV beneficiosos de esta clase de drogas se deberían a sus efectos pleiotrópicos, como la inducción de diuresis y el descenso de la presión arterial, entre otros mecanismos(144).
El efecto adverso más frecuente con el uso de las glifozinas es el de las infecciones micóticas genitales y urinarias, generalmente de intensidad leve a moderada que revierten con los tratamientos habituales(139,143,144).
En algunos estudios se encontró compromiso óseo asociado al uso de estas drogas(146-149), lo que determinó la publicación de un alerta por parte de
También ha sido motivo de alerta por
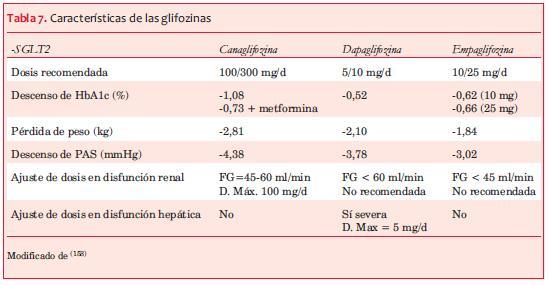
En la tabla 7 se muestran algunas características específicas de las tres glifozinas: cana, dapa y empaglifozina.
Los estudios aún no finalizados que aportarán más datos sobre esta clase de drogas son: DECLARE TIMI58, CANVAS y CREDENCE(154-156).
En relación al impacto de los FRCV y ECV de estas nuevas drogas, podemos concluir que:
· Poseen bajo riesgo de producir hipoglucemias.
· Determinan leve disminución de peso.
· Brindan beneficios leves a moderados sobre FRCV.
· Determinan disminución de eventos y ECV (en mayor porcentaje de lo hallado con otras drogas).
7. Inhibidores de las alfa glucosidasas
Esta clase de fármacos tiene tres representantes: acarbosa, miglitol y vogliboza, de los cuales solo la primera estuvo disponible en Uruguay, siendo discontinuada hace unos años atrás. En Europa y en Asia son drogas más usadas que en otros continentes. Actúan disminuyendo la absorción intestinal de hidratos de carbono simples, determinando un retraso en la absorción de los mismos, con la consecuente disminución de la hiperglucemia posprandial. Aumentan los niveles de GLP1 plasmáticos y alteran la microbiota del tubo digestivo(157-159).
No existen estudios a largo plazo que evalúen sus efectos CV. El estudio STOP-NIDDM analizó a pacientes con intolerancia a la glucosa (ITG) y luego de un seguimiento de 3,3 años se redujo en 25% el riesgo de desarrollar DM e hipertensión arterial. En los tratados con la droga se evidenció una reducción del riesgo de eventos macrovasculares de 49% comparado con placebo(160). Sin embargo, el número de eventos fue bajo, y, por lo tanto, el estudio careció de poder suficiente para aseverar su capacidad cardioprotectora. Actualmente se está llevando a cabo un estudio para evaluar prevención secundaria cuando se agrega esta droga en pacientes con antecedentes de enfermedad coronaria e ITG(161).
Dada la carencia de estudios a largo plazo de este tipo de medicamentos sobre eventos CV, no podemos arribar a conclusiones sobre el tópico que nos ocupa. Por otra parte y como ya fuera mencionado, actualmente no se disponen en nuestro medio.
8. Agonistas del receptor de GLP1
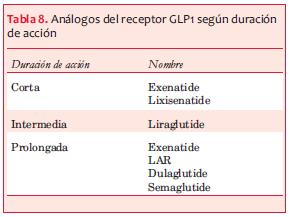
Los análogos del receptor del péptido similar a glucagón tipo 1 (aGLP1) actúan de manera similar a GLP1, por lo que integran el grupo de drogas con efecto de incretinas. En la tabla 8 se pueden observar las drogas que corresponden a este grupo y su clasificación de acuerdo con la duración de acción. No están disponibles aún en Uruguay.
Los aGLP1 mejoran la homeostasis de la glucosa a través de múltiples efectos: estimulación de la secreción de insulina; inhibición de la secreción de glucagón; supresión endógena de la producción de glucosa por mecanismos directos e indirectos; supresión del apetito; aumento de la sensibilidad de la insulina mediada por la pérdida del peso corporal y retraso en el vaciamiento gástrico resultantes en una disminución de la hiperglucemia posprandial(160,162). El efecto de reducción de
En estudios animales se han encontrado beneficios en la contractilidad miocárdica y del gasto cardíaco con reducción de la isquemia miocárdica pos-IAM y mejoría de los procesos moleculares involucrados en la apoptosis celular del miocardio isquémico(168-172).
En humanos con falla cardíaca, con y sin DM, se han realizado estudios pequeños y un gran estudio doble ciego controlado y randomizado en pacientes con IAM en que se les administró exenatide previo al inicio de la angioplastia, obteniendo resultados favorables(165,166,173,178). Recientemente, liraglutide ha sido aceptado por FDA para el tratamiento de la obesidad en diabéticos y no diabéticos(179). Se ha demostrado un efecto beneficioso sobre la presión arterial(180-182) y reducción de la lipemia posprandial y en ayunas(183-184). También se ha encontrado que tienen capacidad de reducir marcadores inflamatorios asociados a la enfermedad aterosclerótica cardiovascular, fundamentalmente el descenso de la proteína C reactiva (PCR), TNFa, PAI-1 y estimulan la síntesis de adiponectina(185-190).
Un estudio retrospectivo, que merece ser destacado, analizó la relación de exenatide con ECV, obteniendo información de LifeLink base de datos, de reclamaciones de seguros médicos y farmacéuticos, entre 2005 y 2009, de pacientes sin historia de IAM en los nueve meses anteriores. Se encontraron en el período mencionado 39.275 pacientes con DM2 tratados con exenatide y se compararon con 38.121 diabéticos tratados con drogas antidiabéticas de otra clase. El grupo tratado con exenatide presentó menos eventos CV (HR = 0,81), menor cantidad de hospitalizaciones de causa CV (HR = 0,88) y por cualquier otra causa (HR = 0,88)(191).
De los estudios prospectivos grandes y diseñados a largo plazo con el fin de evaluar el impacto cardiovascular de estas drogas, se conocen al día de hoy los resultados del estudio ELIXA (lixisenatide vs placebo) y el estudio LEADER (liraglutide vs placebo). El primero mostró resultados CV neutros versus placebo y no fue inferior en determinar o empeorar falla cardíaca(192). El estudio LEADER, recientemente publicado, con un seguimiento a 3,8 años, encontró en el grupo tratado con liraglutide menor mortalidad CV (HR = 0, 78, IC: 0,66-0,93, p=0,007), y menor mortalidad por cualquier causa (HR = 0,85, IC: 0,74-0,97, p=0,02); mientras que la incidencia de IAM, ACV no fatal y hospitalización por IC no alcanzó valores menores estadísticamente significativos(193). En ambos estudios los efectos adversos más frecuentes fueron digestivos, pero en ninguno de los dos se observó mayor incidencia de pancreatitis con el uso de estos aGLP1.
Ha sido publicado recientemente el metaanálisis y revisión sistematizada de Kim JY y colaboradores, cuyo objetivo fue evaluar el impacto de -DPP4 y aGLP1 (tratamientos basados en incretinas) sobre ECV en DM2 con bajo riesgo CV. Incluyó 75 estudios con más de 45.000 pacientes. Encontraron una disminución de ECV no estadísticamente significativa comparado con controles (OR=0,90, IC: 0,80-1,00), concluyendo que el tratamiento basado en incretinas no demostró un efecto protector claro sobre prevención primaria en ECV de DM2 con bajo riesgo CV(192).
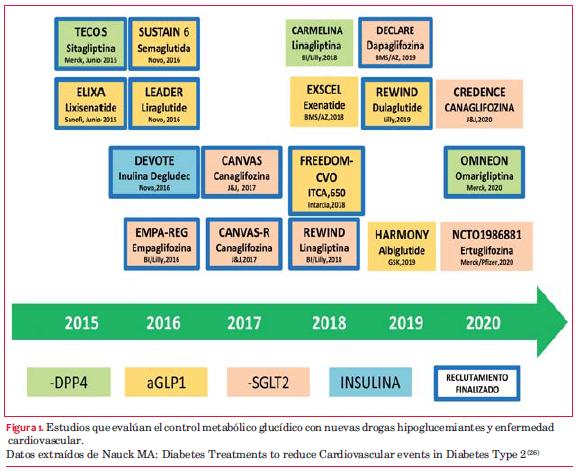
Si bien los resultados de esta clase de drogas son muy alentadores, se esperan los resultados de varios estudios diseñados para la evaluación de este tópico: SUSTAIN 6, EXSCEL, REWIND, FREEDOM CVO y HARMONY, los cuales serán publicados en los próximos años (figura 1 y tabla 2), y que aportarán datos seguramente más concluyentes.
En el grupo de aGLP1 se puede concluir desde el punto de vista del impacto CV que:
· Determinan beneficios sobre FRCV: lipemia posprandial y en ayunas, presión arterial; marcadores inflamatorios asociados a ECV.
· Descenso de peso corporal.
· Lixisenatide no es inferior desde el punto de vista CV a otras drogas.
· Liraglutide disminuye mortalidad CV y por cualquier causa.
9. Insulina
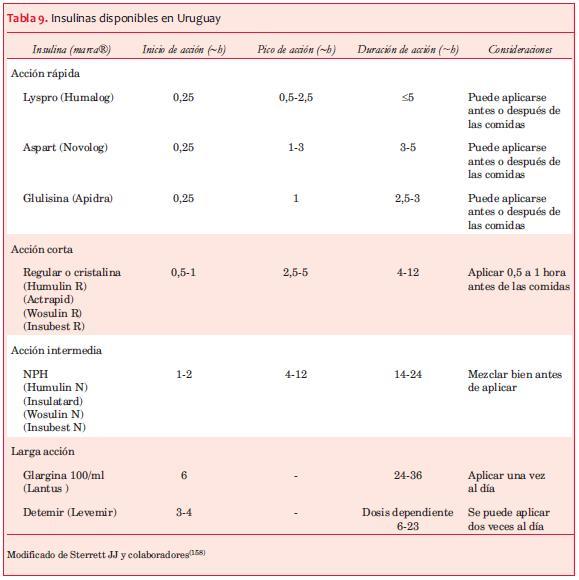
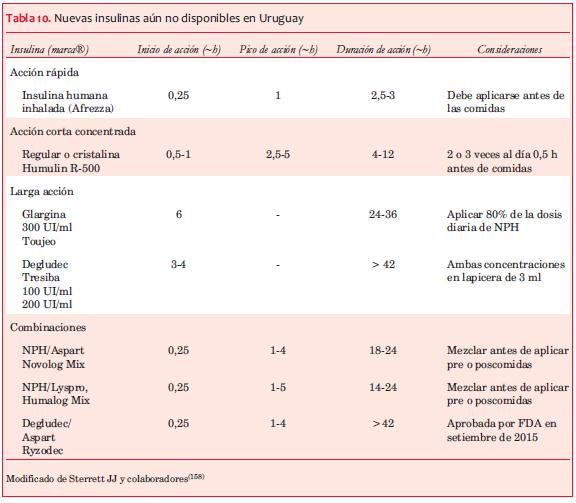
Existen múltiples preparados de insulina de diferentes rangos de inicio y duración de acción. A nivel internacional se dispone de varias preparaciones que aún no han llegado a nuestro país (tablas 9 y 10).
La insulina es la única droga que tiene la capacidad potencial de normalizar
El estudio ORIGIN(197), ya publicado, y llevado a cabo con pacientes con DM2 de reciente diagnóstico, ITG o glucemia de ayuno alterada (GAA) que presentaban el antecedente de un evento CV o alto riesgo de ECV, no reportó reducción de eventos macrovasculares (HR = 1,0). Este resultado se obtuvo a pesar de mantener un excelente control glucémico, con HbA1c promedios de 6,2% a lo largo de los seis años que duró el estudio, usando una dosis media de insulina de 28 U/día.
El estudio inicial del UKPDS y su revisión posterior no presentaron evidencias de que el uso de insulina estuviera asociado a mayor incidencia de ECV(14,15). Sin embargo, muchos estudios retrospectivos de casos-controles bajo tratamiento con insulina han encontrado esta relación(196,198,202). Por otra parte, otros estudios epidemiológicos controlados y randomizados no han podido determinar el nexo entre uso de insulina y riesgo de ECV.
Según la revisión reciente de los Profs. Ferranini y DeFronzo, la biología de la acción de la insulina es ambivalente, ya que puede originar aterogénesis a través de varios mecanismos tanto en humanos como en animales(39). El balance neto de sus efectos anti y pro aterogénicos puede depender de circunstancias experimentales específicas o fisiológicas. La posible asociación entre insulina y aterogénesis se podría explicar por la naturaleza retrospectiva de corte transversal de muchos de los estudios publicados y por el hecho de que la insulina suele usarse fundamentalmente en personas diabéticas tipo 2 de larga data y con frecuentes complicaciones parenquimatosas(195,196,198-202).
Es necesario reconocer que los escasos estudios longitudinales, como el UKPS y el ORIGIN, no demostraron que la insulina, per se, sea aterogénica. Este hecho podría explicarse mediante el supuesto de que cualquier acción pro aterogénica de la insulina exógena puede ser vencida ante el beneficio antihiperglucémico de la droga, disminuyendo a través de esta acción preponderante la incidencia de ECV y mortalidad, como ha sido visto en estudios en DM1, por ejemplo el DCCT/EDIC, en el grupo que se intervino usando tratamiento insulínico intensificado(202,203).
Sin duda que factores como el terreno CV del paciente, grado de insulinorresistencia, dosis de insulina, porcentaje de sobrepeso u obesidad, frecuencia de hipoglucemias y hasta el tipo de formulación de la estrategia de tratamiento insulínico, basal-bolo, fórmulas premezcladas, etcétera, determinen una variabilidad impredecible sobre la evolución CV.
En suma, la insulina tiene los siguientes efectos sobre FRCV y ECV:
· Determinan aumento de peso.
· Es la droga que conlleva mayor riesgo de hipoglucemia.
· Aun logrando un buen y mantenido control glucémico no hay resultados unánimes que demuestren efecto favorable de la insulina sobre ECV y tampoco estudios que demuestren inferioridad comparada con otras drogas.
· Si bien son drogas alentadoras, aún no se ha encontrado en estudios de estas drogas una reducción de eventos CV estadísticamente significativa.
Conclusiones finales
Desde el descubrimiento de la insulina en 1921 por Frederick Grant Banting y Charles Best han pasado casi 100 años, y por primera vez tenemos el mayor arsenal de medicamentos para el tratamiento del paciente diabético que hayamos conocido, con diferentes formas de acción, administración y combinaciones de drogas hasta ahora no disponibles. Ha sido también en las últimas tres décadas a partir del uso de la metformina y las drogas que han aparecido posteriormente, que tenemos la posibilidad de tratar la hiperglucemia y prevenir complicaciones parenquimatosas o su progresión aun en pacientes con alto riesgo CV o con complicaciones parenquimatosas ya establecidas.
La variedad a seleccionar exige que antes de prescribir los medicamentos conozcamos con precisión frente a qué tipo de paciente estamos y cuáles son sus complicaciones parenquimatosas y comorbilidades.
No es menor el aspecto económico, ya que muchas de estas drogas tienen un alto costo.
El futuro nos depara muchas novedades en materia de posibilidades para el manejo del paciente diabético. Nuevas drogas, nuevas formas de administración, sensores de glucosa adheribles a la piel que comunican al glucómetro la glucemia del paciente reduciendo de manera sensible el número de punciones digitales, hasta el páncreas artificial, por mencionar algunos de los adelantos que vendrán. Médicos y pacientes deseamos poder disponer de lo que seguramente facilitará la vida de aquellas personas que desarrollen diabetes en el futuro.
Mientras tanto, no debemos perder de vista que en diabéticos que recién comienzan con la enfermedad y se decide el inicio de farmacoterapia, debemos seleccionar la droga con el fin de ayudarlos a llegar en muy buenas condiciones al momento en que se dispongan los adelantos venideros. En los que ya tienen afectaciones o comorbilidades será necesario seleccionar la mejor estrategia terapéutica para lograr mejorar su calidad de vida y disminuir los riesgos futuros determinados por el paso del tiempo, la enfermedad y sus comorbilidades, y también por los medicamentos que indicamos. Este último concepto es el que debemos agregar a las consideraciones del quehacer médico actual en el tratamiento del paciente diabético.
Bibliografía
1. Centers for Disease Control and Prevention. Diabetes Report Card 2014. Atlanta, GA: CDC, 2015. Disponible en: http://www.cdc.gov/diabetes/pdfs/library/diabetesreportcard2014.pdf. [Consulta: 10 julio 2016].
2. International Diabetes Federation. IDF Diabetes Atlas 2015. 7 ed. Brussels, IDF, 2015. Disponible en: http://www.diabetesatlas.org/resources/2015-atlas.html. [Consulta: 10 junio 2016].
3. Gong Q, Zhang P, Wang J, An Y, Gregg EW, Yang W, et al. Progression to diabetes is associated with an increased incidence of cardiovascular disease among persons with impared glucose tolerance: a 23 year follow up of The Da Qing Diabetes Prevention Trial. Poster 1388-P. En: 76th American Diabetes Association Scientific Sessions. New Orleans, June 12, 2016. Disponible en: https://ada.scientificposters.com/epsAbstractADA.cfm?id=1. [Consulta:10 julio 2016].
4. James W, Sherrill MD. Cardiovascular disease in diabetes. Cal West Med 1933; 38(2):72-8.
5. James W, Sherrill MD. Cardiovascular disease in diabetes. Cal West Med 1933; 39(1):17-20.
6. Goff DC Jr, Gerstein HC, Ginsberg HN, Cushman WC, Margolis KL, Byington RP, et al; ACCORD Study Group. Prevention of cardiovascular disease in persons with type 2 diabetes mellitus: current knowledge and rationale for the Action to Control Cardiovascular Risk in Diabetes (ACCORD) trial. Am J Cardiol 2007; 99(12A):4i-20i.
7. Emerging Risk Factors Collaboration; Sarwar N, Gao P, Seshasai SR, Gobin R, Kaptoge S, Di Angelantonio E, et al. Diabetes mellitus, fasting blood glucose concentration, and risk of vascular disease: a collaborative meta-analysis of 102 prospective studies. Lancet 2010; 375(9733):2215-22.
8. Anand SS, Dagenais GR, Mohan V, Diaz R, Probstfield J, Freeman R, et al; EpiDREAM Investigators. Glucose levels are associated with cardiovascular disease and death in an international cohort of normal glycaemic and dysglycaemic men and women: the EpiDREAM cohort study. Eur J Prev Cardiol 2012; 19(4):755-64.
9. Selvin E, Marinopoulos S, Berkenblit G, Rami T, Brancati FL, Powe NR, et al. Meta-analysis: glycosylated hemoglobin and cardiovascular disease in diabetes mellitus. Ann Intern Med 2004; 141(6):421-31.
10. Gerstein HC, Islam S, Anand S, Almahmeed W, Damasceno A, Dans A, et al. Dysglycaemia and the risk of acute myocardial infarction in multiple ethnic groups: an analysis of 15,780 patients from the INTERHEART study. Diabetologia 2010; 53(12):2509-17.
11. Gerstein HC, Pogue J, Mann JF, Lonn E, Dagenais GR, McQueen M, et al; HOPE investigators. The relationship between dysglycaemia and cardiovascular and renal risk in diabetic and non-diabetic participants in the HOPE study: a prospective epidemiological analysis. Diabetologia 2005; 48(9):1749-55.
12. Stratton IM, Adler AI, Neil HA, Matthews DR, Manley SE, Cull CA, et al. Association of glycaemia with macrovascular and microvascular complications of type 2 diabetes (UKPDS 35): prospective observational study. BMJ 2000; 321(7258):405-12.
13. The Diabetes Control and Complications Trial Research Group. The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulin-dependent diabetes mellitus. N Engl J Med 1993; 329(14):977-86.
14. Nathan DM, Cleary PA, Backlund JY, Genuth SM, Lachin JM, Orchard TJ, et al; Diabetes Control and Complications Trial/Epidemiology of Diabetes Interventions and Complications (DCCT/EDIC) Study Research Group. Intensive diabetes treatment and cardiovascular disease in patients with type 1 diabetes. N Engl J Med 2005; 353(25):2643-53.
15. UK Prospective Diabetes Study (UKPDS) Group. Intensive blood-glucose control with sulphonylureas or insulin compared with conventional treatment and risk of complications in patients with type 2 diabetes (UKPDS 33). Lancet 1998; 352(9131):837-53.
16. Holman RR, Paul SK, Bethel MA, Matthews DR, Neil HA. 10-year follow-up of intensive glucose control in type 2 diabetes. N Engl J Med 2008; 359(15):1577-89.
17. Dormandy JA,Charbonnel B,Eckland DJ, Erdmann E, Massi-Benedetti M, Moules IK, et al. Secondary events in patients with type 2 diabetes in the PROactive Study (PROspective pioglitAzone Clinical Trial In macro- Vascular Events): a randomised controlled trial. Lancet 2005; 366(9493):1279-89.
18. ACCORD Study Group; Gerstein HC, Miller ME, Genuth S, Ismail-Beigi F, Buse JB, Goff DC Jr, et al. Long-term effects of intensive glucose lowering on cardiovascular outcomes. N Engl J Med 2011; 364(9):818-28.
19. ADVANCE Collaborative Group; Patel A, MacMahon S, Chalmers J, Neal B, Billot L, Woodward M, et al. Intensive blood glucose control and vascular outcomes in patients with type 2 diabetes. N Engl J Med 2008; 358(24):2560-72.
20. Duckworth W, Abraira C, Moritz T, Reda D, Emanuele N, Reaven PD, et al; VADT Investigators. Glucose control and vascular complications in veterans with type 2 diabetes. N Engl J Med 2009; 360(2):129-39.
21. Ray KK, Seshasai SR, Wijesuriya S, Sivakumaran R, Nethercott S, Preiss D, et al. Effect of intensive control of glucose on cardiovascular outcomes and death in patients with diabetes mellitus: a meta-analysis of randomised controlled trials. Lancet 2009; 373(9677):1765-72.
22. Authors/Task Force Members; Rydén L, Grant PJ, Anker SD, Berne C, Cosentino F, Danchin N, et al; ESC Committee for Practice Guidelines(CPG). ESC Guidelines on diabetes, pre-diabetes, and cardiovascular diseases developed in collaboration with the EASD: the Task Force on diabetes, pre-diabetes, and cardiovascular diseases of the European Society of Cardiology (ESC) and developed in collaboration with the European Association for the Study of Diabetes (EASD). Eur Heart J 2013; 34(39):3035-87.
23. Rydén L, Shahim B, Mellbin L. Clinical implications of cardiovascular outcome trials in Type 2 diabetes: from DCCT to EMPA-REG. Clin Ther 2016; 38(6):1279-87.
24. Nissen SE, Wolski K. Effect of rosiglitazone on the risk of myocardial infarction and death from cardiovascular causes. N Engl J Med 2007; 356(24): 2457-71.
25. Food and Drug Administration. FDA news release: FDA Announces new recommendations on evaluating cardiovascular risk in drugs intended to treat Type 2 diabetes.December 17, 2008. Silver Spring, MD: FDA, 2008. Disponible en: http://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/2008/ucm116994.htm. [Consulta: 7 julio 2016].
26. Nauck MA, Del Prato S, Gerstein HC, Leiter LA. Diabetes treatments to reduce cardiovascular events in diabetes Type 2. Medscape CME released: 2/1/2016. Disponible en:http://www.medscape.org/viewarticle/857854. [Consulta: 7 julio 2016].
27. American Diabetes Association. Approaches to glycemic treatment. Diabetes Care 2016; 39(Suppl 1):S52-9.
28. Inzucchi SE, Bergenstal RM, Buse JB, Diamant M, Ferrannini E, Nauck M, et al. Management of hyperglycemia in type 2 diabetes, 2015: a patient-centered approach: update to a position statement of the American Diabetes Association and the European Association for the Study of Diabetes. Diabetes Care 2015; 38(1):140-9.
29. International Diabetes Federation. Glucose control therapy: recommendations. En: International Diabetes Federation. Clinical Guidelines Task Force: global guideline for Type 2 diabetes.Brussels: IDF, 2012:55-64. Disponible en:
http://www.idf.org/sites/default/files/IDF-Guideline-for-Type-2-Diabetes.pdf. [Consulta: 13 julio 2016].
30. United Kingdom Prospective Diabetes Study Group. Effect of intensive blood-glucose control with metformin on complications in overweight patients with type 2 diabetes (UKPDS 34). Lancet 1998; 352(9131):854-65.
31. Hong J, Zhang Y, Lai S, Lv A, Su Q, Dong Y, et al; SPREAD-DIMCAD Investigators. Effects of metformin versus glipizide on cardiovascular outcomes in patients with type 2 diabetes and coronary artery disease. Diabetes Care 2013; 36(5):1304-11.
32. Boussageon R, Supper I, Bejan-Angoulvant T, Kellou N, Cucherat M, Boissel JP, et al. Reappraisal of metformin efficacy in the treatment of type 2 diabetes: a meta-analysis of randomised controlled trials. PLoS Med 2012; 9(4):e1001204.
33. Schramm TK, Gislason GH, Vaag A, Rasmussen JN, Folke F, Hansen ML, et al. Mortality and cardiovascular risk associated with different insulin secretagogues compared with metformin in type 2 diabetes, with or without a previous myocardial infarction: a nationwide study. Eur Heart J 2011; 32(15):1900-8.
34. Evans JM, Ogston SA, Emslie-Smith A, Morris AD. Risk of mortality and adverse cardiovascular outcomes in type 2 diabetes: a comparison of patients treated with sulfonylureas and metformin. Diabetologia 2006; 49(5):930-6.
35. Johnson JA, Majumdar SR, Simpson SH, Toth EL. Decreased mortality associated with the use of metformin compared with sulfonylurea monotherapy in type 2 diabetes. Diabetes Care 2002; 25(12):2244-8.
36. Roumie CL, Hung AM, Greevy RA, Grijalva CG, Liu X, Murff HJ, et al. Comparative effectiveness of sulfonylurea and metformin monotherapy on cardiovascular events in type 2 diabetes mellitus: a cohort study. Ann Intern Med 2012; 157(9):601-10.
37. Jørgensen CH, Gislason GH, Andersson C, Ahlehoff O, Charlot M, Schramm TK, et al. Effects of oral glucose-lowering drugs on long term outcomes in patients with diabetes mellitus following myocardial infarction not treated with emergent percutaneous coronary intervention: a retrospective nationwide cohort study. Cardiovasc Diabetol 2010; 9:54.
38. Hung YC, Lin CC, Wang TY, Chang MP, Sung FC, Chen CC. Oral hypoglycaemic agents and the development of non-fatal cardiovascular events in patients with type 2 diabetes mellitus. Diabetes Metab Res Rev 2013; 29(8):673-9.
39. Ferrannini E, DeFronzo RA. Impact of glucose-lowering drugs on cardiovascular disease in type 2 diabetes. Eur Heart J 2015; 36(34):2288-96.
40. Kao J, Tobis J, McClelland RL, Heaton MR, Davis BR, Holmes DR Jr, et al; Investigators in the Prevention of Restenosis With Tranilast and Its Outcomes Trial. Relation of metformin treatment to clinical events in diabetic patients undergoing percutaneous intervention. Am J Cardiol 2004; 93(11): 1347-50.
41. Roussel R, Travert F, Pasquet B, Wilson PW, Smith SC Jr, Goto S, et al; Reduction of Atherothrombosis for Continued Health (REACH) Registry Investigators. Metformin use and mortality among patients with diabetes and atherothrombosis. Arch Intern Med 2010; 170(21):1892-9.
42. El Messaoudi S, Nederlof R, Zuurbier CJ, van Swieten HA, Pickkers P, Noyez L, et al. Effect of metformin pretreatment on myocardial injury during coronary artery bypass surgery in patients without diabetes (MetCAB): a double-blind, randomised controlled trial. Lancet Diabetes Endocrinol 2015; 3(8):615-23.
43. Eppinga RN, Hartman MH, van Veldhuisen DJ, Lexis CP, Connelly MA, Lipsic E, et al. Effect of metformin treatment on lipoprotein subfractions in non-diabetic patients with acute myocardial infarction: a glycometabolic intervention as adjunct to primary coronary intervention in ST elevation myocardial infarction (GIPS-III) trial. PLoS One 2016; 11(1):e0145719.
44. University of Oxford. The Oxford Centre for Diabetes, Endocrinology and Metabolism. Diabetes Trials Unit. Glucose lowering in non diabetic hyperglycaemia trial: GLINT. Oxford, UK: University of Oxford, 2016. Disponible en: https://www.dtu.ox.ac.uk/GLINT/organisation.php. [Consulta: 10 julio 2016].
45. Katakami N, Yamasaki Y, Hayaishi-Okano R, Ohtoshi K, Kaneto H, Matsuhisa M, et al. Metformin or gliclazide, rather than glibenclamide, attenuate progression of carotid intima-media thickness in subjects with type 2 diabetes. Diabetologia 2004; 47(11):1906-13.
46. Meaney E, Vela A, Samaniego V, Meaney A, Asbún J, Zempoalteca JC, et al. Metformin, arterial function, intima-media thickness and nitroxidation in metabolic syndrome: the mefisto study. Clin Exp Pharmacol Physiol 2008; 35(8):895-903.
47. Matsumoto K, Sera Y, Abe Y, Tominaga T, Yeki Y, Miyake S. Metformin attenuates progression of carotid arterial wall thickness in patients with type 2 diabetes. Diabetes Res Clin Pract 2004; 64(3):225-8.
48. Preiss D, Lloyd SM, Ford I, McMurray JJ, Holman RR, Welsh P, et al. Metformin for non-diabetic patients with coronary heart disease (the CAMERA study): a randomised controlled trial. Lancet Diabetes Endocrinol 2014; 2(2):116-24.
49. Lundby-Christensen L, Tarnow L, Boesgaard TW, Lund SS, Wiinberg N, Perrild H, et al. Metformin versus placebo in combination with insulin analogues in patients with type 2 diabetes mellitus-the randomised, blinded Copenhagen Insulin and Metformin Therapy (CIMT) trial. BMJ Open 2016; 6(2):e008376.
50. United Sates. National Institute of Health. REducing With MetfOrmin Vascular Adverse Lesions in Type 1 Diabetes (REMOVAL). Washington, DC: NIH, 2016. Disponible en: https://www.clinicaltrials.gov/ct2/show/NCT01483560. [Consulta: 20 julio 2016].
51. Maruthur NM, Tseng E, Hutfless S, Wilson LM, Suarez-Cuervo C, Berger Z, et al. Diabetes medications as monotherapy or metformin-based combination therapy for Type 2 diabetes: a systematic review and meta-analysis. Ann Intern Med 2016; 164(11):740-51.
52. Natali A, Ferrannini E. Effects of metformin and thiazolidinediones on suppression of hepatic glucose production and stimulation of glucose uptake in type 2 diabetes: a systematic review. Diabetologia 2006; 49(3):434-41.
53. Ferrannini E. The target of metformin in type 2 diabetes. N Engl J Med 2014; 371(16):1547-8.
54. Maedler K, Carr RD, Bosco D, Zuellig RA, Berney T, Donath MY. Sulfonylurea induced beta-cell apoptosis in cultured human islets. J Clin Endocrinol Metab 2005; 90(1):501-6.
55. Donath MY, Ehses JA, Maedler K, Schumann DM, Ellingsgaard H, Eppler E, et al. Mechanisms of beta-cell death in type 2 diabetes. Diabetes 2005; 54(Suppl 2):S108-13.
56. Takahashi A, Nagashima K, Hamasaki A, Kuwamura N, Kawasaki Y, Ikeda H, et al. Sulfonylurea and glinide reduce insulin content, functional expression of K(ATP) channels, and accelerate apoptotic beta-cell death in the chronic phase. Diabetes Res Clin Pract 2007; 77(3):343-50.
57. Del Prato S, Pulizzi N. The place of sulfonylureas in the therapy for type 2 diabetes mellitus. Metabolism 2006; 55(5 Suppl 1):S20-7.
58. Desouza CV, Bolli GB, Fonseca V. Hypoglycemia, diabetes, and cardiovascular events. Diabetes Care 2010; 33(6):1389-94.
59. Calle EE, Thun MJ, Petrelli JM, Rodriguez C, Heath CW Jr. Body-mass index and mortality in a prospective cohort of U.S. adults. N Engl J Med 1999; 341(15):1097-105.
60. Meinert CL, Knatterud GL, Prout TE, Klimt CR. A study of the effects of hypoglycemic agents on vascular complications in patients with adult-onset diabetes: mortality results. Diabetes 1970; 19(Suppl):789-830.
61. Monami M, Genovese S, Mannucci E. Cardiovascular safety of sulfonylureas: a meta-analysis of randomized clinical trials. Diabetes Obes Metab 2013; 15(10):938-53.
62. Morgan CL, Mukherjee J, Jenkins-Jones S, Holden SE, Currie CJ. Association between first-line monotherapy with sulphonylurea versus metformin and risk of all-cause mortality and cardiovascular events: a retrospective, observational study. Diabetes Obes Metab 2014; 16(10):957-62.
63. Johnsen SP, Monster TB, Olsen ML, Thisted H, McLaughlin JK, Sørensen HT, et al. Risk and short-term prognosis of myocardial infarction among users of antidiabetic drugs. Am J Ther 2006; 13(2):134-40.
64. Simpson SH, Majumdar SR, Tsuyuki RT, Eurich DT, Johnson JA. Dose-response relation between sulfonylurea drugs and mortality in type 2 diabetes mellitus: a population-based cohort study. CMAJ 2006; 174(2):169-74.
65. Pantalone KM, Kattan MW, Yu C, Wells BJ, Arrigain S, Jain A, et al. The risk of overall mortality in patients with type 2 diabetes receiving glipizide, glyburide, or glimepiride monotherapy: a retrospective analysis. Diabetes Care 2010; 33(6):1224-9.
66. Monami M, Balzi D, Lamanna C, Barchielli A, Masotti G, Buiatti E, et al. Are sulphonylureas all the same? a cohort study on cardiovascular and cancer-related mortality. Diabetes Metab Res Rev 2007; 23(6):479-84.
67. Khalangot M, Tronko M, Kravchenko V, Kovtun V. Glibenclamide-related excess in total and cardiovascular mortality risks: data from large Ukrainian observational cohort study. Diabetes Res Clin Pract 2009; 86(3):247-53.
68. Simpson SH, Lee J, Choi S, Vandermeer B, Abdelmoneim AS, Featherstone TR. Mortality risk among sulfonylureas: a systematic review and network meta-analysis. Lancet Diabetes Endocrinol 2015; 3(1):43-51.
69. Action to Control Cardiovascular Risk in Diabetes Study Group; Gerstein HC, Miller ME, Byington RP, Goff DC Jr, Bigger JT, Buse JB, et al. Effects of intensive glucose lowering in type 2 diabetes. N Engl J Med 2008; 358(24):2545-59.
70. Lexis CP, van der Horst IC, Lipsic E, van der Harst P, van der Horst-Schrivers AN, Wolffenbuttel BH, et al; GIPS-III Investigators. Metformin in non-diabetic patients presenting with ST elevation myocardial infarction: rationale and design of the glycometabolic intervention as adjunct to primary percutaneous intervention in ST elevation myocardial infarction (GIPS)-III trial. Cardiovasc Drugs Ther 2012; 26(5):417-26.
71. Ye Y, Lin Y, Perez-Polo JR, Birnbaum Y. Oral glyburide, but not glimepiride, blocks the infarct-size limiting effects of pioglitazone. Cardiovasc Drugs Ther 2008; 22(6):429-36.
72. Sillars B, Davis WA, Hirsch IB, Davis TM. Sulphonylurea-metformin combination therapy, cardiovascular disease and all-cause mortality: the Fremantle Diabetes Study. Diabetes Obes Metab 2010; 12(9):757-65.
73. Rao AD, Kuhadiya N, Reynolds K, Fonseca VA. Is the combination of sulfonylureas and metformin associated with an increased risk of cardiovascular disease or all-cause mortality? a meta-analysis of observational studies. Diabetes Care 2008; 31(8):1672-8.
74. Rosenstock J, Marx N, Kahn SE, Zinman B, Kastelein JJ, Lachin JM, et al. Cardiovascular outcome trials in type 2 diabetes and the sulphonylurea controversy: rationale for the active-comparator CAROLINA trial. Diab Vasc Dis Res 2013; 10(4):289-301.
75. Lee TM, Chou TF. Impairment of myocardial protection in type 2 diabetic patients. J Clin Endocrinol Metab 2003; 88(2):531-7.
76. Ye Y, Perez-Polo JR, Aguilar D, Birnbaum Y. The potential effects of anti-diabetic medications on myocardial ischemia-reperfusion injury. Basic Res Cardiol 2011; 106(6):925-52.
77. Holstein A, Plaschke A, Egberts EH. Lower incidence of severe hypoglycaemia in patients with type 2 diabetes treated with glimepiride versus glibenclamide. Diabetes Metab Res Rev 2001; 17(6):467-73.
78. Garber AJ, Abrahamson MJ, Barzilay JI, Blonde L, Bloomgarden ZT, Bush MA, et al. AACE/ACE comprehensive diabetes management algorithm 2015. Endocr Pract 2015; 21(4):438-47.
79. National Institute for Health and Care Excellence. Type 2 diabetes in adults: management.London: NICE, 2016. Disponible en: http://www.nice.org.uk/ng28. [Consulta: 20 julio 2016].
80. Asociación Latinoamericana de Diabetes. Manejo Farmacológico de
81. Dornhorst A. Insulinotropic meglitinide analogues. Lancet 2001;358(9294):1709-16.
82. Plosker GL, Figgitt DP. Repaglinide: a pharmacoeconomic review of its use in type 2 diabetes mellitus. Pharmacoeconomics 2004;22(6):389-411.
83. Madsbad S, Kilhovd B, Lager I, Mustajoki P, Dejgaard A, Scandinavian Repaglinide . Comparison between repaglinide and glipizide in type 2 diabetes mellitus: a 1-year multicentre study. Diabet Med 2001;18(5):395-401.
84. Derosa G, Mugellini A, Ciccarelli L, Crescenzi G, Fogari R. Comparison between repaglinide and glimepiride in patients with type 2 diabetes mellitus: a one-year,randomized, double-blind assessment of metabolic parameters and cardiovascularrisk factors. Clin Ther 2003;25(2):472-84.
85. Huang Y, Abdelmoneim AS, Light P, QiuW, Simpson SH. Comparative cardiovascular safety of insulin secretagogues following hospitalization for ischemic heart disease among type 2 diabetes patients: a cohort study. J Diabetes Comp 2015; 29:196–202.
86. Miyazaki Y, Mahankali A, Matsuda M, Glass L, Mahankali S, Ferrannini E, et al. Improved glycemic control and enhanced insulin sensitivity in type 2 diabetic subjects treated with pioglitazone. Diabetes Care 2001; 24(4):710-9.
87. Gastaldelli A, Ferrannini E, Miyazaki Y, Matsuda M, Mari A, DeFronzo RA. Thiazolidinediones improve beta-cell function in type 2 diabetic patients. Am J Physiol Endocrinol Metab 2007; 292(3):E871-83.
88. DeFronzo RA, Tripathy D, Abdul-Ghani M, Musi N, Gastaldelli A. The disposition index does not reflect â-cell function in IGT subjects treated with pioglitazone. J Clin Endocrinol Metab 2014; 99(10):3774-81.
89. Finegood DT, McArthur MD, Kojwang D, Thomas MJ, Topp BG, Leonard T, et al. Beta-cell mass dynamics in Zucker diabetic fatty rats: Rosiglitazone prevents the rise in net cell death. Diabetes 2001; 50(5):1021-9.
90. Mahaffey KW, Hafley G, Dickerson S, Burns S, Tourt-Uhlig S, White J, et al. Results of a reevaluation of cardiovascular outcomes in the RECORD trial. Am Heart J 2013; 166(2):240-249.e1.
91. Mudaliar S, Chang AR, Henry RR. Thiazolidinediones, peripheral edema, and type 2 diabetes: incidence, pathophysiology, and clinical implications. Endocr Pract 2003; 9(5):406-16.
92. Clarke DC, Molina-Wilkins M, Martínez S, Merovci A, Kincade JR, Solís-Herrera C, et al. Improved left ventricular diastolic function (LVDF) following pioglitazone therapy is strongly related to increased myocardial insulin sensitivity. Diabetes 2014;63(Suppl 1):A298.
93. Erdmann E, Dormandy JA, Charbonnel B, Massi-Benedetti M, Moules IK, Skene AM; PROactive Investigators. The effect of pioglitazone on recurrent myocardial infarction in 2,445 patients with type 2 diabetes and previous myocardial infarction: results from the PROactive (PROactive 05) Study. J Am Coll Cardiol 2007; 49(17):1772-80.
94. Wilcox R, Bousser MG, Betteridge DJ, Schernthaner G, Pirags V, Kupfer S, et al; PROactive Investigators. Effects of pioglitazone in patients with type 2 diabetes with or without previous stroke: results from PROactive (PROspective pioglitAzone Clinical Trial In macroVascular Events 04). Stroke 2007; 38(3):865-73.
95. Nissen SE, Nicholls SJ, Wolski K, Nesto R, Kupfer S, Perez A, et al; PERISCOPE Investigators. Comparison of pioglitazone vs glimepiride on progression of coronary atherosclerosis in patients with type 2 diabetes: the PERISCOPE randomized controlled trial. JAMA 2008; 299(13):1561-73.
96. Mazzone T, Meyer PM, Feinstein SB, Davidson MH, Kondos GT, D’Agostino RB Sr, et al. Effect of pioglitazone compared with glimepiride on carotid intima-media thickness in type 2 diabetes: a randomized trial. JAMA 2006; 296(21):2572-81.
97. Langenfeld MR, Forst T, Hohberg C, Kann P, Lübben G, Konrad T, et al. Pioglitazone decreases carotid intima-media thickness independently of glycemic control in patients with type 2 diabetes mellitus: results from a controlled randomized study. Circulation 2005; 111(19):2525-31.
98. Tzoulaki I, Molokhia M, Curcin V, Little MP, Millett CJ, Ng A, et al. Risk of cardiovascular disease and all cause mortality among patients with type 2 diabetes prescribed oral anti diabetes drugs: retrospective cohort study using UK general practice research database. BMJ 2009; 339:b4731.
99. Morgan CL, Poole CD, Evans M, Barnett AH, Jenkins-Jones S, Currie CJ. What next after metformin?: a retrospective evaluation of the outcome of second-line, glucose-lowering therapies in people with type 2 diabetes. J Clin Endocrinol Metab 2012; 97(12):4605-12.
100. Deacon CF. Dipeptidyl peptidase-4 inhibitors in the treatment of type 2 diabetes: a comparative review. Diabetes Obes Metab 2011; 13(1):7-18.
101. Scheen AJ. DPP-4 inhibitors in the management of type 2 diabetes: a critical review of head-to-head trials. Diabetes Metab 2012; 38(2):89-101.
102. Karagiannis T, Paschos P, Paletas K, Matthews DR, Tsapas A. Dipeptidyl peptidase-4 inhibitors for treatment of type 2 diabetes mellitus in the clinical setting: systematic review and meta-analysis. BMJ 2012; 344:e1369.
103. Jackson EK. Dipeptidyl peptidase IV inhibition alters the hemodynamic response to angiotensin-converting enzyme inhibition in humans with the metabolic syndrome. Hypertension 2010; 56(4):581-3.
104. Monami M, Lamanna C, Desideri CM, Mannucci E. DPP-4 inhibitors and lipids: systematic review and meta-analysis. Adv Ther 2012; 29(1):14-25.
105. Monami M, Ahrén B, Dicembrini I, Mannucci E. Dipeptidyl peptidase-4 inhibitors and cardiovascular risk: a meta-analysis of randomized clinical trials. Diabetes Obes Metab 2013; 15(2):112-20.
106. Tremblay AJ, Lamarche B, Deacon CF, Weisnagel SJ, Couture P. Effect of sitagliptin therapy on postprandial lipoprotein levels in patients with type 2 diabetes. Diabetes Obes Metab 2011; 13(4):366-73.
107. Matikainen N, Mänttäri S, Schweizer A, Ulvestad A, Mills D, Dunning BE, et al. Vildagliptin therapy reduces postprandial intestinal triglyceride-rich lipoprotein particles in patients with type 2 diabetes. Diabetologia 2006; 49(9):2049-57.
108. Derosa G, Maffioli P, Salvadeo SA, Ferrari I, Ragonesi PD, Querci F, et al. Effects of sitagliptin or metformin added to pioglitazone monotherapy in poorly controlled type 2 diabetes mellitus patients. Metabolism 2010; 59(6):887-95.
109. Matsubara J, Sugiyama S, Akiyama E, Iwashita S, Kurokawa H, Ohba K, et al. Dipeptidyl peptidase-4 inhibitor, sitagliptin, improves endothelial dysfunction in association with its anti-inflammatory effects in patients with coronary artery disease and uncontrolled diabetes. Circ J 2013; 77(5):1337- 44.
110. van Poppel PC, Netea MG, Smits P, Tack CJ. Vildagliptin improves endothelium-dependent vasodilatation in type 2 diabetes. Diabetes Care 2011; 34(9):2072-7.
111. Matheeussen V, Jungraithmayr W, De Meester I. Dipeptidyl peptidase 4 as a therapeutic target in ischemia/reperfusion injury. Pharmacol Ther 2012; 136(3):267-82.
112. Williams-Herman D, Engel SS, Round E, Johnson J, Golm GT, Guo H, et al. Safety and tolerability of sitagliptin in clinical studies: a pooled analysis of data from 10,246 patients with type 2 diabetes. BMC Endocr Disord 2010; 10:7.
113. Engel SS, Golm GT, Shapiro D, Davies MJ, Kaufman KD, Goldstein BJ. Cardiovascular safety of sitagliptin in patients with type 2 diabetes mellitus: a pooled analysis. Cardiovasc Diabetol 2013; 12:3.
114. Schweizer A, Dejager S, Foley JE, Couturier A, Ligueros-Saylan M, Kothny W. Assessing the cardio-cerebrovascular safety of vildagliptin: meta-analysis of adjudicated events from a large Phase III type 2 diabetes population. Diabetes Obes Metab 2010; 12(6):485-94.
115. Frederich R, Alexander JH, Fiedorek FT, Donovan M, Berglind N, Harris S, et al. A systematic assessment of cardiovascular outcomes in the saxagliptin drug development program for type 2 diabetes. Postgrad Med 2010; 122(3):16-27.
116. Cobble ME, Frederich R. Saxagliptin for the treatment of type 2 diabetes mellitus: assessing cardiovascular data. Cardiovasc Diabetol 2012; 11:6.
117. White WB, Pratley R, Fleck P, Munsaka M, Hisada M, Wilson C, et al. Cardiovascular safety of the dipetidyl peptidase-4 inhibitor alogliptin in type 2 diabetes mellitus. Diabetes Obes Metab 2013; 15(7):668-73.
118. Johansen OE, Neubacher D, von Eynatten M, Patel S, Woerle HJ. Cardiovascular safety with linagliptin in patients with type 2 diabetes mellitus: a pre-specified, prospective, and adjudicated meta-analysis of a phase 3 programme. Cardiovasc Diabetol 2012; 11:3.
119. Richter B, Bandeira-Echtler E, Bergerhoff K, Lerch CL. Dipeptidyl peptidase-4 (DPP-4) inhibitors for type 2 diabetes mellitus. Cochrane Database Syst Rev 2008; (2):CD006739.
120. Scirica BM, Bhatt DL, Braunwald E, Steg PG, Davidson J, Hirshberg B, et al; SAVOR-TIMI 53 Steering Committee and Investigators. Saxagliptin and cardiovascular outcomes in patients with type 2 diabetes mellitus. N Engl J Med 2013; 369(14):1317-26.
121. White WB, Cannon CP, Heller SR, Nissen SE, Bergenstal RM, Bakris GL, et al; EXAMINE Investigators. Alogliptin after acute coronary syndrome in patients with type 2 diabetes. N Engl J Med 2013; 369(14):1327-35.
122. Bethel M, Green J, Califf R, Holman RR. Rationale and design of the trial evaluating cardiovascular outcomes with sitagliptin (TECOS). Diabetes 2009;58(Suppl 1):A639.
123. Zannad F, Cannon CP, Cushman WC, Bakris GL, Menon V, Perez AT, et al. Heart failure and mortality outcomes in patients with type 2 diabetes taking alogliptin versus placebo in EXAMINE: a multicentre, randomised, double-blind trial. Lancet 2015; 385(9982):2067–76.
124. Rosenstock J, Marx N, Kahn SE, Zinman B, Kastelein JJ, Lachin JM, et al. Cardiovascular outcome trials in type 2 diabetes and the sulphonylurea controversy: rationale for the active-comparator CAROLINA trial. Diab Vasc Dis Res 2013; 10(4): 289-301.
125. United States. National Institute of Health. Cardiovascular and renal microvascular outcome study with linagliptin in patients with Type 2 diabetes mellitus (CARMELINA).ClinicalTrial.gov identifier: NCT01897532. Disponible en: https://clinicaltrials.gov/ct2/show/NCT01897532. [Consulta: 7 julio 2016].
126. United States. National Institute of Health. A study to assess cardiovascular outcomes following treatment with omarigliptin (MK-3102) in participants with Type 2 diabetes mellitus (MK-3102-018). ClinicalTrial.gov identifier: NCT173208. Disponible en: https://clinicaltrials.gov/ct2/show/NCT01703208. [Consulta: 7 julio 2016].
127. DeFronzo RA, Hompesch M, Kasichayanula S, Liu X, Hong Y, Pfister M, et al. Characterization of renal glucose reabsorption in response to dapagliflozin in healthy subjects and subjects with type 2 diabetes. Diabetes Care 2013; 36(10):3169-76.
128. Abdul-Ghani MA, Norton L, Defronzo RA. Role of sodium-glucose cotransporter 2 (SGLT 2) inhibitors in the treatment of type 2 diabetes. Endocr Rev 2011; 32(4):515-31.
129. Ferrannini E, Solini A. SGLT2 inhibition in diabetes mellitus: rationale and clinical prospects. Nat Rev Endocrinol 2012; 8(8):495-502.
130. Sanz-Serra P, Botet JP, Flores Le Roux JA, Benaiges D, Chillaron JJ. Dapaglifozina: más allá del control glucémico en el tatamiento de
131. Rossetti L, Smith D, Shulman GI, Papachristou D, DeFronzo RA. Correction of hyperglycemia with phlorizin normalizes tissue sensitivity to insulin in diabetic rats. J Clin Invest 1987; 79(5):1510-5.
132. Ferrannini E, Muscelli E, Frascerra S, Baldi S, Mari A, Heise T, et al. Metabolic response to sodium-glucose cotransporter 2 inhibition in type 2 diabetic patients. J Clin Invest 2014; 124(2):499-508.
133. Merovci A, Solis-Herrera C, Daniele G, Eldor R, Fiorentino TV, Tripathy D, et al. Dapagliflozin improves muscle insulin sensitivity but enhances endogenous glucose production. J Clin Invest 2014; 124(2):509-14.
134. Merovci A, Mari A, Solis C, Xiong J, Daniele G, Chavez-Velazquez A, et al. Dapagliflozin lowers plasma glucose concentration and improves â-cell function. J Clin Endocrinol Metab 2015; 100(5): 1927-32.
135. Bailey CJ, Gross JL, Hennicken D, Iqbal N, Mansfield TA, List JF. Dapagliflozin add-on to metformin in type 2 diabetes inadequately controlled with metformin: a randomized, double-blind, placebo-controlled 102-week trial. BMC Med 2013; 11:43.
136. Clar C, Gill JA, Court R, Waugh N. Systematic review of SGLT2 receptor inhibitors in dual or triple therapy in type 2 diabetes. BMJ Open 2012; 2(5):e001007.
137. Washburn WN, Poucher SM. Differentiating sodium-glucose co-transporter-2 inhibitors in development for the treatment of type 2 diabetes mellitus. Expert Opin Investig Drugs 2013; 22(4):463-86.
138. Plosker GL. Canagliflozin: a review of its use in patients with type 2 diabetes mellitus. Drugs 2014; 74(7):807-24.
139. Handelsman Y. Potential place of SGLT2 inhibitors in treatment paradigms for Type 2 diabetes mellitus. Endocr Pract 2015; 21(9):1054-65.
140. Ptaszynska A, Hardy E, Johnsson E, Parikh S, List J. Effects of dapagliflozin on cardiovascular risk factors. Postgrad Med 2013; 125(3):181-9.
141. Zinman B, Wanner C, Lachin JM, Fitchett D, Bluhmki E, Hantel S, et al; EMPA-REG OUTCOME Investigators. Empagliflozin, cardiovascular outcomes, and mortality in Type 2 diabetes. N Engl J Med 2015; 373(22):2117-28.
142. Inzucchi SE, Zinman B, Wanner C, Ferrari R, Fitchett D, Hantel S, et al. SGLT-2 inhibitors and cardiovascular risk: proposed pathways and review of ongoing outcome trials. Diab Vasc Dis Res 2015; 12(2):90-100.
143. Monami M, Nardini C, Mannucci E. Efficacy and safety of sodium glucose co-transport-2 inhibitors in type 2 diabetes: a meta-analysis of randomized clinical trials. Diabetes Obes Metab 2014; 16(5):457-66.
144. Wu JH, Foote C, Blomster J, Toyama T, Perkovic V, Sundström J, et al. Effects of sodium-glucose cotransporter-2 inhibitors on cardiovascular events, death, and major safety outcomes in adults with type 2 diabetes: a systematic review and meta-analysis. Lancet Diabetes Endocrinol 2016; 4(5):411-9.
145. Bader N, Mirza L. Euglycemic Diabetic Ketoacidosis in a 27 year-old female patient with type-1-Diabetes treated with sodium-glucose cotransporter-2 (SGLT2) inhibitor Canagliflozin. Pak J Med Sci 2016; 32(3):786-8.
146. Rashid O, Farooq S, Kiran Z, Islam N. Euglycaemic diabetic ketoacidosis in a patient with type 2 diabetes started on empagliflozin. BMJ Case Rep 2016; 2016:bcr2016215340.
147. Kaur A, Winters SJ. Severe hypercalcemia and hypernatremia in a patient treated with canagliflozin. Endocrinol Diabetes Metab Case Rep 2015; 2015:150042.
148. Food and Drug Administration. FDA Drug Safety Communication: FDA revises label of diabetes drug canagliflozin to include updates on bone fracture risk and new information on decreased bone mineral density. Silver Spring, MD: FDA, 2015. Disponible en: http://www.fda.gov/Drugs/DrugSafety/ucm461449.htm. [Consulta: 5 agosto 2016].
149. Bader N, Mirza L. Euglycemic Diabetic Ketoacidosis in a 27 year-old female patient with type-1-Diabetes treated with sodium-glucose cotransporter-2 (SGLT2) inhibitor Canagliflozin. Pak J Med Sci 2016; 32(3):786-8.
150. Rashid O, Farooq S, Kiran Z, Islam N. Euglycaemic diabetic ketoacidosis in a patient with type 2 diabetes started on empagliflozin. BMJ Case Rep 2016; 2016:bcr2016215340.
151. Tahir H, Wani A, Daruwalla V, Daboul N, Sagi J. Euglycemic diabetic ketoacidosis and severe acute kidney injury secondary to off label use of sodium glucose cotransporter 2 inhibitor in a type 1 diabetic patient J Ayub Med Coll Abbottabad 2015; 27(4):923-4.
152. Kaur A, Winters SJ. Severe hypercalcemia and hypernatremia in a patient treated with canagliflozin. Endocrinol Diabetes Metab Case Rep 2015; 2015:150042.
153. American Association of Clinical Endocrinologists. American College of Endocrinologists.AACE/ACE scientific and clinical review: association of SGLT2 inhibitors and DKA: October 24-25, 2015.Conclusion summary. Jacksonville, Fla: AACE, 2015. Disponible en: https://aace.newshq.businesswire.com/sites/aace.newshq.businesswire.com/files/doc_library/file/SGLT2i_FINAL_DKA_Conclusions.pdf. [Consulta: 11 agosto 2016].
154. United States. National Institute of Health. Multicenter trial to evaluate the effect of dapagliflozin on the incidence of cardiovascular events (DECLARE-TIMI58).ClinicalTrials.gov identifier: NCT0173053. Disponible en: https://clinicaltrials.gov/ct2/show/NCT01730534. [Consulta 7 agosto 2016].
155. United States. National Institute of Health. CANVAS: CANagliflozin cardioVascular Assessment Study. ClinicalTrials.gov identifier: NCT01032629. Disponible en: https://clinicaltrials.gov/ct2/show/NCT01032629. [Consulta: 7 agosto 2016].
156. United States. National Institute of Health. Evaluation of the effects of canagliflozin on renal and cardiovascular outcomes in participants with diabetic nephropathy (CREDENCE).ClinicalTrial.gov identifier: NCT02065791. Disponible en: https://clinicaltrials.gov/ct2/show/NCT02065791. [Consulta: 7 agosto 2016].
157. Bischoff H. The mechanism of alpha-glucosidase inhibition in the management of diabetes. Clin Invest Med 1995; 18(4):303-11.
158. Lee EY, Kaneko S, Jutabha P, Zhang X, Seino S, Jomori T, et al. Distinct action of the á-glucosidase inhibitor miglitol on SGLT3, enteroendocrine cells, and GLP1 secretion. J Endocrinol 2015; 224(3):205-14.
159. Su B, Liu H, Li J, Sunli Y, Liu B, Liu D, et al. Acarbose treatment affects the serum levels of inflammatory cytokines and the gut content of bifidobacteria in Chinese patients with type 2 diabetes mellitus. J Diabetes 2015; 7(5):729-39.
160. Holman RR, Bethel MA, Chan JC, Chiasson JL, Doran Z, Ge J, et al; ACE Study Group. Rationale for and design of the Acarbose Cardiovascular Evaluation (ACE) trial. Am Heart J 2014; 168(1):23-9.e2.
161. Drucker DJ. The role of gut hormones in glucose homeostasis. J Clin Invest 2007; 117(1):24-32.
162. Holst JJ, Vilsbøll T, Deacon CF. The incretin system and its role in type 2 diabetes mellitus. Mol Cell Endocrinol 2009; 297(1-2):127-36.
163. Bunck MC, Cornér A, Eliasson B, Heine RJ, Shaginian RM, Taskinen MR, et al. Effects of exenatide on measures of â-cell function after 3 years in metformin-treated patients with type 2 diabetes. Diabetes Care 2011; 34(9):2041-7.
164. Ban K, Noyan-Ashraf MH, Hoefer J, Bolz SS, Drucker DJ, Husain M. Cardioprotective and vasodilatory actions of glucagon-like peptide 1 receptor are mediated through both glucagon-like peptide 1 receptor-dependent and –independent pathways. Circulation 2008; 117(18):2340-50.
165. DeFronzo RA, Ratner RE, Han J, Kim DD, Fineman MS, Baron AD. Effects of exenatide (exendin-4) on glycemic control and weight over 30 weeks in metformin-treated patients with type 2 diabetes. Diabetes Care 2005; 28(5):1092-100.
166. Buse JB, Rosenstock J, Sesti G, Schmidt WE, Montanya E, Brett JH, et al; LEAD-6 Study Group. Liraglutide once a day versus exenatide twice a day for type 2 diabetes: a 26-week randomised, parallel-group, multinational, open-label trial (LEAD-6). Lancet 2009; 374(9683):39-47.
167. Chilton R, Wyatt J, Nandish S, Oliveros R, Lujan M. Cardiovascular comorbidities of type 2 diabetes mellitus: defining the potential of glucagonlike peptide-1-based therapies. Am J Med 2011; 124(1 Suppl):S35-53.
168. Kavianipour M, Ehlers MR, Malmberg K, Ronquist G, Ryden L, Wikström G, et al. Glucagon-like peptide-1 (7-36) amide prevents the accumulation of pyruvate and lactate in the ischemic and non-ischemic porcine myocardium. Peptides 2003; 24(4):569-78
169. Poornima I, Brown SB, Bhashyam S, Parikh P, Bolukoglu H, Shannon RP. Chronic glucagon-like peptide-1 infusion sustains left ventricular systolic function and prolongs survival in the spontaneously hypertensive, heart failure-prone rat. Circ Heart Fail 2008; 1(3):153-60.
170. Nikolaidis LA, Elahi D, Hentosz T, Doverspike A, Huerbin R, Zourelias L, et al. Recombinant glucagon-like peptide-1 increasesmyocardial glucose uptake and improves left ventricular performance in conscious dogs with pacing-induced dilated cardiomyopathy. Circulation 2004;110(8):955-61.
171. Nathanson D, Ullman B, Löfström U, Hedman A, Frick M, Sjöholm A, et al. Effects of intravenous exenatide in type 2 diabetic patients with congestive heart failure: a double-blind, randomised controlled clinical trial of efficacy and safety. Diabetologia 2012; 55(4):926-35.
172. Timmers L, Henriques JP, de Kleijn DP, Devries JH, Kemperman H, Steendijk P, et al. Exenatide reduces infarct size and improves cardiac function in a porcine model of ischemia and reperfusion injury. J Am Coll Cardiol 2009; 53(6):501-10.
173. Sokos GG, Nikolaidis LA, Mankad S, Elahi D, Shannon RP. Glucagon-like peptide-1 infusion improves left ventricular ejection fraction and functional status in patients with chronic heart failure. J Card Fail 2006; 12(9):694-9.
174. Thrainsdottir I, Malmberg K, Olsson A, Gutniak M, Rydén L. Initial experience with GLP-1 treatment on metabolic control and myocardial function in patients with type 2 diabetes mellitus and heart failure. Diab Vasc Dis Res 2004; 1(1):40-3.
175. Nikolaidis LA, Mankad S, Sokos GG, Miske G, Shah A, Elahi D, et al. Effects of glucagon-like peptide-
176. Read PA, Khan FZ, Dutka DP. Cardioprotection against ischaemia induced by dobutamine stress using glucagon-like peptide-
177. Read PA, Hoole SP, White PA, Khan FZ, O’Sullivan M, West NE, et al. A pilot study to assess whether glucagon-like peptide-1 protects the heart from ischemic dysfunction and attenuates stunning after coronary balloon occlusion in humans. Circ Cardiovasc Interv 2011; 4(3):266-72.
178. Lønborg J, Vejlstrup N, Kelbæk H, Bøtker HE, Kim WY, Mathiasen AB, et al. Exenatide reduces reperfusion injury in patients with ST-segment elevation myocardial infarction. Eur Heart J 2012; 33(12):1491-9.
179. Davies M, Bode BW, Kushner R, Lewin AJ, Skjoth TV, Jensen CB, et al. Liraglutide 3.0 mg for weight management in obese/overweight adults with Type 2 diabetes: results from the SCALETM diabetes 56-week randomized, double-blind, placebo-controlled trial. Diabetes 2014; 63(Suppl 1):A26.
180. Okerson T, Yan P, Stonehouse A, Brodows R. Effects of exenatide on systolic blood pressure in subjects with type 2 diabetes. Am J Hypertens 2010; 23(3):334-9.
181. Drucker DJ, Buse JB, Taylor K, Kendall DM, Trautmann M, Zhuang D, et al; DURATION-1 Study Group. Exenatide once weekly versus twice daily for the treatment of type 2 diabetes: a randomised, open-label, non-inferiority study. Lancet 2008; 372(9645):1240-50.
182. Fonseca VA, Devries JH, Henry RR, Donsmark M, Thomsen HF, Plutzky J. Reductions in systolic blood pressure with liraglutide in patients with type 2 diabetes: insights from a patient-level pooled analysis of six randomized clinical trials. J Diabetes Complications 2014; 28(3):399-405.
183. Schwartz EA, Koska J, Mullin MP, Syoufi I, Schwenke DC, Reaven PD. Exenatide suppresses postprandial elevations in lipids and lipoproteins in individuals with impaired glucose tolerance and recent onset type 2 diabetes mellitus. Atherosclerosis 2010; 212(1):217-22.
184. Meier JJ, Gethmann A, Götze O, Gallwitz B, Holst JJ, Schmidt WE, et al. Glucagon-like peptide 1 abolishes the postprandial rise in triglyceride concentrations and lowers levels of non-esterified fatty acids in humans. Diabetologia 2006; 49(3):452-8.
185. Kendall DM, Bhole D, Guan X, Nielsen L, Trautmann M, Wintle M, et al. Exenatide treatment for 82 weeks reduced C-reactive protein, HbA1c, and body weight in patients with type 2 diabetes mellitus. Diabetologia2006;49(Suppl 1):475.
186. Courrèges JP, Vilsbøll T, Zdravkovic M, Le-Thi T, Krarup T, Schmitz O, et al. Beneficial effects of once-daily liraglutide, a human glucagon-like peptide-1 analogue, on cardiovascular risk biomarkers in patients with Type 2 diabetes. Diabet Med 2008; 25(9):1129-31.
187. Liu H, Hu Y, Simpson RW, Dear AE. Glucagon-like peptide-1 attenuates tumour necrosis factor-alpha-mediated induction of plasminogen [corrected] activator inhibitor-1 expression. J Endocrinol 2008; 196(1):57-65.
188. Liu H, Dear AE, Knudsen LB, Simpson RW. A long-acting glucagon-like peptide-1 analogue attenuates induction of plasminogen activator inhibitor type-1 and vascular adhesion molecules. J Endocrinol 2009; 201(1):59-66.
189. Kim Chung le T, Hosaka T, Yoshida M, Harada N, Sakaue H, Sakai T, et al. Exendin-
190. Best JH, Hoogwerf BJ, Herman WH, Pelletier EM, Smith DB, Wenten M, et al. Risk of cardiovascular disease events in patients with type 2 diabetes prescribed the glucagon-like peptide 1 (GLP-1) receptor agonist exenatide twice daily or other glucose-lowering therapies: a retrospective analysis of the LifeLink database. Diabetes Care 2011; 34(1):90-5.
191. Pfeffer MA, Claggett B, Diaz R, Dickstein K, Gerstein HC, Køber LV, et al; ELIXA Investigators. Lixisenatide in patients with Type 2 diabetes and acute coronary syndrome. N Engl J Med 2015; 373(23):2247-57.
192. Marso SP, Daniels GH, Brown-Frandsen K, Kristensen P, Mann JF, Nauck MA, et al; LEADER Steering Committee; LEADER Trial Investigators. Liraglutide and Cardiovascular Outcomes in Type 2 Diabetes. N Engl J Med 2016; 375(4):311-22.
193. Kim JY, Yang S, Lee JI, Chang MJ. Cardiovascular effect of incretin-based therapy in patients with Type 2 diabetes mellitus: systematic review and meta-analysis. PLoS One 2016; 11(4):e0153502.
194. Henry RR, Gumbiner B, Ditzler T, Wallace P, Lyon R, Glauber HS. Intensive conventional insulin therapy for type II diabetes. Metabolic effects during a 6-mo outpatient trial. Diabetes Care 1993; 16(1):21-31.
195. Holden SE, Currie CJ. Mortality risk with sulphonylureas compared to metformin. Diabetes Obes Metab 2014; 16(10):885-90.
196. Lonn EM, Bosch J, Diaz R, Lopez-Jaramillo P, Ramachandran A, Hâncu N, et al; GRACE and ORIGIN Investigators. Effect of insulin glargine and n-3FA on carotid intima-media thickness in people with dysglycemia at high risk for cardiovascular events: the glucose reduction and atherosclerosis continuing evaluation study (ORIGIN-GRACE). Diabetes Care 2013; 36(9):2466-74.
197. Gamble JM, Simpson SH, Eurich DT, Majumdar SR, Johnson JA. Insulin use and increased risk of mortality in type 2 diabetes: a cohort study. Diabetes Obes Metab 2010; 12(1):47-53.
198. Currie CJ, Poole CD, Evans M, Peters JR, Morgan CL. Mortality and other important diabetes-related outcomes with insulin vs other antihyperglycemic therapies in type 2 diabetes. J Clin Endocrinol Metab 2013; 98(2):668-77.
199. Currie CJ, Peters JR, Tynan A, Evans M, Heine RJ, Bracco OL, et al. Survival as a function of HbA(1c) in people with type 2 diabetes: a retrospective cohort study. Lancet 2010; 375(9713):481-9.
200. Colayco DC, Niu F, McCombs JS, Cheetham TC. A1C and cardiovascular outcomes in type 2 diabetes: a nested case-control study. Diabetes Care 2011; 34(1):77-83.
201. Eurich DT, Simpson S, Senthilselvan A, Asche CV, Sandhu-Minhas JK, McAlister FA. Comparative safety and effectiveness of sitagliptin in patients with type 2 diabetes: retrospective population based cohort study. BMJ 2013; 346:f2267.
202. Lachin JM, Orchard TJ, Nathan DM; DCCT/ EDIC Research Group. Update on cardiovascular outcomes at 30 years of the diabetes control and complications trial/epidemiology of diabetes interventions and complications study. Diabetes Care 2014; 37(1):39-43.
203. Writing Group for the DCCT/EDIC Research Group; Orchard TJ, Nathan DM, Zinman B, Cleary P, Brillon D, Backlund JY, et al. Association between 7 years of intensive treatment of type 1 diabetes and long-term mortality. JAMA 2015; 313(1):45-53.