Servicios Personalizados
Revista
Articulo
Links relacionados
Compartir
Revista Uruguaya de Cardiología
versión impresa ISSN 0797-0048versión On-line ISSN 1688-0420
Rev.Urug.Cardiol. vol.31 no.3 Montevideo dic. 2016
Especial Diabetes
Artículo de revisión
Prevención cardiovascular en el diabético
Washington Vignolo, Bernardo Layerle
Recibido Oct 23, 2016; aceptado Nov 11, 2016.
Resumen
La diabetes es una enfermedad de alta prevalencia que constituye una verdadera pandemia. Se caracteriza por alteraciones metabólicas complejas que incluyen el desarrollo de hiperglucemia. A largo plazo ocurren complicaciones micro y macrovasculares. La enfermedad arterial ateromatosa explica tres cuartas partes de las muertes en diabéticos. Las medidas de cambio de estilo de vida, con aumento de la actividad física, y cesación del tabaquismo pueden reducir en forma marcada el riesgo de eventos cardiovasculares adversos. El control adecuado de la presión arterial y de los niveles de lípidos tiene un fuerte impacto positivo en el mismo sentido. Este artículo intenta revisar la evidencia disponible y formular recomendaciones para el manejo clínico de los pacientes diabéticos.
Palabras clave:
Diabetes mellitUs
Ejercicio físico
Tabaquismo
Hipertensión arterial
Dislipemia
Prevención cardiovascular
Summary
Diabetes is a highly prevalent disease that has become a true pandemia. It is characterized by complex metabolic alterations including the development of hyperglycemia. In the long term micro- and macrovascular complications occur. Arterial atheromatous disease explains three quarters of diabetic deaths. Life-style changes, with increased physical activity and smoking cessation, can markedly reduce the risk of adverse cardiovascular events. Adequate blood pressure and lipid levels control have a strong positive impact to that end. This paper tries to summarize the available evidence and to make recommendations for the clinical management of diabetic patients.
Key words:
Diabetes mellitus
Physical activity
Smoking
Hypertension
Dislipemia
Cardiovascular prevention
Introducción
La diabetes es una enfermedad de origen metabólico con aumento de los niveles de glucemia que puede determinar alteraciones a nivel microvascular, macrovascular y neuropático. Si bien dichas alteraciones incluyen retinopatía, nefropatía, neuropatía periférica o neuropatía autonómica, el compromiso cardiovascular constituye su principal causa de muerte(1-3).
Según datos de
Es de destacar que en 2014 el 46,3% (179.181.000 pacientes) de los diabéticos en el mundo no estaba diagnosticado y que el 77% de las personas con diabetes vivía en zonas con ingresos medianos a bajos.
De acuerdo a
Diagnóstico
El diagnóstico de diabetes se puede establecer en base a la medición de la glucemia en ayunas o de la glucemia medida al cabo de dos horas de la administración por vía oral de una cantidad estándar de glucosa, o de la medición de una glucemia “al barrer” elevada asociada a síntomas clásicos de hiperglucemia, o de la medición de la hemoglobina glicosilada. La glucemia postcarga oral de glucosa ha demostrado ser más sensible para el diagnóstico que la glucemia basal y la hemoglobina glicosilada(1).
Siguiendo a
1. Síntomas (polidipsia, poliuria, pérdida inexplicada de peso) y glucemia casual ³200 mg/dL.
2. Glucemia en ayunas (³8 horas de la última comida) ³126 mg/dL.
3. Glucemia dos horas después de una carga oral de 75 gr de glucosa ³200 mg/dL.
4. Hemoglobina glicosilada (HbA1C) ³6,5%.
En los criterios 2, 3 y 4, en ausencia de síntomas o cuadro clínico compatible con hiperglucemia inequívoca, los resultados deben ser confirmados repitiendo los estudios.
Etiología
El trastorno metabólico determinante de la diabetes es un déficit de acción insulínica a nivel tisular. Dicho déficit genera alteraciones en el metabolismo de glúcidos, lípidos y proteínas. La deficiencia de acción insulínica puede ocurrir por dos mecanismos diferentes: en los diabéticos tipo 1 existe una deficiencia absoluta en los niveles de insulina por déficit en la secreción de la misma, mayoritariamente mediada por destrucción inmunogénica de las células beta del páncreas; en cambio, en los diabéticos tipo 2 hay resistencia de los tejidos periféricos a la acción de la insulina e incapacidad del páncreas para aumentar la secreción de esta hormona en forma suficiente para compensar dicha resistencia periférica(1).
Existen otras formas de diabetes, como la diabetes gestacional, los síndromes de diabetes monogénica (Maturity Onset Diabetes of the Young MODY y diabetes neonatal), las secundarias a enfermedades del páncreas exógeno (fibrosis quística), a drogas u otras cuya descripción no es objetivo de este trabajo.
Pronóstico
Como ya fue dicho, la causa más frecuente de muerte de un diabético es la enfermedad cardiovascular que explica aproximadamente las tres cuartas partes de las mismas. Tanto es así que algunos autores plantean que la diabetes es una enfermedad predominantemente cardiovascular.
Haffner y colaboradores(5) realizaron un estudio prospectivo en el que compararon la incidencia de infarto fatal y no fatal en 1.059 pacientes diabéticos versus 1.373 pacientes no diabéticos en una población finlandesa. Al cabo de siete años las tasas de incidencia de infarto de miocardio fatal en diabéticos sin infarto previo fueron similares a las de pacientes no diabéticos con infarto previo (aun luego de los ajustes por múltiples factores) (HR 1,2; IC95%, 0,6-2,4). En este estudio los pacientes diabéticos sin infarto de miocardio previo tuvieron un riesgo de infarto de miocardio fatal similar a los pacientes no diabéticos que ya habían sufrido un infarto de miocardio.
Schramm y colaboradores(6) estudiaron la población dinamarquesa con edad mayor o igual a 30 años (3,3 millones de personas), la que fue seguida durante cinco años. El riesgo de muerte coronaria fue similar en los pacientes diabéticos de sexo masculino que recibían hipoglucemiantes sin infarto de miocardio previo que en los varones no diabéticos que habían sufrido un infarto previo (HR 2,42; IC95%, 2,35-2,49 versus HR 2,42; IC95%, 2,39-2,49; p=0,6).
Sin embargo, el estudio ARIC(7) sugiere que este riesgo es mayor en los diabéticos que en los no diabéticos aunque no tan alto como en los no diabéticos infartados. De todas maneras lo cierto es que la diabetes confiere cerca del doble de riesgo para un amplio espectro de eventos cardiovasculares adversos: mortalidad coronaria y vascular de otra causa, infarto agudo de miocardio (IAM), ataque cerebrovascular (ACV) isquémico o hemorrágico, independientemente de otros factores de riesgo cardiovascular(8). Los tres estudios citados (Haffner, Schramm y ARIC) demostraron también que luego de un evento coronario la mortalidad coronaria fue claramente mayor en los pacientes diabéticos que en los no diabéticos.
Prevención cardiovascular en el diabético
El control de los factores de riesgo cardiovascular en el paciente diabético es de fundamental importancia para reducir su morbimortalidad. Numerosas medidas han demostrado disminuir el riesgo cardiovascular en estos pacientes. Analizaremos a continuación las más relevantes. Se analizará en otro capítulo el impacto de las drogas hipoglucemiantes y del control de la glucemia en la prevención cardiovascular.
Ejercicio físico
En la medicina moderna muchas veces no se jerarquizan las medidas no farmacológicas que tienen muchas veces un impacto en la morbimortalidad cardiovascular mayor que el de fármacos de alta eficacia. Un ejemplo paradigmático es el ejercicio físico, que, como veremos a continuación, puede reducir el riesgo de muerte cardiovascular en el diabético a una tercera parte, igualándola a la del paciente no diabético sedentario.
Destacamos a continuación algunos trabajos relevantes al respecto:
En un análisis post hoc del estudio ADVANCE (seguimiento cinco años) se correlacionó el nivel de ejercicio físico realizado en la semana previa a la aleatorización con la tasa de eventos cardiovasculares en 11.140 diabéticos tipo 2. Se observó que los sujetos que realizaron ejercicio físico moderado o vigoroso durante al menos 15 minutos por semana tuvieron una incidencia más baja de eventos cardiovasculares mayores (HR 0,78; IC95%, 0,69-0,88; p<0,001), menos complicaciones microvasculares (HR 0,85; IC95%, 0,76-0,96; p=0,010) y menor mortalidad (HR 0,83; IC95%, 0,73-0,94; p=0,0044) que los pacientes que realizaron ejercicio físico leve o ninguna actividad física(9).
HUNT fue un estudio prospectivo observacional que incluyó a 56.170 personas mayores de 20 años residentes en el condado de Nord-Trøndelag (Noruega) que fueron seguidas durante una mediana de 12 años. El objetivo fue investigar el efecto de la actividad física desarrollada por los participantes durante su tiempo libre sobre la mortalidad cardiovascular y evaluar si la actividad física podría mitigar los efectos adversos de la diabetes sobre la misma. La diabetes se asoció con una mortalidad cardiovascular casi tres veces mayor en los pacientes físicamente inactivos. En cambio, el riesgo de muerte entre los diabéticos con actividad física moderada a intensa fue similar al de sujetos sedentarios sin diabetes(10).
Tanasescu y colaboradores(11) realizaron un estudio prospectivo de los pacientes diabéticos de sexo masculino sin incapacidad física (n=2.803) con edad mayor o igual a 30 años incluidos en el Health Professionals’ Follow-up Study (HPFS). Analizaron el nivel de actividad física cada dos años con un seguimiento total de 14 años y observaron que el riesgo relativo de enfermedad cardiovascular, la mortalidad cardiovascular y la mortalidad total se redujeron significativamente en los diabéticos para niveles de ejercicio crecientes.
Las recomendaciones de
· Los diabéticos adultos deben realizar por lo menos 150 minutos semanales de ejercicio aeróbico de moderada intensidad (50% a 70% de la frecuencia cardíaca máxima calculada) distribuidos en por lo menos tres días de la semana sin que haya más de dos días sin ejercicio entre ellos.
· Todos los pacientes, incluidos los diabéticos, deben ser alentados a reducir el tiempo que transcurren en forma sedentaria, en particular fraccionando los períodos prolongados (más de 90 minutos) que permanecen en posición sentada.
· En ausencia de contraindicaciones los pacientes diabéticos tipo 2 deben ser alentados a desarrollar entrenamiento contra resistencia por lo menos dos veces por semana.
Si bien los estudios analizados previamente son concordantes con estas indicaciones, algunas de las mismas provienen de estudios sobre el control metabólico de la diabetes(13-16).
Cesación de tabaquismo
El tabaquismo es un factor de riesgo cardiovascular particularmente letal para los diabéticos. El riesgo relativo (RR) de mortalidad cardiovascular de los diabéticos fumadores es casi el doble que el de los no diabéticos fumadores 2,2 vs 1,2)(17).
El tabaquismo aumenta el riesgo de coronariopatía en pacientes diabéticos de ambos sexos(18,19). Un estudio en diabéticos fumadores mostró que la cesación de tabaquismo se asoció con mejoría de los parámetros metabólicos, albuminuria y presión arterial al año(20). Diferentes investigaciones han mostrado que los ambientes libres de humo de tabaco se asocian con la reducción del número de infartos, por lo que los diabéticos deben evitar exponerse a los mismos(21).
En general, para el paciente motivado a dejar de fumar, la autoayuda es de escasa utilidad en tanto que la consejería o el tratamiento farmacológico sí son efectivos(22). Sin embargo, un metaanálisis sobre cesación de tabaquismo en pacientes diabéticos no demostró beneficio de una intervención más intensiva (farmacológicas y no farmacológicas) en la cesación de tabaco frente a otra menos intensiva (cuidado usual con consejería y medicación opcional)(23).
Las guías 2016 de
· Se aconseja a todos los diabéticos no consumir cigarrillos ni otros productos del tabaco, así como tampoco los cigarrillos electrónicos.
· Incluir consejería y otras formas de intervención para evitar el tabaquismo como parte del cuidado rutinario de los diabéticos
Aspirina
La aspirina (AAS) inhibe en forma irreversible la activación y la agregación plaquetaria. Este efecto depende de la inhibición irreversible de la actividad de ciclooxigenasa1 de la enzima prostaglandina endoperóxido reductasa por acetilación de un residuo serina. Se inhibe así la conversión de ácido araquidónico a tromboxano A2, que es esencial para el normal funcionamiento de las plaquetas. La inhibición de la activación y de la agregación plaquetaria es la responsable de la prevención de eventos vasculares trombóticos por parte del AAS. Si se aumenta la dosis de AAS se inhibe progresivamente la actividad de COX2 y la subsiguiente síntesis de prostaciclina, lo que eleva el riesgo de sangrado sin incrementar el efecto antitrombótico(24).
Prevención primaria
El estudio ETDRS evaluó el efecto de 650 mg de AAS versus placebo durante cinco años en 3.711 diabéticos con y sin enfermedad cardiovascular(25). El mismo no encontró reducción significativa del punto final combinado (muerte vascular, IAM no fatal o ACV no fatal) RR 0,91; IC95%, 0,75-1,11.
El estudio POPADAD incluyó a 1.276 pacientes diabéticos, con edad igual o mayor a 40 años, con índice de presión tobillo/brazo 0,99 y sin evidencia de enfermedad cardiovascular sintomática; fueron asignados en un diseño factorial 2x2 a AAS (100 mg/día) o placebo, y antioxidantes o placebo(26). Tras una mediana de seguimiento de 6,7 años el tratamiento con AAS no tuvo efectos sobre la incidencia del punto final primario de muerte por enfermedad coronaria o ACV, infarto y ACV no fatales o amputación por encima del tobillo por isquemia crítica (HR 0,98; IC95%, 0,76-1,26; p=0,86). Tampoco hubo efectos significativos en la incidencia de infarto no fatal (HR 0,98; IC95%, 0,68-1,43; p=0,93) o ACV no fatal (HR 0,71; IC95%, 0,44-1,14; p=0,15).
El estudio JPAD evaluó en forma abierta el tratamiento con AAS (
Varios metaanálisis han intentado aclarar el papel de
De Berardis y colaboradores realizaron un análisis en el que se incluyeron seis estudios con 10.117 participantes. El tratamiento con AAS no tuvo efectos significativos sobre la incidencia de eventos cardiovasculares mayores (RR 0,90; IC95%, 0,81-1,00); IAM (RR 0,86; IC95%, 0,61-1,21); ACV (RR 0,83; IC95%, 0,60-1,14), o muerte (RR 0,93; IC95%, 0,82-1,05). La incidencia de efectos adversos no fue estadísticamente mayor con AAS(32).
Younis y colaboradores analizaron seis estudios con un total de 7.374 pacientes con diabetes. No encontraron beneficio en los pacientes que recibieron AAS frente a los que no recibieron este fármaco con respecto a la mortalidad global (RR=0,96; IC95%, 0,78-1,18; p=0,71), eventos cardiovasculares mayores (RR=0,90; IC95%, 0,78-1,05; p=0,17) o IAM (RR=0,95; IC95%, 0,76-1,18; p=0,63). El riesgo de sangrado mayor no fue significativamente superior en el grupo asignado a AAS (RR=2,49; IC95%, 0,70-8,84; p=0,16) (30).
Stavrakis y colaboradores revisaron siete estudios de los cuales dos incluyen en forma exclusiva a diabéticos y cinco tenían un subgrupo de pacientes diabéticos.
Zhang y colaboradores analizaron siete estudios que incluyeron 11.618 personas con diabetes. El uso de AAS no se asoció con una reducción estadísticamente significativa en eventos cardiovasculares mayores (RR 0,92; IC95%, 0,83-1,02; p=0,11). El uso de AAS tampoco redujo la mortalidad global (0,95, IC95% 0,85-1,06; p=0,33), ni la mortalidad cardiovascular (0,95, IC95% 0,71-1,27; p=0,71), ni los ACV (0,83, IC95% 0,63-1,10; p=0,20), ni el infarto de miocardio (0,85, IC95% 0,65-1,11; p=0,24). Hubo un aumento no significativo en el riesgo de sangrado mayor con AAS (2,46, IC95% 0,70-8,61; p=0,16). Un análisis de metarregresión sugirió que
Butalia y colaboradores analizaron un total de 11.618 pacientes incluidos en siete estudios. El RR global de eventos cardiovasculares adversos mayores fue de 0,91 (IC95% 0,82-1,00) con poca heterogeneidad entre los estudios (I2 0,0%). Los eventos secundarios de interés incluyeron el infarto de miocardio (RR 0,85; IC95%, 0,66-1,10); ACV (RR 0,84; IC95%, 0,64-1,11); muerte cardiovascular (RR 0,95; IC95%, 0,71-1,27), y mortalidad por cualquier causa (RR 0,95; IC95%, 0,85-1,06). Hubo un aumento no significativo de las tasas de sangrado con AAS (RR 2,50; IC95%, 0,77-8,10). En términos absolutos por cada 10.000 pacientes tratados con AAS se podrían prevenir 109 eventos cardiovasculares mayores a expensas de 19 sangrados mayores. Los autores sugieren que los pacientes diabéticos sin enfermedad cardiovascular estarían en algún punto intermedio entre los pacientes en prevención primaria y secundaria en el espectro de riesgo y beneficio, por lo que sería de particular importancia considerar el riesgo individual de cada paciente(36).
Pignone y colaboradores analizaron nueve ensayos clínicos randomizados (ECR) que evaluaron el uso de AAS en diabéticos en prevención primaria. No hubo un efecto estadísticamente significativo con el uso de AAS en la prevención de eventos adversos cardiovasculares. El uso de AAS se asoció con una disminución del riesgo de eventos coronarios de 9% (RR 0,91; IC95%, 0,79-1,05) en tanto que el riesgo de ACV se redujo 10% (RR 0,90; IC95%, 0,71-1,13). El riesgo de sangrado intracraneano quedó incluido en la estimación de riesgo de ACV. El riesgo de sangrados extracraneanos aumentó 54% con el uso de AAS (RR 1,54; IC95%, 1,30–1,82); el aumento de riesgo absoluto fue de unos 3 pacientes en 10.000 por año(35).
Hay que destacar que un análisis de metarregresión estadística(37) de 17 estudios aleatorizados de prevención primaria y secundaria evidenció que el beneficio en la prevención de eventos cardiovasculares con el uso de AAS estaba directamente vinculado al riesgo basal de eventos de los pacientes; a mayor riesgo, mayor beneficio. En el balance entre la prevención de eventos cardiovasculares y el riesgo de sangrado había beneficio cuando el riesgo basal de eventos era superior a 2 por 100 pacientes/año, había perjuicio cuando el riesgo cardiovascular basal era menor de 1 por 100 pacientes/año, en tanto que con un riesgo cardiovascular basal entre 1 y 2 por 100 pacientes/año, el beneficio de la reducción de riesgo cardiovascular y el perjuicio por sangrado con el uso de AAS resultaron similares.
En suma: por los resultados de los diversos metaanálisis citados se puede concluir que el uso de AAS en prevención primaria podría reducir el riesgo de eventos cardiovasculares adversos en el mejor de los casos cerca de un 10% (estadísticamente no significativo) a expensas de al menos una duplicación del riesgo de sangrado. Los resultados de los estudios ACCEPT-D y ASCEND, actualmente en curso, serán importantes para definir el papel de AAS en la prevención primaria en pacientes diabéticos.
Del análisis de esta evidencia se puede concluir que AAS no está indicado en los pacientes diabéticos en prevención primaria, aunque existe evidencia de menor peso para indicarlo en aquellos con mayor riesgo cardiovascular basal.
Las guías de
· Considerar tratamiento con AAS (75-162 mg/día) como estrategia de prevención primaria en sujetos con diabetes tipo 1 o 2 con riesgo cardiovascular aumentado (riesgo CV 10 años >10%). (C) Esto incluye a hombres y mujeres ³50 años con al menos un factor de riesgo CV adicional sin aumento del riesgo de sangrado.
·
· En los pacientes <50 años con múltiples factores de riesgo adicionales (riesgo ECV a diez años entre 5% y 10%), se requiere juicio clínico adecuado. (E)
Sin embargo, la guía europea 2016 sobre prevención de enfermedades cardiovasculares(38) no recomienda el uso de AAS en ningún paciente en prevención primaria por el aumento del riesgo de sangrado.
Una recomendación reciente de
Recomiendan el uso de AAS a dosis de
· Pacientes con antecedentes familiares de cáncer de colon sin alto riesgo de sangrado y que tengan un riesgo cardiovascular >5%, menores de 70 años.
· Pacientes sin antecedentes familiares de cáncer de colon sin alto riesgo de sangrado de
Supeditan el uso de AAS de
· Algunos pacientes de
· Algunos pacientes menores de 59 años sin alto riesgo de sangrado, sin antecedentes familiares de cáncer de colon pero con riesgo cardiovascular entre 5% a 10%, de
· Algunos pacientes de 70 o más años con antecedentes familiares de cáncer de colon, sin alto riesgo de sangrado y riesgo CV >20%.
Aconsejan no usar AAS en el resto de los casos.
Prevención secundaria
No hay discusión sobre la indicación formal del uso de AAS en prevención secundaria.
Un metaanálisis de los Antithrombotic Trialists Collaboration (ATT) estudió el efecto de fármacos antiplaquetarios versus control, sobre todo AAS, en 195 ECR que incluyeron 144.051 pacientes con enfermedad cardiovascular clínica (5.126 diabéticos). El tratamiento antiplaquetario redujo en forma significativa (22%) el riesgo de eventos vasculares adversos (IAM no fatal, ACV no fatal o muerte cardiovascular)(40).
El clopidogrel ha demostrado reducir los eventos cardiovasculares en los diabéticos, por lo que constituye una alternativa en pacientes con intolerancia a AAS(41).
Las guías de
· Utilizar AAS (75-162 mg/día) como estrategia de prevención secundaria en sujetos diabéticos con historia de ECV. (A)
· Para los pacientes con ECV y alergia a
· La combinación de AAS (75-162 mg/día) y clopidogrel (75mg/día) es razonable durante un año después de un síndrome coronario agudo. (B)
Las indicaciones de la guía europea son concordantes con las anteriores.
Número de dosis diarias
Tratamiento de la hipertensión arterial
En el abordaje del tema de la hipertensión arterial (HTA) en el diabético es conveniente intentar contestar las siguientes preguntas:
1. ¿Existe beneficio en tratar la hipertensión arterial en los diabéticos
Está bien establecido el beneficio de tratar
2. ¿Hasta qué cifras debemos descender la presión arterial en esta población?
Presión arterial sistólica. El estudio observacional UKPDS 38 mostró que hubo menor incidencia de complicaciones macro y microvasculares a medida que
El estudio ACCORD BP(47) estudió la hipótesis de que un control intensivo de
Con respecto a otros eventuales perjuicios causados por descenso de
En cuanto a los pacientes añosos cabe destacar que no hay estudios específicos en diabéticos que evalúen diferentes metas de PA. El estudio emblemático para la población de hipertensos añosos es el HYVET(49), que incluyó a pacientes mayores de 80 años, con escasas comorbilidades, y solo 7% de diabéticos. En este estudio hubo reducción de efectos adversos cardiovasculares con el descenso de
Presión arterial diastólica. El estudio HOT(50) mostró reducción de eventos adversos en el subgrupo de pacientes diabéticos asignados a presiones diastólicas objetivo de menos de 80 mmHg comparados con aquellos en que el objetivo era menos de 85 y menos de 90 mmHg. La tasa mínima de eventos cardiovasculares adversos se logró con valores de PAD de 82,6 mmHg y la mortalidad fue mínima para valores de PAD de 86,5 mmHg.
Varios metaanálisis han analizado el tema. Un metaanálisis de Reboldi y colaboradores(51) estudió los efectos de la reducción intensiva de
Mc Brien y colaboradores realizaron otro metaanálisis de cinco estudios y 7.313 pacientes con diabetes tipo 2 evaluando el impacto de control intensivo de
Un metaanálisis de Bangalore y colaboradores incluyó ECR que compararon objetivos de PA así como estrategias terapéuticas. Se concluyó que un objetivo de PAS de 130-135 mmHg era aceptable. Con valores objetivo <130 mmHg hubo mayor reducción de ACV, pero no beneficio en otros eventos macro o microvasculares, observándose un aumento de los eventos adversos serios(52).
Otro metaanálisis de Emdin y colaboradores(53) analizó 40 estudios con 100.354 participantes diabéticos. Por cada 10 mmHg de descenso de
En suma: consideramos que la evidencia es indiscutible para indicar un descenso de
3. ¿Hay fármacos mejores que otros en la prevención de eventos cardiovasculares mayores o que generen otros beneficios adicionales en los hipertensos diabéticos?
Prevención de eventos cardiovasculares adversos mayores
Un subestudio preespecificado de ALLHAT(54) analizó los resultados de los 13.101 diabéticos aleatorizados a amlodipina, lisinopril o clortalidona. Al cabo de 4,9 años de seguimiento no hubo diferencia significativa en el objetivo primario de enfermedad coronaria fatal o IAM no fatal, observándose más insuficiencia cardíaca en los asignados a amlodipina que en los asignados a clortalidona (RR 1,39; IC95% 1,22-1,59), aunque este punto final no estaba definido con anterioridad y además, luego de la aleatorización, se suspendieron los diuréticos en aquellos pacientes que los venían recibiendo.
El estudio ASCOT incluyó a 19.257 hipertensos (5.135 diabéticos) con al menos tres factores de riesgo adicionales, a los que asignó en forma aleatoria a amlodipina (agregando perindopril si era necesario, n=9.639) o atenolol (agregando bendroflumetiazida y potasio según necesidad, n=9.618)(55). Entre los diabéticos, luego de 5,5 años de seguimiento, el régimen basado en amlodipina redujo el punto final secundario de eventos cardiovasculares totales y procedimientos (HR 0,87; IC95% 0,76-0,99). Sin embargo, el objetivo final primario de muerte por enfermedad arterial coronaria o IAM no fatal se redujo en forma no significativa (HR=0,92, IC95% 0,74-1,15). Cabe destacar además que los pacientes asignados a amlodipina/perindopril tuvieron un descenso de
Un subestudio preespecificado de ACCOMPLISH(56) analizó los efectos de la combinación de un inhibidor de la enzima convertidora de la angiotensina (IECA) (benazepril) asociado a amlodipina o asociado a hidroclorotiazida sobre eventos adversos cardiovasculares mayores. Las presiones arteriales medias logradas en el grupo benazepril/amlodipina fueron 131,5/72,6 mmHg versus 132,7/73,7 mmHg en el grupo benazepril/hidroclorotiazida. Al cabo de un seguimiento de 30 meses la tasa de eventos primarios fue de 8,8% y 11,0% respectivamente (HR 0,79, IC95% 0,68-0,92; p=0,003), es decir, significativamente menor en el grupo asignado a IECA/amlodipina. A diferencia del análisis de subgrupos de ASCOT, el leve descenso de
En el estudio ADVANCE, 11.140 diabéticos tipo 2 mayores de 55 años fueron aleatorizados a perindopril/indapamida o placebo, tratamiento que se asoció al que ya recibían previamente(57).
Hay que destacar que a diferencia de los estudios anteriores este trabajo incluyó solamente a diabéticos. Además se trató de un estudio on top of, es decir que el tratamiento con perindopril-indapamida se realizó “además del” tratamiento antihipertensivo de base y no “en vez de” otros antihipertensivos. Por último, el descenso de cifras tensionales es concordante con la disminución de eventos cardiovasculares adversos observada.
Un metaanálisis de 27 ECR que evaluaron IECA, ARA2, calcioantagonistas y diuréticos/ ß-bloqueantes en 158.709 hipertensos (33.395 diabéticos) mostró reducción de eventos cardiovasculares mayores en diabéticos con cualquiera de los regímenes terapéuticos, sin diferencia entre los fármacos en la comparación directa(58). El metaanálisis ya citado de Emdin y colaboradores(53) sobre más de 100.000 diabéticos es ampliamente concordante con la excepción del beneficio sustancialmente mayor de los diuréticos para la insuficiencia cardíaca (dependiente sobre todo de los datos del ALLHAT).
En suma: el beneficio de las drogas antihipertensivas en los diabéticos depende fundamentalmente del descenso de
Beneficios adicionales de IECA y ARA 2 independientes del descenso de la presión arterial
Nefroprotección. Se ha sugerido que algunas drogas del tipo de los IECA o los ARA 2 podrían tener un papel nefroprotector más allá de su efecto antihipertensivo. Limitaremos el análisis de la evidencia a los diabéticos tipo 2.
Normotensos con excreción normal de proteínas. Hay poca evidencia que apoye el uso de IECA o ARA 2 en diabéticos tipo 2 normotensos con excreción urinaria normal de proteínas. El estudio ABCD(59) mostró beneficios de enalapril (y del antagonista cálcico nisoldipina) en términos de reducción de aparición de microalbuminuria. En cambio, DIRECT Protect-2(60) no mostró diferencias significativas con el uso de candesartán versus placebo si bien el estudio carecía de un adecuado poder estadístico.
Hipertensos con excreción normal de proteínas. El valor de los IECA y de los ARA 2 en diabéticos tipo 2 hipertensos sin excreción aumentada de proteínas en la orina fue analizado en varios estudios. BENEDICT(61) y ADVANCE(57) mostraron beneficio de dos IECA, trandolapril y perindopril, respectivamente, en la prevención de la aparición de microalbuminuria. ROADMAP(62) y DIRECT Protect-2(60) compararon olmesartán y candesartán, respectivamente, contra placebo y no detectaron beneficios con respecto al desarrollo de microalbuminuria.
Hipertensos con microalbuminuria. En pacientes con hipertensión y microalbuminuria, IDNT(63) mostró en 590 diabéticos tipo 2 que la administración de irbesartán a dosis de 150 o 300 mg por día disminuyó significativamente el desarrollo de macroalbuminuria al cabo de dos años (5,2% en el grupo irbesartán 300 mg, 9,7% en el grupo irbesartán 150 mg y 14,9% en el grupo placebo; HR no ajustado 0,30, IC95% 0,14-0,91, p<0,001 para irbesartán 300 mg versus placebo y 0,61, IC95% 0,34-1,08; p=0,08 para irbesartán 150 mg versus placebo). Los HR ajustados por nivel de microalbuminuria basal y PA alcanzada al final del estudio fueron 0,56 en el grupos irbesartán 150 mg (IC95% 0,31-0,99; p=0,05) y 0,32 en el grupo irbesartán 300 mg (IC95% 0,15-0,65; p<0,001).
Los IECA y los ARA 2 parecen tener una eficacia similar en diabéticos tipo 2 con microalbuminuria. El estudio DETAIL(64) mostró que 80 mg de telmisartán o 20 mg de enalapril tuvieron similar efecto en la progresión de la nefropatía en diabéticos con nefropatía leve.
Hipertensos con macroalbuminuria. Dos ERC (IDNT y RENAAL) demostraron beneficios significativos de irbesartán y de losartán en pacientes con nefropatía diabética establecida que fueron mayores que los esperables por el descenso de
IDNT(65,66) incluyó a 1.715 hipertensos con nefropatía (concentración media de creatinina sérica de 1,7 mg/dL) causada por diabetes tipo 2 que fueron asignados en forma aleatoria a irbesartán 300 mg/día, amlodipina 10 mg/día, o placebo, y seguidos durante una media de 2,6 años. El grupo asignado a irbesartán tuvo una disminución significativa del RR del objetivo combinado de duplicación de la creatininemia, desarrollo de enfermedad renal terminal, o mortalidad por cualquier causa: RR irbesartán versus amlodipina 0,77 (IC95% 0,63-0,93) p=0,006; RR irbesartán versus placebo 0,80 (IC95% 0,66-0,97), p=0,02.
Estos beneficios fueron independientes de la magnitud de la reducción de
En el estudio RENAAL(69), 1.513 diabéticos tipo 2 con nefropatía diabética y HTA (concentración media de creatinina sérica de 1,9 mg/dL) fueron asignados en forma aleatoria a losartán
Metaanálisis. Un metaanálisis de 127 ECR evaluó el efecto de diferentes drogas antihipertensivas en la progresión de enfermedad renal incluyendo a 14.437 pacientes diabéticos(70). No se encontró beneficio de los IECA ni de los ARA 2 sobre otros antihipertensivos en el punto final de duplicación de la concentración de creatinina o insuficiencia renal terminal (necesidad de trasplante o diálisis): RR 0,89; IC95% 0,74-1,07. Lo mismo se observó entre los no diabéticos, donde ni IECA ni ARA-2 fueron superiores a otros antihipertensivos en la prevención de la falla renal. En los diabéticos los IECA redujeron la microalbuminuria en relación con los otros antihipertensivos: -12,2 mg/día; IC95%
En suma: la conclusión de mayor peso que se desprende de la evidencia previamente mencionada es que los IECA y los ARA 2 tienen un efecto antiproteinúrico en aquellos pacientes diabéticos hipertensos portadores de micro o macroalbuminuria.
Otros beneficios potenciales. Se ha planteado la posibilidad de efectos de protección cardiovascular más allá del descenso de
El estudio MICRO-HOPE(71) estudió el efecto de ramipril en eventos cardiovasculares y renales en 3.577 pacientes diabéticos, con afección vascular u otro factor de riesgo asociado que formaron parte del estudio HOPE(72).
Este beneficio en la reducción de eventos solo podría ser explicado en forma parcial por el modesto descenso de medio de
En cambio, el estudio DIABHYCAR(74), de diseño similar, realizado en 4.912 pacientes con diabetes 2 con excreción urinaria de albúmina ³20 mg/L y creatininemia <150 mmol/L, encontró que ramipril a dosis de 1,25 mg/día no fue mejor que el placebo para prevenir el desarrollo de eventos cardiovasculares y renales adversos.
El estudio PERSUADE(75) incluyó a 1.502 diabéticos con enfermedad coronaria y sin insuficiencia cardíaca que formaron parte de los 12.218 pacientes del estudio EUROPA. Estos diabéticos fueron aleatorizados a perindopril 8 mg por día o placebo. El 40% de ellos eran hipertensos y
En el estudio ONTARGET(76), 25.620 pacientes con enfermedad coronaria, vascular periférica o cerebrovascular o con diabetes con daño de órgano blanco (38% de la población del estudio) fueron aleatorizados a ramipril (10 mg/día, n=8.576), telmisartán (80 mg/día, n=8.542) o la combinación de ambos (n=8.502). La mediana de seguimiento fue de 56 meses y
El estudio TRANSCEND(77), la parte del programa ONTARGET que incluyó a pacientes con los mismos criterios de inclusión que este, pero que eran intolerantes a los IECA, aleatorizó a 5.926 pacientes a telmisartán 80 mg/día o placebo. El 35,7% de la población era diabética. El seguimiento fue de 56 meses. El tratamiento con telmisartán tendió a reducir la incidencia del punto final primario de muerte cardiovascular, infarto, ACV o internación por insuficiencia cardíaca (15,7% vs 17%; HR 0,92; IC95% 0,81-1,05; p=0,22) y del punto final de muerte cardiovascular, infarto o ACV (13% vs 14,8%; HR 0,87, IC95% 0,76-1,00; p ajustada = 0,07). No hubo interacción entre el efecto del tratamiento y la presencia o no de diabetes.
En suma: del análisis de la evidencia previamente expuesta no se demuestra en forma inequívoca un efecto vásculo protector de los IECA o ARA II independiente del descenso de las cifras tensionales generado por dichas drogas.
4. ¿Qué cantidad de fármacos se deben usar y cuáles?
El control adecuado de las cifras tensionales del diabético requiere a lo largo del tiempo del uso de varias drogas asociadas. A modo de ejemplo, en múltiples estudios randomizados se requirió un promedio de más de dos fármacos antihipertensivos para alcanzar las metas de PA objetivo respectivas: 2,7 fármacos para lograr una PAD promedio de 75 mmHg en ABCD(78); 2,8 fármacos para una PAD de 82 mmHg en UKPDS; 3,5 fármacos para una PAD de 74 mmHg en RENAAL(69), y 4 fármacos para lograr una PAD de 77 mmHg en IDNT(65). En ACCORD los pacientes en el grupo tratamiento intensivo requirieron una media de 3,4 drogas (PA 119,3/64,4 mmHg) para controlar
La asociación de múltiples fármacos antihipertensivos en el diabético no está exenta de riesgos como lo demuestra el estudio ACCORD(47) y un reporte de ONTARGET(79) que mostraron un aumento en la incidencia de efectos adversos tales como hipotensión, síncope y deterioro de la función renal.
Sin embargo, un metaanálisis de Wald(80) demuestra que la asociación de dos fármacos a dosis estándar tiene un efecto antihipertensivos cinco veces mayor que el obtenido con la duplicación de la dosis estándar de un único fármaco con el beneficio de presentar menos efectos colaterales.
En suma: como suele ser necesario el uso de varias drogas para un adecuado control de
Si bien la evidencia apoya que el principal beneficio de las drogas antihipertensivas es el descenso de las cifras tensionales per se, es razonable incluir en el plan terapéutico un IECA o un ARA II, ya que su eficacia está demostrada en múltiples estudios con reducción de eventos y además existe la posibilidad de beneficio a nivel renal; su uso es obligatorio en aquellos pacientes diabéticos con micro o macroalbuminuria.
Las combinaciones más estudiadas y más recomendadas son las de IECA o ARA II con calcio antagonistas o diuréticos (tiazidas o indapamida), aunque también la asociación de betabloqueantes con IECA o ARA II, con diuréticos o con amlodipina son posibles. Se desconseja la asociación de IECA con ARA II porque no ha demostrado beneficio para el control de
Hay que destacar que se deben considerar las comorbilidades del paciente. Por ejemplo, el uso de betabloqueantes dentro del grupo de fármacos antihipertensivos es obligatoria en aquellos pacientes que sufrieron un IAM en los dos años previos.
La guía ESC/ESH(81) formula las siguientes recomendaciones para el manejo de
· Es mandatorio iniciar drogas antihipertensivas cuando
· Se aconseja un objetivo de PAS <140 mmHg y de PAD <85 mmHg.
· Todas las clases de drogas antihipertensivas son recomendables y pueden usarse en esta población aunque podría ser preferible el uso de bloqueantes del sistema renina angiotensina, especialmente si existe proteinuria o microalbuminuria.
· Es recomendable que la opción individual del tipo de droga tenga en cuenta las comorbilidades del paciente.
· La administración simultánea de dos bloqueantes del sistema renina angiotensina no es recomendable y debe ser evitada en este tipo de pacientes.
Las guías de
· La meta de PAD es de < 90 mmHg.
· En los pacientes jóvenes o con albuminuria, o con uno o más factores de riesgo asociados que no requieran tratamiento farmacológico “pesado” y no sean añosos, la meta de PA es de < 130/80 mmHg.
Otros elementos a tener en cuenta en el tratamiento farmacológico son los siguientes:
· El análisis del subgrupo de diabéticos del estudio MAPEC(82) evidenció en un seguimiento a ocho años que aquellos pacientes que tomaban por lo menos uno de los antihipertensivos en la noche disminuyeron el riesgo de desarrollo de eventos cardiovasculares mayores con respecto a los que tomaban los antihipertensivos en la mañana.
· La combinación de drogas a dosis fija en un mismo comprimido favorece la adherencia y la persistencia con el tratamiento cuando se la compara con la combinación libre de diferentes comprimidos(83), un mayor porcentaje de pacientes en las metas de PA en el registro NHANES(84), y una menor prevalencia del primer evento cardiovascular luego del inicio del tratamiento en un estudio de cohortes(85).
Es razonable entonces administrar al menos uno de los fármacos antihipertensivos en la noche, ya que puede disminuir la tasa de eventos e intentar usar combinación de fármacos a dosis fija en un comprimido, lo que mejora la adherencia, el cumplimiento y el logro de las metas de PA.
5. ¿Qué precauciones hay que tener para el control de la hipertensión en los diabéticos?(81)
Los pacientes diabéticos, sobre todo aquellos con enfermedad de evolución prolongada y los añosos, suelen ser portadores de neuropatía autonómica cuyo compromiso a nivel cardiovascular se analiza en capítulo aparte. Además, los diabéticos hipertensos tienen un mayor riesgo cardiovascular y suelen padecer una aterogénesis más acelerada que los no diabéticos. Por lo tanto estos pacientes tienen una mayor incidencia de hipotensión ortostática y de episodios hipotensivos bajo tratamiento farmacológico, así como ateromatosis más extensa que la población general. Es por esto fundamental considerar los siguientes ítems:
· En la primera consulta, y luego en forma periódica, se debe tomar
· Siempre se debe tomar
· El MAPA es particularmente útil en los diabéticos para detectar episodios hipotensivos vinculados a su neuropatía autonómica e HTA nocturna, cuya frecuencia es mayor que en otras poblaciones de hipertensos.
· Por último cabe recordar que existe una mayor asociación con el SAOS en los pacientes diabéticos y que esta condición puede ser una causa de dificultad en el control de
Fármacos hipolipemiantes
Antes de analizar estas drogas conviene mencionar algunas características de la dislipemia del diabético(87).
Los pacientes diabéticos presentan una dislipemia particularmente aterogénica que a grandes rasgos incluye anormalidades tanto de las lipoproteínas como de los lípidos plasmáticos con un aumento de lipoproteínas ricas en triglicéridos (incluyendo VLDL y quilomicrones), partículas de LDL colesterol pequeñas y densas, y partículas de HDL colesterol pequeñas y densas ricas en triglicéridos(88). Asocian un aumento de la concentración de apolipoproteína B debido a un incremento del número de las partículas contenidas en ella.
La agresividad de esta dislipemia puede no ser evidente cuando uno analiza el perfil lipídico en la práctica clínica, ya que el LDL colesterol puede permanecer dentro del rango normal, siendo el colesterol no HDL el que puede evidenciar más claramente el riesgo.
Aproximadamente un 50% de los pacientes diabéticos tipo 2 presentan en el perfil lipídico una disminución de HDL colesterol asociada a un aumento de los triglicéridos. El aumento de triglicéridos es característicamente basal y posprandial
En el análisis del manejo de los fármacos hipolipemiantes en los diabéticos debemos intentar contestar las siguientes preguntas:
1. ¿Hay beneficio en el tratamiento con estatinas en los pacientes diabéticos?
2. Si es así, ¿este beneficio se ve en todos los pacientes diabéticos?, ¿hay grupos donde el beneficio es mayor?
3. ¿Cómo ajustar el tratamiento con estatinas en los diabéticos según su riesgo vascular?, ¿con diferentes dosis o con diferentes metas de LDL colesterol?
4. ¿Hay beneficio en el uso de otro tipo de hipolipemiantes?
1. ¿Hay beneficio en el tratamiento con estatinas en los pacientes diabéticos?
Las estatinas reducen la síntesis hepática de colesterol por bloqueo de la hidroximetilglutarilcoenzimaA (HMGCoA) reductasa. La enzima cataliza la conversión de 3-hidroxi-3-metil glutaril CoA a ácido mevalónico. Esta reacción es la más lenta de todas las involucradas en la biosíntesis del colesterol, por lo que es su paso limitante. La caída de la concentración de colesterol dentro de los hepatocitos aumenta la expresión de receptores de LDL colesterol en la membrana hepatocítica, que ligan un mayor número de moléculas de esta lipoproteína y reducen sus concentraciones plasmáticas(87).
Prevención primaria
El único ECR que analizó los beneficios de una estatina en una población constituida en forma exclusiva por diabéticos fue el estudio CARDS(89). En este estudio se evaluaron pacientes diabéticos tipo 2, entre 40 y 75 años, (n=3.838), sin enfermedad cardiovascular previa pero con riesgo cardiovascular aumentado por tener al menos una de las siguientes condiciones: retinopatía, albuminuria, tabaquismo o HTA. El LDL colesterol era menor o igual a 162 mg/dL, y los niveles de triglicéridos en ayunos eran menores o iguales a 54,2 mg/d. Los pacientes fueron aleatorizados a atorvastatina 10 mg por día o placebo. Los pacientes del grupo asignado a recibir atorvastatina tuvieron una reducción del 37% de su objetivo primario: la incidencia de eventos cardiovasculares mayores (p=0,001). En los objetivos secundarios se observó una reducción de 36% en la tasa de eventos coronarios agudos, 31% en la necesidad de nueva revascularización y 48% en la tasa de ACV.
Dos estudios reportaron resultados en subgrupos significativos de diabéticos: ASCOT-LLA y HPS.
En el estudio ASCOT-LLA(90), 10.305 hipertensos sin historia de enfermedad arterial coronaria, pero con al menos otros tres factores de riesgo cardiovascular, fueron asignados en forma aleatoria a recibir 10 mg de atorvastatina o placebo. En el subgrupo de diabéticos tipo 2 (2.532) la tasa de eventos cardiovasculares mayores o procedimientos fue de 9,2% en los asignados a atorvastatina contra 11,9% en el grupo placebo (HR 0,77, IC95% 0,61-0,98; p=0,036). El número de eventos de cada uno de los componentes individuales de este objetivo compuesto fue bajo, y por lo tanto, si bien hubo una reducción de eventos coronarios y de ACV en el grupo tratado con atorvastatina, esta reducción no alcanzó significación estadística(91).
El estudio HPS(92,93) incluyó a personas con edad entre 40 y 80 años, niveles de colesterol total ³135 mg/dL, y que además eran diabéticos (5.963) o portadores de enfermedad arterial oclusiva, sin diagnóstico previo de diabetes (14.573), que fueron aleatorizados a recibir 40 mg de simvastatina por día o placebo. El objetivo primario fue el primer evento coronario mayor (IAM no fatal o muerte coronaria) y el primer evento vascular mayor (evento coronario mayor, ACV o revascularización). Tanto en los diabéticos como en los no diabéticos el grupo asignado a simvastatina mostró reducciones altamente significativas en torno al 25% en las tasas de primer evento coronario mayor, ACV y revascularización. Entre los diabéticos, la incidencia de cualquiera de estos eventos vasculares mayores se redujo 22% (IC95% 13-30) (601 [20,2%] en el grupo asignado a simvastatina vs 748 [25,1%] en el grupo placebo, p<0,0001), similar a la observada en otros sujetos de alto riesgo estudiados. Hubo también una reducción altamente significativa de 33% (IC95% 17-46, p=0,0003) entre los 2.912 participantes diabéticos sin enfermedad arterial oclusiva al ingresar en el estudio, y de 27% (IC95% 13-40, p=0,0007) entre los 2.426 diabéticos cuyos niveles de LDL colesterol pretratamiento eran inferiores a 116 mg/dL.
Un metaanálisis(94) evaluó a pacientes no diabéticos y diabéticos sin enfermedad cardiovascular establecida pero que asociaban otros factores de riesgo cardiovascular. Se incluyeron 10 ECR de tratamiento con estatinas (70.388 pacientes, 23% con diabetes). El seguimiento promedio fue de 4,1 años. El tratamiento con estatinas se asoció con una reducción significativa del riesgo de muerte (OR 0,88; IC95% 0,81-0,96), eventos coronarios mayores (OR 0,70; IC95% 0,61-0,81) y eventos cerebrovasculares (OR 0,81; IC95% 0,71-0,93) en la población global. No hubo heterogeneidad del efecto entre diabéticos y no diabéticos.
Prevención primaria y secundaria
Un metaanálisis(95) incluyó 14 ECR que evaluaron el efecto de las estatinas tanto en prevención primaria como secundaria. Se incluyeron 18.686 diabéticos (1.466 tipo 1 y 17.220 tipo 2) y 71.370 no diabéticos. En este metaanálisis se analizó el grado de beneficio del tratamiento de las estatinas según el descenso logrado del LDL colesterol. Al cabo de 4,3 años, por cada mmol/L (38,5 mg/dL) de descenso del LDL colesterol la mortalidad vascular se redujo en 13% (RR 0,87; IC99% 0,76-1,00) y los eventos vasculares mayores (IAM, muerte coronaria, ACV o revascularización coronaria) en 21% (RR 0,79; IC99% 0,76-0,82). También se redujo en forma significativa la incidencia de IAM o muerte coronaria (RR 0,78; IC99% 0,69-0,87), revascularización coronaria (RR 0,75; IC99% 0,64-0,88) y ACV (RR 0,79; IC99% 0,67-0,93).
Los beneficios observados fueron de similar magnitud en diferentes subgrupos: prevención primaria o secundaria, niveles iniciales de lípidos altos normales o bajos, sexo, edad, presencia o no de HTA, índice de masa corporal o función renal.
Prevención secundaria
La evidencia del efecto benéfico del uso de estatinas en diabéticos en prevención secundaria proviene de análisis de subgrupos de varios ECR que incluyeron tanto no diabéticos como diabéticos.
El estudio TNT reclutó pacientes con cardiopatía isquémica estable y niveles de LDL colesterol menores a 130 mg/dL (97). Los pacientes fueron asignados en forma aleatoria a dos dosis de atorvastatina: 10 vs 80 mg/día. De los 10.001 pacientes reclutados, 15% eran diabéticos (1.501 pacientes). Al cabo de 4,9 años de seguimiento la incidencia de eventos cardiovasculares mayores fue significativamente menor en el grupo tratado con la dosis más alta de atorvastatina, y esto se observó tanto en la población total del estudio como en el subgrupo de diabéticos. En particular, una dosis de 80 mg/día de atorvastatina (mediana de LDL colesterol al final del seguimiento de 77 mg/dL) fue superior a otra de 10 mg/día del mismo fármaco (mediana de LDL colesterol de 98,6 mg/dL) en la prevención del objetivo final combinado de muerte por enfermedad coronaria, IAM no fatal, muerte súbita abortada o ACV (HR 0,75; IC95% 0,58-0,97; p=0,026) (98).
Con respecto a ECR en prevención secundaria en pacientes con síndromes coronarios agudos se destaca el estudio PROVE IT-TIMI 22(96) con 23,5% de pacientes diabéticos. Este estudio incluyó a pacientes ingresados por síndrome coronario agudo en los diez días previos y los aleatorizó a atorvastatina 80 mg/día o pravastatina 40 mg/día (n=4.162 con 978 diabéticos). Al cabo de dos años la atorvastatina a dosis altas fue superior a la pravastatina a dosis estándar para prevenir un punto final combinado de muerte, IAM, internación por angina inestable, revascularización o ACV, determinando una reducción de riesgo significativa de 16% (p=0,005). Un subestudio preespecificado mostró beneficios similares en el grupo de pacientes diabéticos(97).
Es de destacar un análisis post hoc realizado dentro del subestudio de diabéticos que evidenció una reducción del RR de muerte, IAM y hospitalización por angina inestable de 34% (HR 0,66; IC95% 0,46-0,94; p=0,021) en aquellos diabéticos en los que se llegaba a un LDL menor 70 mg/dL y una PCR menor de 2 mg/L con respecto a los que no alcanzaban estos objetivos(97).
Efectos adversos
En los ECR que utilizaron dosis habituales de estatinas no hubo efectos colaterales de relevancia. En los pacientes diabéticos del estudio TNT, la prevalencia de mialgia fue de 3,6% en el grupo de atorvastatina 10 mg y de 2,4% en el de atorvastatina 80 mg. La elevación enzimática persistente (TGO y/o TGP tres veces por encima de lo normal) ocurrió en tres pacientes (0,4%) con atorvastatina 10 mg y en siete con atorvastatina 80 mg. No se reportó ningún caso de rabdomiólisis. En los pacientes diabéticos, el estudio PROVE IT-TIMI 22 no comunicó efectos secundarios relevantes.
En la práctica clínica habitual los efectos adversos más comunes(87) de las estatinas son los que se dan a nivel muscular. Los habituales son las mialgias y raramente la rabdomiólisis. Las mialgias inducidas por estatinas se ven entre el 5% y el 15% en estudios poblacionales. La rabdomiólisis ocurre entre 1 y 3 de cada 100.000 pacientes tratados con estatinas. El diagnóstico de toxicidad muscular por estatinas no siempre es fácil y exige la presencia de síntomas que desaparecen al suspender la estatina y reaparecen al reintroducirla. La administración simultánea de estatinas con algunos otros fármacos aumenta el riesgo de toxicidad muscular. Entre ellos se cuentan los antifúngicos de la familia de los azoles, los antibióticos del grupo de los macrólidos, algunos antirretrovirales como los inhibidores de la proteasa, los calcioantagonistas, la amiodarona, el gemfibrozil y la ciclosporina. En particular la asociación de estatinas y gemfibrozil aumenta mucho el riesgo de miopatía y debe ser evitada.
La toxicidad hepática es poco frecuente. Se pueden encontrar elevaciones leves de las enzimas hepáticas en 0,5% a 2% de los pacientes tratados con estatinas. Es excepcional la progresión a la insuficiencia hepatocítica severa de estos pacientes.
En suma: es claro que las estatinas tienen beneficios notorios sobre la mortalidad y sobre los eventos cardiovasculares adversos en los pacientes diabéticos. Su efectividad es mayor con dosis altas que con dosis más bajas, al costo de un ligero aumento de efectos secundarios. La reducción de riesgo relativo de eventos vasculares adversos con estatinas es similar en diabéticos que en no diabéticos, pero la reducción de riesgo absoluto es mayor en los diabéticos dada su mayor tasa de eventos.
2. ¿Se benefician todos los pacientes diabéticos con el uso de estatinas?, ¿hay grupos donde el beneficio es mayor?
La evidencia es categórica en cuanto al beneficio indiscutible de las estatinas para la reducción de eventos vasculares mayores en la prevención secundaria del paciente diabético independientemente de los valores basales de LDL colesterol.
Dado el muy alto riesgo de los pacientes en prevención primaria cuyo LDL colesterol es ³ 190 mg/dL y el claro beneficio que ofrece el uso de estatinas en los pacientes de alto riesgo, no se discute la indicación de dichos fármacos en este grupo independientemente de que sean o no diabéticos.
En cuanto a los demás pacientes en prevención primaria hay que destacar que el riesgo cardiovascular no es homogéneo. Expertos estadounidenses plantean que existe una sólida evidencia de beneficio en la reducción de eventos en el paciente diabético entre 40 y 75 años cuyo LDL colesterol está entre 70 y 189 mg/dL sin otros factores de riesgo o lesión de órgano blanco y riesgo cardiovascular <7,5% (98,99). Los expertos europeos en los hechos actúan en forma concordante. Sin embargo, los beneficios contundentes observados en los estudios de prevención primaria analizados anteriormente (CARDS, y subgrupo de diabéticos de ASCOT LLA y de HPS) ocurrieron en una población de diabéticos de alto riesgo, con tasas de eventos vasculares adversos superiores a 20% a diez años en el grupo placebo; estas tasas son mucho mayores que las observadas en cohortes poblacionales.
El número de pacientes menores de 40 años o añosos, sin otros factores de riesgo además de su diabetes incluidos en los ECR es escaso; se considera que la fuerza de la evidencia es menor para la recomendación en estos casos y la misma se basa sobre todo en la opinión de expertos.
Es probable que existan diabéticos de bajo riesgo que no obtengan mayores beneficios del uso de estatinas, en particular pacientes jóvenes, menores de 40 años, sin otros factores de riesgo vascular.
En suma: las estatinas benefician más allá de toda duda a los diabéticos en prevención secundaria y a muchos en prevención primaria. Estos últimos constituyen una población heterogénea en cuanto al grado de beneficio obtenido. Un grupo grande de diabéticos en prevención primaria tiene riesgo cardiovascular suficientemente grande como para justificar el uso de estatinas.
3. ¿Cómo ajustar el tratamiento con estatinas en los diabéticos según su riesgo vascular?, ¿con diferentes dosis o con diferentes metas de LDL colesterol?
En este punto hay diferencias en el enfoque entre las guías de
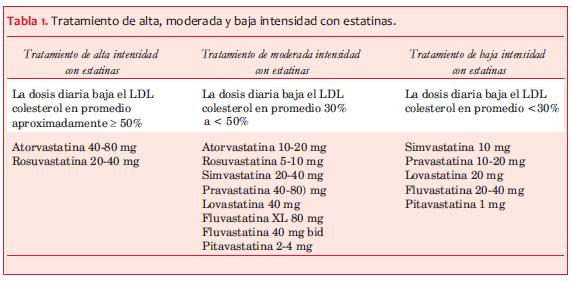
La guía estadounidense afirma basar sus recomendaciones en ECR. En este sentido los estudios disponibles compararon estatinas frente a placebo, o diferentes dosis de la misma estatina o de diferentes estatinas, y ningún estudio comparó grupos con niveles objetivo de LDL colesterol preespecificados. Los ECR mostraron que las dosis más altas de estatinas más potentes lograron mayor reducción de eventos vasculares adversos que las dosis menores. Este beneficio dependió de una mayor disminución del LDL-C, como lo demostró el metaanálisis del 2010 de los CTT(94). El descenso del RR de eventos cardiovasculares adversos en este metaanálisis fue constante entre 70 y 189 mg/dL de LDL-C. Los autores de la guía calcularon el porcentaje de reducción del LDL colesterol logrado en el grupo de pacientes beneficiados con la disminución de eventos en los ECR de este metaanálisis. Clasificaron los tratamientos con estatinas según la magnitud de la disminución del LDL-C en tres grupos: intensidad alta (descenso del LDL-C plasmático ³50%), moderada (descenso del LDL-C entre 30% y <50%) o bajo descenso de LDL-C <30%) (tabla 1). Esta guía concluye que el tratamiento con estatinas debe hacerse con dosis fijas de intensidad alta, moderada o baja, según el riesgo de eventos ateroscleróticos del paciente en cuestión.
Por todo lo dicho la guía estadounidense hace hincapié en dosis de estatinas a administrar y porcentaje de reducción de LDL a lograr, y no en un LDL objetivo determinado.
La guía identifica a los diabéticos de edad media como grupo de claro beneficio con el uso de estatinas. Sugiere usar intensidad de estatinas altas en prevención secundaria y en aquellos pacientes en prevención primaria con alto riesgo de eventos adversos (riesgo CV a 10 años > 7,5%). Si el riesgo CV es menor a 7,5%, sugiere el uso de tratamiento de intensidad moderada.
Concordamos en que en prevención secundaria dosis altas de estatinas lograron mayor beneficio que dosis moderadas (TNT(100) y PROVE IT TIMI 22(101)). En cuanto a la prevención primaria, el único estudio con altas dosis de estatinas excluyó a diabéticos (JUPITER(102)), por lo que no hay evidencia categórica al respecto. Por otro lado, el estudio CARDS, ya analizado, mostró beneficio claro con dosis moderadas de estatinas (atorvastatina 10 mg), lo mismo que ACCORD (simvastatina
¿Qué opinan los expertos europeos en este punto?
La guía europea concuerda con que el logro de niveles de LDL progresivamente menores se asocia a riesgo de eventos cardiovasculares adversos progresivamente menor. En ese sentido, el metaanálisis ya citado de los CTT del 2010(94) con 170.000 pacientes no diabéticos y diabéticos evidenció a cinco años una reducción de 23% de eventos mayores por cada mmol/L de descenso de LDL colesterol con estatinas independientemente del nivel de LDL colesterol inicial y de otras características basales de la población.
Además, la reducción de eventos parece depender más del descenso de LDL-C per se que del tipo de hipolipemiante utilizado, como lo sugiere el estudio IMPROVE IT(103), que se discute más adelante.
La guía europea ESC/EAS sugiere objetivos de LDL colesterol específicos a lograr, más allá de las dosis de estatinas. Reconoce la ausencia de ECR que aborden el tema. Fundamenta su utilización en: 1) la variabilidad de la respuesta individual al efecto de las estatinas, esto es, la misma dosis de una estatina puede provocar un impacto muy diferente sobre los niveles de LDL-C, por lo que el ajuste del tratamiento se favorece con la definición de objetivos terapéuticos; 2) el posible logro de una mejor comunicación entre el médico y el paciente, así como una mayor adherencia de éste al tratamiento.
Sin embargo, insistimos en que los umbrales elegidos específicamente no tienen evidencia contundente que los avale. Solo estudios post hoc del tipo del PROVE IT TIMI 22(101) ya analizado, mostró una reducción del RR de eventos de 34% en aquellos diabéticos en los que se llegaba a un LDL menor 70 mg/dL.
Una actualización de
En suma: las recomendaciones mencionadas no parecen ser excluyentes. Es razonable ajustar la intensidad del tratamiento hipolipemiante al riesgo vascular del paciente usando dosis de estatinas acordes a dicho riesgo, e intentando lograr porcentajes de reducción adecuados de LDL-C, así como también considerar metas de LDL-C objetivo que pueden ayudar a mejorar el éxito del tratamiento.
4. ¿Hay beneficio en el uso de otro tipo de hipolipemiantes?
Fibratos
Los fibratos son sustancias químicas derivadas del ácido fíbrico (ácido clorofenoxiisobutírico). Su mecanismo de acción es complejo y continúa siendo aclarado. Se sabe que en el mismo está implicada la estimulación de receptores nucleares conocidos como receptores activados de proliferación de los peroxisomas (PPAR). Todos los fibratos estimulan los PPAR alfa. Esto tiene como consecuencia: 1) aumento de la producción y de la actividad de la lipasa de lipoproteínas, con el consiguiente descenso de los niveles de triglicéridos plasmáticos; 2) aumento de la síntesis de apolipoproteína A1 y A2 con aumento de los niveles de HDL colesterol plasmático, y 3) cambios en los niveles de LDL colesterol por mecanismos variables según el fenotipo lipídico y la naturaleza de la alteración metabólica de base(104).
Ensayos clínicos
El fenofibrato fue evaluado en 9.795 diabéticos tipo 2 tanto en prevención primaria como secundaria en el estudio FIELD(105). Este ECR incluyó diabéticos con edades comprendidas entre 50 y 75 años, que no recibían tratamiento con estatinas en el momento del ingreso al estudio; 2.131 pacientes tenían enfermedad cardiovascular previa y 7.664 no la padecían. Se incluyeron pacientes con concentraciones de colesterol total entre 116 y 238 mg/dL, relación CT/CHDL igual o mayor a 4,0 y concentraciones de triglicéridos de
A cinco años no hubo beneficio en el objetivo primario de eventos coronarios (muerte de causa coronaria o IAM) (reducción de RR 11%; HR 0,89, IC95% 0,75-1,05; p=0,16). Sí evidenció un beneficio en el objetivo secundario de reducción tasa de eventos cardiovasculares totales (la suma de muerte cardiovascular, IAM, ACV, y revascularización coronaria o carotídea) (HR 0,89, IC95% 0,80-0,99; p=0,035) debido sobre todo a menos IAM no fatales y menos revascularizaciones.
Con respecto a otro fibrato, el gemfibrozil, el subestudio de diabéticos de VA-HIT(106) mostró un beneficio solo en varones con enfermedad arterial coronaria y niveles bajos de HDL colesterol, ya que el uso de esta droga se asoció con una reducción de eventos cardiovasculares mayores.
Metaanálisis
Un metaanálisis(107) evaluó el impacto del uso de fibratos como única droga hipolipemiante en la tasa de eventos cardiovasculares mayores en diabéticos tipo 2. Incluyó a 11.590 pacientes de 6 ECR. El uso de fibratos no tuvo efecto significativo sobre la mortalidad global o cardiovascular, así como tampoco sobre el riesgo de ACV, angina inestable o necesidad de revascularización coronaria. En cambio, el riesgo relativo IAM no fatal se redujo en forma significativa con el uso de fibratos (RR acumulado 0,79; IC95% 0,67-0,93; p=0,006).
Efectos adversos
Jun y colaboradores realizaron un metaanálisis de fibratos en diabéticos y no diabéticos(108) que incluyó a 45.058 pacientes. Hubo un aumento no significativo de efectos adversos serios con el uso de fibratos (RR 1,21; IC95%
Asociación de estatinas y fibratos
El estudio ACCORD (rama de lípidos)(109) analizó los efectos de fenofibrato asociado a simvastatina versus la misma estatina como único hipolipemiante. Se incluyeron 5.518 pacientes con diabetes tipo 2, hemoglobina glicosilada 7,5%,
Efectos adversos
En ACCORD, el tratamiento con fenofibrato se asoció a un aumento leve pero significativo en los niveles de creatinina sérica, sin diferencias en la incidencia de insuficiencia renal terminal o requerimiento de hemodiálisis
Considerando la evidencia analizada, no se recomienda el uso de fibratos como primera droga hipolipemiante en los pacientes diabéticos excepto en los casos de hipertrigliceridemia severa (>500 o 1000 mg/dL); el objetivo en esta situación es disminuir el riesgo de pancreatitis. En pacientes intolerantes a las estatinas, el uso de fibratos (especialmente si presentan hipertrigliceridemia) es una de las alternativas terapéuticas. En hombres con dislipemia aterogénica el uso de estatinas asociadas a fenofibrato podría proporcionar beneficio.
Asociación de estatinas y niacina
El estudio AIM-HIGH(110) aleatorizó a 3.000 pacientes (33% diabéticos) con enfermedad cardiovascular, niveles bajos de HDL colesterol y triglicéridos elevados, a estatinas a dosis elevadas más niacina de liberación extendida o placebo. El estudio fue detenido debido a la ausencia de beneficio en el objetivo primario de eventos cardiovasculares y un posible aumento del ACV isquémico en el grupo de terapia combinada. El estudio HPS2-THRIVE(111) aleatorizó a 25.673 pacientes con enfermedad vascular aterosclerótica establecida (32,5% diabéticos) a recibir
En función de estos resultados no se recomienda el uso de niacina asociado a estatinas.
Asociación de estatinas con ezetimibe
El ezetimibe inhibe la absorción intestinal de colesterol y disminuye la concentración de LDL colesterol alrededor de 15% a 20%. Su efecto se realiza actuando sobre la proteína NPC1L1 del ribete en cepillo del epitelio intestinal. La disminución del aporte de colesterol al hígado causa sobreexpresión de los receptores de LDL colesterol en la membrana hepatocítica y remoción aumentada del LDL colesterol plasmático con descenso de las concentraciones del mismo(87).
El estudio IMPROVE-IT(103) comparó el efecto de una estatina a dosis moderada (simvastatina 40 mg) asociada a ezetimibe 10 mg versus monoterapia con la misma dosis de simvastatina en 18.144 pacientes que habían padecido un síndrome coronario agudo en los diez días previos. Las concentraciones de LDL colesterol debían estar entre 50 y 100 mg/dL en los pacientes bajo tratamiento previo con hipolipemiantes o entre 50 y 125 mg/dL en pacientes sin terapia hipolipemiante precedente. El objetivo primario fue la suma de muerte CV, IAM no fatal, angina inestable que requirió rehospitalización, revascularización coronaria después del primer mes posaleatorización o ACV no fatal. Al cabo de una mediana de seguimiento de seis años hubo una disminución pequeña pero significativa de la incidencia de eventos adversos con la asociación simvastatina ezetimibe versus simvastatina aislada. La mediana de colesterol fue de 53,7 mg/dL en el grupo simvastatina ezetimibe versus 69,5 mg/dL en el grupo de monoterapia con simvastatina (p<0,001).
Un análisis de subgrupos preespecificado mostró que los diabéticos tenían un beneficio particularmente grande con el uso de simvastatina y ezetimibe.
Cabe destacar dos corolarios de este estudio. Por un lado, la demostración de un beneficio claro en la prevención de eventos incluyendo en el plan hipolipemiante una droga diferente de las estatinas. Además, IMPROVE-IT da apoyo a la hipótesis del LDL colesterol (cuanto menor es la concentración de esta lipoproteína menor es la tasa de eventos vasculares, más allá del fármaco utilizado) y sobre todo cuestiona la hipótesis estatínica (esto es, que solamente las estatinas son beneficiosas para la reducción de eventos vasculares).
Efectos colaterales
Se han reportado como efectos adversos del ezetimibe asociado a estatinas: nasofaringitis, mialgias, artralgias y diarrea(99).
Dada la evidencia analizada, la asociación de ezetimibe y estatinas a dosis moderadas puede tener un lugar en el tratamiento de aquellos diabéticos de alto riesgo que no toleren dosis altas de estatinas, o que no lleguen a las metas establecidas.
Asociación de estatinas e inhibidores PCSK9
La proproteína convertasa subtilisina/kexina tipo 9 (PCSK9) es una proteína sérica producida a nivel hepático y que se liga a los receptores de LDL colesterol promoviendo su degradación. Los inhibidores de
Se han realizado estudios controlados de dos inhibidores de
Efectos colaterales
Los anticuerpos monoclonales evolocumab y alirocumab presentaron como efectos colaterales: nasofaringitis, influenza, reacciones locales en el sitio de inyección (se administran por vía subcutánea). Se han reportado trastornos cognitivos en un porcentaje menor (evolocumab vs placebo, 0,9% vs 0,3% y alirocumab vs placebo, 1,2% vs 0,5%)(99).
Dada la evidencia analizada se debería considerar como terapia adyuvante en pacientes diabéticos con alto riesgo cardiovascular y que requieren reducción adicional de LDL colesterol luego de dosis máximas de estatinas o que lo requieren y no toleran las altas dosis de estatinas(12,99).
Recomendaciones de las guías
Por último analizaremos las recomendaciones más recientes de las principales guías internacionales.
Recomendaciones guía ADA 2016
· En adultos que no reciben estatinas es razonable obtener un perfil lipídico en el momento del diagnóstico de la diabetes, cuando se realiza la evaluación inicial y al menos cada cinco años. (E)
· Se sugiere obtener un perfil lipídico al inicio de tratamiento con estatinas y luego en forma periódica, ya que puede ayudar a monitorizar la respuesta al tratamiento y a informar sobre la adherencia. (E)
· Se deben recomendar las siguientes medidas no farmacológicas para mejorar el perfil lipídico de los diabéticos: (A)
• Descenso ponderal si es necesario.
• Reducción de la ingesta de grasas saturadas, grasas trans y colesterol.
• Aumento del consumo de ácidos grasos omega-3, fibra y estanoles/esteroles vegetales.
• Incremento de la actividad física.
· Intensificar las medidas de cambio de estilo de vida y optimizar el control glicémico para los pacientes con niveles elevados de triglicéridos (150 mg/dL [1,7 mmol/L]) y/o HDL colesterol bajo (<40 mg/dL [1,0 mmol/L] para los varones, <50 mg/dL [1,3 mmol/L] para las mujeres). (C)
· Para los pacientes con niveles de triglicéridos en ayunas 500 mg/dL (5,7 mmol/L) se sugiere evaluar causas secundarias de hipertrigliceridemia y considerar tratamiento farmacológico para reducir el riesgo de pancreatitis. (C)
· Si las concentraciones de triglicéridos plasmáticos son 1.000 mg/dL se sugiere iniciar inmediatamente tratamiento farmacológico con fibratos y/o aceite de pescado para reducir el riesgo de pancreatitis aguda. (C)
· Para los pacientes de cualquier edad con diabetes y enfermedad aterosclerótica se deben agregar estatinas a altas dosis a las medidas de cambio de estilo de vida. (A)
· Para los pacientes diabéticos <40 años con factores de riesgo cardiovascular adicionales se debe considerar el uso de estatinas a dosis moderadas o intensas además de cambio de estilo de vida. (C)
· Para los pacientes diabéticos con edad entre 40-75 años sin factores de riesgo adicionales para enfermedad cardiovascular aterosclerótica se sugiere considerar el uso de estatinas a dosis moderadas junto con medidas de cambio de estilo de vida. (A)
· Para los pacientes diabéticos con edad entre 40-75 años con factores de riesgo adicionales para enfermedad cardiovascular aterosclerótica se sugiere considerar el uso de estatinas a dosis altas junto con medidas de cambio de estilo de vida. (B)
· Para los pacientes diabéticos con edad >75 años sin factores de riesgo adicionales para enfermedad cardiovascular aterosclerótica se sugiere considerar el uso de estatinas a dosis moderadas junto con medidas de cambio de estilo de vida. (B)
· Para los pacientes diabéticos con edad >75 años con factores de riesgo adicionales para enfermedad cardiovascular aterosclerótica considerar el uso de estatinas a dosis moderadas o altas junto con medidas de cambio de estilo de vida. (B)
· En la práctica clínica se debe ajustar la intensidad del tratamiento con estatinas en función de la respuesta de cada paciente individual a la medicación (efectos colaterales, tolerabilidad, niveles de LDL colesterol). (E)
· La adición de ezetimibe a tratamiento con estatinas de moderada intensidad ha demostrado proporcionar beneficios cardiovasculares adicionales comparado con tratamiento con estatinas de moderada intensidad aislada y puede ser considerado en pacientes con un síndrome coronario agudo reciente con LDL colesterol 50 mg/dL (1,3 mmol/L) o para aquellos pacientes que no pueden tolerar tratamiento con estatinas de alta intensidad. (A)
· El tratamiento combinado (estatinas/fibratos) no ha demostrado mejorar los resultados en término de eventos cardiovasculares ateroscleróticos y en general no se recomienda. (A) Sin embargo, el tratamiento con estatinas y fenofibrato puede ser considerado para varones con niveles de triglicéridos 204 mg/dL (2,3 mmol/L) y de HDL colesterol =34 mg/dL (0,9 mmol/L). (B)
· El tratamiento combinado (estatinas/niacina) no ha demostrado beneficio cardiovascular adicional respecto al tratamiento exclusivo con estatinas y puede aumentar el riesgo de ACV y en general no se recomienda. (A)
· El tratamiento con estatinas está contraindicado durante el embarazo. (B)
Las guías ACC 2016 son concordantes con las indicaciones de
· En los diabéticos de
• Si estas metas no se logran, se sugiere intensificar las medidas de cambio de estilo de vida y valorar el riesgo/beneficio de pasar a altas dosis de estatinas.
• Si con las máximas dosis toleradas de estatinas no se logran las metas, se evaluará asociar a las estatinas otro tipo de drogas y en primer lugar el ezetimibe, en segundo lugar si los triglicéridos son menores de 300 mg/dL los quelantes de sales biliares (coletiramina u otros).
· En los diabéticos de
• Si las metas no se logran con las máximas dosis toleradas de estatinas se insistirá en cambio de estilo de vida y se evaluará asociar a las estatinas otro tipo de drogas y en primer lugar el ezetimibe; en segundo lugar, si los niveles de triglicéridos son menores de 300 mg/dL, los quelantes de sales biliares (colestiramina u otros).
· En los diabéticos en prevención secundaria se plantea dosis altas de estatinas con el objetivo de reducción del LDLc 50% y adicionalmente LDLc <70 mg/dl y no HDLc <100 mg/dl.
• Si las metas no se logran se insistirá en cambio de estilo de vida y se evaluará asociar a las estatinas otro tipo de drogas, en primer lugar ezetimibe y en segundo lugar la asociación con los inhibidores de
· Los inhibidores de
Con respecto a las guías europeas 2016(87) cabe señalar las siguientes indicaciones:
· En los pacientes con diabetes tipo 1 que asocian microalbuminuria y/o enfermedad renal disminuir al menos un 50% el LDLc con estatinas como primera opción, independientemente del LDLc basal. Nivel de recomendación IC.
· En los pacientes diabéticos con enfermedad cardiovascular o renal, o sin ellas pero mayores de 40 años, con otros factores de riesgo cardiovascular adicionales, o con marcadores de lesión de órgano blanco, el objetivo recomendado de LDLc es <70 mg/dl, el de no HDLC <100 mg/dl y el de apoB <80 mg/dl. Nivel de recomendación IB.
· En los pacientes diabéticos tipo 2 sin otros factores de riesgo adicionales ni evidencia de lesión de órgano blanco se recomienda como primer objetivo el LDLc <100 mg/dl y como objetivos secundarios el no HDLc <130 mg/dl y la apo B <100 mg/dl. Nivel de recomendación IB.
Comentarios finales
· En pacientes diabéticos en prevención secundaria o de alto riesgo es razonable el tratamiento de alta intensidad con estatinas intentando lograr las metas de reducción en porcentaje y metas de LDLc, dentro de la tolerancia del paciente, a los efectos de reducir la morbimortalidad cardiovascular del mismo.
· Parece razonable usar intensidad de dosis y metas de LDL en el tratamiento con estatinas. Si solo usamos metas puede pasar que con bajas dosis de estatinas lleguemos a las mismas y el paciente pierda el beneficio extra de usar dosis más altas, como se demostró en los estudios de prevención secundaria. Por otro lado, si usamos solo intensidad de dosis pueden quedar pacientes de alto riesgo con hipercolesterolemias significativas residuales que disminuirían su riesgo de eventos con un descenso mayor del LDL colesterol de acuerdo a la evidencia ya analizada.
· Hay que tener especial cuidado en los pacientes añosos, especialmente aquellos con enfermedad renal crónica, que están más predispuestos a desarrollar efectos indeseables secundarios de las estatinas, y, por lo tanto, quizá haya que conformarse con dosis diferentes a las de alta intensidad.
· La asociación de ezetimibe a las estatinas como primera droga a elegir es razonable en aquellos pacientes que no toleran la dosis de estatinas más altas o que no llegan a las metas, dado el beneficio demostrado en la reducción de eventos sin efectos indeseables significativos. Con respecto a la asociación con los inhibidores de
· Como ya se estableció, los fibratos no son drogas hipolipemiantes de primera elección en los pacientes diabéticos excepto, para algunos autores, en los casos de hipertrigliceridemia severa a los efectos de evitar la pancreatitis. Sí tienen un lugar como una de las drogas de alternativa en los pacientes intolerantes a las estatinas, especialmente aquellos con hipertrigliceridemia, o la asociación de fenofibrato con estatinas en aquel subgrupo con beneficio de varones con dislipemia aterogénica ya descrito en las guías de
· En cuanto a la prevención primaria de los pacientes diabéticos que no son de alto riesgo, las indicaciones establecidas son razonables en vistas al riesgo intrínseco cardiovascular del diabético y a la mayor morbimortalidad que desarrollan en los eventos comparado con la población general y a los beneficios del descenso de LDLc con estatinas en las poblaciones analizadas en los ECR.
· Sin embargo, como ya se dijo, hay dos grupos en los que la evidencia es escasa, que son los pacientes menores de 40 años y los pacientes añosos. En el primer grupo hay que balancear el eventual beneficio del desarrollo de eventos a largo plazo con el no estudiado riesgo de mantener las estatinas por lapsos muy prolongados (varias décadas). En el segundo grupo hay que balancear el beneficio en términos de reducción de eventos con los eventuales efectos indeseables a los que están más expuestos por la edad y las comorbilidades.
Control multifactorial
Hasta ahora hemos analizado los beneficios en la prevención de eventos vinculada al uso de intervenciones en cada factor de riesgo. Cabe preguntarse si un abordaje multifactorial simultáneo podría mejorar el pronóstico de estos pacientes frente al tratamiento habitual.
Un estudio emblemático en este sentido es el Steno-2. Dicho estudio reclutó a pacientes diabéticos tipo 2 con microalbuminuria y los aleatorizó a tratamiento multifactorial intensivo basado en terapia de conducta, tratamiento farmacológico de la hiperglucemia, la hiperlipemia, la hipertensión y la microalbuminuria versus tratamiento habitual. Con un seguimiento medio de 7,8 años, el grupo de pacientes asignados a tratamiento multifactorial presentó una reducción significativa de eventos macro y microvasculares(114). Tras la finalización del estudio aleatorizado se sugirió una pauta de tratamiento intensiva a todos los pacientes y se los siguió por 5,5 años más (seguimiento total de 13,3 años)(115). Durante este período de seguimiento los pacientes inicialmente asignados a tratamiento intensivo experimentaron menor riesgo de muerte (HR 0,54; IC95% 0,32-0,89; p=0,02), de muerte cardiovascular (HR 0,43; IC95% 0,19-0,95; p=0,04) y de eventos cardiovasculares (HR 0,41; IC95% 0,25-0,67; p<0,001). Además, se registró menor incidencia de nefropatía, de insuficiencia renal terminal, de retinopatía y de neuropatía autonómica con el tratamiento intensivo.
Otros estudios han arrojado resultados concordantes, como el estudio de Yang, en el que luego de siete años de seguimiento los diabéticos tipo 2 aleatorizados a tratamiento multifactorial con control intensivo tuvieron una reducción del riesgo de desarrollo de enfermedad macrovascular subclínica (medida por el aumento del espesor íntima- media y el desarrollo de placas ateroscleróticas) que pasó de 32% en el grupo de cuidado convencional a 10% en el grupo de control intensivo (p<0,05) (116).
También es concordante el estudio SANDS(117), en el que los pacientes diabéticos tipo 2 sometidos a tratamiento intensivo tuvieron una reducción del espesor íntima-media carotídeo frente a un incremento en el grupo tratamiento estándar (p<0,001), así como una mayor reducción de la masa ventricular izquierda.
Conclusiones globales de la prevención en el paciente diabético
El paciente diabético es portador de un riesgo cardiovascular definitivamente mayor que la población general. Sin embargo, existen una serie de estrategias farmacológicas y no farmacológicas que han demostrado disminuir dicho riesgo con menor desarrollo de eventos adversos a futuro. Cada una de ellas es efectiva individualmente, pero se potencian en su beneficio cuando se aplican en forma concomitante en cada persona. Es el deber de todos aquellos médicos y profesionales de la salud que asistimos a este tipo de pacientes conocer las mismas e intentar aplicarlas de la forma más eficaz posible. Esto implica no solo el conocimiento de las estrategias, sino que también requiere tener la capacidad necesaria para poder convencer al paciente de su utilidad. Los mejores resultados se obtienen con el trabajo en equipo multidisciplinario con el objetivo de lograr los cambios de estilo de vida necesarios, la adhesión al tratamiento farmacológico y los controles correspondientes.
Bibliografía
1. Standards of Medical Care in Diabetes-2015. Diabetes Care. 2015 Jan;38 Suppl 1:S1-S93.
2. Stamler J, Vaccaro O, Neaton JD, Wentworth D; The Multiple Risk Factor Intervention Trial Research Group. Diabetes, other risk factors, and 12-yr cardiovascular mortality for men screened in the Multiple Risk Factor Intervention Trial. Diabetes Care. 1993 Feb;16(2):434-44.
3. Vignolo W, Layerle B, Mariani J, Sandoya E. Capítulo 6. Corazón y diabetes. En: Doval HC, Tajer CD, eds. Evidencias en Cardiología: De los ensayos clínicos a las conductas terapéuticas. 8a ed. Buenos Aires: Atlante-Gedic; 2016.
4. IDF Diabetes Atlas. 7th ed. Bruselas: International Diabetes Federation; 2015. Disponible en: http://www.diabetesatlas.org.
5. Haffner SM, Lehto S, Rönnemaa T, Pyörälä K, Laakso M. Mortality from coronary heart disease in subjects with type 2 diabetes and in nondiabetic subjects with and without prior myocardial infarction. N Engl J Med. 1998 Jul 23;339(4):229-34.
6. Schramm TK, Gislason GH, Køber L, Rasmussen S, Rasmussen JN, Abildstrøm SZ, et al. Diabetes patients requiring glucose-lowering therapy and nondiabetics with a prior myocardial infarction carry the same cardiovascular risk. A population study of 3.3 million people. Circulation. 2008 Abr 15;117(15):1945-54. doi:10.1161/CIRCULATIONAHA.107.720847.
7. Lee CD, Folsom AR, Pankow JS, Brancati FL. Cardiovascular events in diabetic and nondiabetic adults with or without history of myocardial infarction. Circulation. 2004 Feb 24;109(7):855-60. doi:10.1161/01.CIR.0000116389.61864.DE.
8. Emerging Risk Factors Collaboration, Sarwar N, Gao P, Seshasai SR, Gobin R, Kaptoge S, Di Angelantonio E, et al. Diabetes mellitus, fasting blood glucose concentration, and risk of vascular disease: a collaborative meta-analysis of 102 prospective studies. Lancet. 2010 June 26;(9733):2215-22. doi: http://dx.doi.org/10.1016/S0140-6736(10)60484-9.
9. Blomster JI, Chow CK, Zoungas S, Woodward M, Patel A, Poulter NR, et al. The influence of physical activity on vascular complications and mortality in patients with type 2 diabetes mellitus. Diabetes Obes Metab. 2013 Nov;15(11):1008-12. doi:10.1111/dom.12122.
10. Moe B, Eilertsen E, Nilsen TIL. The combined effect of leisure-time physical activity and diabetes on cardiovascular mortality. Diabetes Care. 2013 Mar;36(3):690-5. doi: http://dx.doi.org/10.2337/dc11-2472.
11. Tanasescu M, Leitzmann MF, Rimm EB, Hu FB. Physical activity in relation to cardiovascular disease and total mortality among men with type 2 diabetes. Circulation. 2003;107(19):2435-9. doi: http://dx.doi.org/10.1161/01.CIR.0000066906.11109.1F.
12. Standards of Medical Care in Diabetes - 2016. Diabetes Care. 2016 Jan;39 Suppl 1:S1-S112.
13. Boulé NG, Haddad E, Kenny GP, Wells GA, Sigal RJ. Effects of exercise on glycemic control and body mass in Type 2 Diabetes Mellitus: a meta-analysis of controlled clinical trials. JAMA. 2001 Sep 12;286(10):1218-27. doi:10.1001/jama.286.10.1218.
14. Colberg SR, Sigal RJ, Fernhall B, Regensteiner JG, Blissmer BJ, Rubin RR, et al. Exercise and type 2 diabetes: The American College of Sports Medicine and the American Diabetes Association: joint position statement. Diabetes Care. 2010 Dec;33(12):e147-e67. doi:10.2337/dc10-9990.
15. Sigal RJ, Kenny GP, Wasserman DH, Castaneda-Sceppa C. Physical activity/exercise and type 2 diabetes. Diabetes Care. 2004 Oct;27(10):2518-39. doi:10.2337/diacare.27.10.2518.
16. Church TS, Blair SN, Cocreham S, Johannsen N, Johnson W, Kramer K,et al. Effects of aerobic and resistance training on hemoglobin A1c levels in patients with type 2 diabetes. JAMA. 2010;304(20):2253-62. doi: 10.1001/jama.2010.1710.
17. Suarez L, Barrett-Connor E. Interaction between cigarette smoking and diabetes mellitus in the prediction of death attributed to cardiovascular disease. Am J Epidemiol. 1984 Nov [citado 2016 Set 30];120(5):670-5. Disponible en:
http://www.ncbi.nlm.nih.gov/pubmed/6496447.
18. Turner RC, Millns H, Neil HA, Stratton IM, Manley SE, Matthews DR, et al. Risk factors for coronary artery disease in non-insulin dependent diabetes mellitus: United Kingdom Prospective Diabetes Study (UKPDS: 23). BMJ. 1998 Mar 14 [citado 2016 Abr 26];316(7134):823-8. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/9549452.
19. Al-Delaimy WK, Manson JE, Solomon CG, Kawachi I, Stampfer MJ, Willet WC, et al. Smoking and risk of coronary heart disease among women with type 2 diabetes mellitus. Arch Intern Med. 2002 Feb 11 [citado 2016 Abr 26];162(3):273-9. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/11822919.
20. Voulgari C, Katsilam-bros N, Tentolouris N. Smoking cessation predicts amelioration of microalbuminuria in newly diagnosed type 2 diabetes mellitus: a 1-year prospective study. Metabolism. 2011 Oct;60(10):1456-64. doi:10.1016/j.metabol.2011. 02.014.
21. Tan CE, Glantz SA. Association between smoke-free legislation and hospitalizations for cardiac, cerebrovascular, and respiratory diseases: a meta-analysis. Circulation. 2012 Oct 30;126(18):2177-83. doi:10.1161/ CIRCULATIONAHA.112.121301.
22. Ranney L, Melvin C, Lux L, McClain E, Lohr KN. Systematic review: smoking cessation intervention strategies for adults and adults in special populations. Ann Intern Med. 2006 Dec 5 [citado 2016 Abr 26];145(11):845-56. Disponible en:
http://www.ncbi.nlm.nih.gov/pubmed/16954352.
23. Nagrebetsky A, Brettell R, Roberts N, Farmer A. Smoking cessation in adults with diabetes: a systematic review and meta-analysis of data from randomised controlled trials. BMJ Open. 2014;4(3):e004107. doi:10.1136/bmjopen-2013-004107.
24. Park Y, Franchi F, Rollini F, Angiolillo DJ. Antithrombotic therapy for secondary prevention in patients with diabetes mellitus and coronary artery disease. Circ J. 2016;80(4):791-801. doi:10.1253/circj.CJ-16-0208.
25. Aspirin effects on mortality and morbidity in patients with diabetes mellitus. Early Treatment Diabetic Retinopathy Study report 14. ETDRS Investigators. JAMA. 1992 Set 9 [citado 2016 Abr 26];268(10):1292-300. Disponible en:
http://www.ncbi.nlm.nih.gov/pubmed/1507375.
26. Belch J, MacCuish A, Campbell I, Cobbe S, Taylor R, Prescott R, et al. The prevention of progression of arterial disease and diabetes (POPADAD) trial: factorial randomised placebo controlled trial of aspirin and antioxidants in patients with diabetes and asymptomatic peripheral arterial disease. BMJ. 2008 Oct 16 [citado 2016 Abr 26];337:a1840. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/18927173.
27. Ogawa H, Nakayama M, Morimoto T, Uemura S,Kanauchi M, Doi N, Jinnouchi H, et al; Japanese Primary Prevention of Atherosclerosis with Aspirin for Diabetes (JPAD) Trial Investigators. Low-dose aspirin for primary prevention of atherosclerotic events in patients with type 2 diabetes: a randomized controlled trial. JAMA. 2008 Nov 12;300(18):2134-41. doi:10.1001/jama.2008.623.
28. Calvin AD, Aggarwal NR, Murad MH, Shi Q, Elamin MB, Geske JB, et al. Aspirin for the primary prevention of cardiovascular events: a systematic review and meta-analysis comparing patients with and without diabetes. Diabetes Care. 2009 Dec;32(12):2300-06. doi:10.2337/dc09-1297.
29. Antithrombotic Trialists’ (ATT) Collaboration, Baigent C, Blackwell L, Collins R, Emberson J, Godwin J, Peto R, et al. Aspirin in the primary and secondary prevention of vascular disease: collaborative meta-analysis of individual participant data from randomised trials. Lancet. 2009 May 30;373(9678):1849-60. doi:10.1016/S0140-6736(09)60503-1.
30. Younis N, Williams S, Ammori B, Soran H. Role of aspirin in the primary prevention of cardiovascular disease in diabetes mellitus: a meta-analysis. Expert Opin Pharmacother. 2010 Jun;11(9):1 459-66. doi:10.1517/14656561003792538.
31. Stavrakis S, Stoner JA, Azar M, Wayangankar S, Thadani U. Low-dose aspirin for primary prevention of cardiovascular events in patients with diabetes: a meta-analysis. Am J Med Sci. 2011 Jan;341(1):1-9. doi:10.1097/MAJ.0b013e3181f1fba8.
32. De Berardis G, Sacco M, Strippoli GF, Pellegrini F, Graziano G, Tognoni G, et al. Aspirin for primary prevention of cardiovascular events in people with diabetes: meta-analysis of randomised controlled trials. BMJ. 2009 Nov 6 [citado 2016 Abr 26];339:b4531. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/19897665.
33. Zhang C, Sun A, Zhang P, Wu C, Zhang S, Fu M, et al. Aspirin for primary prevention of cardiovascular events in patients with diabetes: A meta-analysis. Diabetes Res Clin Pract. 2010 Feb;87(2):211-8. doi:10.1016/j.diabres.2009.09.029.
34. Buse JB, Ginsberg HN, Bakris GL, Clark NG, Costa F, Eckel R, et al. Primary prevention of cardiovascular diseases in people with diabetes mellitus: a scientific statement from the American Heart Association and the American Diabetes Association. Diabetes Care. 2007 Jan;30(1):162-72. doi:10.2337/dc07-9917.
35. Pignone M, Alberts MJ, Colwell JA, Cushman M, Inzucchi SE, Mukherjee D, et al. Aspirin for primary prevention of cardiovascular events in people with diabetes:a position statement of the American Diabetes Association, a scientific statement of the American Heart Association, and an expert consensus document of the American College of Cardiology Foundation. Circulation. 2010 Jun 22;121(24):2694-701. doi:10.1161/CIR.0b013e3181e3b133.
36. Butalia S, Leung AA, Ghali WA, Rabi DM. Aspirin effect on the incidence of major adverse cardiovascular events in patients with diabetes mellitus: a systematic review and meta-analysis. Cardiovasc Diabetol. 2011 Apr;10(1):25. doi:10.1186/1475- 2840-10-25.
37. Halvorsen S, Andreotti F, ten Berg JM, Cattaneo M, Coccheri S, Marchioli R, et al. Aspirin therapy in primary cardiovascular disease prevention: a position paper of the European Society of Cardiology working group on thrombosis. J Am Coll Cardiol. 2014 Jul 22;64(3):319-27. doi:10.1016/j.jacc.2014.03.049.
38. Piepoli MF, Hoes AW, Agewall S, Albus C, Brotons C, Catapano AL, et al. 2016 European Guidelines on cardiovascular disease prevention in clinical practice. The Sixth Joint Task Force of the European Society of Cardiology and Other Societies on Cardiovascular Disease Prevention in Clinical Practice (constituted by representatives of 10 societies and by invited experts). Developed with the special contribution of the European Association for Cardiovascular Prevention & Rehabilitation (EACPR). Eur Heart J. 2016 Aug 1;37(29):2315-81.
doi:10.1093/eurheartj/ehw106.
39. Capodanno D, Angiolillo DJ. Aspirin for primary cardiovascular risk prevention and beyond in diabetes mellitus. Circulation. 2016 Oct 11;134(15): 1579-94. doi:10.1161/CIRCULATIONAHA.116.023164.
40. Antithrombotic Trialists’ Collaboration. Collaborative meta-analysis of randomised trials of antiplatelet therapy for prevention of death, myocardial infarction, and stroke in high risk patients. BMJ. 2002 Jan 12 [citado 2016 May 2];324(7329):71-86. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/11786451.
41. Bhatt DL, Marso SP, Hirsch AT, Ringleb PA, Hacke W, Topol EJ. Amplified benefit of clopidogrel versus aspirin in patients with diabetes mellitus. Am J Cardiol. 2002 Set 15 [citado 2016 Abr 26];90(6):625-8. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/12231089.
42. Capodanno D, Patel A, Dharmashankar K, Ferreiro JS, Ueno M, Kodali M, et al. Pharmacodynamic effects of different aspirin dosing regimens in type 2 diabetes mellitus patients with coronary artery disease. Circ Cardiovasc Interv. 2011 Apr 19;4(2):180-7. doi:10.1161/CIRCINTERVENTIONS.110.960187.
43. Dillinger J-G, Drissa A, Sideris G, Bal dit Sollier C, Voicu S, Manzo Silberman S, et al. Biological efficacy of twice daily aspirin in type 2 diabetic patients with coronary artery disease. Am Heart J. 2012 Oct;164(4):600-6.e1. doi:10.1016/j.ahj.2012.06.008.
44. Addad F, Chakroun T, Elalamy I, Abderazek F, Chouchene S, Dridi Z, et al. Antiplatelet effect of once- or twice-daily aspirin dosage in stable coronary artery disease patients with diabetes. Int J Hematol. 2010 Sep;92(2):296-301. doi:10.1007/s12185-010-0652-3.
45. McBrien K, Rabi DM, Campbell N, Barnieh L, Clement F, Hemmelgarn BR, et al. Intensive and standard blood pressure targets in patients with type 2 diabetes mellitus. Systematic review and meta-analysis. Arch Intern Med. 2012 Sep 24;172(17):1296-303. doi:10.1001/archinternmed.2012.3147.
46. UK Prospective Diabetes Study Group. Tight blood pressure control and risk of macrovascular and microvascular complications in type 2 diabetes: UKPDS 38. BMJ. 1998 Sep 12 [ 2016 Abr 26];317(7160):703-13. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/9732337.
47. ACCORD Study Group, Cushman WC, Evans GW, Byngton RP, Goff DC Jr, Grimm RH Jr, Cutler JA, et al. Effects of intensive blood-pressure control in type 2 diabetes mellitus. N Engl J Med. 2010 Apr 29;362(17):1575-85. doi:10.1056/NEJMoa1001286.
48. Cooper-DeHoff RM, Gong Y, Handberg EM, Bavry AA, Denardo SJ, Brakis GL, et al. Tight blood pressure control and cardiovascular outcomes among hypertensive patients with diabetes and coronary artery disease. JAMA. 2010 Jul 7;304(1):61-8. doi:10.1001/jama.2010.884.
49. Beckett NS, Peters R, Fletcher AE, Staessen JA, Liu L, Dumitrascu D, et al. Treatment of hypertension in patients 80 years of age or older. N Engl J Med. 2008 May 1;358(18):1887-98. doi:10.1056/NEJMoa0801369.
50. Hansson L, Zanchetti A, Carruthers SG, Dalhöf B, Elmfeldt D, Julius S, et al. Effects of intensive blood-pressure lowering and low-dose aspirin in patients with hypertension?: principal results of the Hypertension Optimal Treatment ( HOT ) randomised trial. HOT Study Group. Lancet. 1998 Jun 13;351(9118):1755-62.
51. Reboldi G, Gentile G, Angeli F, Ambrosio G, Mancia G, Verdecchia P. Effects of intensive blood pressure reduction on myocardial infarction and stroke in diabetes: a meta-analysis in 73,913 patients. J Hypertens. 2011 Jul;29(7):1253-69. doi:10.1097/HJH.0b013e3283469976.
52. Bangalore S, Kumar S, Lobach I, Messerli FH. Blood pressure targets in subjects with type 2 diabetes mellitus/impaired fasting glucose: observations from traditional and bayesian random-effects meta-analyses of randomized trials. Circulation. 2011 Jun 21;123(24):2799-810. doi:10.1161/CIRCULATIONAHA.110.016337.
53. Emdin CA, Rahimi K, Neal B, Callender T, Perkovic V, Patel A, et al. Blood pressure lowering in type 2 diabetes. A systematic review anda meta-analysis. JAMA. 2015 Feb 10;313(6):603-15. doi:10.1001/jama.2014.18574.
54. Whelton PK, Barzilay J, Cushman WC, Davis BR, Ilamathi E, Costis JB, et al. Clinical outcomes in antihypertensive treatment of type 2 diabetes, impaired fasting glucose concentration, and normoglycemia: Antihypertensive and Lipid-Lowering Treatment to Prevent Heart Attack Trial (ALLHAT). Arch Intern Med. 2005 Jun 27;165(12):1401-09. doi:10.1001/archinte.165.12.1401.
55. Dahlöf B, Sever PS, Poulter NR, Wedel H, Beevers DG, Caulfield M, et al; for the ASCOT investigators. Prevention of cardiovascular events with an antihypertensive regimen of amlodipine adding perindopril as required versus atenolol adding bendroflumethiazide as required, in the Anglo-Scandinavian Cardiac Outcomes Trial-Blood Pressure Lowering Arm (ASCOT-BPLA): a muticentre randomised controlled trial. Lancet. 2005 Sep 10;366 (9489):895-906. doi:10.1016/S0140-6736(05)67185-1.
56. Weber MA, Bakris GL, Jamerson K, Weir M, Kjeldsen SE, Devereux RB, et al. Cardiovascular events during differing hypertension therapies in patients with diabetes. J Am Coll Cardiol. 2010 Jun 29;56(1):77-85. doi:10.1016/j.jacc.2010.02.046.
57. Patel A, ADVANCE Collaborative Group. Effects of a fixed combination of perindopril and indapamide on macrovascular and microvascular outcomes in patients with type 2 diabetes mellitus (the ADVANCE trial): a randomised controlled trial. Lancet. 2007 Sep 8;370(9590):829-40. doi:10.1016/S0140-6736(07)61303-8.
58. Blood Pressure Lowering Treatment Trialists’ Collaboration. Effects of different blood pressure-lowering regimens on major cardiovascular events in individuals with and without diabetes mellitus: results of prospectively designed overviews of randomized trials. Arch Intern Med. 2005 Jun 27;165(12):1410-19. doi:10.1001/archinte.165.12.1410.
59. Ravid M, Brosh D, Levi Z, Bar-Dayan Y, Ravid D, Rachmani R. Use of enalapril to attenuate decline in renal function in normotensive, normoalbuminuric patients with type 2 diabetes mellitus. A randomized, controlled trial. Ann Intern Med. 1998 Jun 15 [citado 2016 Jun 3];128(
60. Bilous R, Chaturvedi N, Sjølie AK, Fuller J, Klein R, Orchard T, et al. Effect of candesartan on microalbuminuria and albumin excretion rate in diabetes: three randomized trials. Ann Intern Med. 2009 Jul 7 [2016 Jun 3];151(1):11-20. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/19451554.
61. Ruggenenti P, Fassi A, Ilieva AP, Bruno S, Iliev IP, Brusegan V, et al. Preventing microalbuminuria in type 2 diabetes. N Engl J Med. 2004 Nov 4;351(19):1941-51. doi:10.1056/NEJMoa042167.
62. Haller H, Ito S, Izzo JL Jr, Januszewicz A, Katayama S, Menne J, et al. Olmesartan for the delay or prevention of microalbuminuria in type 2 diabetes. N Engl J Med. 2011 Mar 10;364(10):907-17. doi:10.1056/NEJMoa1007994.
63. Parving HH, Lehnert H, Bröchner-Mortensen J, et al. The effect of irbesartan on the development of diabetic nephropathy in patients with type 2 diabetes. N Engl J Med. 2001 Sep 20;345(12):870-8. doi:10.1056/NEJMoa011489.
64. Barnett AH, Bain SC, Bouter P, Karlberg B, Madsbad S, Jervell J, et al. Angiotensin-receptor blockade versus converting-enzyme inhibition in type 2 diabetes and nephropathy. N Engl J Med. 2004 Nov 4;351(19):1952-61. doi:10.1056/NEJMoa042274.
65. Lewis EJ, Hunsicker LG, Clarke WR, Berl T, Pohl MA, Lewis JB, et al. Renoprotective effect of the angiotensin-receptor antagonist irbesartan in patients with nephropathy due to type 2 diabetes. N Engl J Med. 2001 Sep 20;345(12):851-60. doi:10.1056/NEJMoa011303.
66. Atkins RC, Briganti EM, Lewis JB, Hunsicker LG, Braden G, Champion de Crespigny PJ, et al. Proteinuria reduction and progression to renal failure in patients with type 2 diabetes mellitus and overt nephropathy. Am J Kidney Dis. 2005 Feb [citado 2016 Jun 6];45(2):281-7. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/15685505.
67. Berl T, Hunsicker LG, Lewis JB, Pfeffer MA, Porush JG, Rouleau JL, et al. Impact of achieved blood pressure on cardiovascular outcomes in the irbesartan diabetic nephropathy trial. J Am Soc Nephrol. 2005 Jul 1;16(7):2170-9. doi:10.1681/ASN.2004090763.
68. Pohl MA, Blumenthal S, Cordonnier DJ, De Alvaro F, De Ferrari G, Eisner G, et al. Independent and additive impact of blood pressure control and angiotensin II receptor blockade on renal outcomes in the irbesartan diabetic nephropathy trial: clinical implications and limitations. J Am Soc Nephrol. 2005 Aug 24;16(10):3027-37. doi:10.1681/ASN.2004110919.
69. Brenner BM, Cooper ME, de Zeeuw D, Keane WF, Mitch WE, Parving HH, et al. Effects of losartan on renal and cardiovascular outcomes in patients with type 2 diabetes and nephropathy. N Engl J Med. 2001 Sep 20;345(12):861-9. doi:10.1056/NEJMoa011161.
70. Casas JP, Chua W, Loukogeorgakis S, Vallance P, Smeeth L, Hingorani AD, et al. Effect of inhibitors of the renin-angiotensin system and other antihypertensive drugs on renal outcomes: systematic review and meta-analysis. Lancet. 2005 Dec 10;366(9502):2026-33. doi:10.1016/S0140-6736(05)67814-2.
71. Effects of ramipril on cardiovascular and microvascular outcomes in people with diabetes mellitus: results of the HOPE study and MICRO-HOPE substudy. Heart Outcomes Prevention Evaluation Study Investigators. Lancet. 2000 Jan 22 [citado 2016 Abr 27];355(9200):253-9. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/10675071.
72. The Heart Outcomes Prevention Evaluation Study Investigators. Effects of an angiotensin-converting-enzyme inhibitor, ramipril, on cardiovascular events in high-risk patients. N Engl J Med. 2000 Jan 20;342(3):145-53. doi:10.1056/NEJM200001203420301.
73. Svensson P, de Faire U, Sleight P, Yusuf S, Ostergren J. Comparative effects of ramipril on ambulatory and office blood pressures: a HOPE Substudy. Hypertension. 2001 Dec 1[citado2016 Set 30];38(6):E28-32. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/11751742.
74. Marre M, Lievre M, Chatellier G, Mann JFE, Passa P, Ménard J, et al; DIABHYCAR Study Investigators. Effects of low dose ramipril on cardiovascular and renal outcomes in patients with type 2 diabetes and raised excretion of urinary albumin: randomised, double blind, placebo controlled trial (the DIABHYCAR study). BMJ. 2004 Feb 28;328(7438):495. doi:10.1136/bmj.37970.629537.0D.
75. Daly CA, Fox KM, Remme WJ, Bertrand ME, Ferrari R, Simoons ML, et al. The effect of perindopril on cardiovascular morbidity and mortality in patients with diabetes in the EUROPA study: results from the PERSUADE substudy. Eur Heart J. 2005 Jul;26(14):1369-78. doi:10.1093/eurheartj/ehi225.
76. ONTARGET Investigators. Telmisartan, ramipril, or both in patients at high risk for vascular events. N Engl J Med. 2008 Apr 10;358(15):1547-59. doi:10.1056/NEJMoa0801317.
77. Telmisartan Randomised AssessmeNt Study in ACE iNtolerant subjects with cardiovascular Disease (TRANSCEND) Investigators. Effects of the angiotensin-receptor blocker telmisartan on cardiovascular events in high-risk patients intolerant to angiotensin-converting enzyme inhibitors: a randomised controlled trial. Lancet. 2008 Sep 28;372(9644):1174-83. doi:10.1016/S0140-6736(08)61242-8.
78. Estacio RO, Jeffers BW, Hiatt WR, Biggerstaff SL, Gifford N, Schrier RW. The effect of nisoldipine as compared with enalapril on cardiovascular outcomes in patients with non-insulin-dependent diabetes and hypertension. N Engl J Med. 1998 Mar5;338 (10):645-52. doi:10.1056/NEJM199803053381003.
79. Sleight P, Redon J, Verdecchia P, Mancia G, Gao P, Fagard R, et al. Prognostic value of blood pressure in patients with high vascular risk in the Ongoing Telmisartan Alone and in combination with Ramipril Global Endpoint Trial study. J Hypertens. 2009 Jul;27(7):1360-9.
doi:10.1097/HJH.0b013e32832d7370.
80. Wald DS, Law M, Morris JK, Bestwick JP, Wald NJ. Combination therapy versus monotherapy in reducing blood pressure: meta-analysis on 11,000 participants from 42 trials. Am J Med. 2009 Mar;122(3):290-300. doi:10.1016/j.amjmed.2008.09.038.
81. Mancia G, Fagard R, Narkiewicz K, Redon J, Zanchetti A, Böhm M, et al. 2013 ESH/ESC guidelines for the management of arterial hypertension. Eur Heart J. 2013 Jul;34(28):2159-219. doi:10.1093/eurheartj/eht151.
82. Hermida RC, Ayala DE, Mojón A, Fernández JR. Influence of time of day of blood pressure-lowering treatment on cardiovascular risk in hypertensive patients with type 2 diabetes. Diabetes Care. 2011 Jun;34(6):1270-6. doi:10.2337/dc11-0297.
83. Gupta AK, Arshad S, Poulter NR. Compliance, safety, and effectiveness of fixed-dose combinations of antihypertensive agents: A meta-analysis. Hypertension. 2010 Feb;55(2):399-407. doi:10.1161/HYPERTENSIONAHA.109.139816.
84. Gu Q, Burt VL, Dillon CF, Yoon S. Trends in antihypertensive medication use and blood pressure control among United States adults with hypertension: The National Health and Nutrition Examination Survey, 2001 to 2010. Circulation. 2012 Oct 23;126(17):2105-14. http://dx.doi.org/10.1161/CIRCULATIONAHA.112.096156.
85. Belsey JD. Optimizing adherence in hypertension: a comparison of outcomes and costs using single tablet regimens vs individual component regimens. J Med Econ. 2012;15(5):897-905. doi:10.3111/13696998.2012.689792.
86. Clark CE, Taylor RS, Shore AC, Ukoumunne OC, Campbell JL. Association of a difference in systolic blood pressure between arms with vascular disease and mortality: a systematic review and meta-analysis. Lancet. 2012 Jan 30;379(9819):905-14.
doi: 10.1016/S0140-6736(11)61710-8.
87. Catapano AL, Graham I, De Backer G, Wiklund O, Chapman MJ, Drexel H, et al. 2016 ESC/EAS Guidelines for the management of dyslipidaemias. Eur Heart J. 2016 Aug:ehw272. doi:10.1093/eurheartj/ehw272.
88. Adiels M, Olofsson S-O, Taskinen M-R, Borén J. Overproduction of very low-density lipoproteins is the hallmark of the dyslipidemia in the metabolic syndrome. Arterioscler Thromb Vasc Biol. 2008 Jul;28(7):1225-36. doi:10.1161/ATVBAHA.107.160192.
89. Colhoun HM, Betteridge DJ, Durrington PN, Hitman GA, Neil HAW, Livingstone SJ, et al. Primary prevention of cardiovascular disease with atorvastatin in type 2 diabetes in the Collaborative Atorvastatin Diabetes Study (CARDS): multicentre randomised placebo-controlled trial. Lancet. 2004 Aug 21;364(9435):685-96. doi:10.1016/S0140-6736(04)16895-5.
90. Sever PS, Dahlof B, Poulter NR, Wedel H, Beevers G, Caulfield M, et al. Prevention of coronary and stroke events with atorvastatin in hypertensive patients who have average or lower-than-average cholesterol concentrations, in the Anglo-Scandinavian Cardiac Outcomes Trial—Lipid Lowering Arm (ASCOT-LLA): a multicentre randomised controlled trial. Lancet. 2003 Apr 5;361(9364):1149-58. doi:10.1016/S0140-6736(03)12948-0.
91. Sever PS, Poulter NR, Dahlöf B, Wedel H, Collins R, Beevers G, et al. Reduction in cardiovascular events with atorvastatin in 2,532 patients with type 2 diabetes: Anglo-Scandinavian Cardiac Outcomes Trial—lipid-lowering arm (ASCOT-LLA). Diabetes Care. 2005 May [citado 2016 Oct 9];28(5):1151-7. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/15855581.
92. Heart Protection Study Collaborative Group. MRC/BHF Heart Protection Study of cholesterol lowering with simvastatin in 20,536 high-risk individuals: a randomised placebo controlled trial. Lancet. 2002 July 6;360(9326):7-22.
doi:10.1016/S0140-6736(02)09327-3.
93. Collins R, Armitage J, Parish S, Sleigh P, Peto R; Heart Protection Study Collaborative Group. MRC/BHF Heart Protection Study of cholesterol-lowering with simvastatin in 5963 people with diabetes: a randomised placebo-controlled trial. Lancet. 2003 Jun14 [citado 2016 Oct 9];361(9374):2005-16. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/12814710.
94. Cholesterol Treatment Trialists’ (CTT) Collaboration. Efficacy and safety of more intensive lowering of LDL cholesterol: a meta-analysis of data from 170 000 participants in 26 randomised trials. Lancet. 2010 Nov 13;376(9753):1670-81.
doi:10.1016/S0140-6736(10)61350-5.
95. Cholesterol Treatment Trialists’ (CTT) Collaborators, Kearney PM, Blackwell L, Collins R, Keech A, Simes J, Peto R, et al. Efficacy of cholesterol-lowering therapy in 18,686 people with diabetes in 14 randomised trials of statins: a meta-analysis. Lancet. 2008 Jan 12;371(9607):117-25. doi:10.1016/S0140-6736(08)60104-X.
96. Cannon CP, Braunwald E, McCabe CH, Rader DJ, Rouleau JL, Belder R, et al. Intensive versus moderate lipid lowering with statins after acute coronary syndromes. N Engl J Med. 2004 Apr 8;350(15):1495-504. doi:10.1056/NEJMoa040583.
97. Ahmed S, Cannon CP, Murphy SA, Braunwald E. Acute coronary syndromes and diabetes: is intensive lipid lowering beneficial? Results of the PROVE IT-TIMI 22 trial. Eur Heart J. 2006 Oct;27(19):2323-9. doi:10.1093/eurheartj/ehl220.
98. Stone NJ, Robinson JG, Lichtenstein AH, Bairey Merz CN, Blum CB, Eckel RH, et al. 2013 ACC/AHA guideline on the treatment of blood cholesterol to reduce atherosclerotic cardiovascular risk in adults: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. J Am Coll Cardiol. 2014 Jul 1;63(
99. Lloyd-Jones DM, Morris PB, Ballantyne CM, Birtcher KK, Daly DD Jr, DePalma SM, et al. 2016 ACC Expert Consensus Decision Pathway on the Role of Non-Statin Therapies for LDL-Cholesterol Lowering in the Management of Atherosclerotic Cardiovascular Disease Risk: A Report of the American College of Cardiology Task Force on Clinical Expert Consensus Documents. J Am Coll Cardiol. 2016 Jul;68(1):92-125.
doi:10.1016/j.jacc.2016.03.519.
100. LaRosa JC, Grundy SM, Waters DD, Shear C, Barter P, Fruchart JC, et al. Intensive lipid lowering with atorvastatin in patients with stable coronary disease. N Engl J Med. 2005 Apr 7;352(14): 1425-35. doi:10.1056/NEJMoa050461.
101. Cannon CP, Braunwald E, McCabe CH, Rader DJ, Rouleau JL, Belder R, et al; for the Pravastatin or Atorvastatin Evaluation and Infection Therapy-Thrombolysis in Myocardial Infarction 22 Investigators. Comparison of Intensive and Moderate Lipid Lowering with Statins after Acute Coronary Syndromes. 2004 Apr 8;350:1-10.
102. Ridker PM, Danielson E, Fonseca FAH, Genest J, Gotto AM Jr, Kastelein JJ, et al; JUPITER Study Group. Rosuvastatin to Prevent Vascular Events in Men and Women with Elevated C-Reactive Protein. N Engl J Med. 2008 Nov 20; 359(21):2195-207.
103. Cannon CP, Blazing MA, Giugliano RP, McCagg A, White JA, Theroux P, et al; IMPROVE-IT Investigators. Ezetimibe Added to Statin Therapy after Acute Coronary Syndromes. N Engl J Med. 2015 Jun 18;372(25):2387-97. doi:10.1056/NEJMoa1410489.
104. Chapman MJ, Redfern JS, McGovern ME, Giral P. Niacin and fibrates in atherogenic dyslipidemia: pharmacotherapy to reduce cardiovascular risk. Pharmacol Ther. 2010 Jun;126(3):314-45. doi:10.1016/j.pharmthera.2010.01.008.
105. The FIELD study investigators. Effects of long-term fenofibrate therapy on cardiovascular events in 9795 people with type 2 diabetes mellitus (the FIELD study): randomised controlled trial. Lancet. 2005 Nov 26;366(9500):1849-61. doi:10.1016/S0140-6736(05)67667-2.
106. Rubins HB, Robins SJ, Collins D, Nelson DB, Elam MB, Schaefer EJ, et al. Diabetes, plasma insulin, and cardiovascular disease: subgroup analysis from the Department of Veterans Affairs high-density lipoprotein intervention trial (VA-HIT). Arch Intern Med. 2002 Dec 9-23 [citado 2016 May 16];162(22):2597-604. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/12456232.
107. Saha SA, Arora RR. Fibrates in the prevention of cardiovascular disease in patients with type 2 diabetes mellitus - A pooled meta-analysis of randomized placebo-controlled clinical trials. Int J Cardiol. 2010 May 28;141(2):157-66. doi:10.1016/j.ijcard.2008.11.211.
108. Jun M, Foote C, Lv J, Neal B, Patel A, Nicholls SJ, et al. Effects of fibrates on cardiovascular outcomes: a systematic review and meta-analysis. Lancet. 2010 May 29;375(9729):1875-84. doi:10.1016/S0140-6736(10)60656-3.
109. ACCORD Study Group. Effects of combination lipid therapy in type 2 diabetes mellitus. N Engl J Med. 2010 April 29;362(17):1563-74. doi:10.1056/NEJMoa1001282.
110. AIM-HIGH Investigators. Niacin in patients with low HDL cholesterol levels receiving intensive statin therapy. N Engl J Med. 2011 Dec 15;365(24):2255-67. doi:10.1056/NEJMoa1107579.
111. HPS2-THRIVE Collaborative Group. Effects of extended-release niacin with laropiprant in high-risk patients. N Engl J Med. 2014 Jul 17;371(3):203-12. doi:10.1056/NEJMoa1300955.
112. Robinson JG, Farnier M, Krempf M, Bergeron J, Luc G, Averna M,et al; ODYSSEY LONG TERM Investigators. Efficacy and safety of alirocumab in reducing lipids and cardiovascular events. N Engl J Med. 2015 Apr 16;372(16):1489-99. doi:10.1056/NEJMoa1501031.
113. Sabatine MS, Giugliano RP, Wiviott SD, Raal FJ, Blom DJ, Robinson J, et al; Open-Label Study of Long-Term Evaluation against LDL Cholesterol (OSLER) Investigators. Efficacy and safety of evolocumab in reducing lipids and cardiovascular events. N Engl J Med. 2015 Apr 16;372(16):1500-9. doi:10.1056/NEJMoa1500858.
114. Gaede P, Vedel P, Parving HH, Pedersen O. Intensified multifactorial intervention in patients with type 2 diabetes mellitus and microalbuminuria: the Steno type 2 randomised study. Lancet. 1999 Feb 20;353(9153):617-22. doi:10.1016/S0140-6736(98)07368-1.
115. Gaede P, Lund-Andersen H, Parving H-H, Pedersen O. Effect of a multifactorial intervention on mortality in type 2 diabetes. N Engl J Med. 2008 Feb 7;358(6):580-91. doi:10.1056/NEJMoa0706245.
116. Yang Y, Yao J, Du JL, Bai R, Sun LP, Sun GH, et al. Primary prevention of macroangiopathy in patients with short-duration type 2 diabetes by intensified multifactorial intervention: seven-year follow-up of diabetes complications in Chinese. Diabetes Care. 2013 Apr;36(4):978-84. doi:10.2337/dc12-0227.
117. Howard BV, Roman MJ, Devereux RB, Fleg JL, Galloway JM, Henderson JA, et al. Effect of lower targets for blood pressure and LDL cholesterol on atherosclerosis in diabetes: the SANDS randomized trial. JAMA. 2008 Apr 9;299(14):1678-89. doi:10.1001/jama.299.14.1678.